En este artículo se explican, con un enfoque práctico, los hallazgos radiológicos de las complicaciones vasculares y biliares en el postrasplante de hígado completo en el paciente adulto, diferenciándolos de los hallazgos radiológicos normales tras el trasplante. Se incide en el manejo radiológico del paciente trasplantado y se explica el tratamiento intervencionista de las distintas complicaciones. Todo ello está basado en la experiencia de las autoras y en una revisión actualizada de la literatura indexada.
This article uses a practical approach to explain the imaging findings for vascular and biliary complications after total liver transplantation in adults, comparing them to the normal imaging findings after transplantation. It emphasizes the radiologic management of patients who have undergone transplantations and explains the treatment of the different complications by interventional radiology. The information provided comes from the authors’ experience and a thorough, up-to-date review of the indexed literature.
El trasplante hepático es el tratamiento curativo para la enfermedad hepática crónica avanzada, así como para la insuficiencia hepática aguda grave. Según la memoria de 2015 del Registro Español de Trasplante Hepático1, entre 1984 y 2015 se han realizado 23.746 trasplantes de hígado; la cirrosis ha sido la indicación más frecuente (52,9%). La cirrosis hepática alcohólica y la cirrosis hepática por el virus de la hepatitis C (VHC) han sido las causas más frecuentes (29% y 22,6%, respectivamente), seguidas del carcinoma hepatocelular (19,7%) y el fallo hepático agudo (4,3%)1. Hoy en día, gracias a los avances de la inmunosupresión y de la técnica quirúrgica2, la supervivencia de los pacientes receptores de un trasplante hepático es del 85,8%, 73% y 62% al año, a los 5 años y a los 10 años1. Sin embargo, las complicaciones médicas y/o quirúrgicas continúan siendo una importante fuente de morbimortalidad, así como de pérdida de injertos a medio y largo plazo. Un 10-20% de los pacientes presentan complicaciones vasculares o biliares precoces tras el trasplante hepático (durante el primer mes), y entre un 5% y un 30%, complicaciones tardías (después del primer mes). Las pruebas radiológicas son fundamentales junto con los parámetros analíticos y clínicos para detectar y tratar precozmente estas complicaciones3. En este artículo se describen los hallazgos radiológicos normales tras el trasplante de hígado completo en el paciente adulto y se explican los hallazgos radiológicos de las complicaciones vasculares y biliares. Se incide en el manejo radiológico del paciente trasplantado y se explica el tratamiento intervencionista de las distintas complicaciones.
Anastomosis y anatomía del hígado trasplantadoEl injerto hepático se coloca en situación ortotópica sin vesícula biliar, y se realizan anastomosis vasculares y biliar4. Conocer el tipo de anastomosis realizadas en el trasplante es fundamental para poder interpretar las imágenes:
- 1.
Arteria hepática. Anastomosis terminoterminal con distintas variantes con respecto al nivel del vaso donante y receptor. Si la arteria hepática del receptor es inadecuada (por trombosis, ateromatosis o disección), en ocasiones es necesaria la interposición de injertos ilíacos del donante entre la aorta receptora y la arteria del donante.
- 2.
Vena porta principal: terminoterminal. Si existe trombosis extensa, puede ser necesario interponer injertos iliacos.
- 3.
Vena cava inferior:
- •
Tipo “piggyback” con conservación de la vena cava del receptor y anastomosis de un muñón de venas suprahepáticas del donante a la vena cava inferior del receptor. Es la forma que se emplea con más frecuencia.
- •
Tipo clásico, con resección del segmento de la vena cava retrohepática del receptor y dos anastomosis terminoterminales.
- 4.
Vía biliar. Coledococoledocostomía más frecuentemente, o coledocoyeyunostomía. Se reserva la hepaticoyeyunostomía para los casos donde existe desproporción de la vía biliar del donante y el receptor, trasplante por colangitis esclerosante, atresia de vía biliar y en algunos retrasplantes.
El seguimiento del paciente trasplantado se realiza mediante ecografía Doppler2 por ser una prueba inocua que aporta información hemodinámica, con un protocolo variable según la institución, pero que incluye una exploración inicial en las primeras 24-48 horas y al menos otra a la semana. Después, el seguimiento es variable; un esquema frecuente es el seguimiento a 1, 3, 6, 9 y 12 meses y, posteriormente, anual. Los hallazgos de cada ecografía se deben comparar con los de las anteriores. Si es necesario confirmar complicaciones o si existe sospecha de sangrado activo, se emplea la tomografía computarizada (TC). La colangio-RM es de elección para confirmar complicaciones biliares. La arteriografía y las técnicas intervencionistas son fundamentales para solucionar muchas de las complicaciones vasculares y biliares.
Hallazgos normales postrasplante en la ecografía DopplerEl periodo postrasplante inmediato es un estado fisiológico anormal, en el que el nuevo hígado se encuentra en un proceso de adaptación a su nuevo medio, recuperándose de los efectos de la isquemia fría y de la reperfusión. En él se producen alteraciones hemodinámicas que tardan un tiempo variable en recuperarse. Conocer cuál es la evolución hemodinámica normal en el periodo postrasplante permite distinguir situaciones normales de patológicas5. Los valores más alterados y más variables ocurren en la exploración inicial a las 24-48 horas y en la primera semana.
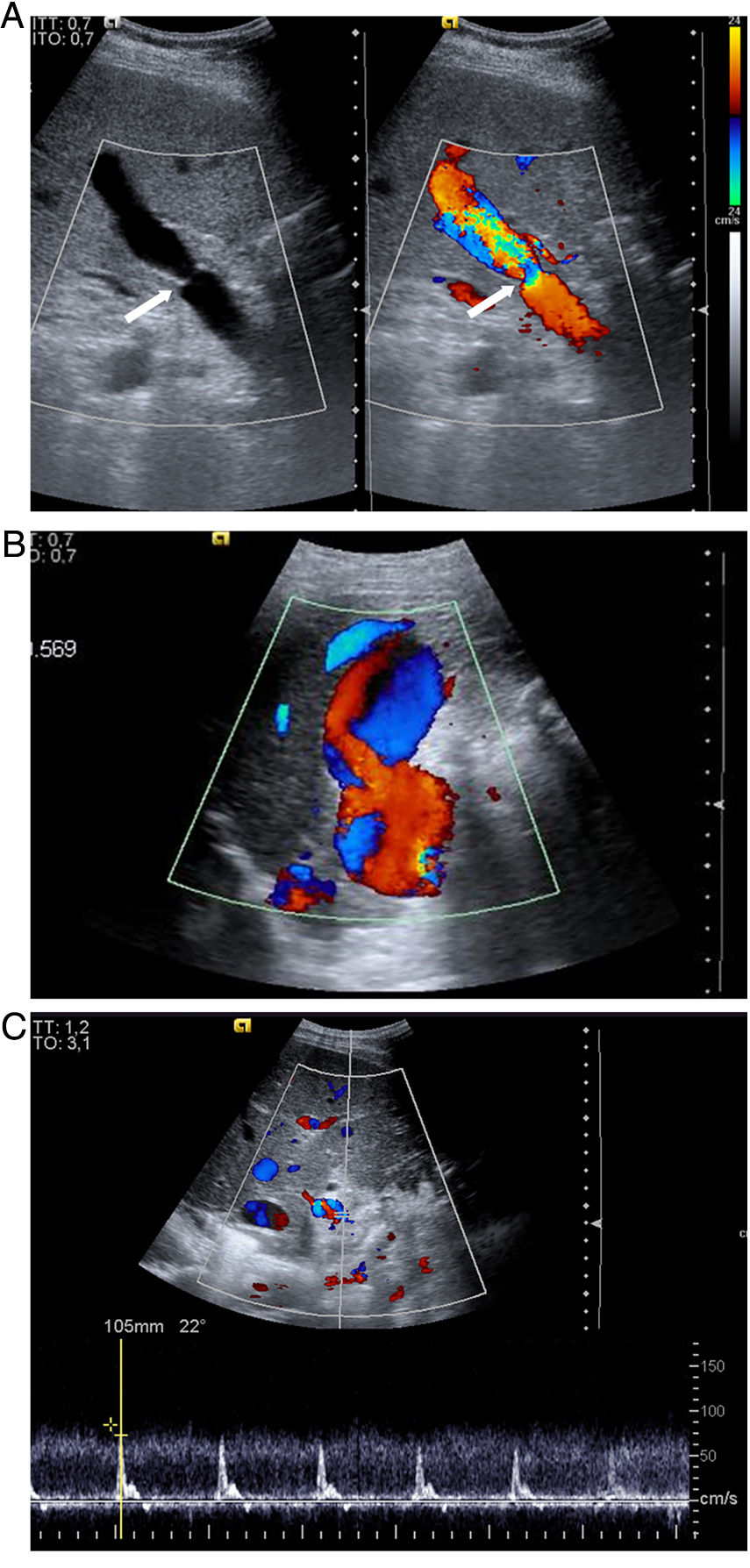
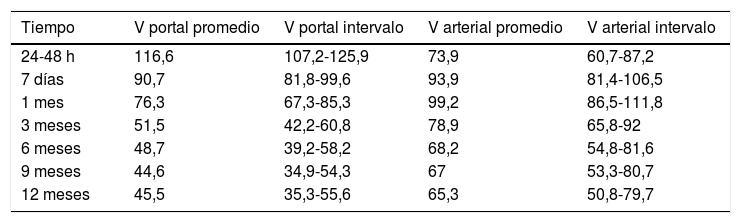
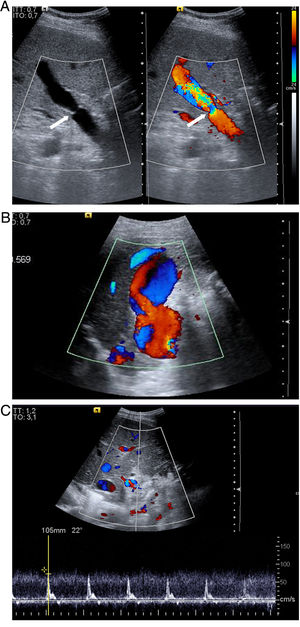
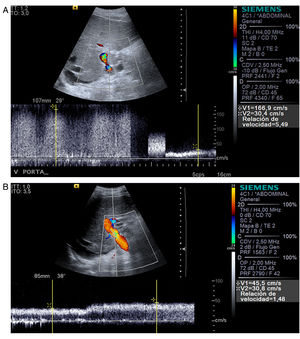
En el postrasplante inmediato, el flujo portal es hepatópeto con aliasing en Doppler color en el área anastomótica y postanastomótica (fig. 1) y flujo turbulento en el Doppler espectral. La velocidad portal máxima es variable, en general con unas velocidades muy elevadas en las primeras 24 horas y una disminución progresiva, rápida inicialmente, sobre todo en la primera semana6 y más lenta después hasta el año e incluso hasta los 2 años postrasplante7 (tabla 1). Esta evolución sugiere una anastomosis inicialmente menos distensible que va haciéndose más distensible a lo largo del tiempo. Una variante portal es el flujo helicoidal postanastomótico, que se manifiesta como un área de flujo inverso en la vena porta postanastomótica, con flujo hepatópeto preanastomótico, y con flujo hepatópeto postanastomótico distal a las áreas de flujo inverso (fig. 1). Este flujo se ha relacionado con discrepancia de tamaño entre la vena porta del donante y la del receptor.
A) Vena porta principal y anastomosis portal normal en trasplante reciente con aliasing (variación de colores saturados) en Doppler color por aumento significativo de la velocidad en y distal a la anastomosis (flecha) con flujo turbulento. B) Flujo portal helicoidal postanastomótico que se manifiesta en la ecografía Doppler color como áreas de flujo inverso (azul) que alternan con áreas de flujo hepatópeto en un segmento de una vena porta con flujo neto hepatópeto. C) Arteria hepática con velocidad normal y curva de alta pulsatilidad en Doppler espectral a las 24 horas postrasplante que se resolvió a los 4 días postrasplante.
Predicción de las velocidades máximas portales (V portal) en centímetros por segundo y picosistólica arteriales (Varterial) en centímetros por segundo con respecto al tiempo, basadas en un estudio prospectivo durante un año en 60 pacientes adultosa
| Tiempo | V portal promedio | V portal intervalo | V arterial promedio | V arterial intervalo |
|---|---|---|---|---|
| 24-48 h | 116,6 | 107,2-125,9 | 73,9 | 60,7-87,2 |
| 7 días | 90,7 | 81,8-99,6 | 93,9 | 81,4-106,5 |
| 1 mes | 76,3 | 67,3-85,3 | 99,2 | 86,5-111,8 |
| 3 meses | 51,5 | 42,2-60,8 | 78,9 | 65,8-92 |
| 6 meses | 48,7 | 39,2-58,2 | 68,2 | 54,8-81,6 |
| 9 meses | 44,6 | 34,9-54,3 | 67 | 53,3-80,7 |
| 12 meses | 45,5 | 35,3-55,6 | 65,3 | 50,8-79,7 |
La velocidad arterial inicial suele ser elevada en comparación con los valores de normalidad en pacientes no trasplantados (40-80cm/s) y muestra variaciones menores que los de la vena porta entre los pacientes y a lo largo del tiempo: aumenta durante la primera semana8, está en meseta durante el primer mes y posteriormente se reduce hasta alcanzar valores normales (tabla 1). La velocidad arterial está influida por la resistencia intrahepática, y el índice de resistencia (IR) intrahepático puede mostrar una variación paralela e inversa a la de la velocidad arterial, aunque en general se encuentra dentro de límites normales (0,5-0,8).
Existen tres variantes en la hemodinámica arterial que se consideran no patológicas: curva de alta pulsatilidad transitoria, velocidad arterial elevada de forma transitoria en la anastomosis y velocidad elevada en las curvas o bucles. La curva de alta pulsatilidad transitoria en la arteria consiste en flujo arterial con espectro de alta pulsatilidad (con IR > 0,8), incluso con ausencia de flujo diastólico en los primeros 5 días postrasplante, y en general se normaliza antes de transcurrido este tiempo (fig. 1). En estos pacientes se recomienda realizar controles en días alternos para confirmar la permeabilidad de la arteria y para comprobar la normalización del flujo. El patrón arterial de alta pulsatilidad puede relacionarse con sufrimiento hepático durante el tiempo de isquemia y preservación del injerto, y se asocia a edad avanzada del donante9. Otro factor contribuyente o consecuente es el flujo predominante inicial hacia la arteria esplénica que se da en algunas ocasiones y que en casos extremos puede llegar a constituir un síndrome de robo de la esplénica10. La segunda de las variantes arteriales es la velocidad arterial elevada (>200cm/s) en la anastomosis de forma transitoria en las primeras 24-48 horas, con reducción significativa en la primera semana. La arteria es un vaso pequeño y el edema inicial en la anastomosis puede explicar este aumento transitorio de velocidad. Por último, el flujo acelerado en las curvas o bucles se produce si la arteria hepática es tortuosa y puede darse aceleración del flujo con valores superiores a 200cm/s, que no se deben considerar patológicos si el flujo es normal antes de la curva y a cierta distancia de esta y si el IR intrahepático es normal.
Complicaciones vascularesComplicaciones arterialesTrombosis de la arteria hepáticaEs la complicación vascular más frecuente (incidencias entre el 2,5% y el 9%) y la más grave, ya que, si no se soluciona de forma urgente, ocasiona la pérdida del injerto3,11–14. La mortalidad oscila entre el 11% y el 35% y es la causa más frecuente de retrasplante. Es más habitual en el primer mes postrasplante (trombosis precoz), y se relaciona con problemas técnicos en la reconstrucción quirúrgica arterial. Las manifestaciones clínicas y las alteraciones analíticas son inespecíficas, y el diagnóstico se basa en las técnicas de imagen.
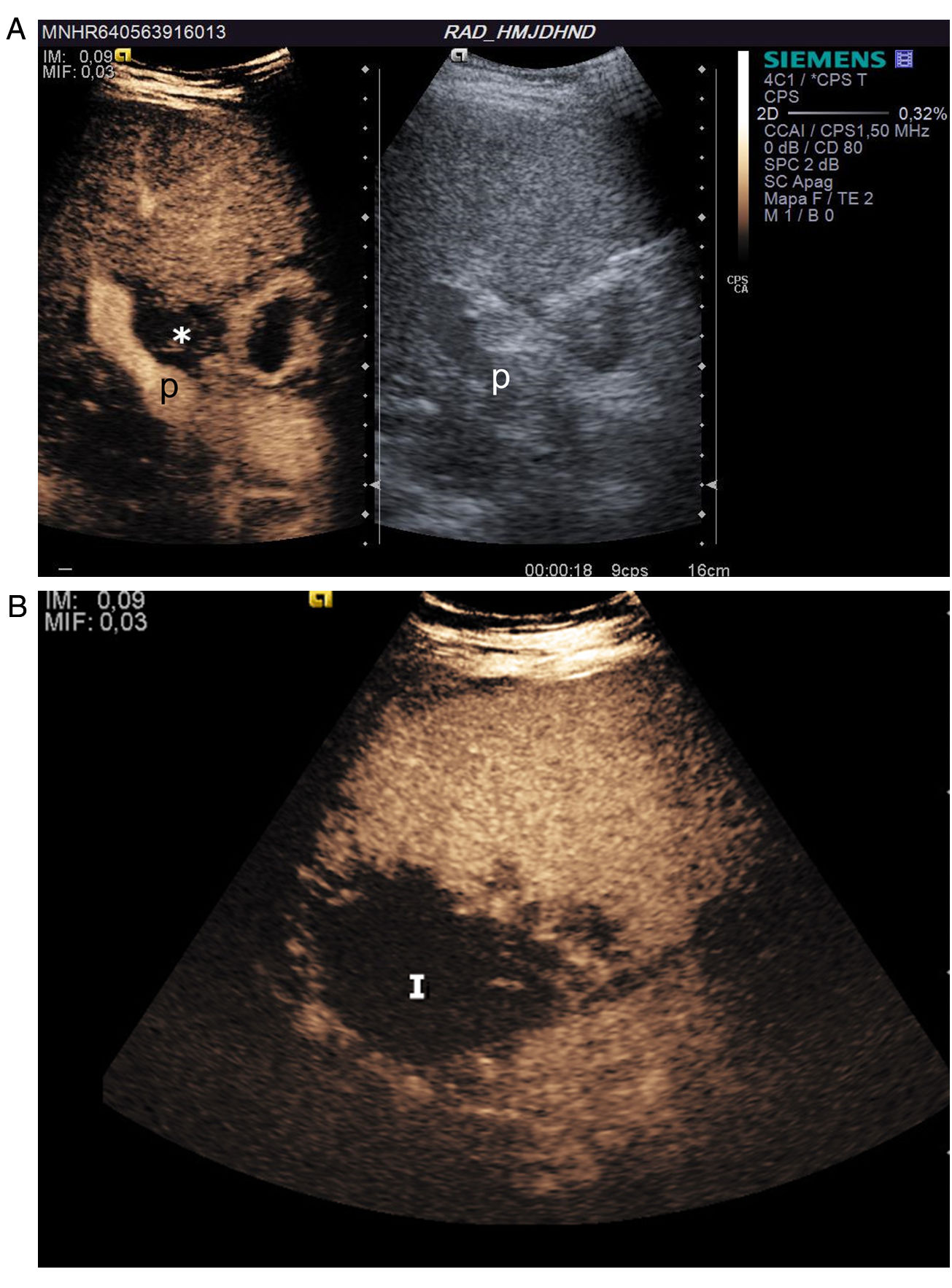
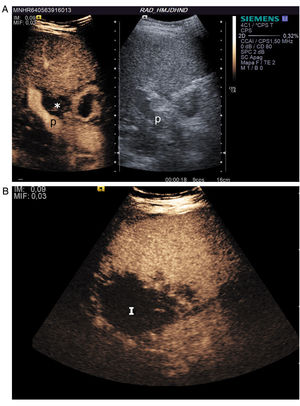
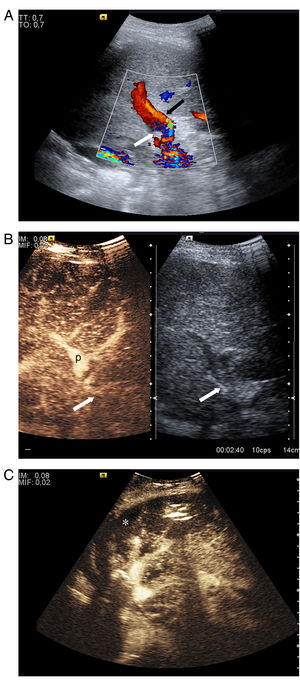
El criterio ecográfico para diagnosticar trombosis es la ausencia de señal en la exploración Doppler color y de señal espectral11,14. Durante la exploración hay que asegurarse de que la arteria se ve bien en el hilio hepático (puede ocurrir que se vea la arteria permeable proximal a la trombosis y confundirse con permeabilidad de toda la arteria). Si existe duda, se debe administrar contraste ecográfico, el cual permite emitir un diagnóstico rápido y fiable, con un 100% de sensibilidad, de especificidad y de fiabilidad en la detección de la trombosis arterial15. Se confirma trombosis cuando se demuestra ausencia de realce en la arteria16,17 (fig. 2); típicamente se ve, además, un realce portal precoz17. El contraste permite identificar áreas de isquemia17, infartos que casi siempre pasan desapercibidos en la ecografía en escala de grises (fig. 2). La trombosis se puede confirmar o diagnosticar mediante TC o arteriografía, como una ausencia de repleción del vaso. La trombosis arterial suele implicar isquemia biliar debido a la vascularización exclusiva arterial de la vía biliar por el plexo peribiliar y puede derivar en complicaciones biliares. El informe de trombosis de la arteria debe ser inmediato y con comunicación oral y alerta a los clínicos para realizar un tratamiento precoz18.
Trombosis de la arteria hepática a las 48 horas del trasplante. A) Imagen dual de ecografía con contraste y escala de grises. El contraste muestra realce portal y ausencia de realce en la arteria con pequeño infarto periportal (asterisco), que se ve como un área de ausencia de realce en la zona que correspondería a la arteria y al plexo peribiliar. B) Infarto amplio periférico (I) que se ve como un área de ausencia de realce en comparación con el resto del hígado realzado.
P: vena porta principal.
Las formas tardías de la trombosis ocurren tras el primer mes, en ocasiones años11,19, y la supervivencia del injerto se debe a presencia de vascularización colateral arterial20. Suelen tener una presentación clínica larvada, con manifestaciones biliares que se relacionan con fístula biliar o biloma, ictericia obstructiva progresiva por estenosis de la vía biliar, episodios sépticos recidivantes e incluso hay formas asintomáticas sin disfunción del injerto.
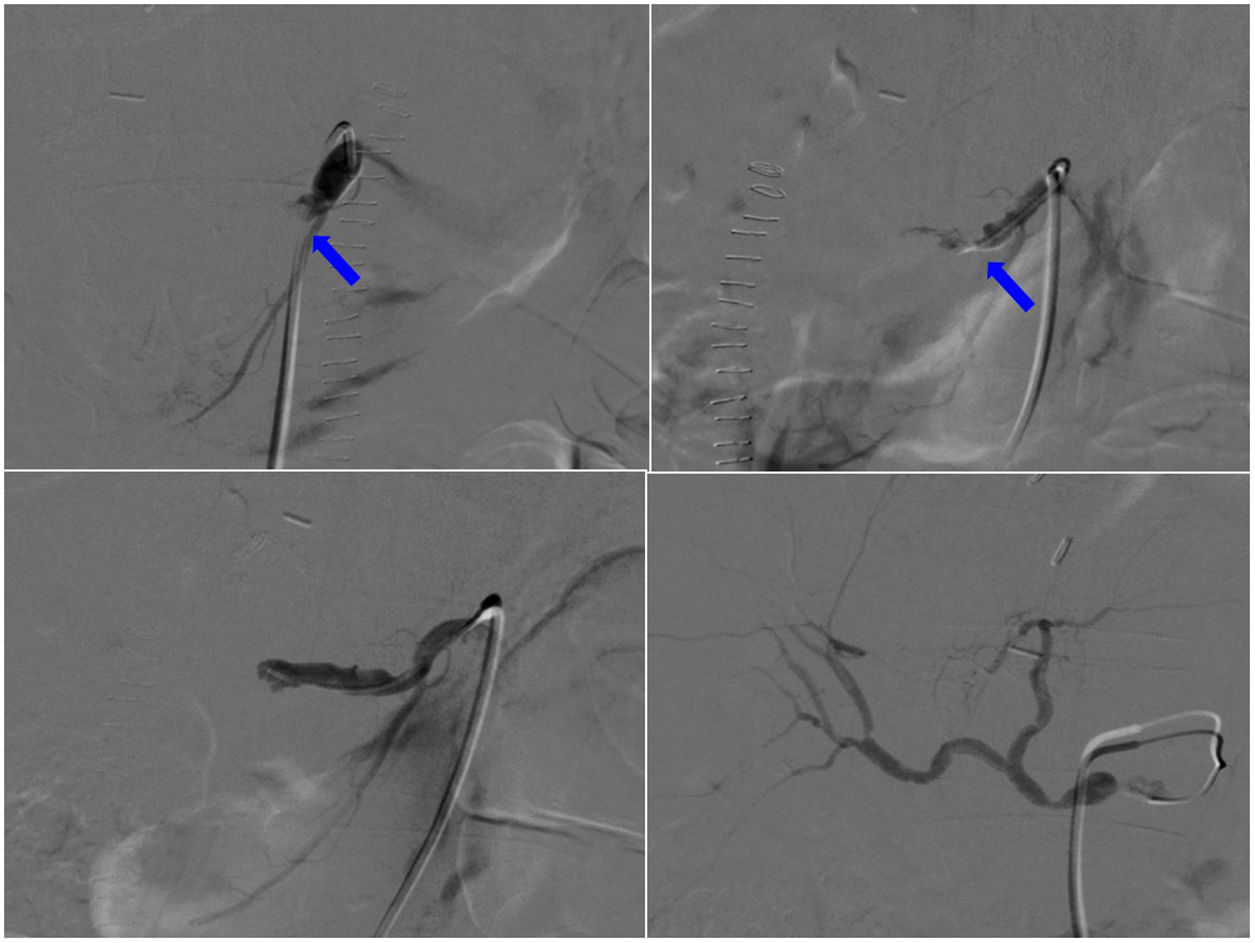
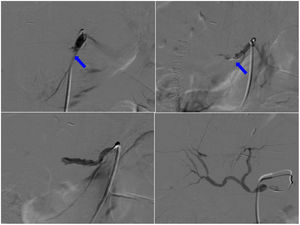
El tratamiento de la trombosis de la arteria hepática dependerá del tiempo transcurrido desde la cirugía, del tiempo de evolución de la trombosis, de la presencia de áreas isquémicas y de la repercusión clínico-analítica. Las opciones terapéuticas son tres: revascularización (quirúrgica o endovascular), retransplante, con mejor supervivencia, pero limitado por la escasez de donantes, y la observación, en pacientes que desarrollan colaterales distales a la trombosis21. Las formas agudas con necrosis hepática y disfunción primaria grave del injerto requieren retrasplante urgente; las trombosis subclínicas detectadas de forma precoz se pueden tratar mediante trombectomía quirúrgica con revascularización directa, y alternativamente en ciertos casos se puede utilizar la fibrinólisis transcatéter (fig. 3). Hay numerosos protocolos fibrinolíticos con diferentes productos y regímenes (urocinasa, estreptocinasa, alteplasa), asociados o no a dosis bajas de heparina, sin que exista una directriz recomendada específica. Si el trombo es secundario a un defecto anatómico, debe ser reparado: reducción de un kinking o estenosis de la anastomosis mediante angioplastia y stent22. La revascularización quirúrgica abierta es otra opción viable con trombectomía mecánica, trombólisis intraarterial “in situ”, revisión de la anastomosis y, ocasionalmente, reconstrucción quirúrgica de la arteria. El diagnóstico y revascularización precoces reducen la incidencia de complicaciones biliares a largo plazo secundarias a la isquemia de la vía biliar. Sin embargo, entre el 50% y el 75% de los pacientes requieren un nuevo trasplante23.
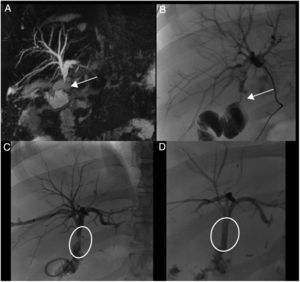
Arteriografía. Trombosis de la arteria hepática desde su origen, 72 horas después de la cirugía (flecha). No hay paso de contraste por la arteria debido a la oclusión producida por el trombo. Se realiza fibrinólisis con 750.000 UI de urocinasa y 2000 UI de heparina. Las imágenes muestran la apertura progresiva del flujo de la arteria hasta conseguir su repermeabilización completa.
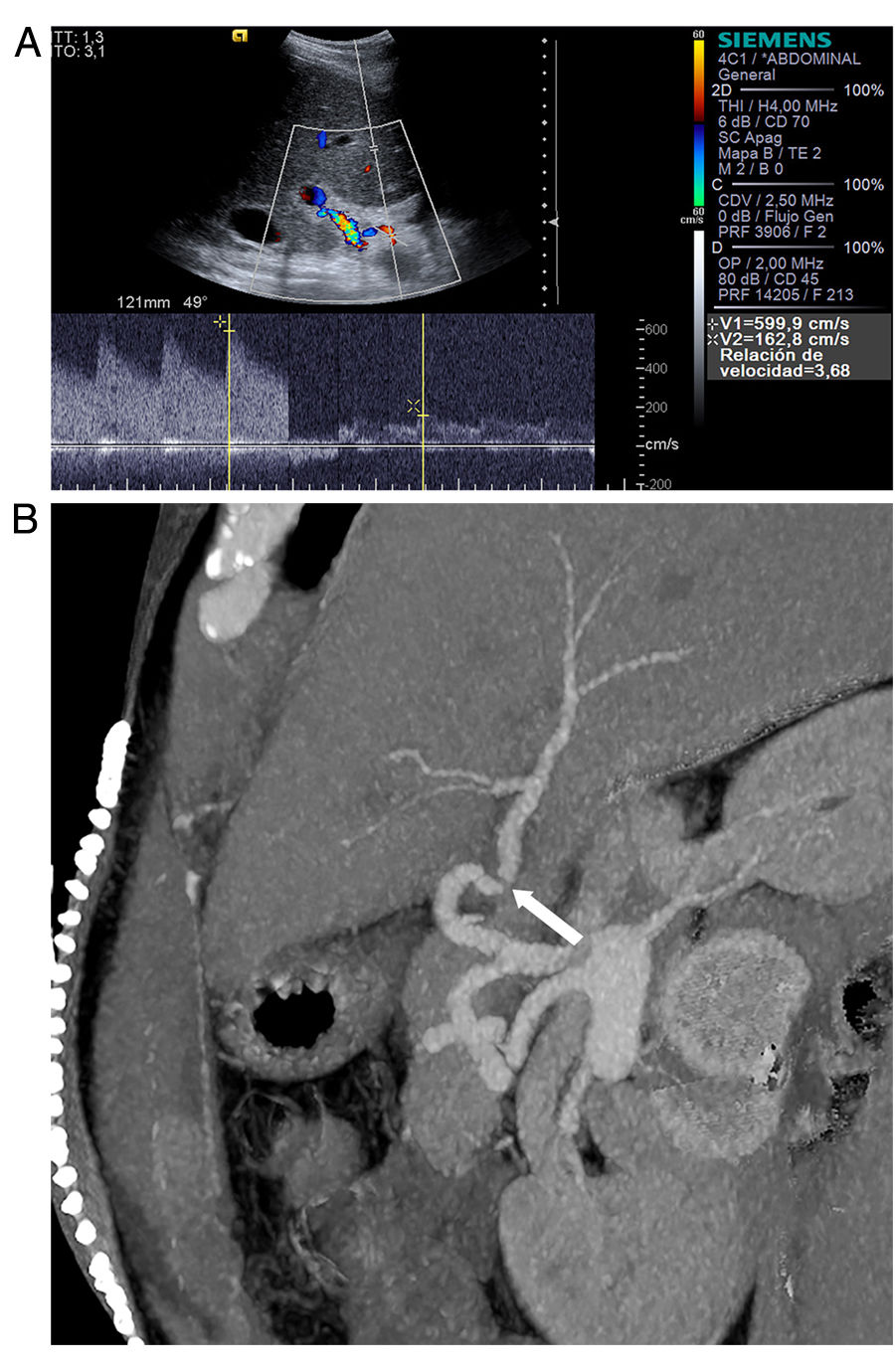
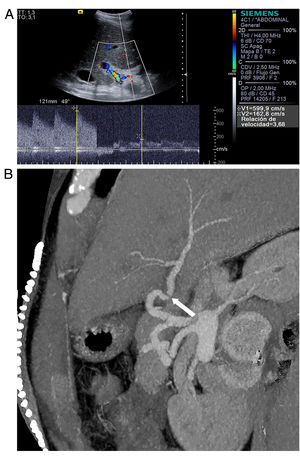
La mayoría de las estenosis suceden entre 1 y 3 meses tras el trasplante, en el segmento anastomótico, debido al proceso de cicatrización y fibrosis. La clínica es inespecífica e incluye elevación de transaminasas, insuficiencia hepática y complicaciones biliares leves y tardías. Esta variabilidad depende del grado de estenosis, y del grado de colateralización si la estenosis es tardía. Los criterios ecográficos de estenosis incluyen un aumento focal de la velocidad picosistólica mayor de 200cm/s, asociada a flujo turbulento en la exploración Doppler color y espectral (fig. 4). Cuando es significativa también se producen signos indirectos distalmente: curva arterial intrahepática anómala con bajo IR (<0,5) o incluso curva “tardus parvus” con velocidades picosistólicas disminuidas y tiempo de aceleración prolongado (>0,8 s)24. Mediante angio-TC, las reconstrucciones tridimensionales permiten identificar la estenosis como un estrechamiento focal de la arteria y permiten diferenciar estenosis reales de kinking de la arteria o bucles muy acusados que pueden ocasionar un aumento focal de la velocidad en la exploración Doppler2.
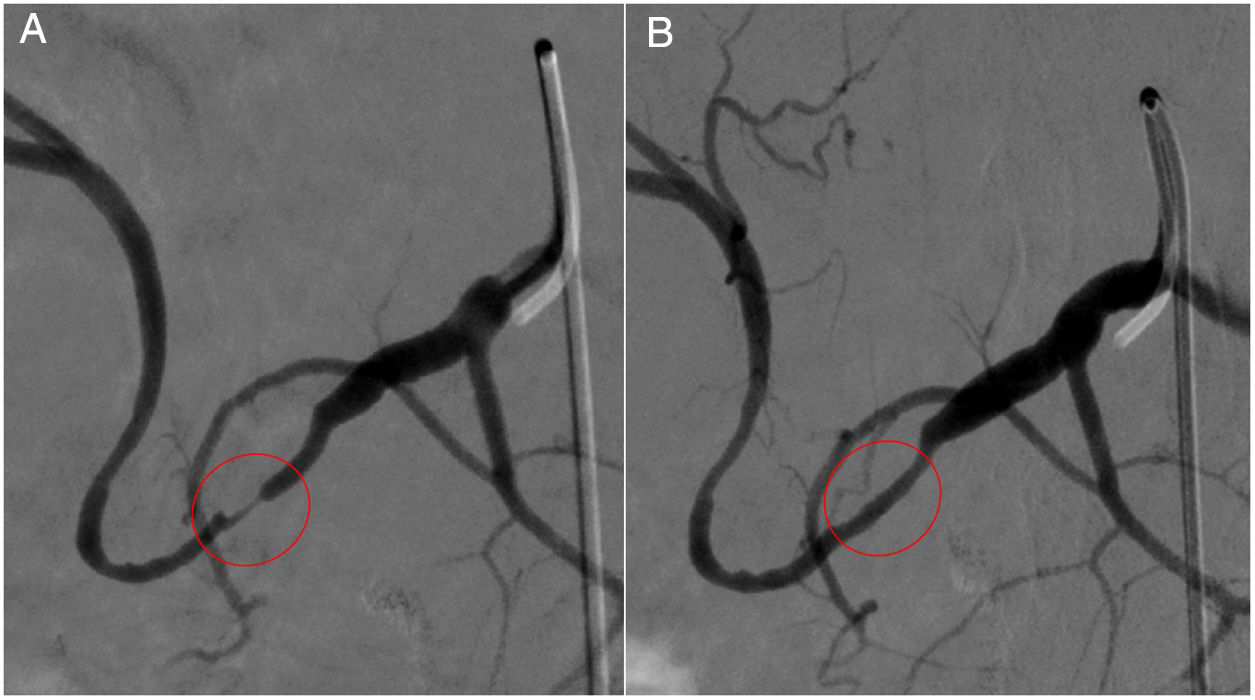
Estenosis anastomótica de la arteria hepática. A) Doppler color y espectral. Velocidad arterial muy elevada y relación de velocidades anastomótica/preanastomótica mayor de 3. B) La imagen de angio-TC (reconstrucción MIP, corte oblicuo siguiendo el curso de la arteria) muestra disminución de calibre de la arteria (flecha).
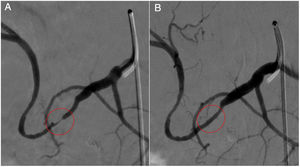
La primera opción terapéutica de la estenosis arterial es la angioplastia endovascular25. Dado que se va a actuar sobre una cicatriz reciente, hay riesgo de disección y rotura arterial, por lo que debe disponerse de stents cubiertos para resolver las eventuales complicaciones. Según un metaanálisis reciente, la angioplastia con dilatación de balón por sí sola (fig. 5) tiene una tasa de éxito algo inferior (89% vs. 98%) a la asociada a la colocación del stent. Ambas técnicas tienen tasas de complicaciones similares (16% vs. 19%)26. Cuando el tratamiento endovascular no es posible, la reconstrucción quirúrgica de la arteria es la opción terapéutica apropiada. A pesar de ello, se describen cifras de retrasplante debido a estenosis arteriales próximas al 20%.
PseudoaneurismaLos pseudoaneurismas de la arteria hepática pueden ser extrahepáticos anastomóticos (secundarios a angioplastia o infección) o intrahepáticos (secundarios a biopsia o a procedimientos intervencionistas biliares)27. Son muy poco frecuentes y aparecen hacia la segunda o tercera semana o tras los procedimientos intervencionistas descritos. Suele ser un hallazgo incidental, aunque pueden cursar con hemorragia digestiva o hemobilia, por lo que deben tratarse. Su apariencia ecográfica es la de una estructura quística redondeada o lobulada intrahepática o redondeada o sacular extrahepática en relación con la arteria que presenta flujo Doppler típicamente bidireccional (signo del ying-yang). El tratamiento de elección por su menor morbimortalidad es endovascular, habitualmente mediante stent cubierto21.
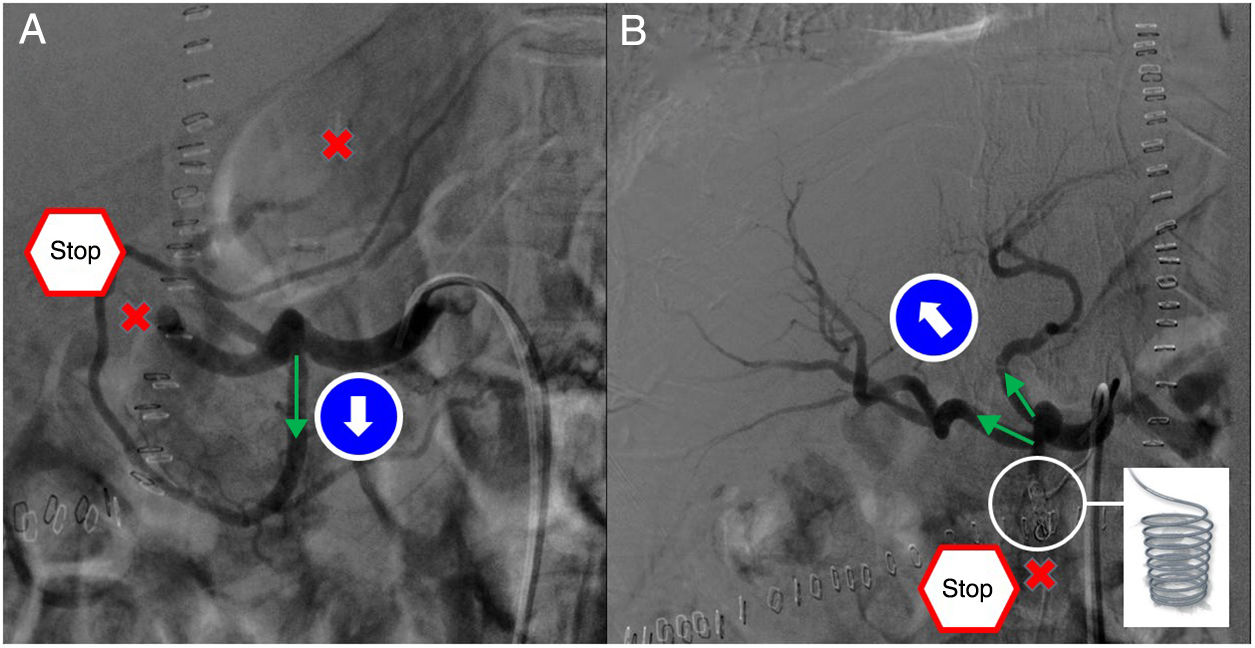
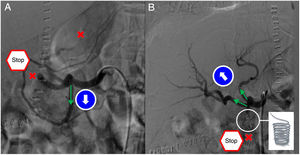
Hipoperfusión por robo arterialLos síndromes de robo arterial son infrecuentes. Se definen por la hipoperfusión hepática debida a la desviación del flujo sanguíneo a otra rama arterial diferente de la arteria hepática, pero originada del mismo tronco, habitualmente la arteria esplénica o gastroduodenal. El diagnóstico específico se realiza con arteriografía, donde se observan hallazgos dinámicos indicativos de hipoperfusión del injerto y un ensanchamiento de la arteria esplénica o gastroduodenal. El objetivo del tratamiento es reducir el flujo en la arteria esplénica o gastroduodenal para incrementar el de la arteria hepática. La embolización esplénica es la primera opción, aunque puede ocasionar complicaciones infecciosas sobre el bazo avascularizado (fig. 6). Igualmente se pueden realizar ligaduras quirúrgicas arteriales con o sin esplenectomía28.
A) En la arteriografía diagnostica se observa permeabilidad de la arteria hepática derecha y de la arteria hepática izquierda con importante disminución del flujo (aspas) hepático por “robo” de la arteria gastroduodenal (flecha). B) Se procede a la embolización selectiva de la arteria gastroduodenal con coils y Ónix. La obliteración de esta arteria (aspa) permite restaurar el flujo por las arterias hepáticas (flechas).
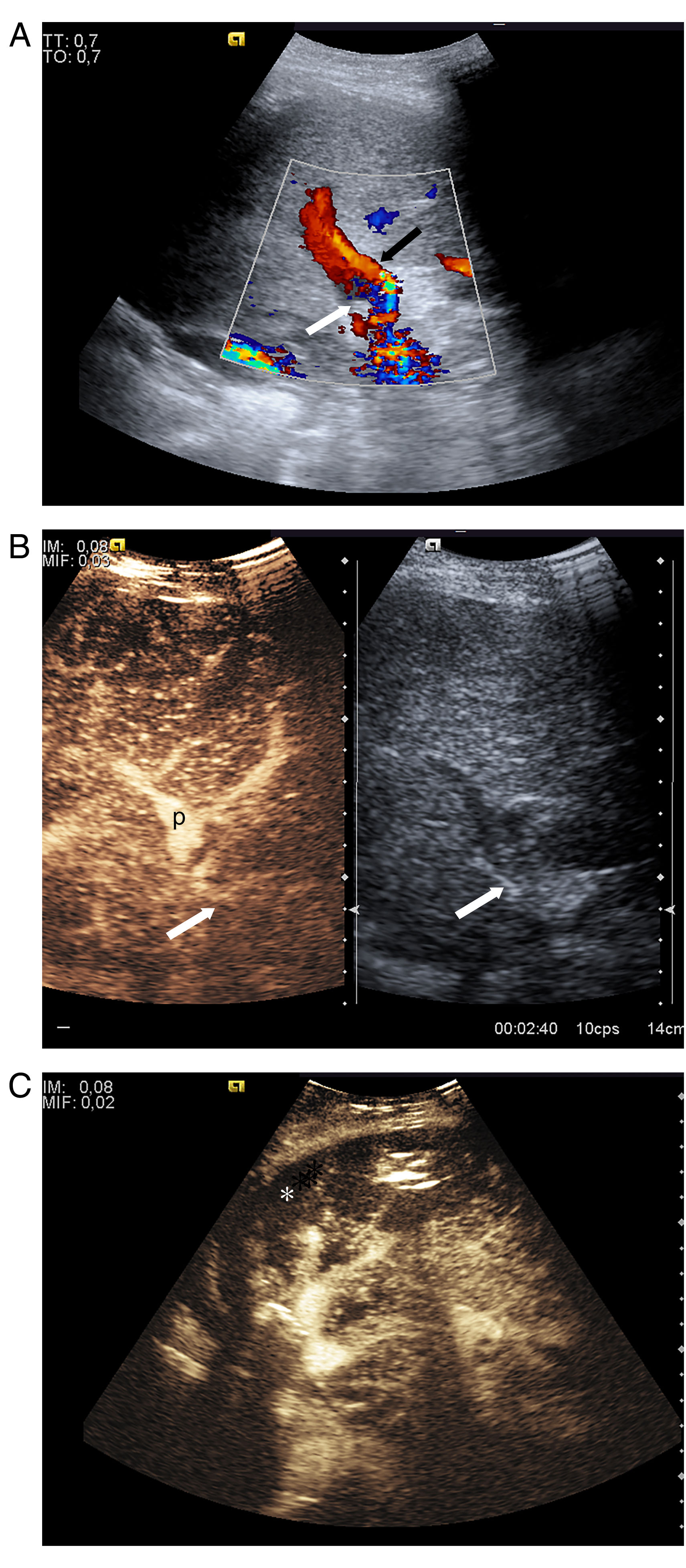
Se dan en el 3-7% de los trasplantes, con formas de presentación clínica que oscilan desde una presentación fulminante hasta hipertensión portal con ascitis, encefalopatía y hemorragia digestiva alta. También puede ser asintomática si la trombosis es parcial. El criterio ecográfico es la ausencia de flujo en la exploración Doppler color en la luz de la vena porta y/o sus ramas, de forma parcial o completa, casi siempre con ocupación de la luz por ecos29. La trombosis se confirma con rapidez mediante ecografía con contraste o TC, que permiten además identificar y delimitar áreas isquémicas parenquimatosas (fig. 7) como áreas de ausencia de realce.
Trombosis de la vena porta. A) Permeabilidad de la vena porta intrahepática y de la arteria hepática (flecha negra). Mala visualización de la vena porta principal (flecha blanca). B) La ecografía con contraste muestra ausencia de realce de la vena porta principal por trombosis de esta (flecha blanca). C) Infarto periférico grande (asterisco) que se ve como un área de ausencia de realce. La paciente requirió retrasplante.
En cuanto al manejo de la trombosis portal, es necesario distinguir tres situaciones que requieren distinto manejo:
- •
Trombosis completa precoz (<48h): la revisión quirúrgica es obligada.
- •
Trombosis completa o parcial (48 h-30 días): el procedimiento de elección es la trombólisis percutánea asociada con la colocación de stent mediante abordaje clásico transhepático o abordaje transyugular en pacientes con coagulopatía o ascitis. La tasa de éxito de estos métodos oscila entre 68% y el 100%, y las tasas de mortalidad y morbilidad se encuentran entre el 0% y el 11%, respectivamente30.
- •
Trombosis tardía (>30 días): en pacientes asintomáticos por desarrollo de colaterales, la actitud es la observación. En pacientes con síntomas de hipertensión portal hay autores que combinan una punción venosa directa y trombectomía (para reducir el riesgo de embolia pulmonar) y posteriormente realizan un TIPS31. Se ha descrito también la recanalización completa usando activador tisular de plasminógeno (rtPA) y heparina durante 10 días32.
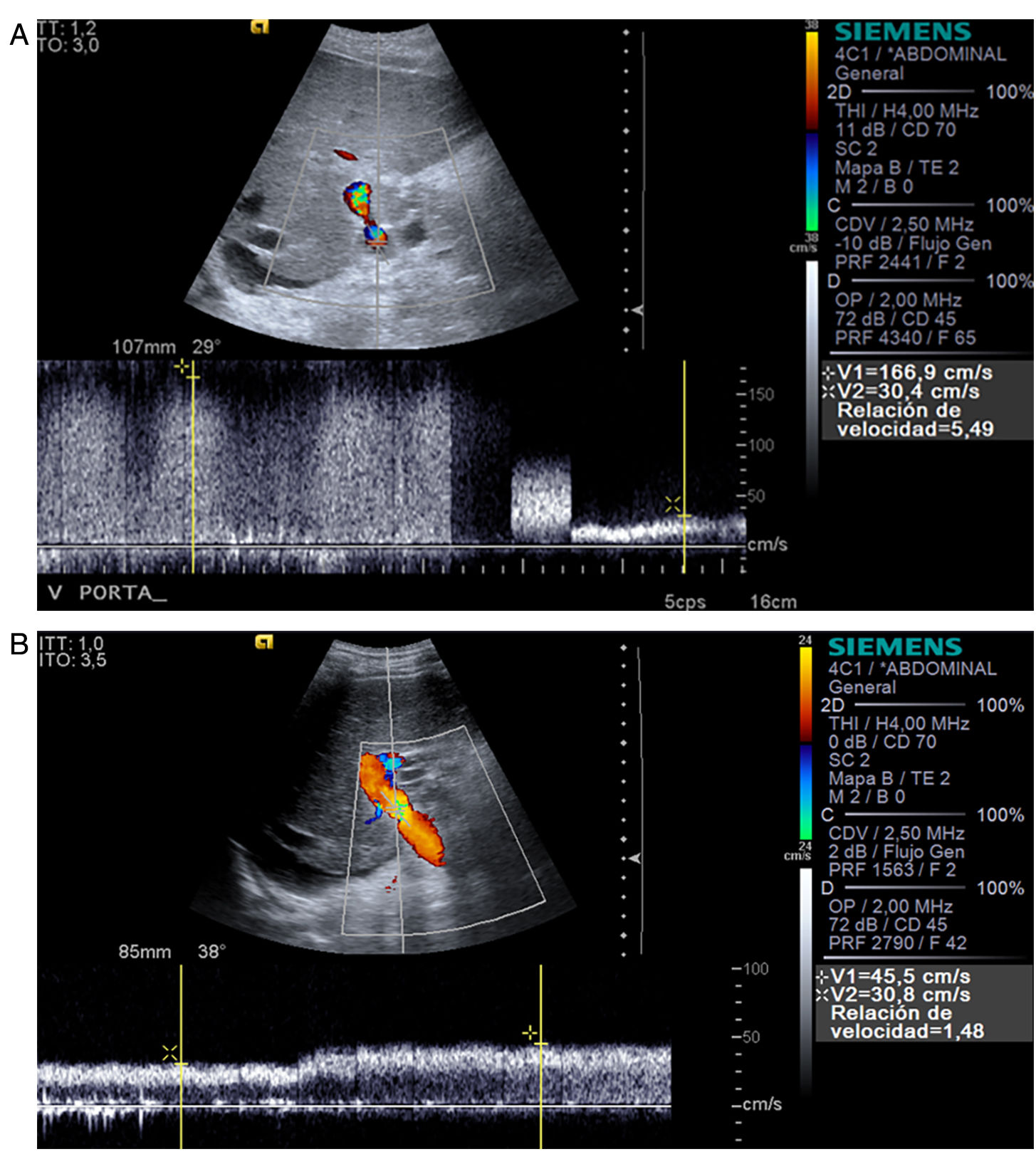
Es una complicación infrecuente que ocurre en la anastomosis. Los criterios Doppler de estenosis incluyen aliasing anastomótico y postanastomótico en Doppler color con relación de velocidades anastomótica/preanastomótica > 3:133 en el Doppler espectral, y velocidad máxima portal (Vp) muy alta (>125) sin reducción a lo largo del tiempo34 (fig. 8). El valor de Vp > 125cm/s está descrito como muy sensible y específico para diagnosticar estenosis portal35; sin embargo, en la experiencia de los autores, en la primera ecografía Doppler tiene que ser interpretado con precaución, ya que no es excepcional encontrar velocidades más altas que luego se normalizan (tabla 1).
Si no se trata la estenosis portal, puede desarrollarse trombosis. El tratamiento de elección es la intervención radiológica transhepática con angioplastia y colocación de stent. Tiene una alta tasa de éxito y una tasa baja de recurrencia y/o complicaciones, siendo la más frecuente el hemoperitoneo causado por el sangrado del trayecto transhepático y pseudoaneurismas intrahepáticos.
Complicaciones de vena cava y de las venas suprahepáticasSon complicaciones vasculares más raras e incluyen estenosis y trombosis. Las estenosis pueden ser precoces (en relación con problemas técnicos quirúrgicos y por compresión por hematomas) o tardías (por hiperplasia intimal o fibrosis perianastomótica)34,36. En las estenosis de la vena cava aparece flujo turbulento con velocidad aumentada de forma focal y se considera significativa cuando existe un gradiente de velocidad anastomótica/preanastomótica de al menos 3:1. No se considera fiable la medida aislada de la velocidad máxima en la vena cava porque el ángulo de insonación Doppler es mayor de 60°. La estenosis de las venas suprahepáticas o del confluente “piggy-back” se manifiesta como una pulsatilidad disminuida en la curva espectral venosa, aunque este hallazgo puede ser normal en el periodo postoperatorio temprano, por lo que debe ser valorado con cautela en este periodo34. Cuanto menor es el índice de pulsatilidad venoso, mayor probabilidad de estenosis, y un índice de pulsatilidad menor de 0,45 es un 95% específico para estenosis. Sin embargo, un flujo trifásico en las venas suprahepáticas excluye estenosis suprahepática significativa36. La trombosis de las venas suprahepáticas puede asociar inversión del flujo proximal a la trombosis.
Las estenosis de la vena cava y de las venas suprahepáticas se tratan por vía transyugular, y únicamente se recurre al acceso transhepático percutáneo cuando la anastomosis no puede ser cateterizada desde el acceso yugular. La angioplastia con balón tiene un éxito próximo al 100%, aunque las recidivas son frecuentes. Hay autores que asocian a la angioplastia la inserción de un stent con buena seguridad y resultados. Se reserva la revisión quirúrgica para los casos no resueltos endovascularmente, y en última instancia es necesario el retransplante en pacientes con disfunción grave del injerto21.
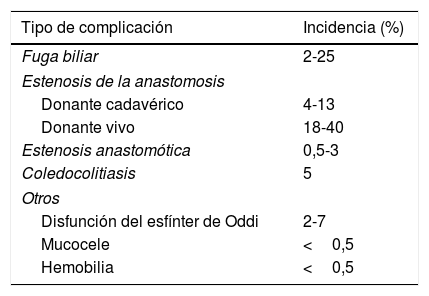
Complicaciones biliaresSon las complicaciones quirúrgicas más frecuentes en el trasplante hepático. Con una incidencia del 10-25%, suponen una necesidad de retrasplante del 6-12% y tienen una mortalidad asociada del 0% al 19%37. Se pueden clasificar en cuatro grupos: 1) fístula o fuga biliar, 2) estenosis anastomótica, 3) estenosis no anastomótica y 4) otras complicaciones. Su incidencia se detalla en la tabla 2.
Complicaciones biliares asociadas al trasplante hepático
| Tipo de complicación | Incidencia (%) |
|---|---|
| Fuga biliar | 2-25 |
| Estenosis de la anastomosis | |
| Donante cadavérico | 4-13 |
| Donante vivo | 18-40 |
| Estenosis anastomótica | 0,5-3 |
| Coledocolitiasis | 5 |
| Otros | |
| Disfunción del esfínter de Oddi | 2-7 |
| Mucocele | <0,5 |
| Hemobilia | <0,5 |
Tomada de: Balderramo D, et al.49.
Los factores de riesgo son técnicos y de vascularización, inmunológicos y asociados a la reperfusión. Con respecto a la técnica empleada, está estandarizada la coledococoledocostomía terminoterminal37,38. Varios estudios aleatorizados y metaanálisis han demostrado que el uso sistemático del tubo de Kehr (tubo en T) no está justificado. Aunque su empleo puede disminuir la incidencia de estenosis, las complicaciones no mejoran de forma global39–41.
La presentación clínica es variada, desde cuadros asintomáticos a cuadros graves de colangitis. La técnica diagnóstica inicial es la ecografía, que debe incluir estudio Doppler para descartar trombosis o estenosis de la arteria hepática. La capacidad de dilatación de la vía biliar del injerto es menor que en el hígado no trasplantado, por lo que la ecografía tiene una sensibilidad del 40-70% para detectar dilatación de la vía biliar42; por ello, en pacientes con sospecha clínica y eco normal, debe realizarse colangio-RM. Esta técnica tiene una sensibilidad del 93-98% y una especificidad del 92-98% comparada con la prueba de referencia que es la colangiografía retrógrada endoscópica (CPRE)43. El protocolo de estudio para la colangio-RM emplea una antena phased-array abdominal multicanal, realizando secuencias T2 single shot fast spin echo (SSFSE) en plano axial y coronal, axial difusión y axial T1 fast gradient echo en fase y fuera de fase, con el fin de descartar patología peribiliar. Las secuencias colangiográficas incluyen la realización de cortes gruesos T2 SSFSE obtenidos con diferentes angulaciones y secuencia 3D potenciada en T2 fast spin echo (FSE). El estudio se realiza con un ayuno mínimo de 6 horas, sin contraste intravenoso, cuyo uso no está recomendado en el periodo inmediato postrasplante.
En los pacientes portadores de tubo T, la realización de una colangiografía trans-Kehr permite una rápida y precisa valoración de la vía biliar44. Los procedimientos diagnósticos invasivos como CPRE y/o colangiografía transparietohepática se reservan para casos aislados. Cuando existe importante alteración analítica y las pruebas de imagen son normales, debe recurrirse a la biopsia hepática para descartar rechazo u otras causas de colestasis45.
En general, el primer abordaje terapéutico se realiza con CPRE en pacientes con anastomosis coledococoledocostomía terminoterminal, reservando la colangiografía transparietohepática en pacientes con hepaticoyeyunostomía en “Y de Roux”46.
Fuga biliar y bilomaLa incidencia de la fuga biliar ha disminuido notablemente en los últimos años. Es una complicación del trasplante inmediato. Las fugas tardías son infrecuentes. Las localizaciones habituales son la anastomosis biliar, el remanente del conducto cístico, la zona de inserción del tubo Kehr y, en el caso de donante vivo, en la superficie de sección. Es menos frecuente la fuga secundaria a necrosis coledociana por trombosis de la arteria.
Si el paciente es portador de drenaje, se objetiva la salida de bilis por el tubo. Si el paciente es portador de tubo Kehr, la colangiografía trans-Kehr permite el diagnóstico. Si la fístula no está drenada, se acumula formando una colección habitualmente subhepática llamada biloma. Puede aparecer un cuadro de peritonitis biliar con fiebre, dolor y defensa abdominal y alteración de las pruebas hepáticas. El diagnóstico se realiza con ecografía y/o TC que permiten evaluar el biloma, la vascularización del injerto y son guía de imagen para colocar un drenaje. La apariencia ecográfica del biloma es la de una colección anecogénica en una localización próxima al hilio hepático o subhepática que va aumentando de volumen progresivamente, incluso puede aparecer como abundante líquido peritoneal indistinguible de ascitis. En ocasiones puede tener un aspecto más complejo con algunos septos o ecos. Aunque no se recomienda el uso de contraste en el postoperatorio inmediato, la colangiografía-RM con Gd-EOB-DTPA (ácido pentaacético gadolinio agente etoxibencil-dietilentriamina), al ser un contraste de excreción biliar, permite la detección de fugas activas de bilis mediante la visualización directa del material de contraste extravasado, describir la localización anatómica y la comunicación de la fuga con el árbol biliar. Otra característica de la colangiografía-RM con contraste es la posibilidad de establecer el diagnóstico diferencial entre una biloma y otras lesiones como abscesos, hematomas o quistes47,48.
El tratamiento de la fuga biliar consiste en permitir su correcto drenaje. Así, en pacientes portadores de tubo de Kehr se mantiene abierto el tubo un periodo más prolongado y ocasionalmente se asocia una esfinterotomía endoscópica43. Cuando no hay tubo en T, el abordaje para la descompresión de la vía se realiza con CPRE o CTH según el tipo de reconstrucción biliar existente. Se coloca una prótesis plástica que aísle el defecto biliar y se realiza papilotomía. La mejoría clínica se produce en pocos días; sin embargo, como consecuencia de la inmunosupresión, la cicatrización está muy enlentecida y la fuga puede tardar en resolverse hasta 5 semanas49. Por esta razón, la prótesis debe mantenerse 2 meses. La cirugía se reserva para los casos en que no es posible drenar el biloma y para la reconstrucción de una dehiscencia completa de la anastomosis50.
Estenosis anastomóticaRepresenta el 80% de las estenosis en pacientes con trasplante hepático44. Según su momento de aparición, se clasifican en precoces (<6 meses del trasplante) o tardías (>6 meses)51. Habitualmente se presenta con un cuadro de colestasis con elevación de la fosfatasa alcalina y de la bilirrubina. La mejor prueba diagnóstica es la colangio-RM, que demuestra una estenosis única y corta en la anastomosis (fig. 9).
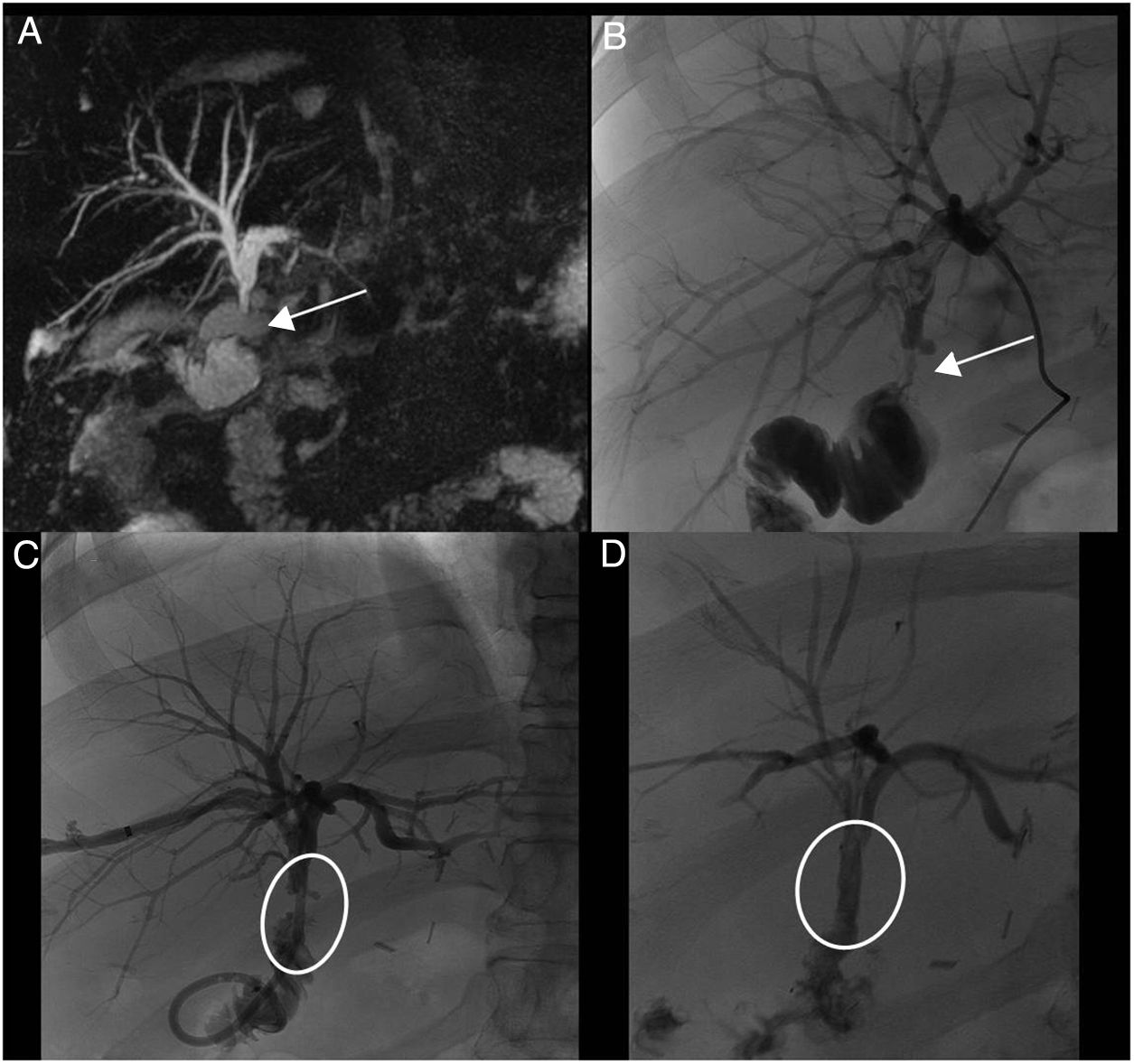
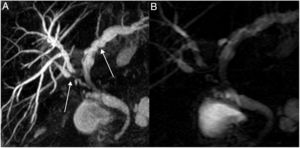
A) Colangio-RM imagen (MIP) secuencia 3D T2 FSE plano coronal (TR: 3000, TE: 580) que demuestra estenosis de la anastomosis en la hepaticoyeyunostomía (flecha). B) La colangiografía percutánea reproduce la misma imagen de estenosis (flecha). El paciente presentaba cuadros frecuentes de colangitis. C) La terapia elegida fue la colocación por vía transhepática de prótesis reabsorbible. D) Buen resultado morfológico.
El tratamiento de elección es colangiográfico, preferentemente mediante acceso endoscópico. Otra opción es el abordaje radiológico percutáneo, con cifras similares de éxito y morbilidad, por lo que la elección depende de la disponibilidad y experiencia del centro. El tratamiento consiste en la realización de esfinterotomía biliar y bilioplastia con balones de 6-8 mm (fig. 9). Después se coloca un stent plástico de 7-11 Fr. Estas prótesis deben recambiarse cada 3-6 meses y se requieren 3-4 sesiones, por lo que el tratamiento se prolonga entre 9 y 24 meses. La morbilidad es del 30% con recidivas en el 20-30%42. Son factores de mal pronóstico las estenosis infranqueables, las de aparición tardía, la presencia de fístula biliar y el uso previo de tubo de Kehr. Cuando fracasa el tratamiento colangiográfico se realiza abordaje quirúrgico; la opción más aceptada es la hepaticoyeyunostomía en Y de Roux.
Estenosis no anastomóticaAunque su incidencia es mucho menor, es la complicación biliar más temida dado su difícil manejo y mal pronóstico. Conlleva una necesidad de retrasplante del 60-70% y una mortalidad cercana al 50%50.
Se distinguen dos tipos:
- •
Las estenosis no anastomóticas (ENA) precoces aparecen antes de un año postrasplante. Se relacionan con factores isquémicos: trombosis de la arteria (40-50% de las ENA) o daños de preservación. Morfológicamente son estenosis en el hilio42.
- •
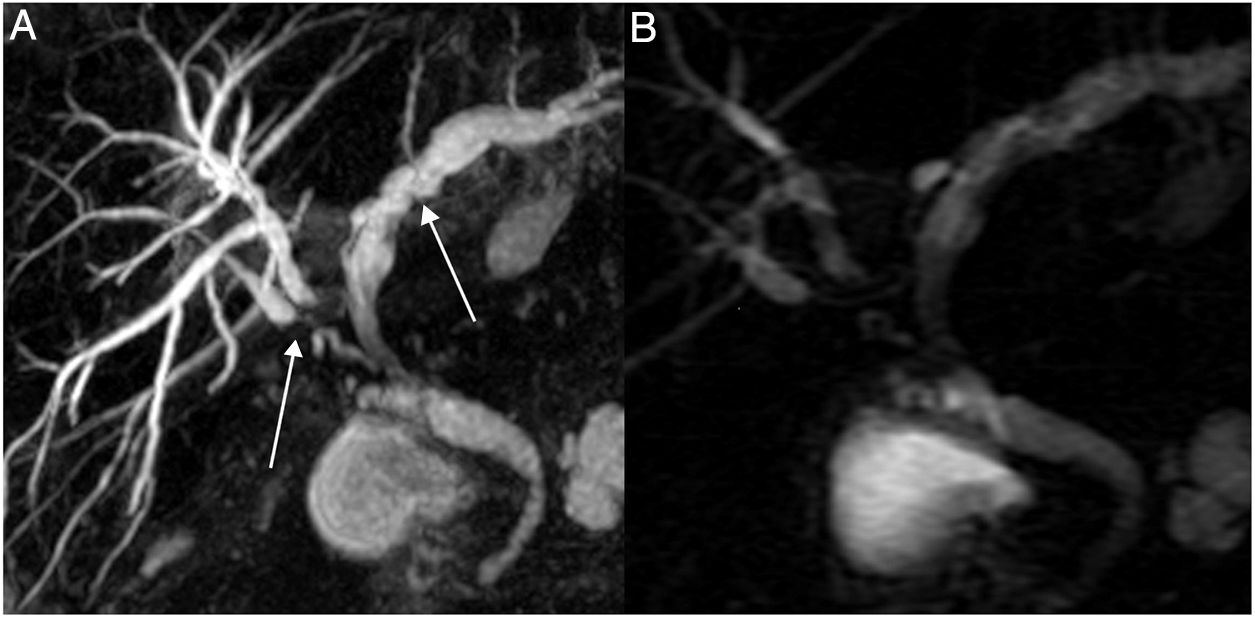
Las ENA tardías aparecen más allá de 12 meses tras el trasplante y se relacionan con factores inmunológicos: trasplante por colangitis esclerosante, por hepatitis autoinmunitaria, infección por citomegalovirus y rechazo. Su aspecto morfológico es difuso, con estenosis y dilataciones múltiples de la vía biliar intrahepática (fig. 10)52.
Figura 10.Estenosis no anastomótica de la vía biliar intrahepática con dilataciones preestenóticas de morfología arrosariada (flechas) por patología vascular. A) Colangio-RM imagen (MIP) secuencia 3D T2 FSE plano coronal (TR: 3000, TE: 580). B) Imagen de secuencia colangiográfica radial T2 SSFSE con corte grueso (40 mm) (TR: 4000, TE: 1000).
(0,07MB).
El cuadro puede ser asintomático y el diagnóstico, casual por una prueba de imagen rutinaria. En estos casos, la actitud debe ser expectante y realizar seguimiento, ya que hasta en un 25% de los casos no hay progresión clínica52. El cuadro clínico más habitual es la colestasis; pueden existir colangitis de repetición y el cuadro puede evolucionar hasta una cirrosis biliar secundaria.
En las estenosis focales puede realizarse tratamiento endoscópico o radiológico intervencionista, aunque requieren más sesiones de tratamiento que las estenosis anastomóticas, con peores tasas de respuesta. La hepaticoyeyunostomía es otra opción terapéutica en estos casos. En las estenosis de tipo difuso, los resultados de los tratamientos colangiográficos son muy pobres y con alta morbilidad, por lo que la opción preferible es el retrasplante de manera preferente.
Otras complicaciones biliaresLos defectos de relleno biliar pueden corresponder con litiasis, barro biliar y coágulos. Las litiasis representan el 70% de estos defectos y se relacionan con alteración del drenaje biliar por denervación secundaria al procedimiento quirúrgico y a otros factores como el uso de ciclosporina53. El manejo es similar al de los pacientes no trasplantados, con esfinterotomía y extracción por vía endoscópica.
La disfunción de esfínter de Oddi es un diagnóstico de exclusión. Aparece como un cuadro de colestasis y en la colangiografía solo se demuestra dilatación uniforme de la vía biliar sin estenosis ni defectos de llenado. Su origen parece estar en la denervación biliar que ocasiona hipertonía del esfínter. Esta denervación hace que el cuadro raramente curse con dolor abdominal. El tratamiento de elección es la esfinterotomía, con una tasa de resolución próxima al 100%49.
Otras complicaciones infrecuentes descritas son el mucocele y la hemobilia yatrogénica secundaria a biopsias y CPRE.
ConclusiónLas pruebas de imagen son fundamentales en el seguimiento del trasplante hepático para detectar complicaciones posquirúrgicas, vasculares y biliares. La prueba de elección para el seguimiento es la ecografía Doppler; la TC y colangio-RM se emplean para diagnosticar y confirmar las complicaciones. La colangio-RM es fundamental en el diagnóstico de las complicaciones biliares. La detección precoz de las complicaciones es fundamental para su tratamiento, que se realiza preferiblemente mediante técnicas intervencionistas, pero que puede requerir intervención quirúrgica o retrasplante.
Autoría- 1.
Responsable de la integridad del artículo: TFE.
- 2.
Concepción del artículo: TFE, EV, MG y AMD.
- 3.
Diseño del artículo: TFE, EV, MG y AMD.
- 4.
Obtención de los datos: no procede.
- 5.
Análisis e interpretación de los datos: no procede.
- 6.
Tratamiento estadístico: no procede.
- 7.
Búsqueda bibliográfica: TFE, EV, MG y AMD.
- 8.
Redacción del trabajo: TFE, EV, MG y AMD.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes TFE, EV, MG y AMD.
- 10.
Aprobación de la versión final TFE, EV, MG y AMD.
Los autores declaran no tener ningún conflicto de intereses.
A Manolo Jiménez, gran cirujano, por sus explicaciones sobre la técnica de las anastomosis y sobre las complicaciones quirúrgicas en el trasplante hepático.