El objetivo de este trabajo es revisar las indicaciones actuales en el ámbito radiológico de los contrastes ecográficos sobre la base de la reciente publicación de unas guías clínicas por la Federación Europea de las Sociedades de Ecografía en Medicina y Biología (EFSUMB). El artículo se inicia con una breve descripción de los medios de contraste disponibles, de sus efectos adversos y contraindicaciones, y de las técnicas especificas de contraste que permiten la detección de la señal emitida por las microburbujas de los contrastes. Posteriormente, se revisan las indicaciones descritas de los contrastes ecográficos, tanto en el hígado —detección y caracterización de lesiones focales, así como guía y monitorización de los tratamientos percutáneos— como fuera del hígado —en riñón, reflujo vesicoureteral, páncreas, traumatismos y circulación cerebral—. Se describen en cada una de las indicaciones descritas, primero la interpretación de los hallazgos, después los usos recomendados y, por último, las limitaciones. Finalmente, se repasan otras múltiples aplicaciones que todavía no se han recogido en las mencionadas guías.
The aim of this article is to review the current indications for the use of contrast agents in ultrasonography in imaging departments with reference to the guidelines and recommendations recently published by the European Federation of Societies for Ultrasound in Medicine and Biology (EFSUMB). The article begins with a brief description of currently available contrast agents, of their adverse effects and contraindications, and of the specific techniques that enable the signal emitted from the microbubbles in the contrast to be detected. Next, we review the indications for ultrasound contrast agents both in the liver (detecting and characterizing focal lesions as well as guiding and monitoring percutaneous treatments) and outside the liver (in the kidney, vesicoureteral reflux, pancreas, traumatisms, and cerebral circulation). For each of the indications, first we describe the interpretation of the findings, then the recommended uses, and finally the limitations of the technique. Finally, we review all the other applications that have yet to be included in the EFSUMB guidelines.
Los medios de contraste ecográficos (CE) han abierto nuevas perspectivas a la ecografía. La lista de sus posibles aplicaciones y beneficios potenciales es numerosa, y además, la continua publicación de nuevos usos indica que la técnica no está totalmente explotada. Un grupo de estudio organizado por la Federación Europea de las Sociedades de Ecografía en Medicina y Biología (EFSUMB) acaba de publicar unas guías de práctica clínica en el uso de los contrastes ecográficos1. En su primera versión, publicada en 20042, estas guías incluían sólo aplicaciones del contraste en el hígado, pero la versión actual, que refleja el rápido crecimiento de la técnica, incluye recomendaciones para su uso en riñón, reflujo vesicoureteral, páncreas, traumatismos y circulación cerebral.
Este artículo revisa las indicaciones actuales de los CE sobre la base de las guías clínicas de la EFSUMB, incluyendo descripciones de la técnica, interpretación de los hallazgos, usos recomendados y sus limitaciones. Se revisan también otras aplicaciones publicadas recientemente que no están incluidas todavía en las guías clínicas.
GeneralidadesContrastes disponiblesEn Europa hay 4 contrastes aprobados por la Agencia Europea del Medicamento. Sus características se resumen en la tabla 1.
Tabla 1. Contrastes ecográficos disponibles en Europa
| Nombre | Fabricante | Sustancia | Estabilizante | Indicaciones en Europa |
| Levovist® | Bayer | Microcristales de galactosa | Ácido palmítico | Abdominal |
| Cardíaca | ||||
| Transcraneal | ||||
| Reflujo vesicoureteral a | ||||
| Optison® | GE Healthcare | Octafluoropropano | Fosfolípidos | Cardíaca |
| Luminity® | Bristol-Myers Squibb | Perflutren | Fosfolípidos | Cardíaca |
| Sonovue® | Bracco | Hexafluoruro de azufre | Fosfolípidos | Abdominal |
| Cardíaca | ||||
| Transcraneal |
a Principal indicación actual del Levovist®.
Los CE son muy seguros, con una incidencia de efectos adversos muy baja1,2,3,4,5. Las reacciones de hipersensibilidad son mucho menos frecuentes que con los contrastes utilizados en tomografía computarizada (TC) o en resonancia magnética (RM). En una revisión de 23.188 estudios procedentes de 28 hospitales italianos, el índice de reacciones adversas graves y leves fue del 0,0086 y 0,125%, respectivamente, y no hubo ninguna muerte5. Otra ventaja es la ausencia de nefrotoxicidad y de tirotoxicidad1.
Se han descrito 3 muertes con el uso de Sonovue®, todos en estudios de ecocardiografía en pacientes con cardiopatía conocida severa. Los efectos colaterales suelen ser leves (cefalea, náuseas, vómitos, mareos, alteración del sentido gustativo, sensación de calor, parestesias, eritema cutáneo, escozor) y autolimitados.
ContraindicacionesLos CE no han sido aprobados en embarazadas ni, en algunos países (incluido España), durante el período de lactancia1,2. No ha sido aprobado el uso intravenoso de Sonovue® en pediatría. Debe evitarse su utilización 24h antes de la litotricia extracorpórea4.
El hexafluoruro de azufre (Sonovue®) está contraindicado en el síndrome coronario agudo reciente y en la miocardiopatía isquémica inestable, en la insuficiencia cardíaca aguda y en los trastornos graves del ritmo cardíaco. También está contraindicado en derivaciones cardíacas derecha-izquierda, hipertensión pulmonar avanzada, hipertensión sistémica no controlada y en pacientes con síndrome de distrés respiratorio del adulto.
No se recomienda el uso de los CE en ecografía ocular ni en el estudio cerebral si el cráneo no está intacto por el riesgo de rotura microvascular, detectado en estudios experimentales1,2.
Medios de detecciónLos CE disponibles, formados por microburbujas de gas estabilizadas por diversas sustancias, aumentan la señal ecográfica. Sin embargo, este aumento de señal es difícil de discernir del tejido circundante cuando se usa la ecografía convencional en modo B6. Aunque las técnicas Doppler son sensibles a estos contrastes, su señal es de corta duración (usan un índice mecánico alto) y tiene abundantes artefactos de sobresaturación.
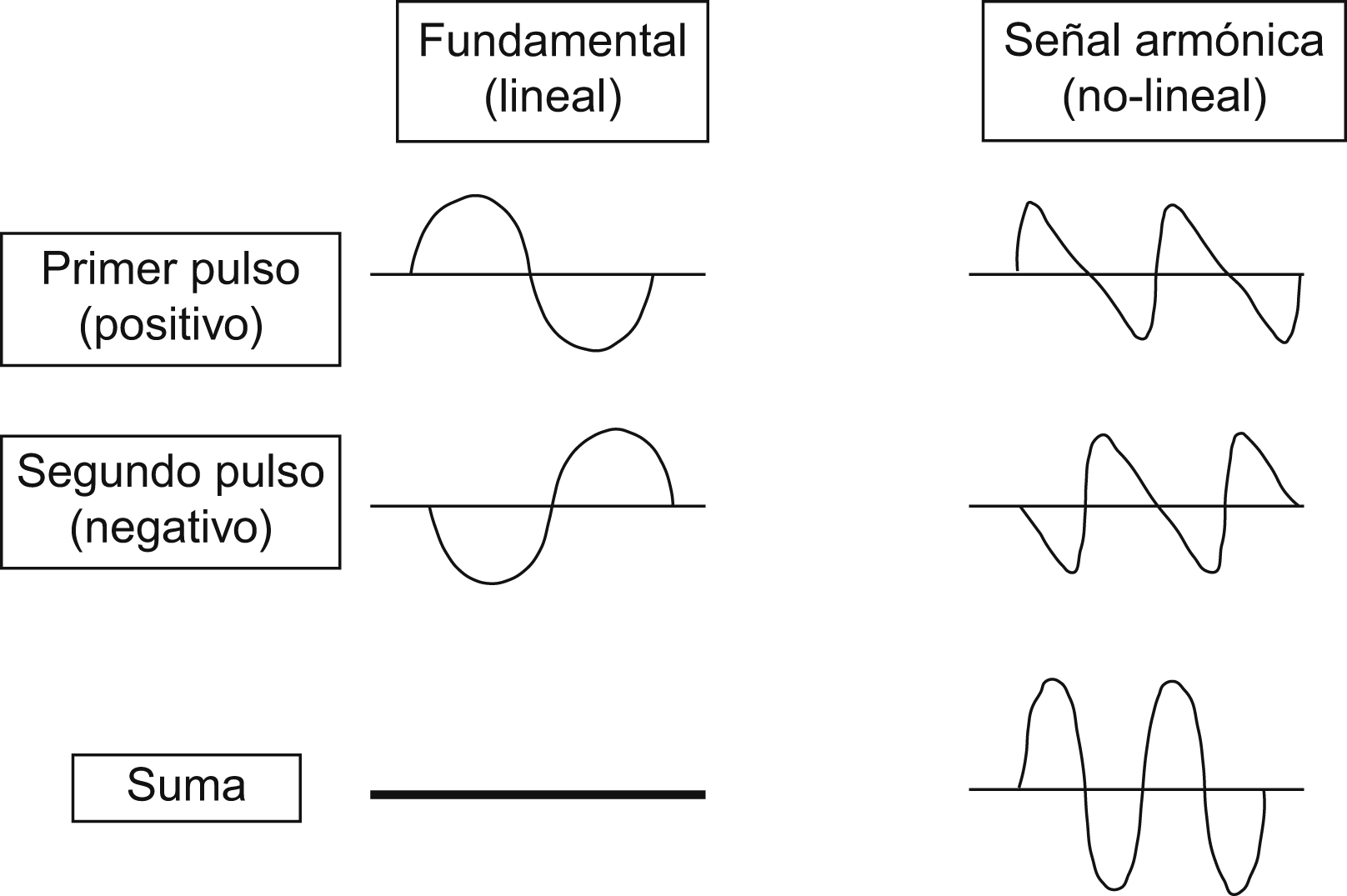
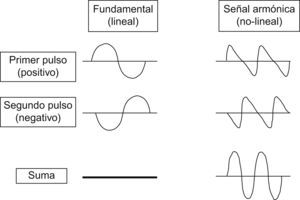
Para la evaluación de los CE se han desarrollado diversas técnicas específicas de contraste consistentes en la cancelación y/o separación de la señal lineal procedente del tejido, de la señal no-lineal procedente de la microburbujas7,8,9,10. La mayoría de equipos utiliza la técnica de inversión de pulsos (figura 1). La respuesta no-lineal de las microburbujas se basa en 2 mecanismos distintos:
Figura 1. Técnica de inversión de pulso (IP). Consiste en enviar 2 pulsos consecutivos inversos, el segundo idéntico al primero en amplitud pero con la fase invertida. El transductor detecta el eco de estos 2 pulsos sucesivos y los suma. En el tejido normal, cuyo comportamiento es lineal, esta suma es 0 y se cancela la señal. Sin embargo, como el comportamiento de las microburbujas es no lineal, la suma de ambos pulsos resultantes es distinta de 0 y provoca una señal acústica realzada.
Respuesta no-lineal con bajo índice mecánico, que minimiza la rotura de burbujas. Esto permite el estudio efectivo durante varios minutos en tiempo real.
Respuesta no-lineal con alta energía, cuando se utiliza un índice mecánico alto. Es el método que produce mayor señal acústica, pero su señal es muy transitoria.
El principal uso de los CE en radiología no cardíaca es en el hígado. Las técnicas de estudio empleadas utilizan bajo índice mecánico (IM), que permite el estudio continuo de las 3 fases vasculares cuando se usan CE con gases de solubilidad baja. Las técnicas con alto IM actualmente no están recomendadas.
El estudio debe cumplir las siguientes condiciones1:
Mantener la lesión en el campo de visión durante los movimientos respiratorios.
Administrar el CE en forma de bolo, seguido de 5–10ml de suero salino a través de una vía periférica, con un diámetro mínimo de 20G para evitar la ruptura de burbujas.
Control del tiempo del estudio con un cronómetro (aconsejable, aunque no imprescindible).
Registro del estudio en vídeo u otros medios digitales, de forma continua durante los primeros 90s (fases arterial y portal). La fase tardía se puede registrar de forma intermitente.
Una sola dosis de CE suele ser suficiente, pero se puede administrar más dosis.
En el caso de búsqueda de metástasis, debe explorarse todo el hígado, y para ello se dispone de unos 4–6min cuando se utiliza una dosis de los contrastes disponibles.
En el caso de valoración previa a tratamiento percutáneo, se recomienda medir los 3 diámetros del tumor y calcular el volumen tumoral.
La caracterización de lesiones focales hepáticas mediante CE se basa en 2 hechos:
Arterial (que se inicia a los 10–20s después de la administración del contraste y termina a los 25–35s).
Portal (de los 30–35 hasta los 120s).
Tardía (de los 120s hasta los 4–6min), por persistencia de las microburbujas en los pequeños vasos/espacio sinusoidal10. Es diferente a la fase de equilibrio (extracelular) de la TC o RM, porque los CE son puramente intravasculares.
El estudio se realiza de forma continua durante las 3 fases, a diferencia de la TC o RM cuya adquisición de datos es intermitente, por lo que pueden omitir fenómenos fugaces, como la captación de contraste en fase arterial muy precoz de algunas metástasis. La fase arterial aporta información del grado y patrón de vascularización. Las fases portal y tardía dan información del lavado de las lesiones respecto al hígado.
La dualidad de la vascularización hepática, 25–30% por la arteria hepática y el resto por vía portal (70–75%), que define 3 fases de estudio:
La ecografía convencional tiene una precisión diagnóstica de 49–65%, que aumenta hasta el 85–92% cuando se utilizan CE11,12,13,14,15.
Las características detalladas de las diferentes lesiones se resumen en la tabla 2. Las lesiones benignas se caracterizan por captar contraste en fases portal y tardía, excepto en algunas lesiones benignas como los abscesos y algunos adenomas. Algunas, además, tienen patrones de captación característicos en fase arterial, como la captación nodular periférica de los hemangiomas (figura 2) o la captación homogénea rápida en la hiperplasia nodular focal.
Tabla 2. Patrones de realce de las lesiones focales hepáticas con contraste ecográfico
| Tipo de lesión | Fase arterial | Fase portal | Fase tardía |
| Hemangioma | Realce anular globular periférico | Relleno centrípeto progresivo | Relleno completo |
| Hallazgos adicionales | Realce rápido completo en lesiones pequeñas | Áreas centrales no realzadas por trombosis o fibrosis | |
| Hiperplasia nodular focal | Realce homogéneo completo | Hiperecoico | Iso o hiperecoico |
| Hallazgos adicionales | Arterias en rueda de carro, arteria nutricia | Cicatriz central hipoecoica | Cicatriz central hipoecoica |
| Área de preservación grasa | Isocaptante | Isocaptante | Isocaptante |
| Infiltración grasa nodular | Isocaptante | Isocaptante | Isocaptante |
| Nódulo regenerativo | Isocaptante | Isocaptante | Isocaptante |
| Hallazgos atípicos | Hipocaptante | ||
| Adenoma | Realce homogéneo completo | Isocaptante | Isocaptante |
| Hallazgos adicionales | Áreas sin realce por hemorragia | Hipocaptante | Hipocaptante |
| Absceso | Realce periférico en anillo | Anillo hiper o isoecoico en lesión hipoecoica | Lesión hipoecoica |
| Hallazgos adicionales | Realce en los septos | Realce en los septos | |
| Realce segmento hepático | |||
| Hepatocarcinoma | Realce completo | Iso-hipoecoico | Hipoecoico |
| Áreas sin realce por necrosis | Áreas sin realce por necrosis | ||
| Hallazgos adicionales | Vasos caóticos | ||
| Trombo hipercaptante en vena porta | |||
| Hallazgos atípicos | No realce | No realce | Isoecoico (bien diferenciados) |
| Metástasis hipovasculares | Captación en anillo | Hipoecoica | Hipoecoica |
| Hallazgos adicionales | Áreas sin realce por necrosis | ||
| Metástasis hipervasculares | Realce completo | Hipoecoica | Hipoecoica |
| Hallazgos adicionales | Vasos caóticos | ||
| Colangiocarcinoma | Captación en anillo | Hipoecoica | Hipoecoica |
| Hallazgos atípicos | No realce o realce homogéneo |
Modificada de las guías de la EFSUMB 6 .
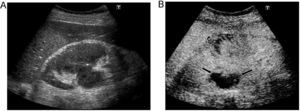
Figura 2. Hemangioma hepático. Lesión hiperecoica (A) en lóbulo hepático derecho (entre marcas) que al administrar contraste ecográfico (CE) muestra en fase arterial (B) realce nodular periférico (cabezas de flecha) con progresivo relleno centrípeto, sin poderse identificar en fase tardía (C).
Las lesiones malignas se caracterizan por ser hipocaptantes en fase tardía (figura 3). Hay excepciones, por ejemplo, el hepatocarcinoma bien diferenciado que puede ser isocaptante16,17. En fase arterial, muchas metástasis y el 95% de los hepatocarcinomas son hipervasculares.
Figura 3. Hepatocarcinoma. Comportamiento característico con contraste ecográfico (CE). A) Paciente cirrótico que presenta en la ecografía una gran lesión subcapsular levemente hiperecoica con áreas hipoecoicas en su interior. B) La lesión se realza intensamente en fase arterial (25s) excepto una pequeña área central necrótica. C) El tumor se lava rápidamente en fase portal, permaneciendo hipoecoico en fase tardía (no mostrada).
Los comportamientos de las lesiones hepáticas con los CE son muy parecidos a los que tienen lugar en la TC o la RM con contraste18. Sin embargo, pueden haber discordancias19:
Por la difusión del contraste, exclusivamente intravascular en los CE o extracelular en TC y RM, que provoca lavado en fase portal en algunos colangiocarcinomas y metástasis con los CE.
Por la adquisición de las imágenes (tiempo real en los CE; intermitente en TC y RM), que permite observar con CE hipercaptación fugaz en la fase arterial en muchas metástasis o captación globular periférica en hemangiomas, mientras son homogéneamente hipervasculares en TC o RM.
Presencia de grasa, que explica que la lesión se observe hiperecoica en todas las fases, mientras que en la TC es hipodensa.
Hallazgo incidental de lesión focal en la ecografía.
Nódulos en pacientes con hepatitis crónica o cirrosis.
Caracterización de trombosis portal.
Nódulos en pacientes oncológicos.
Nódulos que en TC, RM o citología/histología no son concluyentes.
La caracterización de estas lesiones debe realizarse en conjunto con la historia clínica y datos de laboratorio. Cuando los hallazgos son típicos, especialmente en los casos de hemangioma, hiperplasia nodular focal, hepatocarcinoma o metástasis, el diagnóstico es muy probable. Cuando los hallazgos son atípicos debe recurrirse a otras técnicas.
InconvenientesLas lesiones que están muy profundas (>10cm) o las situadas en hígados con mala transmisión del sonido, son difíciles de caracterizar.
Detección de lesiones focalesLa ecografía convencional es menos sensible que la TC o la RM para detectar metástasis hepáticas. La introducción de los CE ha incrementado la capacidad de detectar metástasis (85–91%) con respecto al estudio ecográfico convencional (40–81%)20,21,22. Esto es particularmente útil en las metástasis isoecoicas, en las lesiones<1cm y en las lesiones profundas. Algunos estudios han demostrado la equivalencia entre la ecografía con contraste y la TC para detectar metástasis21,22. También se ha demostrado que el uso de CE en ecografía intraoperatoria mejora los resultados de esta técnica23.
Indicaciones y recomendacionesPara descartar metástasis o abscesos, excepto si la ecografía convencional ya es concluyente. Las metástasis son hipoecoicas en las fases portal y tardía. En fase arterial su comportamiento es variable: hipovasculares, con o sin captación en anillo, o bien hipervasculares, con realce homogéneo. Los abscesos realzan en anillo en fase arterial, para quedarse como lesiones hipoecoicas en fases portal y tardía.
En casos en que el número de lesiones y su localización sea importante para decidir el tratamiento, como complemento a la TC o RM.
Sospecha de colangiocarcinoma cuando otros métodos de imagen no son concluyentes.
Algunas situaciones de traumatismo hepático (v. sección correspondiente).
Las metástasis muy pequeñas (<5–10mm) pueden pasar desapercibidas.
Los quistes muy pequeños pueden confundirse con metástasis en la fase tardía (necesidad de valorar la ecografía convencional).
Las lesiones subdiafragmáticas, especialmente las del segmento 8 y las lesiones profundas en hígados con mala transmisión del sonido, son difíciles de valorar.
No es la mejor técnica para la detección de hepatocarcinomas, especialmente en cirróticos, por la heterogenicidad del hígado y la corta duración de la fase arterial que impide estudiar en esta fase todo el hígado.
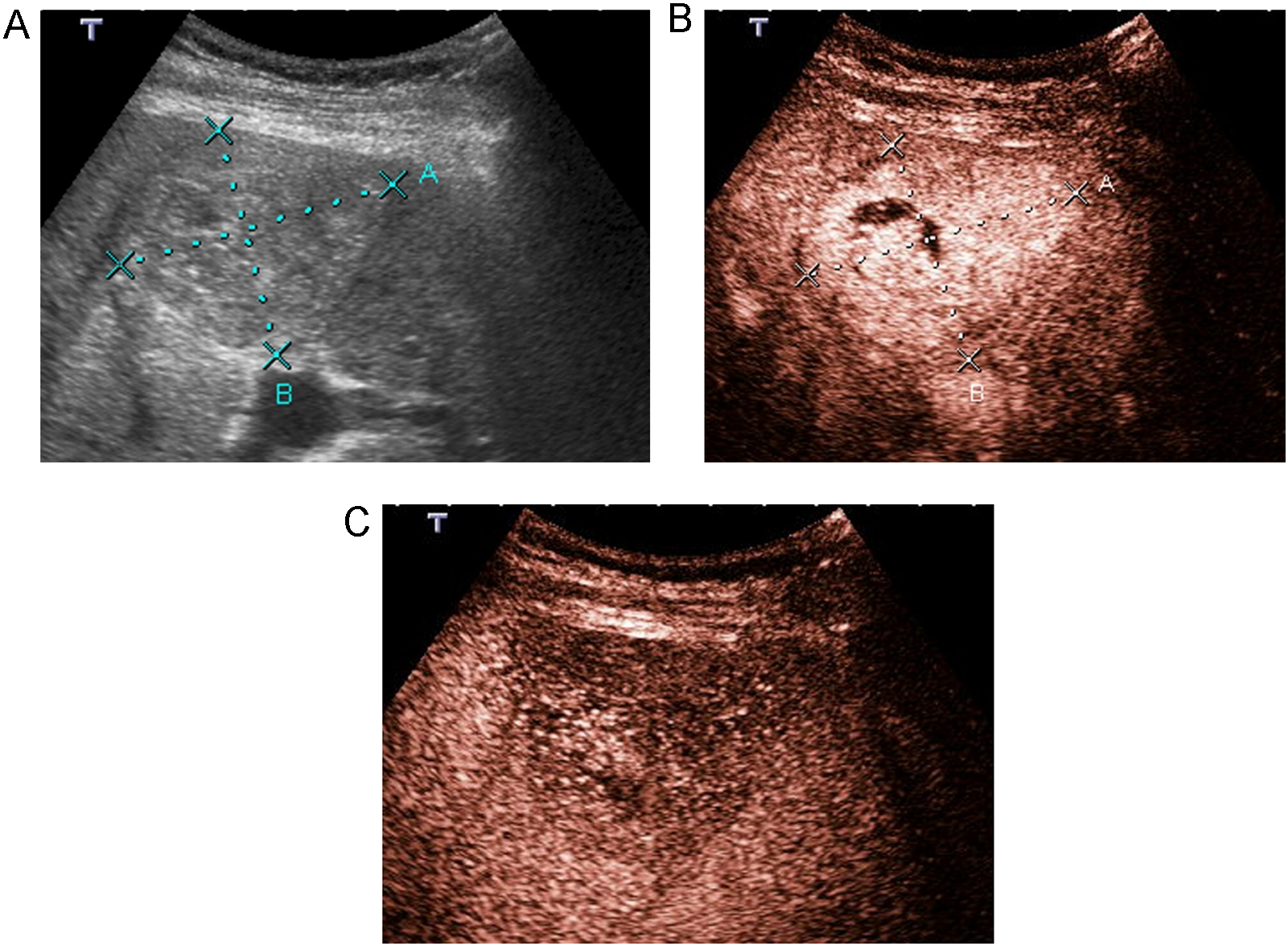
El hallazgo más importante que sugiere la necrosis total del tumor es la ausencia de captación de contraste de todo el volumen del tumor, sobre todo en fase arterial (figura 4). Debe compararse el tamaño del área avascular antes y después del tratamiento, único dato para valorar en tumores hipovasculares si el tumor se ha tratado con un margen de seguridad de 5–10mm1.
Figura 4. Hepatocarcinoma con signos de persistencia/recidiva tumoral. Paciente con un hepatocarcinoma tratado con radiofrecuencia y ablación tumoral completa en el seguimiento. En el control al cabo de 4 años se observa en la ecografía (A) una lesión de 2cm ovalada, isoecoica con centro hipoecoico correspondiente al área tratada (entre cabezas de flecha) y un nódulo hipoecoico periférico de nueva aparición (entre cruces). Al administrar contraste se observa en fase arterial (B) una zona avascular de 2cm correspondiente a necrosis tumoral (entre cabezas de flecha), mientras que el nódulo periférico realza intensamente, en relación con recidiva tumoral (entre cruces).
Es fácil confundir en los primeros 30 días postratamiento el halo hipervascular peritumoral con tumor residual. Se puede evitar comparando las imágenes pre y postratamiento.
Indicaciones y recomendaciones 1,6,24Localización y guía de los tratamientos percutáneos. En general los CE no son necesarios para localizar las lesiones antes de su tratamiento ni para guiar las agujas durante el procedimiento. Sin embargo, hay 3 situaciones en las que pueden ser de ayuda para localizar los tumores25,26: a) hepatocarcinomas detectados por TC o RM no identificables en la ecografía basal; b) metástasis hipovasculares de muy pequeño tamaño, generalmente subcentimétricas, escasamente visibles o invisibles en la ecografía basal, y c) retratamiento de áreas de persistencia tumoral o recidiva local, en las que la ecografía convencional no puede distinguir entre el área de tumor necrosado y el área de tumor viable.
Evaluación inmediata postratamiento y guía para el retratamiento inmediato de lesión residual (controvertido). Diversos grupos defienden la ecografía contrastada inmediatamente después del tratamiento para identificar restos de tumor viable y volver a tratar en la misma sesión25,26. Sin embargo, la presencia de gas en el interior de la lesión inmediatamente después del tratamiento determina que la sensibilidad para detectar restos tumorales, tanto de la ecografía con contraste como de la TC a las 24h, sea muy baja24. La ecografía contrastada realizada al mes tiene una sensibilidad, especificidad y precisión diagnóstica de 91, 96 y 95%, respectivamente, en la identificación de la persistencia tumoral, resultados equivalentes a los alcanzados por la TC o la RM, técnicas consideradas hoy en día de referencia24,25,26,27.
Valoración y seguimiento a más largo plazo.
Valoración de recurrencia cuando la TC o RM no son concluyentes o están contraindicados.
Vienen determinadas por la profundidad de la lesión y el grado de atenuación del hígado.
Sólo se puede valorar una lesión durante la administración de contraste, por lo que si hay tumores de nueva aparición que estén fuera del campo de estudio suelen pasar desapercibidos. Es aconsejable, por tanto, hacer un rastreo de todo el hígado en la fase tardía en busca de nuevas lesiones y alternar en los controles la ecografía contrastada con la TC o la RM.
Valoración de las complicaciones vasculares en el seguimiento del trasplante hepático. La ecografía contrastada es mejor que la ecografía Doppler para evaluar la permeabilidad de la arteria hepática y de la vena porta28.
Valoración de la permeabilidad portal en pacientes con mala transmisión del sonido.
Estudio de permeabilidad de las derivaciones portosistémicas intrahepáticas transyugulares.
Tras la inyección del CE se observan de forma detallada las arterias renales en la fase arterial precoz, seguido por un realce uniforme e intenso del córtex renal. Las pirámides se realzan gradualmente, haciéndose isoecoicas al córtex 20–30s más tarde, aunque a veces pueden permanecer levemente hipoecoicas. El intenso realce del parénquima normal facilita la detección de trastornos vasculares, tipo infarto o laceraciones traumáticas, donde hay áreas hipoperfundidas. Los CE no están contraindicados en pacientes con insuficiencia renal, ya que no se excretan por la vía urinaria.
Indicaciones y recomendacionesEvaluación de variantes anatómicas (p. ej., hipertrofia de columna de Bertin). Los seudotumores realzan de forma similar al resto del parénquima, mientras que los verdaderos tumores generalmente muestran diferencias de captación con el tejido normal en alguna de las fases29,30.
Caracterización de lesiones quísticas complejas. Las lesiones tipos IIF, III y IV, según la clasificación de Bosniak, son probablemente la indicación más evidente de los CE en el riñón. La ecografía con contraste muestra hallazgos similares o superiores a la TC en la clasificación de las lesiones quísticas complejas renales con el sistema Bosniak31,32,33. La ecografía con contraste puede ser especialmente útil en pacientes con lesiones que requieran seguimiento para evitar mayor radiación.
Sospecha de lesiones vasculares, especialmente infartos parciales o totales del riñón, que muestran ausencia de realce en todas las fases.
Detección y caracterización de la trombosis de la vena renal.
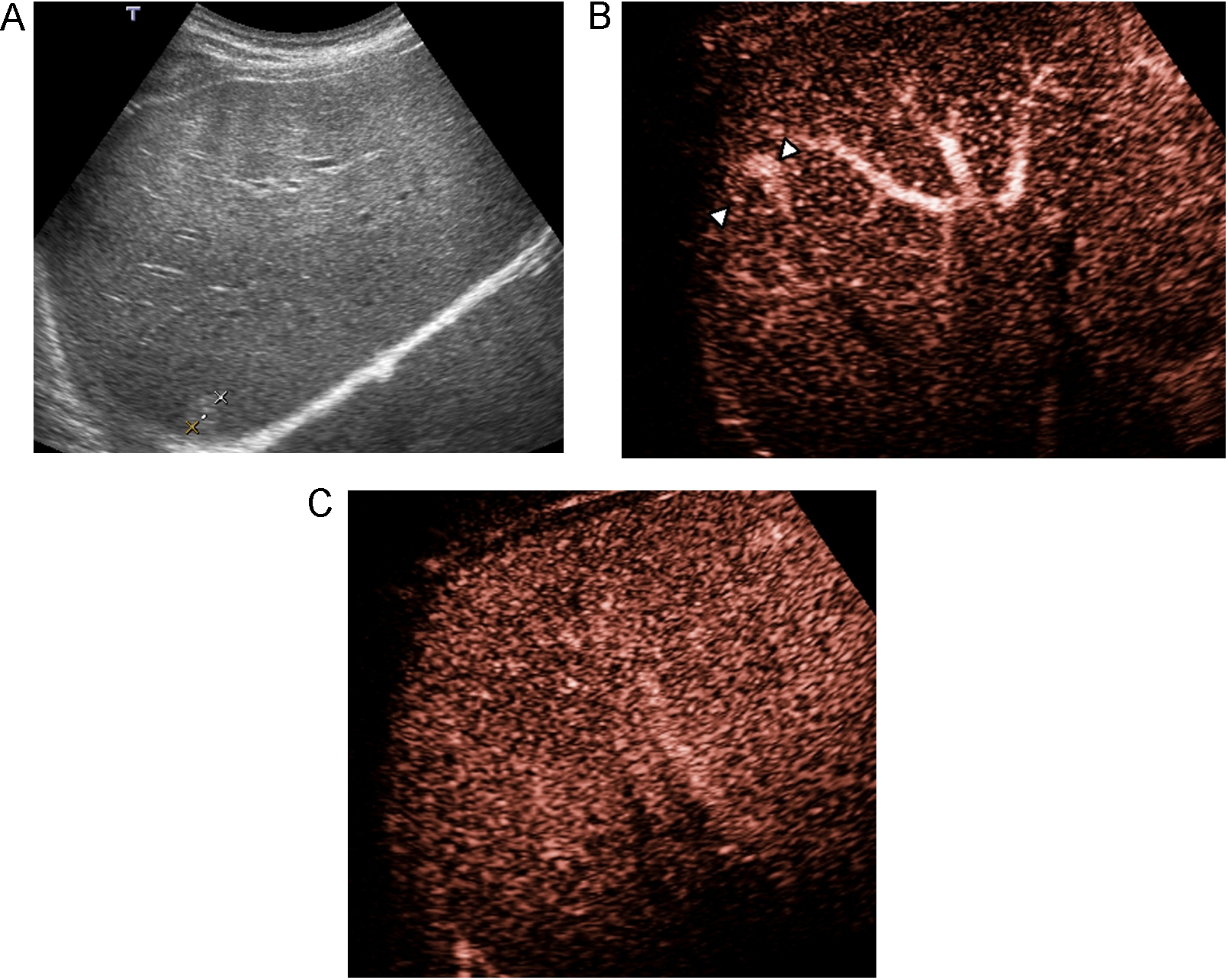
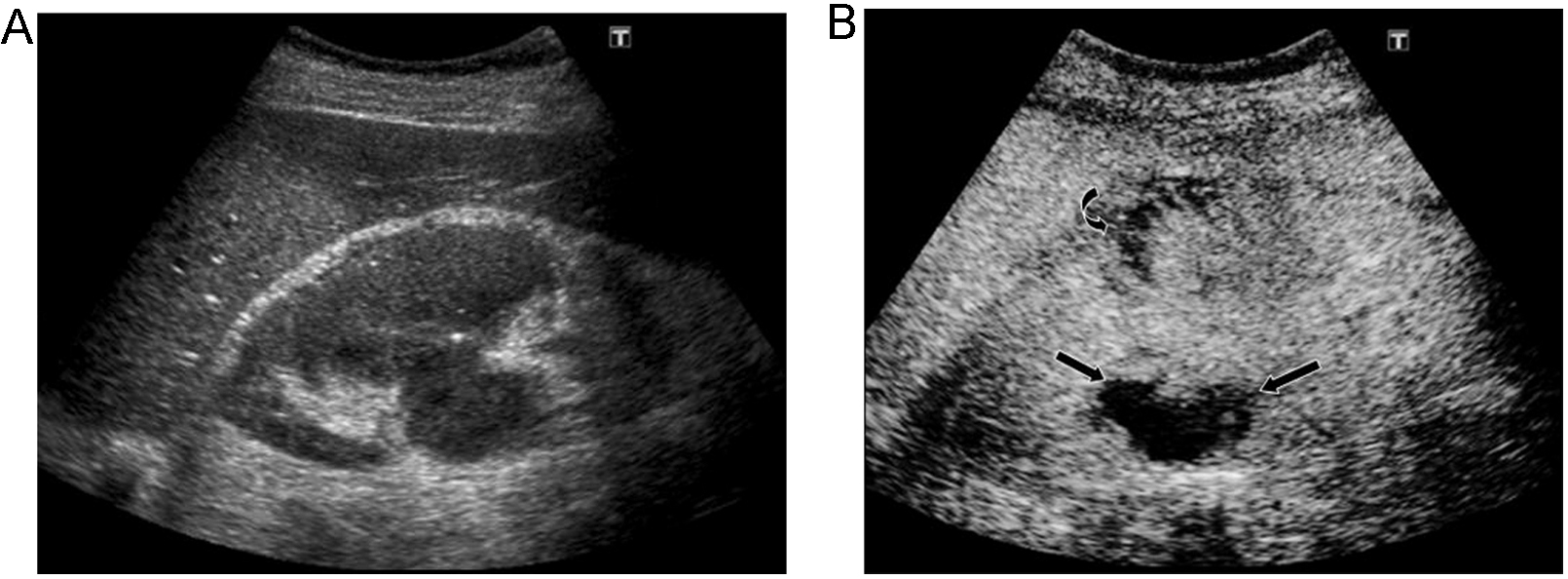
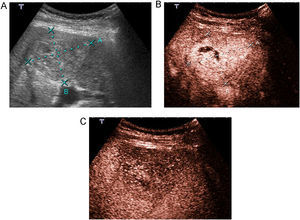
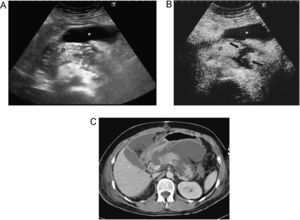
Evaluación de la pielonefritis aguda, tanto en la detección de lesiones como en la de sus complicaciones. La técnica permite la detección de lesiones con sensibilidad y especificidad similar a la TC; además es útil en el seguimiento34,35. Las nefritis focales se ven como zonas de realce menor que la cortical adyacente, de morfología triangular, lineal o redondeada, mientras que los abscesos se observan como áreas con ausencia de realce durante todas las fases, en las que puede haber realce periférico (figura 5)36.
Figura 5. Pielonefritis aguda. Paciente con sepsis y dolor en hipocondrio derecho. A) La ecografía muestra un riñón derecho edematoso y heterogéneo. B) Tras inyección de contraste se observan varios focos de realce menor que la cortical en la parte anterior del riñón en relación a focos de nefritis focal (flecha curva), definiéndose en la parte posterior del riñón una zona de ausencia de realce correspondiente a un absceso (flechas).
Trasplante renal: evaluación de infartos o trombosis venosas. Con el contraste se obtiene una mejor definición de las colecciones perirrenales.
Monitorización de tumores tratados percutáneamente con radiofrecuencia: tanto en la planificación del tratamiento como en el seguimiento.
Aunque la mayoría de tumores son hipervasculares en fase precoz e hipoecoicos en fases tardías, no está demostrado que la utilización de CE aumente su detección.
No permiten diferenciar entre lesiones sólidas malignas o benignas.
Sonovue® no se recomienda en el estudio de la estenosis de la arteria renal, ya que no está comprobado que sea superior a la ecografía Doppler.
Los CE permanecen en el lecho vascular, por lo que no informan de la función excretora de los riñones.
El uso intravesical de CE, denominado urosonografía miccional, en el estudio del reflujo vesicoureteral (RVU) es la única indicación aceptada en pediatría37,38,39. En esta indicación sólo está aprobado el uso de Levovist®. Con el uso intravesical no se han descrito reacciones adversas.
El CE se administra a través de una sonda urinaria del 5-8F de 3 vías, por una de las cuales se inyecta lentamente Levovist® (5–10% del volumen vesical, 7ml como dosis habitual) a una concentración de 300mg/ml y, por otra, suero salino al 0,9% en volumen variable hasta el relleno total de la vejiga37,38.
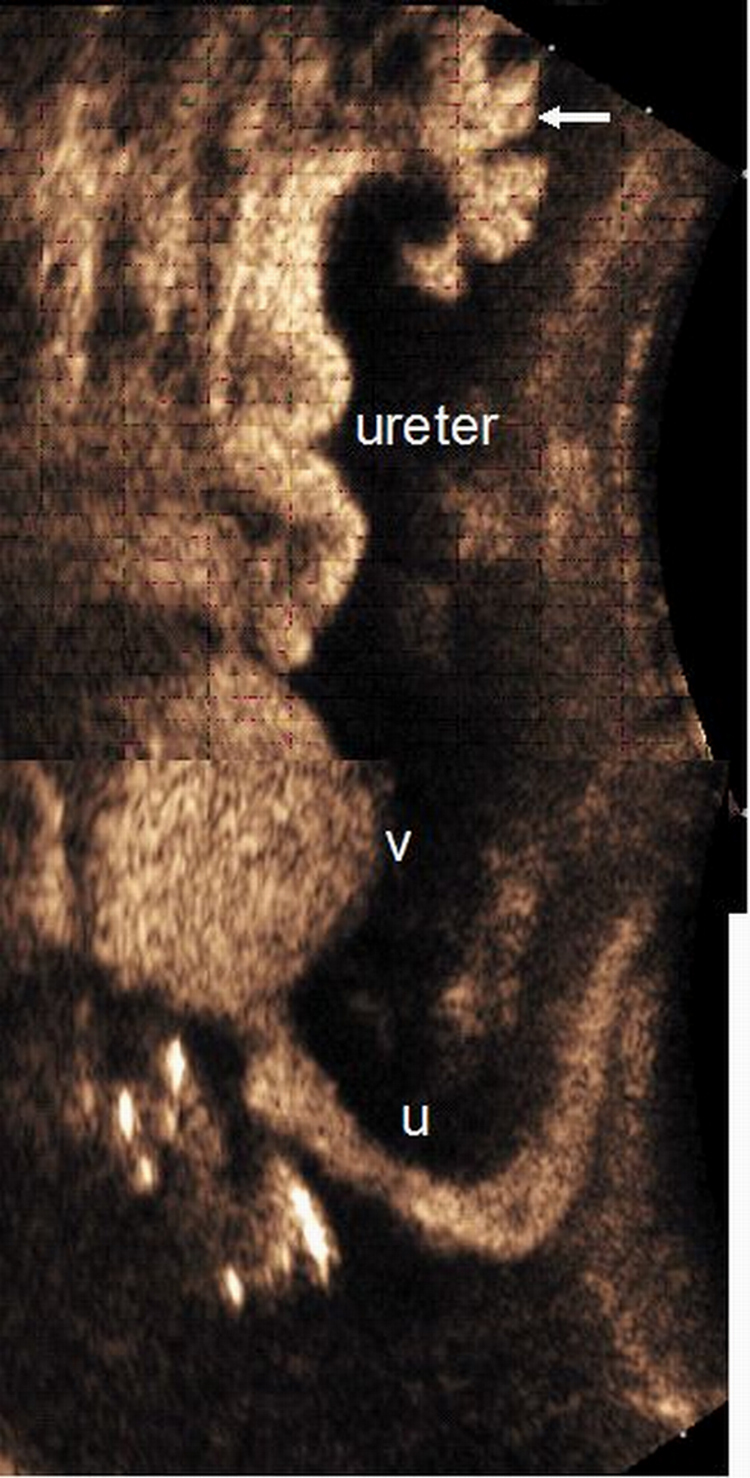
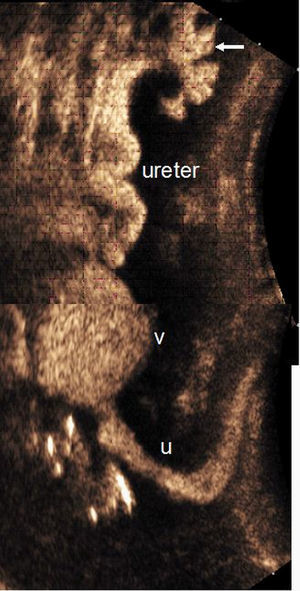
Los uréteres distales y la pelvis renal se estudian por vía transabdominal, tanto en máxima repleción vesical como postmiccional. La visualización de contenido ecogénico (microburbujas) en estas localizaciones indica RVU (figura 6). La uretra se estudia por vía transperineal durante la micción1,37. Las microburbujas se observan mejor si se utiliza imagen armónica.
Figura 6. Reflujo vesicoureteral grado III. Composición ecográfica de un estudio con contraste ecográfico (CE) intravesical realizado en un niño, con vejiga llena (v) durante la micción, donde se observa la uretra (u). Se identifica contraste en el uréter y en el sistema pielocalicilar (flecha).
IndicacionesLa urosonografía es la primera prueba que hay que realizar en el estudio del RVU, porque es más sensible que la cistouretrografía y porque no irradia1,37,38,39.
Posibilidad de estudiar también la uretra37.
Seguimiento del RVU tratado.
Cribado de RVU en situaciones especiales (p. ej., trasplante renal).
El páncreas es un órgano muy perfundido cuyo aporte vascular es completamente arterial, por lo que el parénquima normal se contrasta de forma homogénea prácticamente coincidiendo con el realce de la aorta (15–20s). El parenquimograma es más precoz y más corto que el del hígado por la ausencia de aporte venoso, y hay un lavado rápido después de la fase arterial. Este hecho determina que las lesiones hipo o avasculares (necrosis, tumores quísticos) se vean mejor que las vasculares (tumores neuroendocrinos).
Indicaciones y recomendacionesEvaluación de masas sólidas: la gran mayoría de los adenocarcinomas son hipovasculares, por lo que se visualizan hipoecoicos durante todas las fases del estudio. Los CE no aumentan la detección de lesiones, pero permiten definir mejor el tamaño y los márgenes de la lesión visualizada, así como la infiltración de los vasos peripancreáticos40,41. Además, en la fase portal se puede explorar el hígado para la detección de metástasis hepáticas.
Diferenciación entre adenocarcinoma y seudomasas en el contexto de pancreatitis (aguda o crónica). En la ecografía con contraste, los focos de pancreatitis realzan de forma similar al resto del páncreas, mientras que el adenocarcinoma permanece hipoecoico en todas las fases por la intensa reacción desmoplásica y la baja densidad vascular42,43,44.
Diferenciación entre seudoquistes y tumores quísticos: los seudoquistes muestran ausencia de realce en todas las fases, independientemente de su contenido interno en la ecografía basal. La cápsula puede realzar si el seudoquiste es reciente. En los tumores quísticos se observa siempre realce de tabiques o nódulos45. En el estudio de D′Onofrio et al46 la ecografía con contraste permitió identificar el 93% de los tabiques y el 75% de los nódulos de 33 masas quísticas analizadas histológicamente, sin encontrar diferencias significativas con la RM.
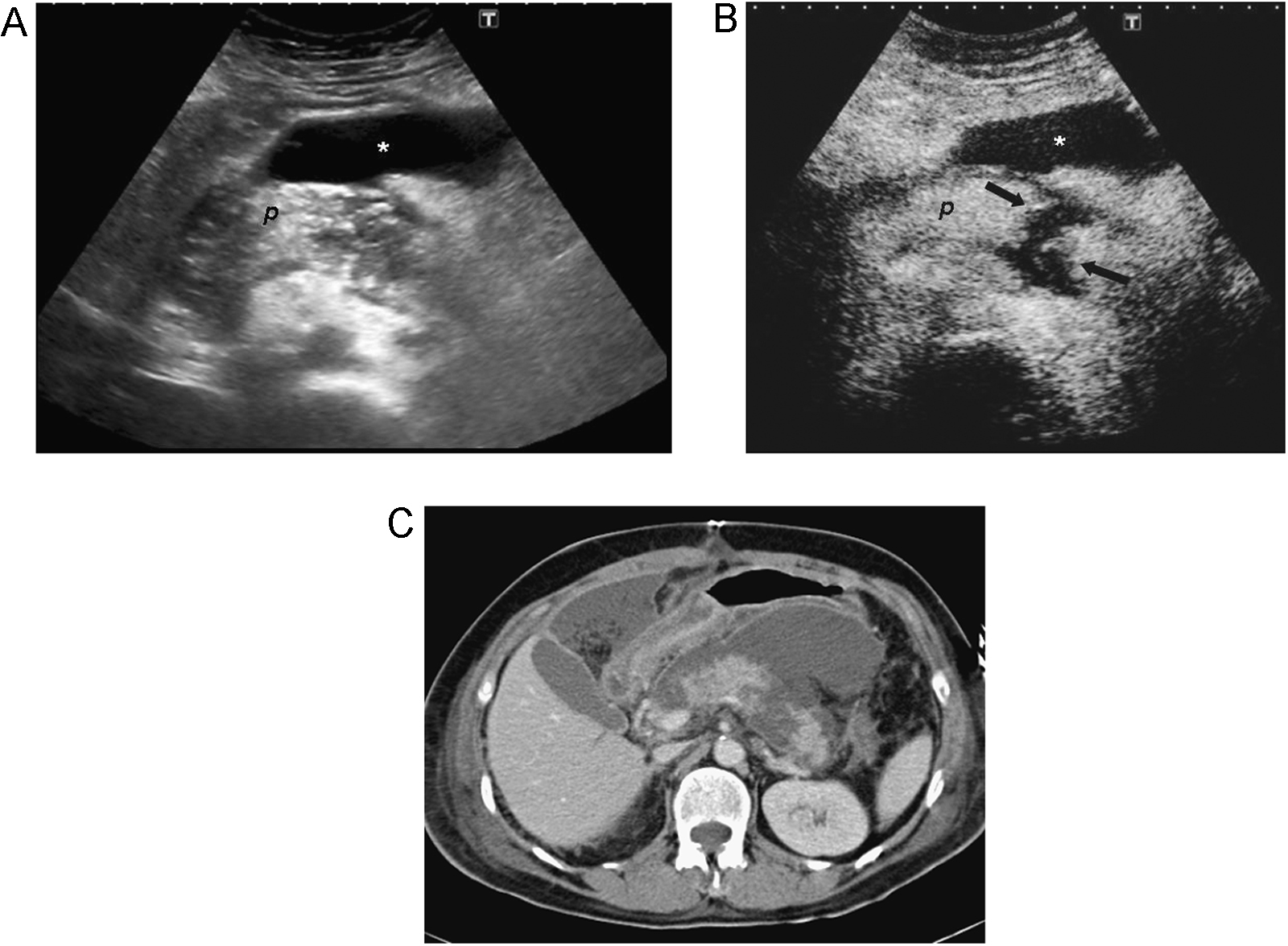
Evaluación de zonas de necrosis en las pancreatitis agudas. Tras inyección de CE las zonas de necrosis se comportan como áreas hipoperfundidas y las pancreatitis focales como áreas normoperfundidas (figura 7). Además las colecciones se identifican mejor que en la ecografía basal. Rickes et al47 detectan por ecografía el 100% de las necrosis diagnosticadas con TC. La ecografía con CE se puede recomendar para pacientes alérgicos al contraste iodado o con insuficiencia renal, o pacientes de UCI que no puedan ser trasladados a la sala de TC.
Figura 7. Pancreatitis aguda. A) La ecografía en modo-B muestra un páncreas (p) agrandado y heterogéneo, con una colección anterior anecoica (*). B) Tras inyección de contraste ecográfico el páncreas (p) realza intensamente, excepto una zona de necrosis en el cuerpo donde se observa ausencia de realce (flechas). C) La tomografía computarizada correspondiente confirma los hallazgos de la ecografía con contraste.
El corto período de realce limita la ventana diagnóstica.
El uso de CE no aumenta la detección de neoplasias.
El intenso realce de los tejidos peripancreáticos dificulta la valoración de los tumores hipervasculares.
La TC es, indiscutiblemente, la técnica indicada en el paciente politraumatizado, debido a la rapidez y seguridad con que permite evaluar la presencia de lesiones en cualquier órgano. Sin embargo, hay muchos casos de traumatismos abdominales de baja energía donde el rendimiento de la TC no es tan evidente, ya que la probabilidad de lesiones es baja y la mayoría de estudios realizados son normales. Además, muchos de estos pacientes son jóvenes y se debe disminuir la radiación.
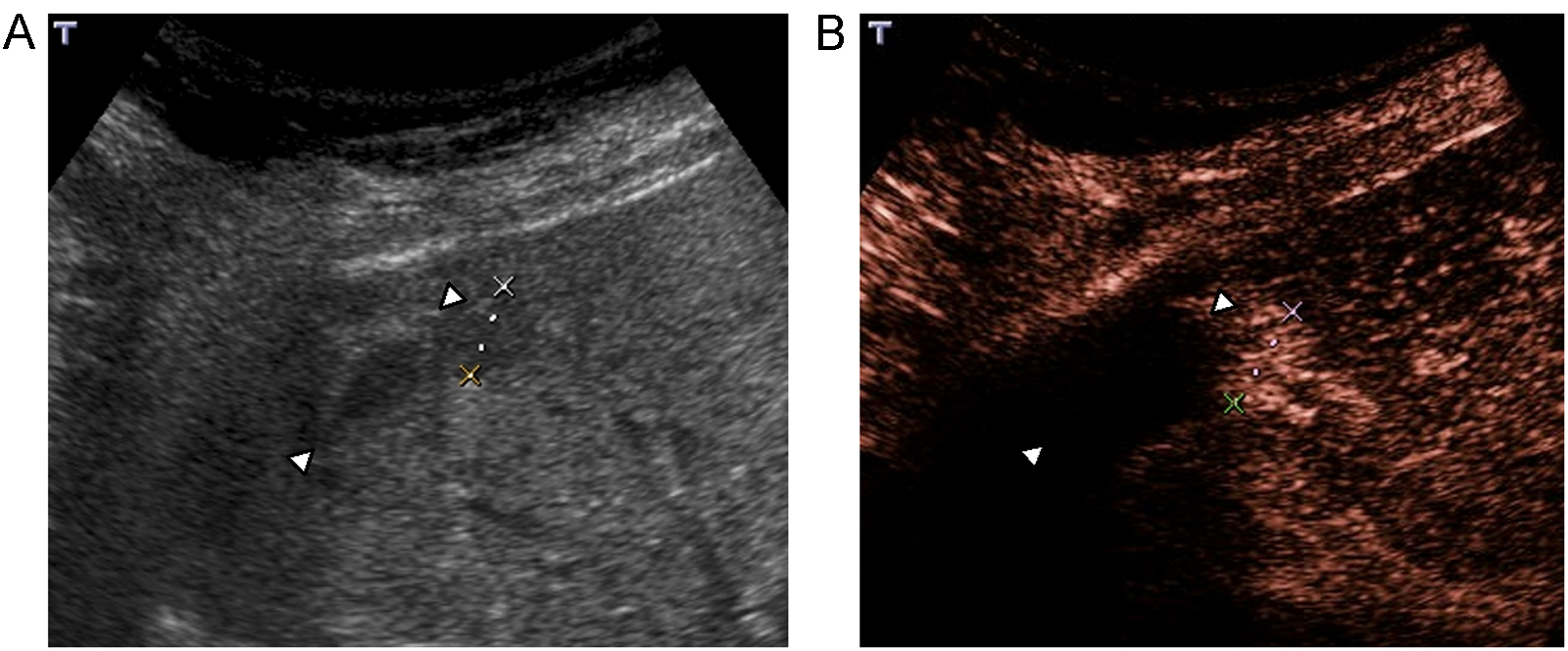
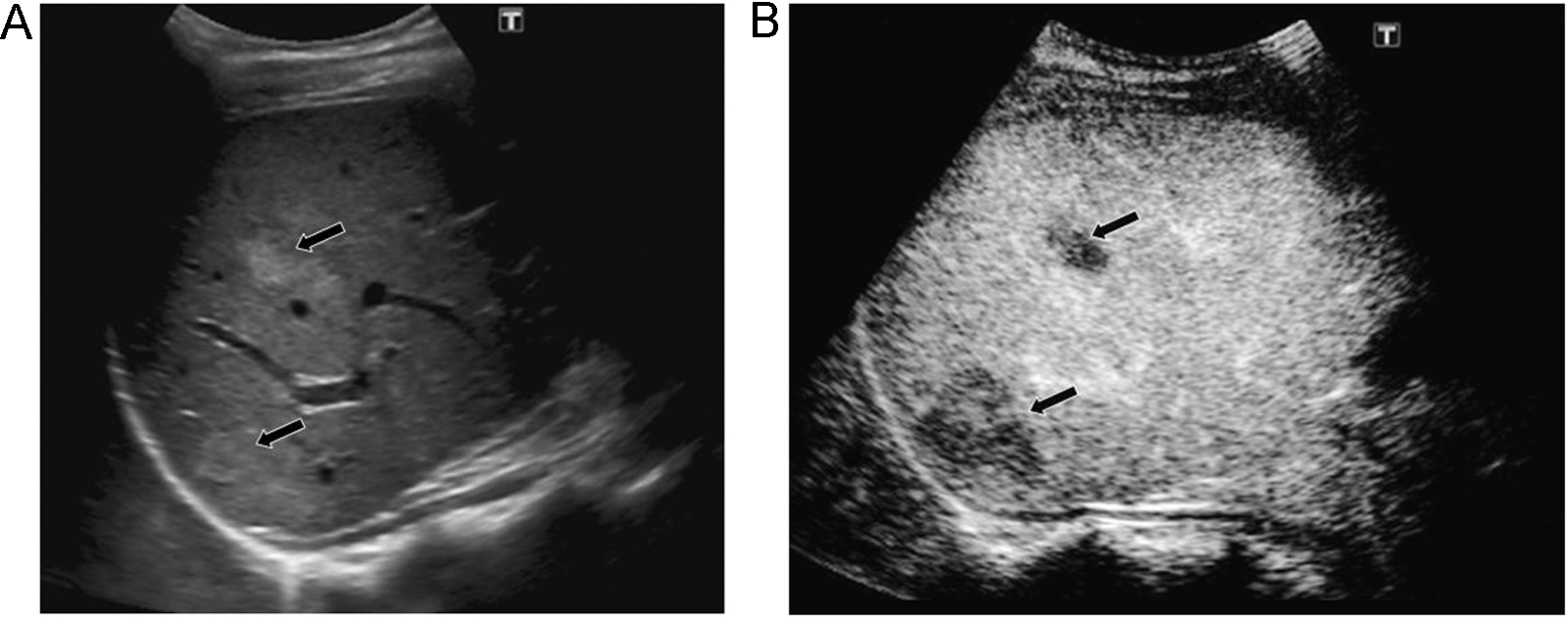
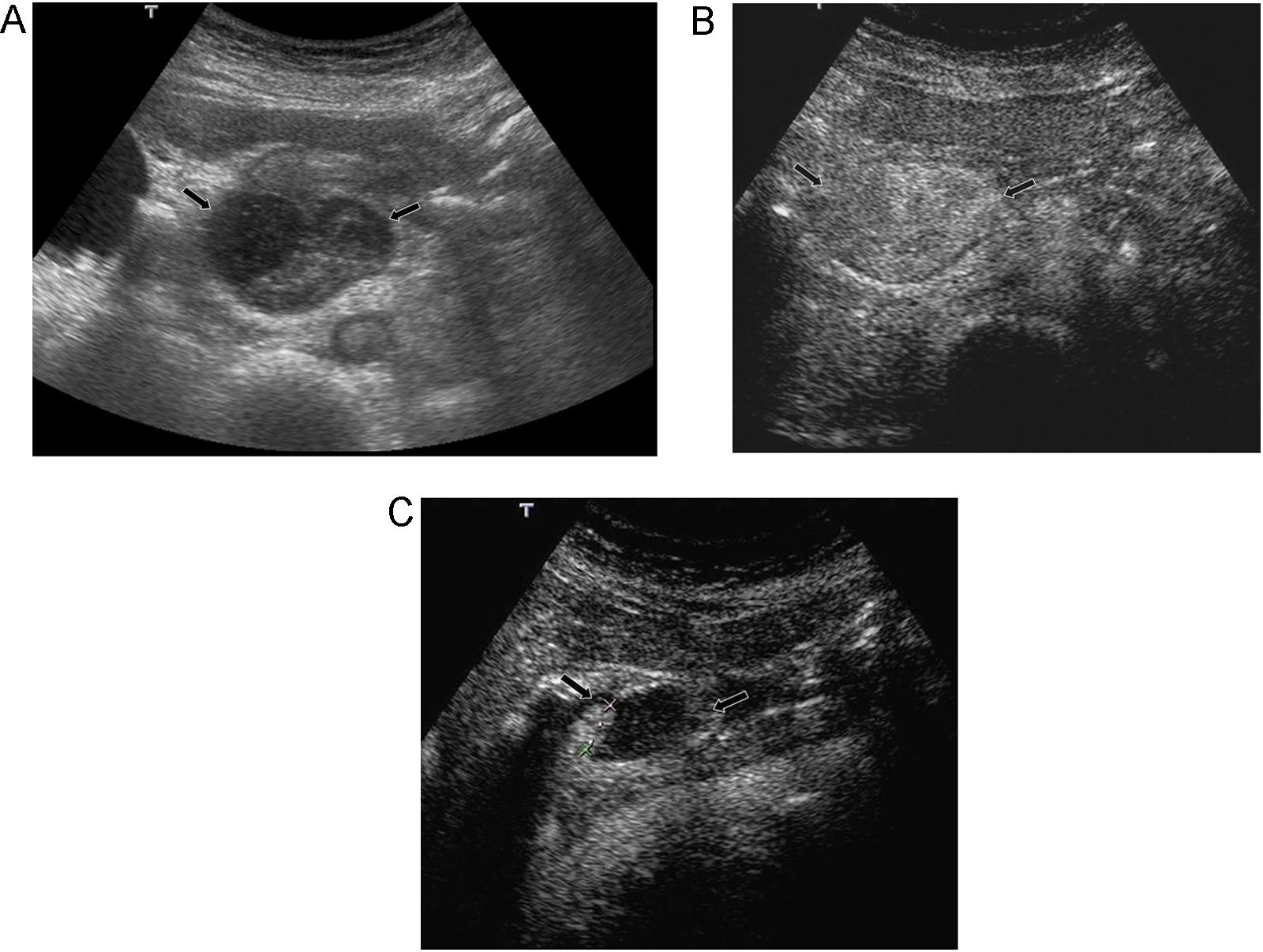
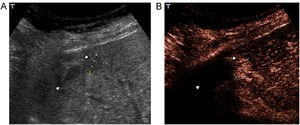
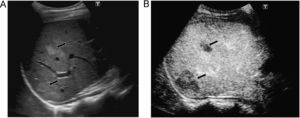
Indicaciones y recomendacionesTraumatismos de baja o moderada intensidad, especialmente en casos de trauma localizado en flancos o hipocondrios. En un estudio multicéntrico reciente que incluyó 156 pacientes, comparando con la TC, la ecografía con contraste obtuvo una sensibilidad del 94% y una especificidad del 89% en la detección de lesiones parenquimatosas48. En esta serie, todos los falsos negativos fueron laceraciones menores que se trataron de forma conservadora. Las laceraciones y los hematomas en los órganos sólidos abdominales se identifican como zonas de ausencia de realce en comparación con el parénquima circundante normal (figura 8)49,50,51,52. La ausencia de realce de todo el órgano indica avulsión vascular. El hecho de que las lesiones se vean como hipovasculares durante todas las fases, permite estudiar con una sola inyección todos los órganos en la mayoría de los casos. Los sangrados activos se visualizan ya en fases precoces como focos hiperecoicos que se acumulan en el interior del parénquima o de los hematomas periviscerales50,51,53. Los seudoaneurismas también se ven como focos hiperecoicos ya visibles desde el primer minuto, pero con morfología redondeada54.
Figura 8. Traumatismo leve en hipocondrio derecho por accidente de moto. A) Por abordaje intercostal ecográficamente se identifican 2 pequeñas zonas ecogénicas en lóbulo derecho hepático (flechas). B) El menor realce de las 2 lesiones tras inyección de contraste es concordante con focos de contusión.
Pacientes inestables, con contraindicación para ser trasladados a la sala de TC.
Pacientes con TC de pobre calidad (sin contraste, artefactos, movimientos, etc.), para resolver dudas. La utilización de CE puede confirmar o descartar lesiones en un área particular de interés.
La principal indicación es el seguimiento de lesiones de órganos sólidos detectadas con TC y manejadas de forma conservadora, para evitar controles repetidos de TC y disminuir la dosis de radiación.
Si la ecografía basal no visualiza bien todo el órgano que se estudia, no se debe inyectar contraste, ya que el examen será subóptimo.
No permite evaluar lesiones asociadas en asas intestinales o mesenterio, ni lesiones de la vía excretora renal.
Los CE en el intestino básicamente se han utilizado en la enfermedad inflamatoria intestinal. En pacientes con enfermedad de Crohn activa hay un proceso de neoangiogénesis en la pared intestinal de los segmentos inflamados, con proliferación de microvasos en la lámina propia y en la submucosa. Con el Doppler color sólo se puede valorar la presencia de vasos macroscópicos, mientras que con los CE se puede evaluar también la microvascularización de la pared intestinal, sin que el peristaltismo intestinal influya en su valoración55. El realce de la pared se produce a los 10–20s de la inyección, con lavado lento posterior. La introducción de técnicas de cuantificación permite realizar medidas objetivas del realce de la pared. La dosis de contraste requerida es la mitad de la habitual (1,2ml).
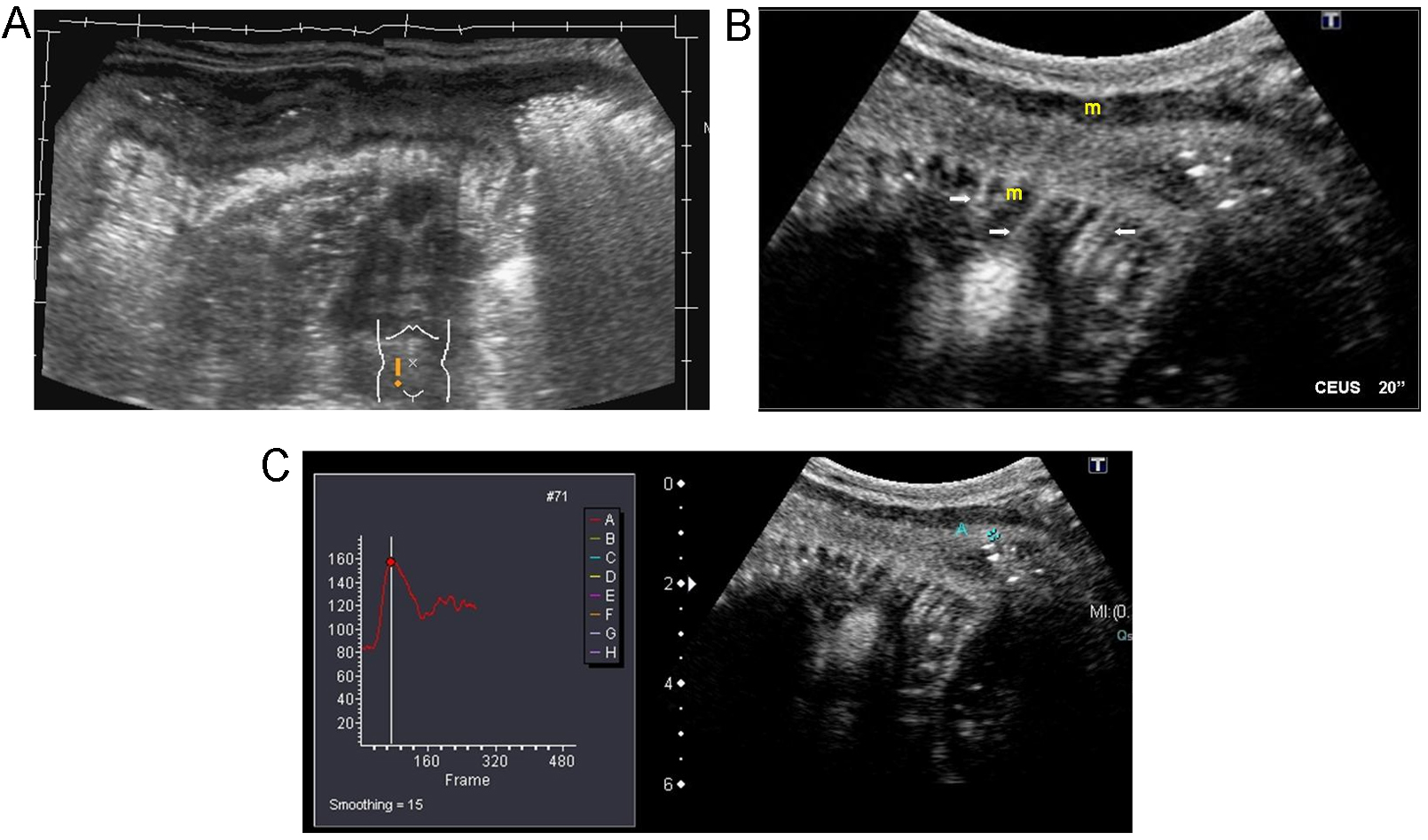
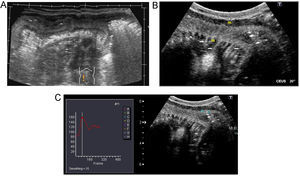
Indicaciones y recomendacionesLa principal aplicación clínica en la enfermedad de Crohn es la cuantificación de la actividad inflamatoria, dato importante para monitorizar la respuesta al tratamiento. Varios estudios han demostrado una correlación muy buena entre CDAI (Crohn′s Disease Activity Index) y realce del asa tras la inyección de contraste56,57,58. Los pacientes con enfermedad activa muestran realce completo de la pared o realce de las capas internas (mucosa y submucosa)58. Las medidas cuantitativas del realce de la pared intestinal mediante análisis de curvas brillo-tiempo son más objetivas y precisas, y se correlacionan significativamente con la actividad inflamatoria endoscópica (figura 9)59. La valoración del realce permite determinar el grado de respuesta al tratamiento médico.
Figura 9. Paciente con enfermedad de Crohn y resección ileocecal previa con recurrencia de la enfermedad. A) Imagen panorámica ecográfica longitudinal de fosa ilíaca derecha que muestra engrosamiento de las paredes del íleon neoterminal. B) Tras inyección de contraste ecográfico (CE) realzan de forma intensa las capas internas de la pared (flechas), excepto la muscular propia (m); nótese los vasos mesentéricos atravesando la pared, equivalente al signo del peine descrito en la tomografía computarizada o la resonancia magnética. C) Curva brillo/tiempo en un ROI definido que permite medidas objetivas de la vascularización parietal.
Diferenciación entre estenosis inflamatoria o por fibrosis (tejido cicatricial), objetivando realce mural en las estenosis inflamatorias y ausencia o realce escaso en las fibróticas60.
Distinguir con seguridad flemones y abscesos en los casos en que haya duda en la ecografía basal. Los flemones realzan, ya que son masas inflamatorias, mientras que los abscesos son avasculares.
La valoración de cada segmento intestinal necesita una dosis de contraste.
Necesidad de especificar el segmento intestinal que se ha estudiado, para evaluar el mismo segmento durante la monitorización del tratamiento.
Se están utilizando los CE en otras múltiples aplicaciones, como:
Doppler transcraneal. A través de un abordaje temporal u occipital, la utilización de CE mejora la visualización, tanto de los vasos normales como de oclusiones, seudo-oclusiones (por flujo lento o por pobre ventana de insonación), estenosis y colaterales en el árbol vascular intra y extracraneal61. También se ha descrito su utilización en la valoración de la perfusión parenquimatosa cerebral.
Bazo. Los CE son útiles en el estudio de múltiples patologías esplénicas: bazo accesorio, infartos, abscesos, hemangioma, metástasis, linfoma, traumatismos62.
Próstata. Los CE mejoran la visualización de la microvascularización asociada a los cánceres de próstata, visibles como focos de hipercaptación. Las biopsias transrectales dirigidas a las zonas con mayor realce detectan más cánceres por biopsia, lo cual permite disminuir el número de biopsias y, por tanto, de complicaciones63,64. Además, las biopsias dirigidas por el realce con contraste detectan cánceres con mayor índice de Gleason65.
Pelvis femenina. Los CE han demostrado su utilidad en la valoración inmediata de la eficacia de la embolización de los miomas uterinos66. La persistencia de realce en el interior del mioma está relacionada con la recurrencia y el posterior crecimiento del mioma. No está demostrada su utilidad en la caracterización de las masas ováricas67.
Mama. Hay controversia acerca de si los CE mejoran los resultados de la mamografía en la diferenciación entre masas benignas y malignas68,69. En la valoración de la respuesta tumoral a la quimioterapia neoadyuvante han mostrado resultados similares a la RM, que es la técnica utilizada actualmente70. La recurrencia tumoral realza con el CE, por lo que podría ser útil en la diferenciación con cambios posquirúrgicos. Los CE inyectados por vía subcutánea han demostrado muy buenos resultados en la detección de metástasis en el ganglio centinela en modelos animales; sin embargo, en la actualidad esta aplicación está todavía en fase experimental.
Adenopatías. La utilización de contrastes permite diferenciar con alta precisión entre adenopatías benignas y tumorales basándose en el patrón de vascularización71,72,73. Los ganglios inflamatorios típicamente muestran realce homogéneo, mientras que los tumorales tienen realce heterogéneo, con áreas de ausencia o escasa captación correspondientes a zonas de infiltración tumoral72. La obtención automática de curvas de captación muestra diferencias significativas entre adenopatías benignas y tumorales, permitiendo una valoración más objetiva73.
Articulaciones. Se utilizan sobre todo en la artritis reumatoide: en la valoración del grado de vascularización sinovial como signo de grado de actividad de la enfermedad y en la detección de sinovitis vascularizada peritendinosa relacionada con mayor riesgo de rotura tendinosa74. En las bursitis puede diferenciar fácilmente entre líquido sinovial, engrosamiento sinovial fibroso y engrosamiento inflamatorio75. También es útil en la evaluación de la respuesta al tratamiento médico: la medición del realce permite determinar el grado de respuesta74.
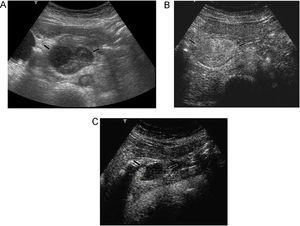
Miscelánea. Diferenciación entre barro biliar y pólipos de vesícula; diferenciación entre lesiones neoplásicas y coágulos vesicales; valoración de fugas en prótesis de aneurismas aórticos; caracterización de la placa ateromatosa; valoración de la respuesta tumoral a fármacos antiangiogénicos (figura 10); evaluación de áreas hipoperfundidas en el traumatismo testicular, etc.
Figura 10. Tumor de la estroma gastrointestinal (GIST) duodenal. A) Masa bien definida (flechas) posterior a bulbo duodenal. B) La imagen poscontraste muestra realce intenso y homogéneo de la masa en fase arterial. C) La ecografía poscontraste de control, 3 meses después de comenzar el tratamiento con imatinib, muestra reducción del tamaño y de la vascularización de la masa, con persistencia de un pequeño foco hipervascular.
Como conclusión, el uso de la ecografía con contraste está ampliamente aceptado, tanto en el hígado como en otros órganos, donde en muchas situaciones clínicas ha demostrado resultados similares a otra técnicas más implantadas, como la TC o la RM. Su utilización puede ser importante en el manejo radiológico de los pacientes, ya que en ocasiones puede evitar exploraciones innecesarias y, en otros casos, según los hallazgos, determinar la siguiente prueba a realizar. Aunque forma parte de la rutina diaria en algunos hospitales, parece necesaria una mayor familiarización con la técnica para que su uso se extienda en la práctica clínica.