La presencia de atrofia cortical radiológica (focal o difusa) previa al desarrollo de síntomas de deterioro cognitivo podría predecir los casos más tempranos de enfermedad neurodegenerativa en pacientes con trastorno de conducta de sueño REM (TCSR). Revisamos la utilidad de la tomografía craneal computarizada (TC) y resonancia magnética (RM) craneal como marcadores tempranos de atrofia cortical en pacientes con TCSR en nuestro centro.
Pacientes y métodosAnálisis descriptivo retrospectivo observacional de pacientes diagnosticados de TCSR desde octubre de 2012 hasta octubre de 2022. Todos con TC o RM craneal, evaluados por un neurorradiólogo.
ResultadosSe incluyeron 54 pacientes: 21 mujeres (38,88%) y 33 hombres (61,12%); edad media al diagnóstico de TCSR: 69,04±12,625 años. De los 54 pacientes, 44 (81,48%) con pruebas de imagen acordes a la edad, y 10 con atrofia mayor a la esperada para la edad. De los 54 pacientes, 21 (38,88%) con diagnóstico de enfermedad neurodegenerativa, 33 (61,12%) persisten como idiopáticos, casi todos con más de 5años de evolución (rango de 1 a 10años de evolución sin diagnóstico). De los 10 (18,52%) pacientes con mayor atrofia, todos fueron diagnosticados de enfermedad neurodegenerativa (8 en 1año, 2 en 8años).
ConclusionesCasi la mitad de nuestra serie ha desarrollado una enfermedad neurodegenerativa en los primeros 10años de evolución. La mayoría de ellos presentaban atrofia cortical global medida por la escala de atrofia cortical global (GCA) en el primer año de diagnóstico, sin otra sintomatología neurológica. Los pacientes que no mostraban atrofia cortical al diagnóstico no han desarrollado todavía la enfermedad neurodegenerativa en 10años de evolución. En nuestra experiencia, la ausencia de atrofia cortical en RM o TC craneal (medida por escalas como la GCA) al diagnóstico de TCSR parece predecir los casos de evolución más lenta. Estos datos deberían ser corroborados con series más amplias.
The presence of cortical atrophy (focal or diffuse) prior to the development of symptoms of cognitive impairment could predict the earliest cases of neurodegenerative disease in patients with REM sleep behavior disorder (RSBD). We reviewed the usefulness of cranial CT and MRI as early markers of cortical atrophy in patients with RSBD at our center.
Patients and methodsRetrospective observational descriptive analysis of patients diagnosed with RSBD from October 2012 to October 2022. All with cranial CT or MRI, evaluated by a neuroradiologist.
Results54 patients were included, 21 women (38.88%), 33 men (61.12%), mean age at diagnosis of RSBD: 69.04±12.625 years. Of the 54 patients, 44 (81.48%) had imaging tests consistent with their age, and 10 had atrophy greater than expected for their age. Of the 54 patients, 21 (38.88%) with a diagnosis of neurodegenerative disease, 33 (61.12%) persist as idiopathic, almost all with more than 5years of evolution (range of 1 to 10years of evolution without diagnosis). Of the 10 (18.52%) patients with greater atrophy, all were diagnosed with neurodegenerative disease (8 in 1year, 2 in 8years).
ConclusionsAlmost half of our series have developed a neurodegenerative disease in the first 10years of evolution. The majority of them presented global cortical atrophy measured by the GCA scale in the first year of diagnosis, without other neurological symptoms. Patients who did not show cortical atrophy at diagnosis have not yet developed the neurodegenerative disease in 10years of evolution. In our experience, the absence of cortical atrophy on cranial MRI or CT (measured by scales such as GCA) at the diagnosis of RSBD seems to predict slower progression cases. These data should be corroborated with larger series.
El trastorno de conducta de sueño REM (TCSR) asociado a las enfermedades neurodegenerativas, tanto como síntoma prodrómico, como durante el desarrollo de las mismas, está ampliamente descrito. Desde el año 1996 se han publicado múltiples series en las que se ha asociado el TCSR al desarrollo posterior de la enfermedad de Parkinson idiopática (EPI), demencias, esclerosis múltiple o parkinsonismos atípicos, entre otras1-10. El descubrimiento de marcadores precoces asociados al TCSR que puedan orientar al desarrollo de una u otra patología es la diana sobre la que se investiga en la actualidad. El objetivo final es tratar de forma precoz, para intentar retrasar o incluso evitar el desarrollo de la enfermedad neurodegenerativa.
La importancia de tener una entidad que predice, con hasta 14años de adelanto, el desarrollo de una enfermedad neurodegenerativa como una demencia o la enfermedad de Parkinson es una gran oportunidad para la investigación dirigida a intentar retrasar o controlar la aparición de estas enfermedades.
La mejoría progresiva de las técnicas de neuroimagen para la detección de las enfermedades neurológicas ha supuesto un gran avance que permite detectar patologías en estadios más precoces, como en esclerosis múltiple, tumores, infartos cerebrales o enfermedades neurodegenerativas11-24. La presencia de atrofia cortical radiológica (focal o difusa) anterior al desarrollo de síntomas de deterioro cognitivo podría predecir los casos más precoces en los pacientes con TCSR.
Actualmente hay varias escalas radiológicas validadas de medición visual para valorar la atrofia cortical global (GCA), la atrofia focal mesial temporal (MTA), la atrofia parietal (escala koedam), o las lesiones vasculares de sustancia blanca (escala Fazekas) 12-19.
Revisamos la utilidad de la tomografía craneal computarizada (TC) y de la resonancia magnética (RM) craneal como marcadores precoces de atrofia cortical en pacientes con TCSR en nuestro centro.
Pacientes y métodosAnálisis descriptivo retrospectivo observacional de pacientes con diagnóstico de TCSR atendidos en la consulta de Neurología de la Unidad de Trastornos del Sueño de nuestro centro desde octubre de 2012 hasta octubre de 2022. Se han incluido todos los pacientes consecutivos mayores de 18años, confirmados todos por polisomnografía nocturna (PSG), siguiendo los criterios diagnósticos de la Clasificación Internacional de los Trastornos del Sueño (International classification of sleep disorders ICSD, 3-TR, revisada en junio 2023). Aquellos con dudas diagnósticas, datos incompletos o con pruebas de sueño no concluyentes han sido excluidos.
Se han analizado las variables: edad al diagnóstico, sexo, edad, tiempo de demora diagnóstica, síntomas clínicos específicos neurológicos (anosmia, temblor, rigidez, alteración mnésica, bradicinesia), año de inicio de los síntomas, año de realización de PSG, confirmación de diagnóstico en PSG, pruebas de neuroimagen (RM craneal, TC craneal), escalas de atrofia frontotemporal y escala parietal de Koedam, escala de atrofia cortical global (GCA), escala de atrofia mesial (MTA), escala de valoración de lesiones de sustancia blanca (Fakezas), ajuste de valoración de atrofia acorde a la edad, tratamientos empleados, otros trastornos del sueño, diagnóstico final, tiempo de evolución desde el inicio del TCSR y el diagnóstico neurodegenerativo.
Los pacientes han sido valorados en las consultas de Neurología, y las pruebas de imagen han sido analizadas por los neurorradiólogos de nuestro centro.
El software usado para el procesado de los datos es el programa SPSS estadístico de IBM, en su versión 25. Para calcular la prevalencia se ha utilizado el número de casos diagnosticados, ajustado a las cifras de población asignada a nuestro centro en el año 2020. Las variables categóricas se han presentado en frecuencias y porcentajes, y las continuas, como media y desviación estándar (DE). Para la asociación de las variables cualitativas se ha empleado la chi-cuadrado, y la t de Student para las cuantitativas. Se ha creado una base de datos específica para el análisis estadístico. Se han tratado los datos de forma anonimizada y agrupada, cumpliendo lo dispuesto en el reglamento (UE) 2016/679 del Parlamento Europeo y el Consejo de 27 de abril de 2016.
La realización de este trabajo ha sido aprobada por la Comisión de Investigación de nuestro centro.
ResultadosSe incluyeron 54 pacientes: 21 mujeres (38,88%) y 33 hombres (61,12%); edad media al diagnóstico de TCSR: 69,04±12,625, rango de edades de 36 a 87años.
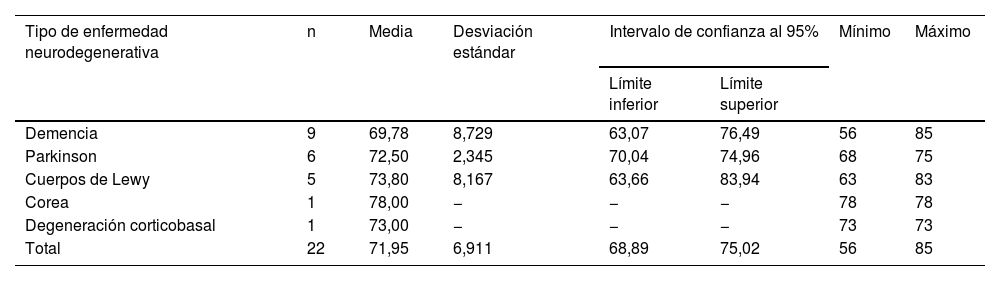
De los 54 pacientes, 21 (38,88%) están diagnosticados de enfermedad neurodegenerativa, 33 (61,12%) persisten como idiopáticos, casi todos con más de 5años de evolución (rango de 1 a 10años de evolución sin diagnóstico). De los pacientes con enfermedad neurodegenerativa, 6 (11,11%) pacientes con EPI, 1 (1,85%) con corea, 5 (9,26%) con demencia por cuerpos de Lewy, 8 (14,81%) pacientes con demencia (todos de tipo Alzheimer, menos uno con demencia vascular), 1 (1,85%) con degeneración corticobasal (tabla 1).
Distribución del tipo de enfermedad neurodegenerativa en los pacientes enfermos
| Tipo de enfermedad neurodegenerativa | n | Media | Desviación estándar | Intervalo de confianza al 95% | Mínimo | Máximo | |
|---|---|---|---|---|---|---|---|
| Límite inferior | Límite superior | ||||||
| Demencia | 9 | 69,78 | 8,729 | 63,07 | 76,49 | 56 | 85 |
| Parkinson | 6 | 72,50 | 2,345 | 70,04 | 74,96 | 68 | 75 |
| Cuerpos de Lewy | 5 | 73,80 | 8,167 | 63,66 | 83,94 | 63 | 83 |
| Corea | 1 | 78,00 | − | − | − | 78 | 78 |
| Degeneración corticobasal | 1 | 73,00 | − | − | − | 73 | 73 |
| Total | 22 | 71,95 | 6,911 | 68,89 | 75,02 | 56 | 85 |
Tiempo de demora diagnóstica desde el inicio de síntomas hasta la confirmación con PSG: 2,26±2,755años, mediana: 1. Tiempo de evolución desde el inicio de los síntomas hasta el desarrollo de la enfermedad neurodegenerativa: 3,54±3,107años.
De los 54 pacientes, 23 (42,59%) presentaban síntomas de alteración cognitiva subjetiva, sin repercusión en test de evaluación (minimental test de Lobo [MMSE] o evaluación cognitiva de Montreal [MOCA] en consulta), sin criterios de deterioro cognitivo leve o demencia.
De los 54 pacientes, en todos se ha realizado se ha realizado TC (20 pacientes) o RM craneal (34 pacientes) craneal al inicio del diagnóstico, sin ningún síntoma de alteración cognitiva o síntomas sugestivos de enfermedad de Parkinson.
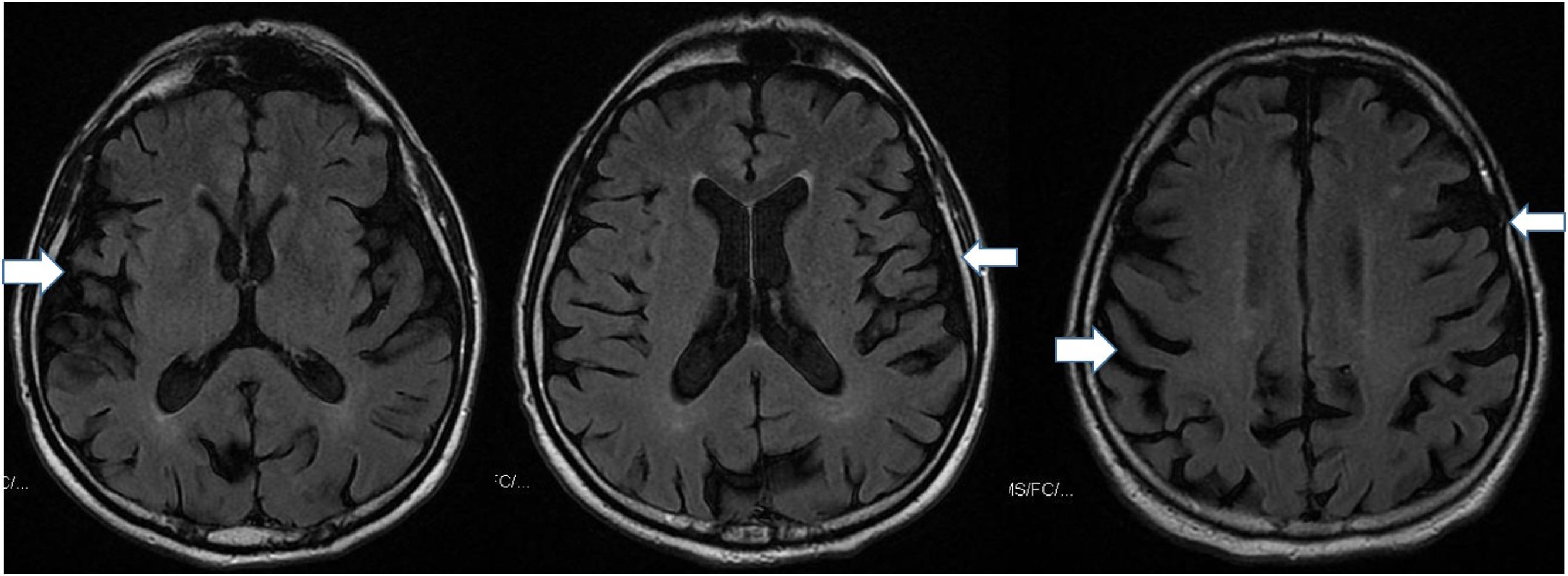
De los 54 pacientes, 33 (61,11%) presentaban atrofia global (GCA), 3 pacientes en grado2 y 30 en grado1 (fig. 1). El resto fueron clasificados con puntuación0 (sin atrofia). La edad media de estos 33 pacientes fue de 73años±8,90. Del total, 17 (31,48%) pacientes presentaron atrofia mesial (MTA): 1 con puntuación de 3, 6 con puntuación de 2 y 14 con puntuación de 1 en la escala; del total, 16 pacientes presentaban atrofia parietal en escala Koedam (1 grado 2, y 15 grado 1). En 6 pacientes encontramos atrofia frontotemporal, y en 19 pacientes encontramos lesiones vasculares con la escala Fazekas (Grado 1: 13 pacientes, Grado 2: 5 pacientes, y Grado 3: 1).
De los 21 pacientes con diagnóstico de enfermedad neurodegenerativa, 18 tenían atrofia en la escala GCA (y de ellos, 8 presentaban atrofia mayor de la esperada por la edad). Solo 3 pacientes no presentaban atrofia cortical en pruebas de imagen y 7 pacientes mostraban alteración en todas las escalas.
De los 54 pacientes, 44 (81,48%) presentaron pruebas de imagen acordes a la edad y 10 con mayor atrofia de la esperada para la edad. De los 10 (18,52%) pacientes con mayor atrofia, todos fueron diagnosticados de enfermedad neurodegenerativa: 8 en 1año y 2 en 8años. De los 10 pacientes: 1 con degeneración corticobasal, 1 con EPI, 1 con corea, 3 con cuerpos de Lewy y 4 con demencia tipo Alzheimer.
DiscusiónCuando comenzamos a pedir pruebas de imagen rutinarias (TC, RM craneal) en pacientes con TCSR, teníamos como objetivo descartar otras patologías estructurales que pudieran estar causando los síntomas. Nos llamó la atención la cantidad de pacientes en las que se informaba la presencia de atrofia cortico-subcortical, y en varios mayor de lo esperado para la edad. Esto sucedía también en pacientes jóvenes (menores de 60años) sin la presencia de otras alteraciones más habituales, como lesiones de sustancia blanca (inespecíficas o vasculares), y sin evidencia de ninguna otra lesión estructural.
Cuando revisamos las publicaciones más recientes, encontramos pocos artículos sobre la utilidad de la RM o el PET-FDG como detectores precoces de enfermedad en estos casos, y la mayoría en los últimos 5-6años, por lo que nos planteamos revisar nuestra casuística12-16.
La edad media y la prevalencia por sexo de nuestra serie están dentro de lo publicado en otros trabajos. La demora diagnóstica del TCSR desde que comienzan los primeros síntomas hasta que se confirma con PSG es baja en nuestra serie, probablemente por la disponibilidad de una Unidad del Sueño en nuestro servicio.
En cuanto a las pruebas diagnósticas, en nuestro centro se solicita a todos los pacientes con TCSR una RM o TC craneales al inicio del diagnóstico para descartar casos secundarios a patología estructural. Son pruebas rutinarias sencillas, que se pueden realizar en prácticamente todos los centros hospitalarios. En nuestra serie destaca que casi la mitad de los pacientes presentan al inicio del diagnóstico una atrofia cortico-subcortical, sin tener en ese momento síntomas prodrómicos o sugestivos de demencia, enfermedad de Parkinson u otra enfermedad neurodegenerativa. De estos, la mayoría ya ha desarrollado una enfermedad neurodegenerativa confirmada, mientras que ninguno de los pacientes que tuvieron la prueba informada como normal ha desarrollado una patología hasta el momento (más de 5años de evolución). Esto podría sugerir que los pacientes que no tienen atrofia cortical precoz en las pruebas pueden tener una evolución más lenta.
En cuanto al análisis de las pruebas de imagen, como neurólogos clínicos nos llamaba la atención la atrofia cortical en la mayoría de pacientes. Sin embargo, cuando estas imágenes fueron revisadas por neurorradiólogos expertos de nuestro hospital, consideraron que en más de la mitad de los casos era acorde con la edad.
Casi todos nuestros pacientes no presentaban otra comorbilidad significativa, salvo los factores de riesgo vascular clásicos (dislipemia, hipertensión arterial), todos ellos con buen control, y sin evidencia de lesiones significativas craneales por esta causa medida con la escala Fazekas.
Dentro de las limitaciones de nuestra serie, el tamaño muestral es probablemente el que más condiciona los resultados, aunque es similar a la mayoría de las series que se publican de forma individual6-8. Los pacientes que cumplían todos los criterios de inclusión han sido menos de los esperados, ya que muchos de ellos con síntomas sugestivos de TCSR ya tenían síntomas claros de EPI o demencia al diagnóstico, y cumplían criterios de enfermedad, por lo que no los hemos incluido.
Otro sesgo de selección en nuestra serie es la aparición de un mayor número de pacientes con demencia que con EPI, cuando el TCSR está más asociado a alfasinucleinopatía. Además de tener 33 pacientes que todavía no han desarrollado una enfermedad degenerativa, los pacientes con TCSR que ya tienen algún otro síntoma prodrómico o algún signo en la exploración que sugiera EPI son derivados a la Unidad de Trastornos del Movimiento, en vez de a la consulta de Sueño, por lo que estos pacientes no están incluidos en nuestra serie. El TCSR es el síntoma prodrómico más frecuentemente asociado al desarrollo de EPI (mayor del 90%, por encima de otros, como estreñimiento o anosmia), por lo que muchas veces se asocia directamente con esta entidad, y se derivan a consultas específicas.
Creemos que las pruebas de neuroimagen básicas realizadas de forma precoz en los pacientes con TCSR idiopático, cuando los pacientes aún no han desarrollado los síntomas de cada enfermedad neurodegenerativa (o solo presentan algún síntoma de sospecha), pueden ayudar a orientar precozmente el diagnóstico y a predecir los casos con una evolución más lenta. Esto puede facilitar la participación de los pacientes en ensayos clínicos y de investigación dirigidos.
ConclusionesCasi la mitad de los pacientes de nuestra serie ha desarrollado una enfermedad neurodegenerativa en los primeros 10años de evolución, más de la mitad de estos casos una demencia. La mayoría presentaban atrofia cortical global medida por escala GCA en el primer año de diagnóstico, sin otra sintomatología neurológica más que el trastorno del sueño. Casi una cuarta parte de los pacientes presentaban mayor atrofia de la esperada por la edad al diagnóstico de TCSR, desarrollando casi todos demencia de forma precoz en el primer año. Los pacientes que no mostraban atrofia cortical al diagnóstico no han desarrollado todavía la enfermedad neurodegenerativa en 10 años de evolución. En nuestra experiencia, la ausencia de atrofia cortical en RM o TC craneal (medida por escalas como la GCA) al diagnóstico de TCSR parece predecir los casos de evolución más lenta. Estos datos deberían ser corroborados con series más amplias.
FinanciaciónLa autora principal ha recibido financiación de la Fundación FIIB HUIS HUHEN únicamente para el coste de la publicación del trabajo en open access.
Consideraciones éticasEl trabajo ha sido aprobado por la Comisión de Investigación de nuestro centro. Los datos han sido tratados de forma anonimizada, por lo que no se firma un consentimiento específico por parte de los pacientes.
Conflicto de interesesLa autora principal ha recibido financiación de la Fundación FIIB HUIS HUHEN únicamente para el coste de la publicación del trabajo en open access.