Determinar la seroprevalencia del SARS-CoV-2 en pacientes con enfermedades inflamatorias inmunomediadas (IMID) tratados con fármacos antirreumáticos modificadores de la enfermedad biológica (FAMEb) o sintéticos dirigidos (FAMEsd).
MétodosSe realizó un estudio observacional, descriptivo, prospectivo y transversal de análisis de prevalencia analítica en pacientes con IMID tratados con FAMEb o FAMEsd. Se comparó la seroprevalencia midiendo la inmunoglobulinaG (IgG) frente al SARS-CoV-2 entre octubre de 2020 y mayo de 2021.
ResultadosSe estudiaron un total de 550 pacientes con IMID, todos ellos en tratamientos con FAMEb o FAMEsd. La seroprevalencia del grupo total de pacientes fue del 16% (88/550). Los pacientes que recibieron terapia con inhibidores del factor de necrosis tumoral alfa (inhib. de TNFα) presentaron mayor seroprevalencia frente al resto de terapias biológicas y sintéticas dirigidas (OR: 1,792 [IC95%: 1,088-2,951]; p=0,021). También se analizó la influencia en la seroprevalencia del uso concomitante con los FAMEb/sd de los FAME convencionales sintéticos (FAMEcs). Se demostró una menor seroprevalencia en el grupo de pacientes tratados con inhib. de TNFα y metotrexato juntos, comparando con los que se encontraron con inhib. de TNFα en monoterapia, 10,1 vs 24,1% (OR: 0,355 [IC95%: 0,165-0,764]; p=0,006). Con el resto de FAMEcs no se encontraron diferencias significativas. En cuanto a las IMID, no se identifican diferencias en la seroprevalencia entre los diferentes grupos de enfermedades.
ConclusiónLos pacientes en tratamiento con inhibidores de TNFα tienen mejor respuesta humoral en comparación con los demás FAMEb/sd. Sin embargo, cuando se los asocia con metotrexato, la seroprevalencia disminuye de forma significativa.
To determine the seroprevalence of SARS-CoV-2 in patients with immune-mediated inflammatory diseases (IMID) treated with biologic (bDMARDs) or synthetic targeted disease-modifying antirheumatic drugs (tsDMARDs).
MethodsAn observational, descriptive, prospective and cross-sectional study of analytical prevalence analysis was conducted in patients with IMID with bDMARDs or tsDMARDs. Seroprevalence was compared by measuring immunoglobulinG (IgG) against SARS-CoV-2 between October/2020 and May/2021.
ResultsA total of 550 IMID's patients were studied, all of them on treatment with bDMARDs or tsDMARDs. The seroprevalence of the total patient group was 16% (88/550). Patients receiving therapy with tumor necrosis factor alpha inhibitors (TNFi) had a higher seroprevalence compared to other biologic and synthetic targeted therapies (OR: 1.792 [95%CI: 1.088-2.951]; P=.021). The influence on seroprevalence of concomitant use with b/tsDMARDs of conventional synthetic DMARDs (csDMARDs) was also analyzed. A lower seroprevalence was demonstrated in the group of patients treated with TNFi and methotrexate together, compared with those on TNFi monotherapy, 10.1 vs 24.1% (OR: 0.355 [95%CI: 0.165-0.764]; P=.006). No significant differences were found with the other DMARDs. Regarding IMIDs, no differences in seroprevalence were identified between the different disease groups.
ConclusionPatients on treatment with TNFα inhibitors have better humoral response compared to the other b/tsDMARDs. However, when associated with methotrexate the seroprevalence decreases significantly.
El síndrome respiratorio agudo severo coronavirus2 (SARS-CoV-2) es una enfermedad infectocontagiosa que, desde su aislamiento por primera vez a finales del 2019 en Wuhan, China, ha producido una pandemia mundial1,2.
Este virus infecta las células humanas mediante la unión de una proteína «espiga» en su superficie (proteínaS) a la enzima convertidora de angiotensina2 (ACE2) dentro del huésped. Por tanto, los órganos implicados son preferentemente los que expresan esta ACE2 (los pulmones, la mucosa nasal y oral, los vasos sanguíneos, los riñones, el corazón, el tracto gastrointestinal, el páncreas y el cerebro)3,4.
Los pacientes con enfermedades inflamatorias inmunomediadas (IMID) tienen mayor predisposición a contraer infecciones tanto por su enfermedad de base como por los tratamientos que reciben. Estudios anteriores evaluaron la seroprevalencia del SARS-CoV-2 en los pacientes con IMID en comparación con la población general, demostrando en varios de ellos una seroprevalencia similar. Tampoco se encontraron diferencias significativas en la gravedad de la infección por SARS-CoV-2 en comparación con el resto de la población5-9.
En este estudio nos proponemos evaluar la seroprevalencia frente al SARS-CoV-2 en pacientes con IMID tratados con fármacos antirreumáticos modificadores de la enfermedad biológicos o sintéticos dirigidos (FAMEb o FAMEsd), además de determinar los potenciales cambios en la seroprevalencia de los diferentes tratamientos concomitantes que reciben.
Pacientes y métodosDiseño del estudio y participantesSe diseñó un estudio observacional, descriptivo, prospectivo y transversal de análisis de prevalencia analítica. Se incluyeron pacientes con IMID en tratamiento con FAMEb o FAMEsd de los servicios de Reumatología, Aparato Digestivo y Oftalmología del Hospital Universitario Infanta Sofía y del servicio de Reumatología del Hospital Universitario Infanta Leonor que acudieron a consulta de seguimiento habitual entre octubre de 2020 y mayo de 2021. Los criterios de inclusión son los mismos que los del estudio predefinido BIOCOVID9: edad ≥18años con diagnóstico previo de IMID, en tratamiento con FAMEb o FAMEsd de manera ininterrumpida desde, al menos 3meses antes del inicio de la pandemia (1de diciembre de 2019). En cuanto a los pacientes tratados con rituximab, se incluyeron aquellos cuyo último ciclo de tratamiento era posterior al 1de septiembre de 2019. Ninguno de los pacientes incluidos en este estudio había recibido previamente vacunación contra el SARS-CoV-2.
Variables clínicasLos pacientes fueron agrupados según el tratamiento recibido, el tipo de enfermedad inmunomediada y las comorbilidades que presentaban.
Los FAMEb fueron clasificados en 7 grupos: 1)los inhibidores del TNFα (infliximab, etanercept, adalimumab [y sus biosimilares], golimumab, certolizumab); 2)los inhibidores de la interleucina6 (IL-6) (tocilizumab y sarilumab); 3)los inhibidores de la interleucina 17 y de la 12/23 (incluidos en este grupo secukinumab, ixekizumab, ustekinumab); 4)el inhibidor de la CD20 (rituximab); 5)el inhibidor del coestimulador de linfocitosT (abatacept); 6)el inhibidor de la integrina α4β7 (vedolizumab), y 7)otros (anakinra [inhibidor de la IL-1] y belimumab [inhibidor del estimulador de los linfocitos B (BLyS)]).
Los FAMEsd fueron clasificados en inhibidores de la Janus quinasa (JAK) (tofacitinib, baricitinib) y en el inhibidor de la fosfodiesterasa4 (PDE4) (apremilast). También se recogieron datos sobre el tratamiento concomitante a los FAMEb y FAMEsd con los fármacos antirreumáticos modificadores de la enfermedad convencionales sintéticos (FAMEcs): metotrexato, leflunomida, sulfasalazina, hidroxicloroquina, azatioprina. Al resto de los FAMEcs, como micofenolato mofetilo, ciclosporinaA, tacrolimus y mercaptopurina, se les asoció en el mismo grupo.
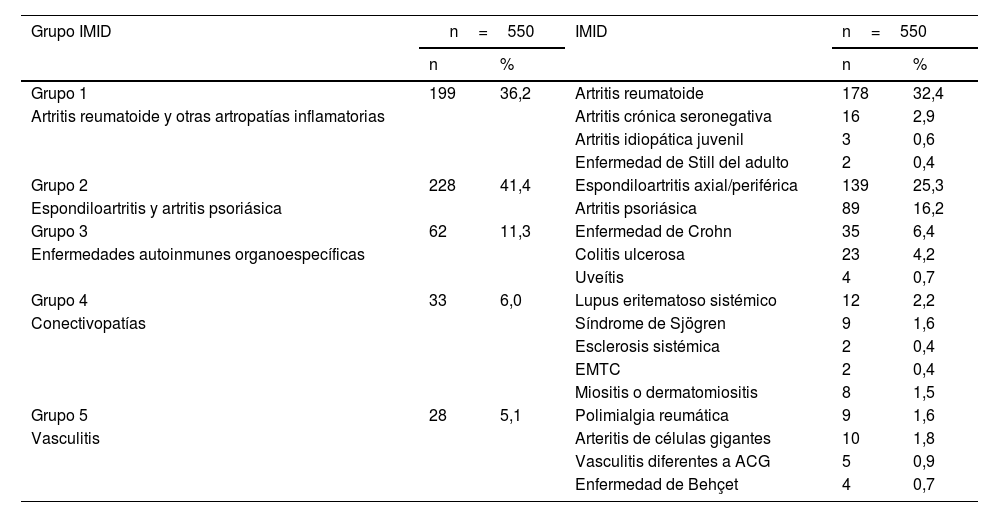
Dentro del grupo de enfermedades, fueron clasificados como grupo1 los pacientes con artritis reumatoide y otras artropatías inflamatorias (poliartritis crónica seronegativa y artritis idiopática juvenil, enfermedad de Still del adulto); como grupo2, los pacientes con espondiloartritis (tanto axiales como periféricas) y artritis psoriásica; como grupo3, los pacientes con enfermedades autoinmunes organoespecíficas (colitis ulcerosa, enfermedad de Crohn, uveítis); como grupo4, los pacientes con conectivopatías (lupus eritematoso sistémico, síndrome de Sjögren, esclerosis sistémica, enfermedad mixta de tejido conectivo, miositis o dermatomiositis), y como grupo5, las vasculitis (arteritis de células gigantes [ACG], polimialgia reumática, vasculitis diferentes a ACG, enfermedad de Behçet).
La presencia y el tipo de comorbilidades se dividieron en 5 categorías: 1)pacientes sin comorbilidades; 2)pacientes con factores de riesgo cardiovascular (hipertensión arterial, diabetes mellitus, dislipemia, cardiopatías isquémicas, accidente cerebrovascular); 3)pacientes con enfermedades pulmonares (asma bronquial, enfermedad pulmonar obstructiva crónica [EPOC], síndrome de apnea-hipopnea del sueño [SAHS]); 4)pacientes con antecedentes de cáncer (mama, próstata, pulmonar), y 5)pacientes con otro tipo de comorbilidad a las mencionadas en los grupos anteriores (patología tiroidea, reflujo gastroesofágico, gastritis crónica, pancreatitis, diverticulosis, celiaquía, enfermedad hepática, litiasis renal, hiperplasia benigna de próstata, malnutrición, anemia, gota, demencia, epilepsia, patología psiquiátrica).
También se recogieron datos de los síntomas por COVID-19 de los pacientes con serología positiva y se los agrupó en asintomáticos, síntomas leves y síntomas graves (pacientes que han requerido ingreso hospitalario).
Test serológicoSe midió la respuesta humoral basada en los niveles de anticuerpo IgG contra la proteína S1 del SARS-CoV-2 mediante la técnica de inmunoanálisis tipo sándwich de dos pasos por quimioluminiscencia indirecta (CLIA) en la plataforma Advia Centaur XP (Siemens). El sistema informa de los resultados, según lo sugerido por los fabricantes, mediante valores índice: «no reactivo» si índice <1,00, y «reactivo» si índice ≥1,0, clasificándose como negativo y positivo, respectivamente. Fórmula de conversión: 1,00 valor del índice=1,00U/ml.
Tamaño muestral y análisis estadísticoEl estudio elaborado por Favalli et al.10 reportaba una prevalencia de anticuerpos frente al SARS-CoV-2 del 15,2%. En base a ello se calculó que era necesario incluir un mínimo de 545 pacientes con IMID para determinar la prevalencia analítica con un error de estimación del 3% y un nivel de confianza del 95%.
Para la estadística descriptiva de las variables de estudio de tipo cuantitativo se ha utilizado la media ±desviación estándar o mediana [rango intercuartílico] una vez comprobada la distribución. Para describir las variables cualitativas se utilizaron las frecuencias absolutas (n) y relativas (%) y se calculó su intervalo de confianza al 95% (IC95%).
Se emplearon pruebas de chi cuadrado (o pruebas exactas de Fisher) para estudiar las diferencias en seroprevalencia de pacientes IMID con distintos tratamientos FAMEb o FAMEsd. Se realizaron modelos de regresión logística binaria para determinar la odds ratio (OR) de seroprevalencia y su IC95% para cada uno de los tratamientos con respecto al resto. De la misma forma se analizó la existencia de diferencias en la seroprevalencia de pacientes que recibían o no un tratamiento concomitante con FAMEcs y/o glucocorticoides asociados y de acuerdo al tipo de IMID y a la presencia/ausencia de las distintas comorbilidades (en caso de ser necesario se aplicó la corrección de Haldane para el cálculo del efecto cuando un valor era nulo).
Todos los cálculos estadísticos se realizaron utilizando el programa estadístico SPSS (versión 25.0, IBM Corp., EE.UU.). Se asumió que existían diferencias estadísticamente significativas si el valor de p obtenido era menor o igual a 0,05.
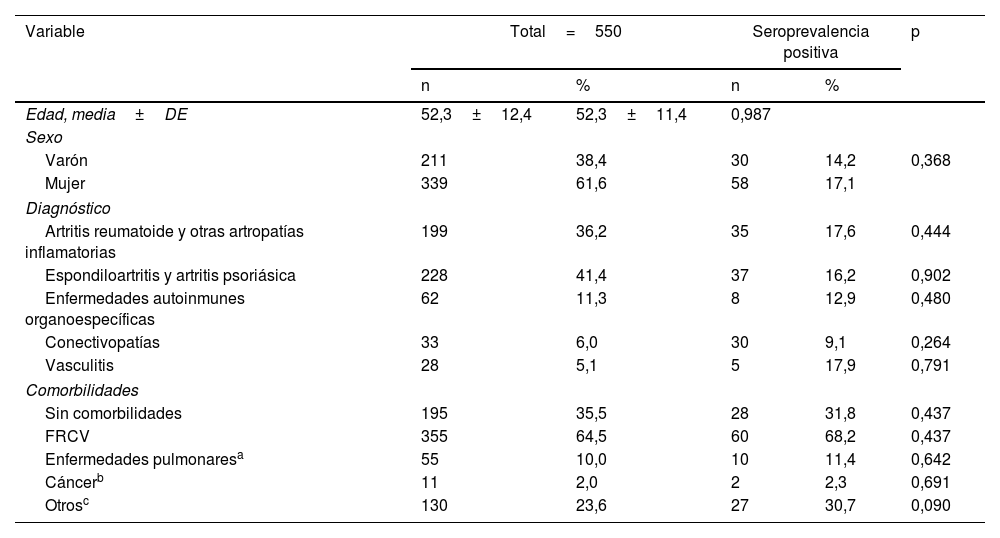
ResultadosSe estudió un total de 550 pacientes con IMID, de los cuales 339 (61,6%) eran mujeres, con una media de edad de 52,3±12,4años.
La seroprevalencia del grupo total de pacientes fue del 16% (88/550).
Con relación al sexo, no se observó diferencia significativa en la seroprevalencia (14,2% en los hombres vs 17,1% en las mujeres; p=0,368) ni en relación con la edad (seropositivos: 52,3±11,4 vs seronegativos: 52,3±12,6; p=0,987) (tabla 1).
Características sociodemográficas de los pacientes
| Variable | Total=550 | Seroprevalencia positiva | p | ||
|---|---|---|---|---|---|
| n | % | n | % | ||
| Edad, media±DE | 52,3±12,4 | 52,3±11,4 | 0,987 | ||
| Sexo | |||||
| Varón | 211 | 38,4 | 30 | 14,2 | 0,368 |
| Mujer | 339 | 61,6 | 58 | 17,1 | |
| Diagnóstico | |||||
| Artritis reumatoide y otras artropatías inflamatorias | 199 | 36,2 | 35 | 17,6 | 0,444 |
| Espondiloartritis y artritis psoriásica | 228 | 41,4 | 37 | 16,2 | 0,902 |
| Enfermedades autoinmunes organoespecíficas | 62 | 11,3 | 8 | 12,9 | 0,480 |
| Conectivopatías | 33 | 6,0 | 30 | 9,1 | 0,264 |
| Vasculitis | 28 | 5,1 | 5 | 17,9 | 0,791 |
| Comorbilidades | |||||
| Sin comorbilidades | 195 | 35,5 | 28 | 31,8 | 0,437 |
| FRCV | 355 | 64,5 | 60 | 68,2 | 0,437 |
| Enfermedades pulmonaresa | 55 | 10,0 | 10 | 11,4 | 0,642 |
| Cáncerb | 11 | 2,0 | 2 | 2,3 | 0,691 |
| Otrosc | 130 | 23,6 | 27 | 30,7 | 0,090 |
FRCV: factores de riesgo cardiovasculares (hipertensión arterial, diabetes mellitus, dislipemia, cardiopatías isquémicas, accidente cerebrovascular).
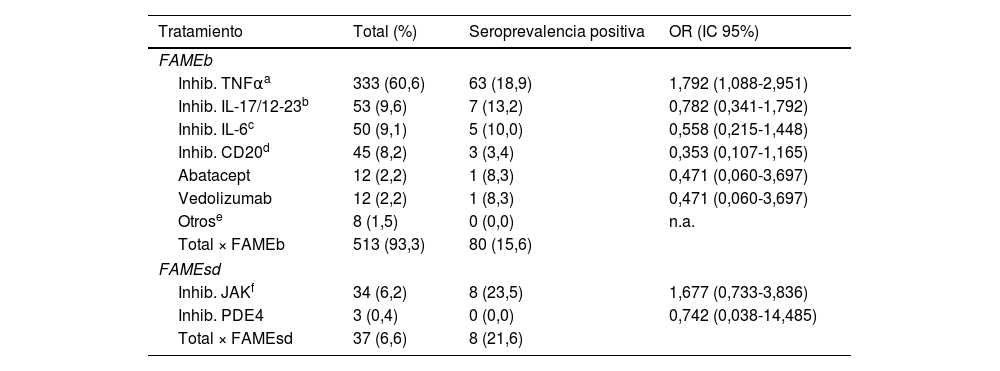
Analizando los diferentes FAMEb o FAMEsd entre sí, se observó que los pacientes tratados con inhibidores de TNFα presentaron una mayor seroprevalencia frente al resto de los fármacos: 18,9% (63/333) vs 11,5% (25/217) (OR: 1,792 [IC95%: 1,088-2,951]; p=0,021). En los pacientes tratados con fármacos que inhiben a las IL-17 e IL-12/23 se encontró una seroprevalencia del 13,2% (7/53), frente al 16,3% (81/497) del resto de las terapias biológicas y sintéticas dirigidas. Con los inhibidores de la IL-6 se observó un 10% (5/50) de seroprevalencia frente a un 16,6% (83/500) del resto de FAMEb/FAMEsd. Con rituximab se observó una tendencia a una menor seroprevalencia frente al resto de tratamientos: 6,7% (3/45) vs 16,8% (85/505) (OR: 0,353 [IC95%: 0,107-1,165]; p=0,075). Los pacientes tratados con abatacept y con vedolizumab presentaron una seroprevalencia del 8,3% (1/12) versus el 16,2% (87/538) del resto de terapias (tabla 2).
Seroprevalencia de los pacientes agrupados por FAMEb/FAMEsd
| Tratamiento | Total (%) | Seroprevalencia positiva | OR (IC 95%) |
|---|---|---|---|
| FAMEb | |||
| Inhib. TNFαa | 333 (60,6) | 63 (18,9) | 1,792 (1,088-2,951) |
| Inhib. IL-17/12-23b | 53 (9,6) | 7 (13,2) | 0,782 (0,341-1,792) |
| Inhib. IL-6c | 50 (9,1) | 5 (10,0) | 0,558 (0,215-1,448) |
| Inhib. CD20d | 45 (8,2) | 3 (3,4) | 0,353 (0,107-1,165) |
| Abatacept | 12 (2,2) | 1 (8,3) | 0,471 (0,060-3,697) |
| Vedolizumab | 12 (2,2) | 1 (8,3) | 0,471 (0,060-3,697) |
| Otrose | 8 (1,5) | 0 (0,0) | n.a. |
| Total × FAMEb | 513 (93,3) | 80 (15,6) | |
| FAMEsd | |||
| Inhib. JAKf | 34 (6,2) | 8 (23,5) | 1,677 (0,733-3,836) |
| Inhib. PDE4 | 3 (0,4) | 0 (0,0) | 0,742 (0,038-14,485) |
| Total × FAMEsd | 37 (6,6) | 8 (21,6) | |
FAME: fármaco antirreumático modificador de la enfermedad; FAMEb: FAME biológico; FAMEsd: FAME sintético dirigido; Inhib. IL-6: inhibidores de la interleucina6; Inhib. IL-17 y 12/23: inhibidores de las interleucinas 17 y 12/23; Inhib. JAK: inhibidores de la JAK quinasa; Inhib. PDE4: inhibidor de la fosfodiesterasa4 (apremilast); n.a.: no aplica; OR: odds ratio; TNFα: factor de necrosis tumoral alfa.
Los FAMEb del grupo «otros» (belimumab y anakinra) no han sido analizados, dado el escaso número de la muestra. Los pacientes tratados con FAMEsd presentaron una seroprevalencia del 21,6% (8/37) vs el 15,6% (80/513) de los pacientes con FAMEb, sin observarse una diferencia significativa (OR: 0,670 [IC95%: 0,295-1,518]; p=0,352). Dentro de este grupo destacan los inhibidores de la JAK, con una seroprevalencia del 23,5% (8/34) frente al 15,5% (8/34) de los inhibidores de la PDE4 (tabla 2).
Seroprevalencia según el tratamiento concomitante con FAMEcsDe los 550 pacientes, 240 (43,6%) recibían de forma concomitante terapia con FAMEcs. De estos, un total de 132 (56,4%) fueron tratados con metotrexato, 42 (17,9%) con leflunomida, 24 (10,3%) con azatioprina, 15 (6,4%) con sulfasalazina, 15 (6,4%) con hidroxicloroquina y 12 (5,1%) recibían tratamiento con otro tipo de FAMEcs (micofenolato: 6 [2,6%], ciclosporina: 2 [0,8%], tacrolimus: 3 [1,3%] y mercaptopurina: 1 [0,4%]).
Los pacientes tratados de forma concomitante con algún tipo de FAMEcs presentaron una menor seroprevalencia frente a pacientes tratados en monoterapia con FAMEb o FAMEsd: 10,7% vs 19,9% (OR: 2,082 [IC95%: 1,265-3,426]; p=0,003).
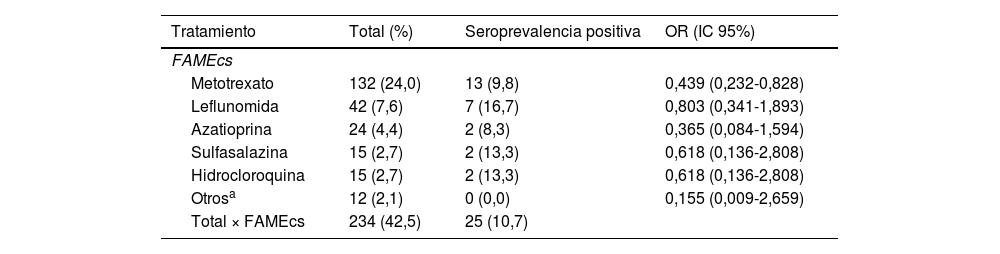
Al comparar la seroprevalencia en los pacientes tratados de forma concomitante con los diferentes tipos de FAMEcs frente a pacientes tratados en monoterapia con FAMEb o FAMEsd, el único FAMEcs que demostró una menor seroprevalencia fue el metotrexato: 9,8% vs 19,9% (OR: 0,439 [IC95%: 0,232-0,828]; p=0,011). Con el resto de los FAMEcs no se encontró una diferencia significativa en la seroprevalencia entre los pacientes tratados de forma concomitante con dichos FAMEcs frente a monoterapia (tabla 3).
Odds Ratio de serología positiva de anticuerpos contra el SARS-CoV-2 de los pacientes con FAMEb con otros FAMEcs concomitantes con respecto a los que reciben FAMEb en monoterapia
| Tratamiento | Total (%) | Seroprevalencia positiva | OR (IC 95%) |
|---|---|---|---|
| FAMEcs | |||
| Metotrexato | 132 (24,0) | 13 (9,8) | 0,439 (0,232-0,828) |
| Leflunomida | 42 (7,6) | 7 (16,7) | 0,803 (0,341-1,893) |
| Azatioprina | 24 (4,4) | 2 (8,3) | 0,365 (0,084-1,594) |
| Sulfasalazina | 15 (2,7) | 2 (13,3) | 0,618 (0,136-2,808) |
| Hidrocloroquina | 15 (2,7) | 2 (13,3) | 0,618 (0,136-2,808) |
| Otrosa | 12 (2,1) | 0 (0,0) | 0,155 (0,009-2,659) |
| Total × FAMEcs | 234 (42,5) | 25 (10,7) | |
FAMEcs: fármacos antirreumáticos modificadores de la enfermedad convencionales sintéticos; OR: odds ratio.
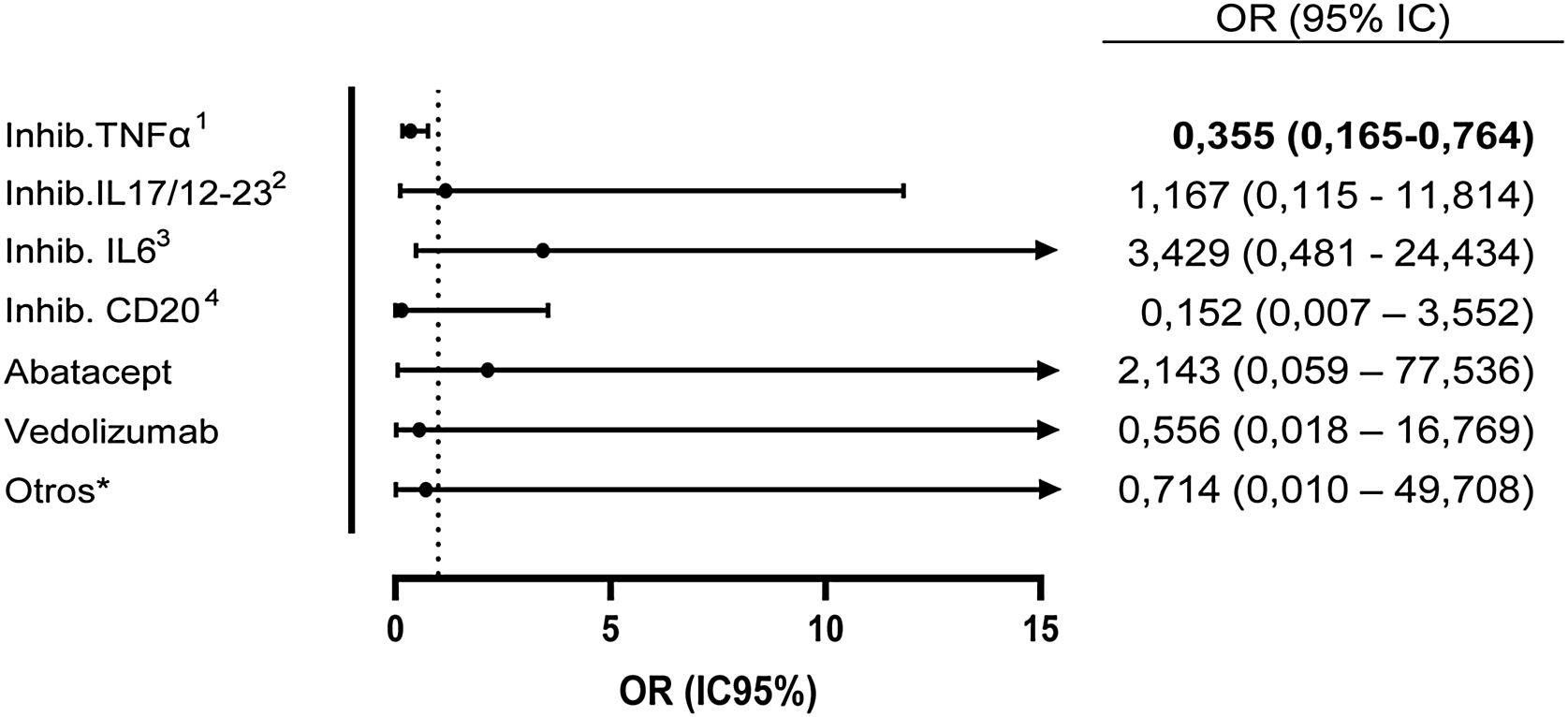
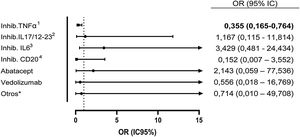
Dentro del grupo de todos los FAMEb y FAMEsd se determinó la seroprevalencia de cada uno de los fármacos en monoterapia frente a tratamiento concomitante con metotrexato. En el grupo de pacientes tratados con inhibidores de TNFα y metotrexato se encontró una seroprevalencia del 10,1, vs el 24,1% en pacientes tratados con inhibidores de TNFα en monoterapia (OR: 0,355 [IC95%: 0,165-0,764]; p=0,006). Con el resto de biológicos no se observaron diferencias (fig. 1).
Odds ratio de serología positiva de anticuerpos contra el SARS-CoV-2 de los pacientes con FAMEb con metotrexato concomitante con respecto a los pacientes con FAMEb en monoterapia. No se analizó metotrexato + FAMEsd dado el número de muestra muy pequeño de este grupo.
1 Inhib. de TNFα: infliximab, adalimumab, etanercept (y sus biosimilares), certolizumab, golimumab.
2 Inhib. de IL-17 y de IL-12/23: secukinumab, ixekizumab, ustekinumab.
3 Inhib de IL-6: tocilizumab, sarilumab.
4 Inhib. de CD20: rituximab.
* Otros: belimumab, anakinra.
De los 550 pacientes, 94 (17,1%) recibían tratamiento concomitante con glucocorticoides, 82 (87,2%) en dosis ≤7,5mg/día de prednisona, y 12 (12,8%) a dosis >7,5mg/día. Se observó una tendencia a una menor seroprevalencia en el grupo de pacientes tratados con glucocorticoides en comparación con los que no tomaban estos fármacos (9,6 vs 17,6%; p=0,055).
La seroprevalencia de los pacientes que se encontraban en tratamiento con glucocorticoides a dosis ≤7,5mg/día de prednisona fue del 9,8%, vs al 8,3% de los pacientes con dosis >7,5mg/día, sin observarse diferencias significativas (p=0,678).
Seroprevalencia según grupos de enfermedades inmunomediadasLa frecuencia de las distintas IMID se expone en la tabla 4.
Agrupación de los pacientes por enfermedades inmunomediadas
| Grupo IMID | n=550 | IMID | n=550 | ||
|---|---|---|---|---|---|
| n | % | n | % | ||
| Grupo 1 | 199 | 36,2 | Artritis reumatoide | 178 | 32,4 |
| Artritis reumatoide y otras artropatías inflamatorias | Artritis crónica seronegativa | 16 | 2,9 | ||
| Artritis idiopática juvenil | 3 | 0,6 | |||
| Enfermedad de Still del adulto | 2 | 0,4 | |||
| Grupo 2 | 228 | 41,4 | Espondiloartritis axial/periférica | 139 | 25,3 |
| Espondiloartritis y artritis psoriásica | Artritis psoriásica | 89 | 16,2 | ||
| Grupo 3 | 62 | 11,3 | Enfermedad de Crohn | 35 | 6,4 |
| Enfermedades autoinmunes organoespecíficas | Colitis ulcerosa | 23 | 4,2 | ||
| Uveítis | 4 | 0,7 | |||
| Grupo 4 | 33 | 6,0 | Lupus eritematoso sistémico | 12 | 2,2 |
| Conectivopatías | Síndrome de Sjögren | 9 | 1,6 | ||
| Esclerosis sistémica | 2 | 0,4 | |||
| EMTC | 2 | 0,4 | |||
| Miositis o dermatomiositis | 8 | 1,5 | |||
| Grupo 5 | 28 | 5,1 | Polimialgia reumática | 9 | 1,6 |
| Vasculitis | Arteritis de células gigantes | 10 | 1,8 | ||
| Vasculitis diferentes a ACG | 5 | 0,9 | |||
| Enfermedad de Behçet | 4 | 0,7 | |||
EMTC: enfermedad mixta del tejido conectivo.
Al analizar por grupos de enfermedades entre sí, se observó una seroprevalencia del 17,6% en los pacientes del grupo1 frente al 15,1% del resto de pacientes; del 16,2% en los del grupo2 vs 15,8% del resto; del 12,9% del grupo3 vs 16,4% del resto; del 9,1% del grupo4 vs 16,4% del resto, y del 17,9% del grupo5 vs 15,9% del resto, sin diferencias significativas entre los grupos de enfermedades (tabla 1).
Seroprevalencia según grupos de comorbilidadesLa seroprevalencia de los pacientes con y sin comorbilidades no mostró diferencias significativas (OR: 1,213 [IC95%: 0,745-1,974]; p=0,437). Al analizar las diferentes categorías de comorbilidades frente al paciente sin comorbilidades, tampoco se encontraron diferencias significativas (tabla 1).
Síntomas de COVID-19De los 88 pacientes con serología positiva para el SARS-CoV-2, 28 (31,8%) fueron asintomáticos, 52 (59,1%) presentaron síntomas leves y 8 (9,1%), síntomas graves.
DiscusiónEn este estudio se observó una mayor seroprevalencia frente al SARS-CoV-2 en los pacientes tratados con anti-TNFα frente al resto de los grupos de tratamientos, aunque sin alcanzar significación estadística. Estos datos están en contraposición al trabajo de Simon et al.11, quienes encontraron una proporción menor de seroprevalencia en pacientes con inhibidores de TNFα. Estas diferencias se pueden explicar probablemente por la variabilidad en las poblaciones estudiadas. En su trabajo, del total de pacientes con IMID, solo el 23% recibían tratamiento con inhibidores de TNFα; sin embargo, en el nuestro hasta el 60% se encontraban con este fármaco. En el grupo de tratamiento con inhibidores de CD20 (rituximab) se encontró una tendencia a una menor seroprevalencia, aunque el número de muestra de estos pacientes era pequeño, motivo por el que probablemente no fue estadísticamente significativo el resultado. Existen varios estudios publicados previamente que demuestran evoluciones más graves de la infección por COVID-19 en los pacientes con rituximab y falta de seroconversión tras la misma12-15. No obstante, aunque la inmunidad humoral se vea alterada en este grupo de pacientes tras la infección, existen diversas investigaciones que respaldan el desarrollo de una sólida respuesta celular (célulasT), y en la mayor parte de estos pacientes se mantiene su efecto hasta 9-12meses después de la recuperación de la infección por COVID-19, y al menos durante 6meses tras la vacunación con ARNm16-19.
Asimismo, estudios realizados en los pacientes con enfermedades inflamatorias intestinales (EII) tratados con vedolizumab no demostraron ser un factor de riesgo para la infección por SARS-CoV-2 y se determinaron seroprevalencias similares a las de la población general, al igual que en nuestro estudio no se observaron diferencias con este tratamiento20-22.
En relación con la terapia combinada con FAMEcs, la seroprevalencia fue significativamente inferior en los pacientes tratados con inhibidores de TNFα que recibían tratamiento concomitante con metotrexato frente a monoterapia con inhibidores de TNFα. No obstante, no se encontraron diferencias significativas en este grupo de pacientes con el resto de FAMEcs y tampoco con ninguno de los FAMEcs en el resto de los grupos de las diferentes terapias biológicas y sintéticas dirigidas.
En el estudio de Favalli et al.23 no se observó diferencia significativa en la seroprevalencia en los pacientes que recibían FAMEb junto con FAMEcs. No obstante, existen datos publicados de la falta de seroconversión posterior a la vacunación en estos pacientes debido a la atenuación de la inmunidad humoral que provoca el metotrexato24-26.
La seroprevalencia de los pacientes con IMID tratados con FAMEb/sd observada en nuestro trabajo es muy similar al grupo italiano, quizá porque tanto España como Italia fueron unos de los países más afectados en cuanto al número de contagio en las primeras olas de la pandemia en comparación a otros países europeos23. Además, estos estudios encontraron que no hubo diferencias significativas entre la seroprevalencia en los pacientes tratados con terapias biológicas y sujetos sanos11,23.
En este trabajo hubo una tendencia a una menor seroprevalencia en los pacientes tratados con glucocorticoides. Sin embargo, no se han encontrado diferencias significativas, probablemente por el escaso número de pacientes que recibían estos tratamientos. Existen datos publicados de que la seroprevalencia disminuye de forma significativa con dosis superiores a 10mg/día de prednisona (p=0,0253)23. Varios estudios respaldan que el uso de terapia esteroidea se asocia con mayor tasa de infección por COVID-19, mayores casos de hospitalización, ingresos a unidades de cuidados intensivos y mortalidad27-30. Brenner et al.29, en su trabajo en pacientes con EII, también observaron mayor proporción de COVID-19 severa en los que recibían glucocorticoides como parte de su tratamiento para la enfermedad (OR: 6,87 [IC95%: 2,30-20,51]), no así en los tratados con inhibidores de TNFα. Para determinar la existencia de la influencia real de los glucocorticoides en la seroprevalencia sería necesario valorar no solo las dosis diarias recibidas, sino también las dosis acumuladas del fármaco.
En cuanto a las enfermedades inmunomediadas, en nuestro estudio se encontraron seroprevalencias similares entre los diferentes grupos de las enfermedades, al igual que en trabajos publicados anteriores, donde no se encontraron diferencias significativas en la seroprevalencia entre los diferentes grupos de IMID11,23.
En relación con las comorbilidades, no se vio influencia sobre la seroprevalencia comparando con los pacientes sin comorbilidades. Saadoun et al. tampoco encontraron diferencias significativas en la seroprevalencia entre pacientes con IMID con y sin comorbilidades31. Sin embargo, en otro estudio se ha visto un riesgo aumentado de seropositividad para los anticuerpos IgG en los pacientes con IMID con al menos una comorbilidad (p=0,003), al igual que la ausencia de comorbilidades fue asociada con un una baja probabilidad de positividad a los anticuerpos anti SARS-CoV-2 (p=0,004)32. Se conoce, a través de varios estudios publicados con anterioridad, que la presencia de comorbilidades ha contribuido a peores desenlaces en casos de infección por COVID-19, especialmente entre pacientes con hipertensión arterial, diabetes mellitus, obesidad, EPOC y neoplasias, quienes desarrollan síntomas sustancialmente más graves con tasas de mortalidad comparativamente más altas33. En nuestro trabajo hemos analizado la influencia de los diferentes tipos de comorbilidades en la seroprevalencia de nuestro grupo de pacientes, sin encontrar asociación entre las comorbilidades y la seroprevalencia.
En cuanto a las fortalezas, mencionar el enfoque prospectivo y transversal del trabajo, posibilitando así la adquisición de datos en tiempo real. Además, se emplearon modelos de regresión logística binaria, lo que añade mayor respaldo estadístico.
Las principales limitaciones de este estudio son el tamaño reducido de la muestra para algunos FAMEb y FAMEsd. Esto impide la determinación precisa de su impacto real en la seroprevalencia debido a la falta de datos representativos. También la ausencia de asignación aleatoria de la muestra, lo que pudo haber limitado la generalización de los hallazgos.
Por otra parte, en relación con el uso concomitante de glucocorticoides, no fue posible obtener información sobre las dosis acumuladas de todos los pacientes a lo largo de los años.
En cuanto a la respuesta inmunológica, solo se determinó la respuesta humoral a través de la medición de anticuerpos IgG y no se analizó la respuesta celular, al no disponer de los medios necesarios para el procedimiento.
El presente estudio resulta relevante en la práctica clínica debido a la posibilidad de poder identificar qué pacientes pueden experimentar una respuesta inmunológica deficiente o presentar peores resultados tras la infección por COVID-19, en función del tratamiento inmunosupresor que hayan recibido, lo que permite una mejor comprensión de cómo ciertos tratamientos pueden afectar la respuesta inmunitaria en este grupo de pacientes.
En conclusión, en nuestro estudio encontramos que los pacientes en tratamiento con inhibidores de TNFα tienen mejor respuesta humoral frente a los demás tratamientos biológicos o FAMEsd. En cuanto al tratamiento concomitante con FAMEcs, el metotrexato influye de manera negativa en la seroprevalencia de estos pacientes. En nuestro trabajo no se demostró que los glucocorticoides tengan impacto sobre la seroprevalencia.
Consideraciones éticasEl estudio se realizó de acuerdo con los principios de la Declaración de Helsinki y fue aprobado por el Comité de ética de la investigación con medicamentos (CEIm) del Hospital Universitario La Paz, código HULP: PI-4164 a fecha 4 de junio de 2020. Se obtuvo el consentimiento informado por escrito de todos los participantes del estudio.
FinanciaciónEl estudio ha recibido dos becas de la Fundación para la Investigación e Innovación Biomédica del Hospital Universitario Infanta Sofía y Hospital Universitario del Henares (FIIB HUIS HHEN): Beca con código asignado FHH20/COVID04, otorgada el 12 de junio de 2020, y Beca con código asignado FHH20/COVID07, otorgada el 11 de diciembre de 2020.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.