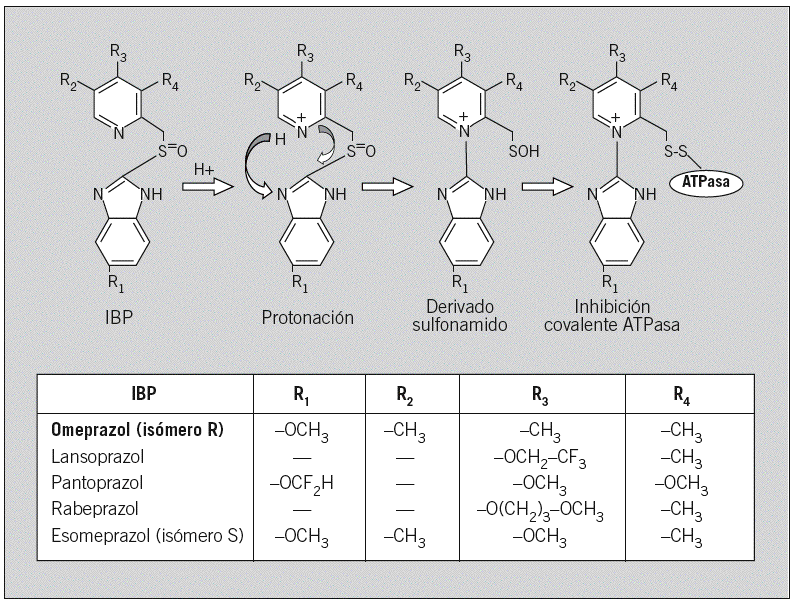
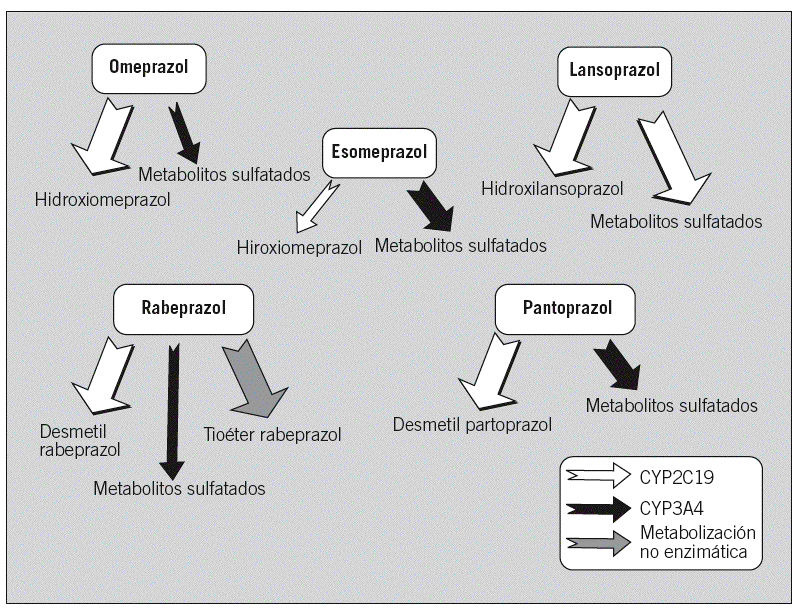
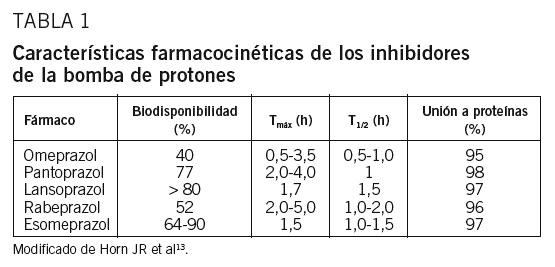
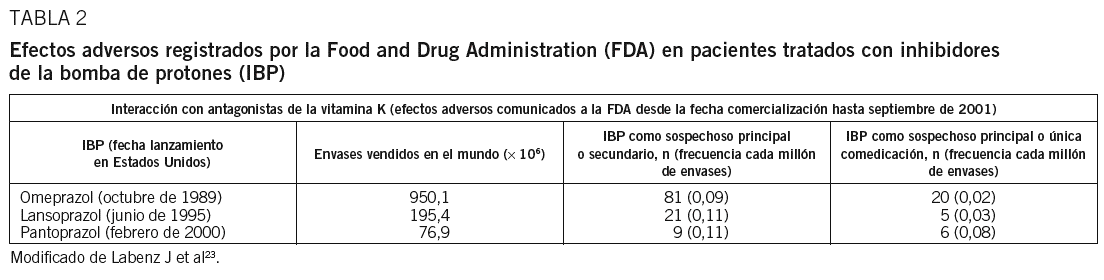
El factor de impacto mide la media del número de citaciones recibidas en un año por trabajos publicados en la publicación durante los dos años anteriores.
© Clarivate Analytics, Journal Citation Reports 2025
SJR es una prestigiosa métrica basada en la idea de que todas las citaciones no son iguales. SJR usa un algoritmo similar al page rank de Google; es una medida cuantitativa y cualitativa al impacto de una publicación.
Ver másSNIP permite comparar el impacto de revistas de diferentes campos temáticos, corrigiendo las diferencias en la probabilidad de ser citado que existe entre revistas de distintas materias.
Ver más