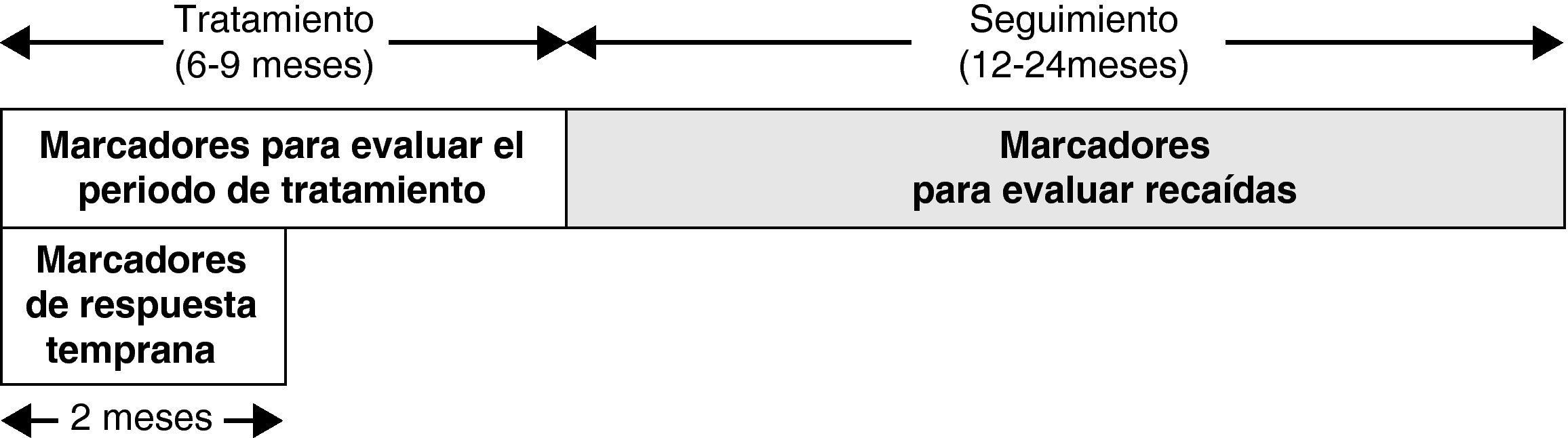
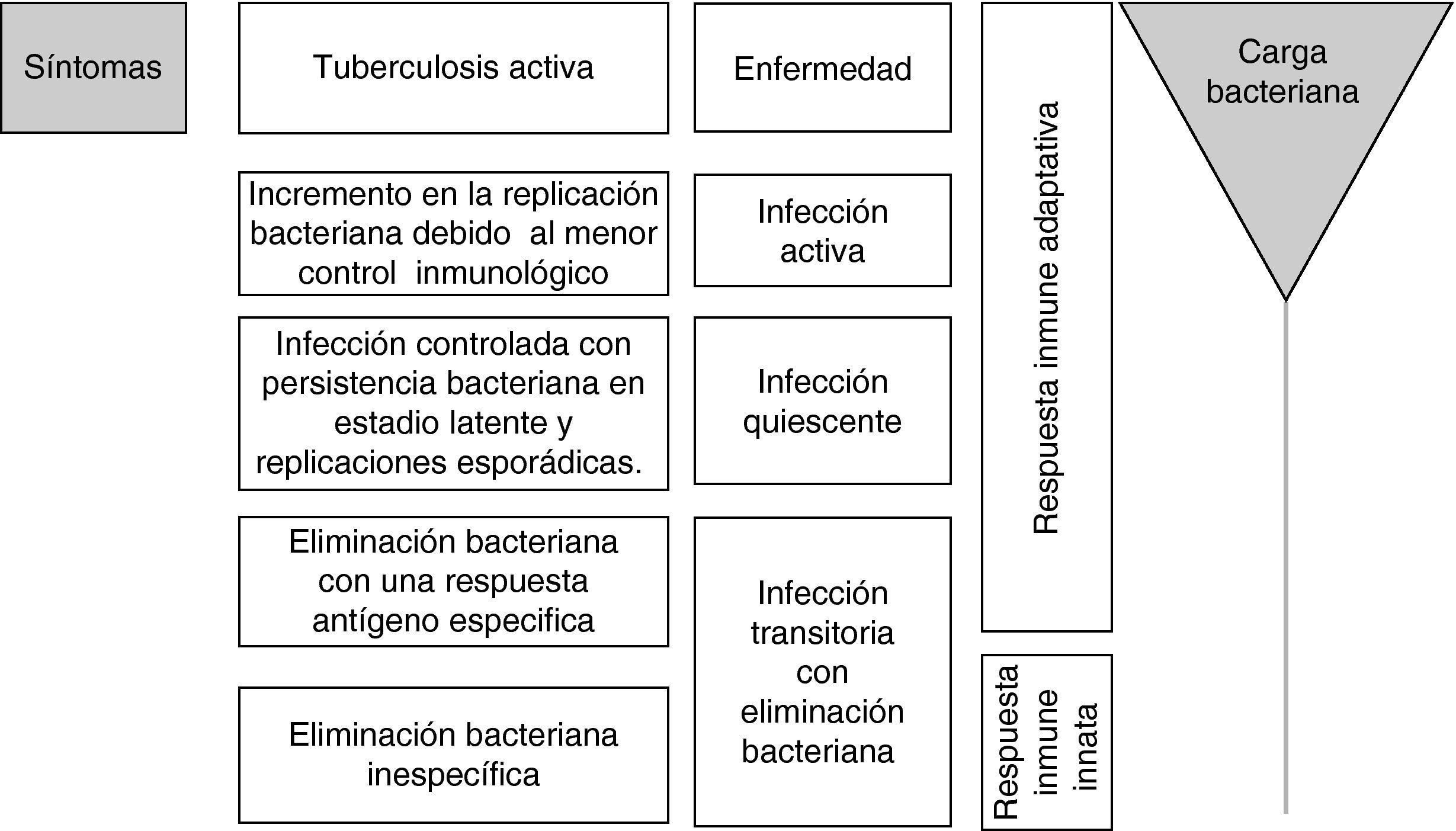
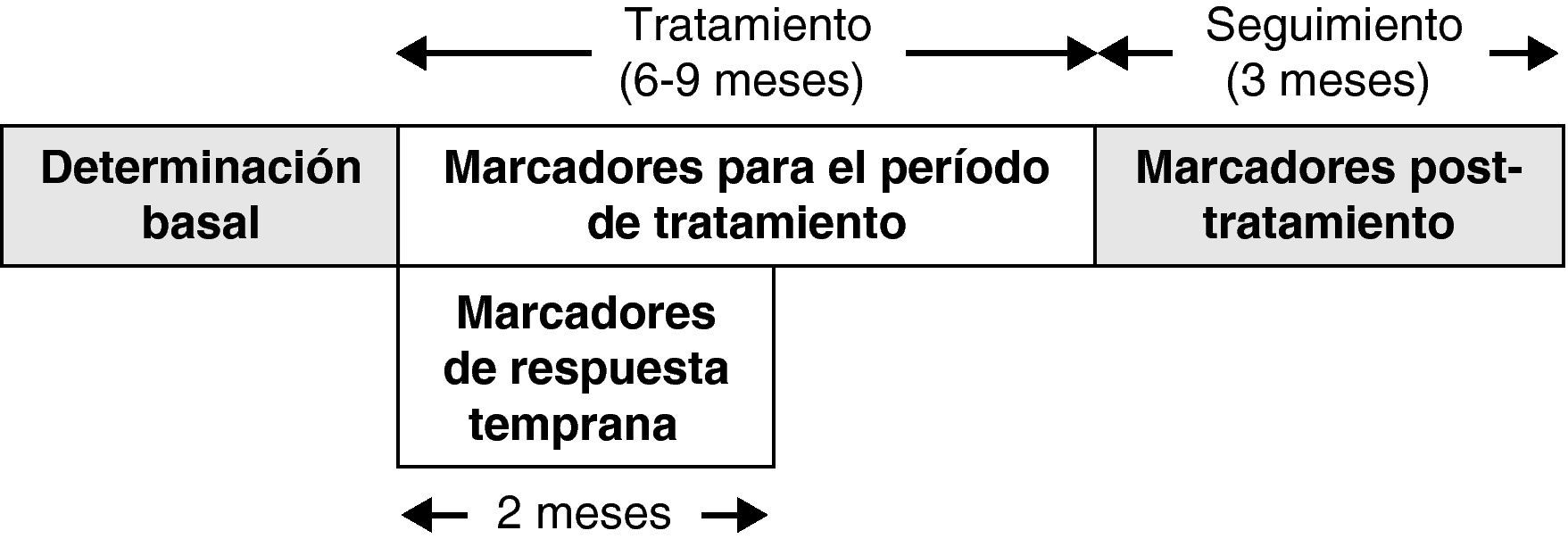
Basándose en el test cutáneo de la tuberculina se estima que un tercio de la población mundial tiene una infección tuberculosa latente. Las nuevas estrategias en salud pública e investigación están dirigidas a disminuir y erradicar este enorme reservorio. Sin embargo, la ausencia de biomarcadores para el diagnóstico y tratamiento de la tuberculosis latente limita el desarrollo de nuevos fármacos y vacunas. Algunos componentes están presentes tanto en la proteína purificada derivada de Mycobacterium tuberculosis (PPD) (usada en el test cutáneo de la tuberculina) como en la vacuna BCG, lo cual incrementa el número de falsos positivos en personas vacunadas. Al día de hoy, ningún método inmunológico existente puede diferenciar la tuberculosis latente de la tuberculosis activa. Estudios recientes han abordado estrategias incluyendo anticuerpos específicos, nuevas citocinas y/o antígenos como candidatos a biomarcadores. Sin embargo, los altos costos de estos estudios, el bajo número de participantes y su diferente metodología dificultan la posibilidad de realizar un futuro metanálisis y hacen que todavía no se tengan resultados concluyentes.
Based on the tuberculin skin test it is estimated that latent tuberculosis infection is present in one-third of the world's population. The new strategies in public health and research are aimed to reduce and eradicate this enormous reservoir. However, the absence of effective biomarkers for diagnosis and treatment of latent tuberculosis limits the development of new drugs and vaccines. Some components are present in both, the PPD (used in the tuberculin skin test) and the BCG vaccine. This increases the number of false positives in vaccinated individuals. Nowadays, there is not an immune diagnostic method that can differentiate latent tuberculosis and tuberculosis disease. New studies have addressed some strategies including specific antibodies, new cytokines and / or antigens as candidates for biomarkers. However, the high costs of these studies, the low number of participants and their different methodology make difficult a future meta-analysis and more conclusive results.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora