La criptococosis puede afectar niños de todas las edades, especialmente aquellos inmunocomprometidos. Usualmente se adquiere a través de la inhalación de esporas del medio ambiente, aunque existen otras formas de transmisión. Describimos un caso de criptococosis congénita adquirido de una madre con síndrome de inmunodeficiencia adquirida (SIDA) y tratado en forma exitosa con combinación de antimicoticos.
Cryptococcosis may affect children of all ages, specially those who are inmunocompromised. It is usually acquired from the inhalation of environmental spores, although other sources of transmission exist. We describe a case of congenital cryptococcosis transmitted from a mother with acquired immunodeficiency syndrome (AIDS), which was successfully treated with combination antifungal agents.
La criptococosis es una enfermedad micótica sistémica, que puede afectar a niños inmunocompetentes e inmunodeprimidos. Su prevalencia es mayor en niños inmunodeprimidos, especialmente en aquellos con deficiencias en la inmunidad celular1. En Colombia, esta es una enfermedad poco frecuente en la población infantil, con una incidencia anual de 0,017 casos/100.000 niños entre un mes y 16 años. En esta población, se reporta que la inhalación de esporas del medio ambiente es el principal mecanismo de adquisición de la infección2.
La adquisición transplacentaria de la infección es un fenómeno raro3. El propósito de este trabajo es reportar el caso de un neonato con criptococosis, infectado por vía transplacentaria de su madre con el virus de la inmunodeficiencia humana (VIH) e infección sistémica por criptococo.
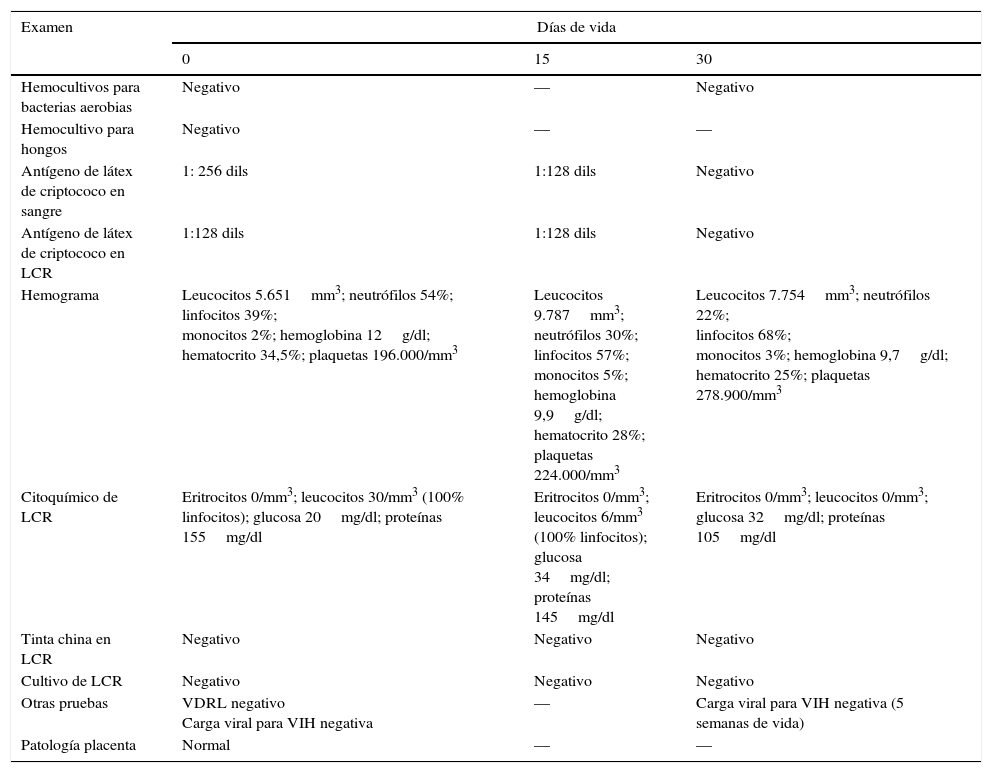
Reporte de casoPaciente cuya madre es diagnosticada con VIH en el primer trimestre del embarazo, pero quien no recibió terapia antiretroviral por mala adherencia terapéutica. Su carga viral a las 33 semanas de gestación es de 177.611 copias/ml. Ingresa en el Hospital Universitario del Valle (HUV) con 32 semanas de gestación, y es hospitalizada en la unidad de cuidados intensivos (UCI) por cefalea intensa seguida de convulsiones tónico-clónicas generalizadas. Es diagnosticada con criptococosis diseminada con compromiso meníngeo con base en un hemocultivo positivo para criptococo y cultivo y antígeno (Ag) en látex para criptococo positivo en líquido cefalorraquídeo (LCR). Se inicia tratamiento con anfotericina B deoxicolato a 1mg/kg/día. A los 2 días de hospitalización desarrolla choque séptico y paro cardiorrespiratorio, para lo que se inician maniobras avanzadas de resucitación. Ante el rápido deterioro hemodinámico y baja posibilidad de sobrevida, se practica cesárea de urgencia. Se obtiene recién nacido de sexo femenino de 35 semanas de edad gestacional (por puntaje de Ballard). No presenta esfuerzo respiratorio ni frecuencia cardiaca, por lo que se inicia ventilación con presión positiva y compresiones torácicas con recuperación de pulso, tono y perfusión distal. Por pobre esfuerzo respiratorio se practica intubación orotraqueal y la paciente es trasladada a la unidad de cuidado intensivo neonatal. Al examen físico la paciente se encuentra en regulares condiciones generales, cabeza y cuello normal, murmullo vesicular conservado con estertores en ambos campos pulmonares, abdomen con hepatomegalia sin esplenomegalia, llenado capilar lento y gradiente térmico en miembros inferiores. Se inicia manejo profiláctico para VIH por sonda nasogástrica con zidovudina a 4mg/kg/dosis cada 12h y nevirapina a 200mg/m2/dosis cada 24h y se realizan paraclínicos (tabla 1).
Exámenes de laboratorio
| Examen | Días de vida | ||
|---|---|---|---|
| 0 | 15 | 30 | |
| Hemocultivos para bacterias aerobias | Negativo | — | Negativo |
| Hemocultivo para hongos | Negativo | — | — |
| Antígeno de látex de criptococo en sangre | 1: 256 dils | 1:128 dils | Negativo |
| Antígeno de látex de criptococo en LCR | 1:128 dils | 1:128 dils | Negativo |
| Hemograma | Leucocitos 5.651mm3; neutrófilos 54%; linfocitos 39%; monocitos 2%; hemoglobina 12g/dl; hematocrito 34,5%; plaquetas 196.000/mm3 | Leucocitos 9.787mm3; neutrófilos 30%; linfocitos 57%; monocitos 5%; hemoglobina 9,9g/dl; hematocrito 28%; plaquetas 224.000/mm3 | Leucocitos 7.754mm3; neutrófilos 22%; linfocitos 68%; monocitos 3%; hemoglobina 9,7g/dl; hematocrito 25%; plaquetas 278.900/mm3 |
| Citoquímico de LCR | Eritrocitos 0/mm3; leucocitos 30/mm3 (100% linfocitos); glucosa 20mg/dl; proteínas 155mg/dl | Eritrocitos 0/mm3; leucocitos 6/mm3 (100% linfocitos); glucosa 34mg/dl; proteínas 145mg/dl | Eritrocitos 0/mm3; leucocitos 0/mm3; glucosa 32mg/dl; proteínas 105mg/dl |
| Tinta china en LCR | Negativo | Negativo | Negativo |
| Cultivo de LCR | Negativo | Negativo | Negativo |
| Otras pruebas | VDRL negativo Carga viral para VIH negativa | — | Carga viral para VIH negativa (5 semanas de vida) |
| Patología placenta | Normal | — | — |
Se realiza diagnóstico de criptococosis congénita y se inicia manejo con anfotericina B deoxicolato a 1mg/kg/día con lo que la paciente presenta un progreso favorable, se logran suspender los inotrópicos, se extuba e inicia la vía oral con adecuada tolerancia. A los 15 días del tratamiento, la paciente persiste en buenas condiciones clínicas. En el LCR de control se detecta el antígeno capsular (tabla 1); se adiciona manejo con fluconazol 12mg/kg/día dosis inicial seguido de 6mg/kg/día. Se toma resonancia magnética de cráneo simple y contrastada sin alteraciones.
Después de 30 días de tratamiento se repite punción lumbar en donde no se detecta el antígeno capsular por la prueba de aglutinación con látex (tabla 1). Con este resultado y su adecuada evolución clínica, se decide dar alta hospitalaria con fluconazol oral a 6mg/kg/día durante 30 días más, para completar 8 semanas de tratamiento total. A las 5 semanas de vida, se toma nueva carga viral para VIH que es negativa, por lo que se decide no dar profilaxis con trimetoprim-sulfametoxazol.
A las 12 semanas de vida la paciente continua en buenas condiciones generales, asintomática, sin compromiso neurológico y alcanzando todas las metas en su neurodesarrollo.
DiscusiónLa criptococosis es una micosis endémica causada por 2 hongos levaduriformes encapsulados del genero Cryptoccoccus, Cryptococcus neoformans y Cryptocococus gattii. Este microorganismo tiene múltiples factores de virulencia que incluyen la capsula, la melanización, la habilidad de crecer a 37°C y la producción de ureasa y fosfolipasa. Estas características le dan la capacidad de sobrevivir en el medio ambiente e infectar huéspedes humanos susceptibles, principalmente aquellos con deficiencias en la inmunidad celular como quienes tiene la infección por VIH/sida4.
Aunque se han reportado casos de criptococosis en mujeres embarazadas con coinfección por VIH, pocos casos resultan en criptococosis en el recién nacido3. Cuando ocurre, la transmisión frecuenta por vía transplacentaria o perinatal, por aspiración o inhalación de secreciones vaginales y endometriales durante el paso por el canal del parto1,3. La principal hipótesis para la baja incidencia de la criptococosis congénita se debe a que la placenta es una barrera efectiva para el control de la diseminación micotica1,5. En la mayoría de casos de infección materna, la infección está limitada al espacio intervelloso, con extensión a las vellosidades coriónicas, pero sin criptococosis manifiesta5–7.
La trasmisión por vía transplacentaria se manifiesta de manera más temprana (en la primera semana de vida), mientras que la aparición tardía de los síntomas (semanas a meses) indica que probablemente fue adquirida en el canal del parto1. Aunque en este caso no se logró detectar la infección en la placenta, documentamos trasmisión transplacentaria, dado que el diagnóstico se realizó en las primeras 24h de vida y no existe otra posible fuente de infección.
Diez casos de criptococosis congénita se han reportado en la literatura3,8,9. En los casos descritos, el recién nacido presentó manifestaciones sugestivas de sepsis neonatal con especial compromiso del sistema nervioso central y pulmón con una tasa de mortalidad superior al 50%1.
El diagnóstico de criptococosis se hace mediante examen directo de tejidos con tinta china, aislamiento del hongo en cultivo de fluidos o tejidos corporales, detección por histopatología o medición del antígeno capsular. Esta última es una prueba de aglutinación que reacciona contra los antígenos capsulares presentes en los líquidos biológicos al sensibilizar partículas de látex o de nitrocelulosa con anticuerpos anti-criptococo. Es útil para el diagnóstico cuando se obtienen títulos mayores a 1:16 y se puede usar para el seguimiento de pacientes con criptococosis meníngea donde títulos persistentes indican no curación y títulos que se doblan indican la posibilidad de una recaída con una sensibilidad y especificidad mayor al 95% en ambos casos10,11. Al tratarse de una proteína de gran tamaño (aproximadamente 106Da) es poco probable la trasferencia transplacentaria solo de esta parte del hongo, por lo que se puede utilizar para el diagnóstico de la criptococosis congénita3.
Existe poca información sobre el tratamiento de la criptococosis congénita. Los casos reportados se han tratado con anfotericina B, y en 3 de ellos se ha adicionado fluconazol, estos últimos con desenlace fatal. Nuestro caso representa el primer caso descrito del uso exitoso de terapia combinada para meningitis por criptococo adquirida por vía transplacentaria y sin alteraciones neurológicas a largo plazo.
A pesar de ser una enfermedad poco frecuente, la criptococosis congénita transplacentaria, al igual que otras infecciones de trasmisión congénita (p. ej., sífilis, toxoplasmosis, citomegalovirus, tuberculosis) deben considerarse en hijos de madres con factores de riesgo para estas enfermedades y con manifestaciones de sepsis neonatal temprana.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEl presente manuscrito no contó con ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la madre del paciente, por su colaboración y por proveer la información necesaria para la escritura del manuscrito.