El objetivo de este estudio fue evaluar la eficacia y los efectos secundarios de distintas combinaciones de antieméticos para la profilaxis de náuseas y vómitos postoperatorios (NVPO) en pacientes propicios a presentarlos tras cirugía muy emetógena.
MétodosTras revisar retrospectivamente las historias clínicas de pacientes sometidos a cirugía electiva muy emetógena bajo anestesia general durante el periodo 2009 a 2011, seleccionamos 368 mujeres con puntuación de Apfel ≥3 y que recibieron una combinación de 2 antieméticos como profilaxis. Analizamos la incidencia de NVPO a las 2, 6, 12 y 24 h del postoperatorio, rescates antieméticos, patrón de aparición de NVPO, efectos secundarios y nivel de sedación. Valoramos la respuesta completa como ausencia de NVPO en las primeras 24 h.
ResultadosOndansetrón 4mg i.v. en combinación con dexametasona 8mg i.v. (O&Dex), haloperidol 1mg i.v. (O&Hal1), haloperidol 2mg i.v. (O&Hal2) o droperidol 1,25mg i.v. (O&Dro) fueron las combinaciones más empleadas. La respuesta completa fue mayor en los grupos O&Dex: 68,5% (IC: 58-78); O&Hal2: 64,1% (IC: 53-74) y O&Dro 63% (IC: 52-73) que en el grupo O&Hal1: 41,3% (IC: 31-52) (p<0,01). La máxima incidencia de NVPO ocurrió entre las 2 y 6 h del postoperatorio. La incidencia de efectos secundarios fue mayor en el grupo O&Hal2.
ConclusionesEn pacientes con elevado riesgo de NVPO sometidos a cirugía muy emetógena, la eficacia de dosis bajas de haloperidol (1mg) en combinación con ondansetrón es escasa. Dosis mayores (2mg) son altamente eficaces, pero se asocian a una alta incidencia de efectos secundarios.
In this observational study we reviewed the efficacy and side effects of different antiemetic combinations used in our hospital for postoperative nausea and vomiting (PONV) prophylaxis in high-risk women undergoing highly emetogenic surgery.
MethodsAfter reviewing retrospectively the medical records of patients undergoing highly emetogenic elective surgeries under general anaesthesia, we selected 368 women whose Apfel risk score was ≥ 3 and receiving a combination of 2 antiemetics for PONV prophylaxis. We analysed the incidence of PONV at 2, 6, 12 and 24h after surgery, antiemetic rescue requirements, pattern of occurrence of PONV, side effects and level of sedation were also assessed. The main goal was complete response defined as no PONV within 24h after surgery.
ResultsOndansetron 4mg i.v. plus dexamethasone 8mg i.v. (O&Dex), haloperidol 1mg i.v. (O&Hal1), haloperidol 2mg i.v. (O&Hal2) or droperidol 1.25mg i.v. (O&Dro) were the combinations most frequently used. The complete response was better in groups O&Dex: 68.5% (CI: 58-78), O&Hal2: 64.1% (CI: 53-74) and O&Dro 63% (CI: 52-73) than in group O&Hal1: 41.3% (CI: 31-52) (p<0,01). Peak incidence of PONV occurred within the 2-6h period. The incidence of side effects was higher in group O&Hal2.
ConclusionIn high risk patients for PONV who underwent highly emetogenic surgeries, the efficacy of low-dose haloperidol (1mg) in combination is limited. Higher doses (2mg) are more effective but its use is associated with a high incidence of side effects.
A pesar de la aparición de nuevos antieméticos con un perfil más potente y seguro, las náuseas y vómitos postoperatorios (NVPO) continúan siendo un problema en los pacientes quirúrgicos, principalmente en aquellos con elevado riesgo de desarrollar esta complicación, en los que la incidencia puede ser hasta del 80%, incluso tras la administración de antieméticos de manera profiláctica1–3. Un buen control de las NVPO aumenta la satisfacción del paciente, disminuye las complicaciones postoperatorias y permite el desarrollo de la cirugía ambulatoria y «fast-track»4–7. Las guías clínicas recomiendan una profilaxis antiemética proporcional al riesgo del paciente, utilizando combinaciones de antieméticos con diferente mecanismo de acción en pacientes de alto riesgo8.
Ondansetrón, dexametasona y droperidol, solos y en combinación, han demostrado su eficacia y seguridad en múltiples estudios9–12. Droperidol ha sido utilizado en anestesia durante años, pero desde la alerta lanzada por la FDA en 2001 por el riesgo de arritmias asociadas a su uso, el haloperidol surge como alternativa, ya que también pertenece al grupo de las butirofenonas y comparte mecanismo de acción (bloquea receptores D2)13,14, se ha usado como antiemético desde su aprobación como antipsicótico en 1967 y las guías clínicas actuales lo recomiendan8,15.
Basándonos en estos criterios, revisamos la eficacia y seguridad de las combinaciones de antieméticos más utilizadas en nuestra práctica clínica habitual para la profilaxis de NVPO en pacientes con elevado riesgo de presentar estos síntomas. La hipótesis principal fue que todas las combinaciones de antieméticos son igualmente eficaces, sin efectos secundarios destacables.
Pacientes y métodosEl estudio, aprobado por el Comité de Ética de Navarra, fue diseñado como un estudio de cohortes retrospectivo16. Todos los pacientes se seleccionaron a través de nuestra historia clínica informatizada. Revisamos por orden cronológico desde septiembre del 2009 a todos los pacientes sometidos a intervenciones quirúrgicas con elevado riesgo de vómitos postoperatorios (colorrectal, ginecológica, de mama, tiroides y colecistectomías), realizadas en mujeres mayores de 18 años y cuya puntuación en la escala de Apfel fuera ≥ 3 (mujer, no fumador, historia previa de NVPO/cinetosis, uso de opioides postoperatorios). Seleccionamos a aquellas que recibieron durante la cirugía una combinación de 2 antieméticos como profilaxis de NVPO. Excluimos a aquellas pacientes sometidas a cirugía ambulatoria o de urgencia, y a aquellas que recibieron anestesia locorregional o anestesia total intravenosa (TIVA).
Una vez que la paciente fue válida para ser incluida, contactamos con ella para obtener el consentimiento informado. Como explicaremos más adelante, necesitábamos 92 pacientes por grupo de profilaxis, así que incluimos consecutivamente en cada grupo las primeras 92 pacientes revisadas que cumplían criterios de elegibilidad y dieron su consentimiento. La última paciente fue intervenida en diciembre del 2011.
Obtuvimos todas las variables necesarias para completar la base de datos a través de la historia clínica informatizada, en la que se registran diariamente variables relacionadas con NVPO, lo que hace posible tener una fuente fiable de datos. En quirófano, las constantes vitales se transfieren electrónicamente desde el monitor a la historia clínica, y los tiempos quirúrgicos y anestésicos, medicación y fluidoterapia son registrados directamente por el anestesista.
En la Unidad de Recuperación Postanestésica (URPA), las constantes vitales son transferidas electrónicamente, los tiempos de estancia, medicación, fluidoterapia y otras variables como la intensidad del dolor o la presencia de náuseas o episodios eméticos (EE) son recogidos por la enfermera de anestesia cada 30 min hasta el momento del alta. En planta de hospitalización, la enfermera registra estos datos cada 6 h. Las notas de cada pase médico y de enfermería son escritas en la historia clínica.
El objetivo principal fue la respuesta completa a la medicación antiemética: ausencia de náuseas y EE en las primeras 24 h tras la cirugía (desde el momento «fin sutura»). Se registraron en URPA (0-2 h) y a las 6, 12 y 24 h: incidencia de náuseas (sí/no); incidencia de episodios eméticos (EE) (arcada o vómito) (sí/no); intensidad del dolor en reposo: leve (EVA < 3), moderado (EVA 3-7) y severo (EVA > 7); frecuencia cardíaca, presión arterial y saturación de oxígeno (pulsioximetría), además de los requerimientos de rescate antiemético, efectos secundarios y momento de la primera ingesta. La fluidoterapia y la presencia de arritmias se recogieron en quirófano y URPA. En URPA se registró el nivel de sedación: completamente despierto, ojos abiertos (4); somnoliento, ojos cerrados (3); dormido, responde a la llamada (2); dormido, responde al estímulo táctil (1); no responde (0).
Análisis estadísticoSegún la incidencia de NVPO en estudios realizados en nuestro hospital con ondansetrón 4mg+dexametasona 8mg (cercana al 20%) y para tener un 80% de probabilidad de encontrar un 15% de reducción absoluta de la incidencia de NVPO en las primeras 24h del postoperatorio, con un error alfa del 5% (a 2 colas), se necesitaban 92 pacientes por grupo. T de Student y Mann-Whitney se utilizaron para comparar las diferencias intergrupos. El test de χ2 (con corrección de Bonferroni) se usó para variables categóricas. El valor p<0,05 indicó significación estadística. Se usó el programa SPSS 17.0 para el análisis.
ResultadosPara obtener nuestra cohorte de 368 pacientes, revisamos 1.288 pacientes sometidos a cirugía altamente emetógena. Fueron excluidos 266 varones o menores de 18 años, 259 por ser Apfel < 3, 46 por no recibir la combinación de 2 antieméticos, 52 por haberse utilizado anestesia regional/TIVA y 115 por tratarse de casos urgentes/ambulatorios. Para incluir cronológicamente (según fecha de cirugía) a las primeras 92 pacientes que dieron su consentimiento hasta completar cada grupo de profilaxis, fue necesario revisar 550 pacientes que cumplían criterios de elegibilidad.
Las combinaciones más utilizadas (96,2%) y por tanto las incluidas en el análisis fueron ondansetrón 4mg+dexametasona 8mg (O&Dex), ondansetrón 4mg+haloperidol 1mg (O&Hal1), ondansetrón 4mg+haloperidol 2mg (O&Hal2) y ondansetrón 4mg+droperidol 1,25mg (O&Dro). Se utilizaron otras combinaciones (3,8%), pero no las consideramos para el análisis.
No encontramos diferencias entre grupos en cuanto a las características de las pacientes ni a los factores relacionados con la cirugía y la anestesia que podrían influir en la aparición de NVPO (tabla 1).
Características basales de las pacientes y factores relacionados con la cirugía y la anestesia
| O&Dex | O&Hal1 | O&Hal2 | O&Dro | p | |
|---|---|---|---|---|---|
| N | 92 | 92 | 92 | 92 | |
| Edad (años) | 47,5 (18-70) | 45,4 (20-69) | 46,3 (19-70) | 48,3 (26-70) | 0,37 |
| IMC (kg·m−2) | 23,8 (4) | 24,1 (4) | 24,5 (4) | 24,1 (3,9) | 0,73 |
| Puntuación Apfel 3/4 | 53/39 | 56/36 | 54/38 | 60/32 | 0,72 |
| No fumador | 90 | 86 | 88 | 82 | |
| Historia de NVPO/cinetosis | 48 | 47 | 44 | 44 | |
| Opioides postoperatorios | 86 | 85 | 90 | 90 | |
| Tipo de cirugía | 0,98 | ||||
| Colorrectal laparotomía/laparoscopia | 2/3 | 0/4 | 1/3 | 0/4 | |
| Colecistectomía laparoscópica | 11 | 11 | 13 | 11 | |
| Ginecológica laparotomía/laparoscopia | 22/15 | 14/18 | 15/18 | 16/17 | |
| Cirugía de mama | 24 | 26 | 26 | 27 | |
| Cirugía de tiroides | 14 | 17 | 16 | 16 | |
| Otra cirugía abdominal (laparoscópica) | 1 | 2 | 0 | 1 | |
| Duración de la anestesia (min) | 150 (69) | 155 (63) | 163 (75) | 155 (67) | 0,64 |
| Fentanilo intraoperatorio (μg) | 186 (68) | 184 (59) | 188 (62) | 190 (71) | 0,97 |
| Consumo medio de morfina (mg) | 9,51 (3,0) | 8,59 (2,1) | 8,90 (2,6) | 8,80 (2,6) | 0,09 |
| Fluidoterapia (cirugía+URPA) (ml·kg−1) | |||||
| Cristaloides | 25,8 (10) | 23,8 (10) | 25,6 (11) | 26,6 (10) | 0,30 |
| Coloides | 1,4 (4) | 0,8 (3) | 0,9 (3) | 1,6 (5) | 0,45 |
| Tiempo hasta la primera ingesta (min) | 680 (546) | 588 (396) | 638 (476) | 606 (462) | 0,57 |
Los valores se expresan como media (desviación estándar [DE] o rango) o número de pacientes.
IMC: índice de masa corporal; min: minutos; NVPO: náuseas y vómitos postoperatorios; O&Dex: ondansetrón 4mg i.v. en combinación con dexametasona 8mg i.v.; O&Dro: en combinación con droperidol 1,25mg i.v.; O&Hal1: en combinación con haloperidol 1mg i.v.; O&Hal2: en combinación con haloperidol 2mg i.v.; URPA: unidad de recuperación postanestésica;
Obtuvimos una respuesta completa en el 41% de las pacientes del grupo O&Hal1 (IC95%: 31-52) vs. 68% (IC: 58-78); 64% (IC: 53-74) y 63% (CI: 52-73) en las pacientes de los grupos O&Dex, O&Hal2 y O&Dro respectivamente (p=0,001). Estas diferencias significativas se observaron desde el intervalo 2-6 h (fig. 1).
Porcentaje de pacientes con respuesta completa (incidencia acumulada) en cada momento de la valoración.
O&Dex: ondansetrón 4mg i.v. en combinación con dexametasona 8mg i.v.; O&Dro: en combinación con droperidol 1,25mg i.v.; O&Hal1: en combinación con haloperidol 1mg i.v.; O&Hal2: en combinación con haloperidol 2mg i.v.
*Diferencias significativas (p<0,05) entre grupos.
Usando la corrección de Bonferroni:
# Diferencias significativas (p<0,01) comparado con O&Dex, O&Hal2 y O&Dro.
El 55% (IC: 45-66) de las pacientes en el grupo O&Hal1 sufrieron náuseas en algún momento vs. 30% (IC: 21-41), 36% (IC: 26-46) y 35% (IC: 25-45) en los grupos O&Dex, O&Hal2 y O&Dro respectivamente (p=0,002). Estas diferencias significativas se observaron desde el intervalo 2-6 h (tabla 2).
Incidencia acumulada de náuseas, episodios eméticos y náuseas y vómitos postoperatorios
| O&Dex | O&Hal1 | O&Hal2 | O&Dro | p | |
|---|---|---|---|---|---|
| n | 92 | 92 | 92 | 92 | |
| 0-2h | |||||
| N | 12 (13) | 16 (17) | 16 (17) | 6 (6) | 0,1 |
| EE | 6 (6) | 6 (6) | 8 (9) | 3 (3) | 0,5 |
| NVPO | 12 (13) | 16 (17) | 17 (18) | 7 (8) | 0,13 |
| 0-6h | |||||
| N | 24 (26) | 39 (42)a | 27 (29) | 23 (25) | 0,04 |
| EE | 12 (13) | 25 (27) | 19 (21) | 20 (22) | 0,1 |
| NVPO | 24 (26) | 41 (45)a | 28 (30) | 25 (28) | 0,026 |
| 0-12h | |||||
| N | 27 (29) | 50 (54)b | 29 (31) | 31 (34) | 0,001 |
| EE | 18 (20) | 36 (39)c | 21 (23) | 28 (30) | 0,015 |
| NVPO | 28 (30) | 52 (56)b | 30 (32) | 33 (36) | 0,001 |
| 0-24h | |||||
| N | 28 (30) | 51 (55)b | 33 (36) | 32 (35) | 0,002 |
| EE | 18 (20) | 39 (42)d | 23 (25) | 28 (30) | 0,005 |
| NVPO | 29 (31) | 54 (59)b | 33 (36) | 34 (37) | 0,001 |
EE: episodios eméticos; N: náuseas; NVPO: náuseas y vómitos postoperatorios; O&Dex: ondansetrón 4mg i.v. en combinación con dexametasona 8mg i.v.; O&Dro: en combinación con droperidol 1,25mg i.v.; O&Hal1: en combinación con haloperidol 1mg i.v.; O&Hal2: en combinación con haloperidol 2mg i.v.
Número de pacientes (%) desde el final de la cirugía hasta cada momento de evaluación.
El 42% (IC: 32-53) de las pacientes del grupo O&Hal1 sufrieron algún EE vs. 20% (12-29), 25% (16-35) y 30% (21-41) en los grupos O&Dex, O&Hal2 y O&Dro (p=0,005). Estas diferencias significativas se observaron entre O&Dex y O&Hal1 desde el intervalo 6-12 h (tabla 2).
De las pacientes que sufrieron NVPO, el 72% requirió tratamiento de rescate: 17% de O&Dex, 33% de O&Hal1, 26% de O&Hal2 y 24% de O&Dro, pero estas diferencias no resultaron significativas (p=0,156).
Si valoramos la incidencia global de náuseas, EE y NVPO en cada intervalo de tiempo, encontramos que la máxima incidencia se detecta en el intervalo 2-6 h cuando el 27% de las pacientes sufrieron NVPO, 26% náuseas y el 17% EE (fig. 2).
Para evaluar la influencia de diferentes factores de confusión en la aparición de NVPO analizamos las NVPO según tipo de cirugía, intensidad del dolor y requerimientos de opioides. No hubo diferencias en la incidencia de NVPO según el tipo de cirugía por localización anatómica (p=0,74). Debido al escaso número de pacientes con dolor severo y para facilitar el análisis estadístico agrupamos a las pacientes con dolor moderado y severo. No hallamos diferencias entre grupos en la intensidad del dolor, excepto a las 24 h, cuando un mayor número de pacientes de O&Hal2 refirieron dolor leve comparado con O&Dex. No obstante, los requerimientos de opioides no difirieron entre grupos.
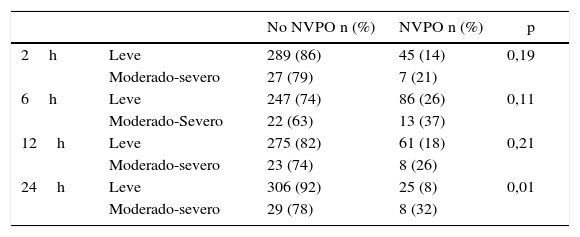
Analizamos la incidencia de NVPO en cada intervalo de tiempo según la intensidad del dolor de ese período. Encontramos diferencias en la incidencia de NVPO a las 24 h, un 32% de las pacientes con dolor moderado-severo sufrieron NVPO frente al 8% de las pacientes con dolor leve (p=0,01) (tabla 3). No hubo diferencias significativas en la cantidad de morfina recibida entre las pacientes que sufrieron NVPO en comparación con aquellas que no las sufrieron. El consumo medio fue de 8,81mg vs. 9,06mg respectivamente (p=0,38).
Incidencia de náuseas y vómitos postoperatorios según la intensidad del dolor en cada intervalo de tiempo
| No NVPO n (%) | NVPO n (%) | p | ||
|---|---|---|---|---|
| 2h | Leve | 289 (86) | 45 (14) | 0,19 |
| Moderado-severo | 27 (79) | 7 (21) | ||
| 6h | Leve | 247 (74) | 86 (26) | 0,11 |
| Moderado-Severo | 22 (63) | 13 (37) | ||
| 12h | Leve | 275 (82) | 61 (18) | 0,21 |
| Moderado-severo | 23 (74) | 8 (26) | ||
| 24h | Leve | 306 (92) | 25 (8) | 0,01 |
| Moderado-severo | 29 (78) | 8 (32) |
NVPO: náuseas y vómitos postoperatorios.
Encontramos diferencias estadísticas en el nivel de sedación en URPA. Un número significativamente mayor de pacientes en el grupo O&Dex estuvieron completamente despiertas (nivel 4) a las 2 h de URPA comparado con las pacientes del grupo O&Dro (p=0,007).
La incidencia de efectos secundarios fue mayor en el grupo O&Hal2: 63 vs. 45%, 49% y 51% en los grupos O&Dex, O&Hal1 y O&Dro respectivamente, aunque no resultó significativa (p=0,075). Encontramos efectos secundarios específicos de cada grupo de profilaxis, como euforia en el grupo O&Dex o movimientos anormales/síntomas extrapiramidales (SEP), inquietud o mareo/vértigos en los grupos de las butirofenonas (tabla 4).
Número de pacientes con efectos secundarios en cada grupo y número y tipo de los efectos secundarios más relevantes en cada grupo de profilaxis
| O&Dex | O&Hal1 | O&Hal2 | O&Dro | Total | |
|---|---|---|---|---|---|
| Pacientes con algún efecto secundario n (%) | 41 (45) | 45 (49) | 58 (63) | 47 (51) | 191 (52) |
| Cefalea | 16 | 13 | 12 | 19 | 60 |
| Mareo/vértigo | 10 | 22 | 23 | 14 | 69 |
| Ansiedad/inquietud | 4 | 11 | 14 | 11 | 40 |
| Movimientos anormales/SEP | 3a | 0 | 1 | 2 | 6 |
| Euforia | 6 | 0 | 0 | 0 | 6 |
O&Dex: ondansetrón 4mg i.v. en combinación con dexametasona 8mg i.v.; O&Dro: en combinación con droperidol 1,25mg i.v.; O&Hal1: en combinación con haloperidol 1mg i.v.; O&Hal2: en combinación con haloperidol 2mg i.v.; SEP: síntomas extrapiramidales.
No hallamos diferencias entre grupos en las variables hemodinámicas ni respiratorias. No se describieron arritmias durante la cirugía o en las primeras 2 h del periodo postoperatorio.
DiscusiónEl problema del control de las NVPO en pacientes de alto riesgo y el hecho de que el droperidol, el antiemético más usado en las últimas décadas, fuera retirado del mercado volviendo a nuestros hospitales pocos años después con mayor precio y sujeto a restricciones, nos llevó a la utilización del haloperidol. En este contexto, decidimos revisar la eficacia de nuestras combinaciones de antieméticos en pacientes de alto riesgo.
Los tipos de cirugía elegidos fueron aquellos considerados altamente emetógenos que habitualmente realizamos en nuestro centro17–20. La escala de Apfel para predecir el riesgo de sufrir NVPO en adultos ha sido validada y es la más empleada21, se aplica sistemáticamente en el preoperatorio para calcular el riesgo y guiar la profilaxis y nos sirvió para encontrar a las pacientes incluidas en nuestra cohorte.
Excluimos pacientes intervenidas mediante cirugía ambulatoria/urgente porque su manejo anestésico y postoperatorio es muy diferente al habitual, haciendo complicado encontrar una cohorte uniforme y hacer un seguimiento postoperatorio. Las pacientes que recibieron TIVA/anestesia regional también se excluyeron porque estas técnicas disminuyen el riesgo basal de NVPO.
Al analizar factores relacionados con la paciente, la cirugía y la anestesia que influyen en la aparición de NVPO, no hallamos diferencias entre los grupos, de modo que las diferencias encontradas en la respuesta completa podrían atribuirse a la profilaxis recibida.
La eficacia antiemética de dexametasona, ondansetrón y droperidol es bien conocida9–12, así como la de aquellas combinaciones que incluyen ondansetrón22–25. Droperidol fue el antiemético más utilizado a nivel mundial26 y, tras la alerta de la FDA, el uso del haloperidol ha aumentado. Existe evidencia de su efecto antiemético desde los años 70 y posee una vida media más larga que el droperidol (12-36 vs. 2,5h). En la única revisión sistemática que valoró la eficacia antiemética del haloperidol se concluyó que es eficaz entre 0,5-4mg con una toxicidad mínima15. Pero muchos de los estudios incluidos tenían un diseño poco satisfactorio. Los resultados de los ensayos clínicos con haloperidol son controvertidos. Revisándolos en profundidad desde los años 70, las dosis más altas de haloperidol han demostrado mayor eficacia27–30. Varios estudios con haloperidol 1mg han demostrado que es eficaz15,28,31,32 pero otros trabajos no han conseguido los mismos resultados33,34. Aún así, las guías clínicas indican el uso de haloperidol 1 o 2mg en combinación8,27,35,36. En aquellos trabajos en los que el haloperidol resultó eficaz, los pacientes no eran de alto riesgo o no fueron seguidos el tiempo suficiente27,31,35.
O&Hal2, O&Dex o O&Dro resultaron más eficaces que O&Hal1. La respuesta completa observada fue peor que la obtenida en otros estudios, posiblemente por el alto riesgo de NVPO de las pacientes y el tipo de cirugías.
El pico de incidencia de NVPO ocurre en el intervalo 2-6 h, y la incidencia se mantiene elevada entre las 6-12 h. La causa de este patrón es multifactorial: el efecto secundario tardío de los opioides postoperatorios, el traslado de URPA a planta y la movilización de las pacientes (en un sistema vestibular sensibilizado debido a los opioides), el inicio de la tolerancia oral, un peor control del dolor o la pérdida del efecto de algunos antieméticos podrían explicarlo. No realizar una visita postoperatoria nos puede hacer pensar que la profilaxis utilizada es eficaz, ignorando que las pacientes sufren NVPO tardíamente en planta37.
Aunque varios estudios han demostrado una menor intensidad del dolor postoperatorio cuando se administran corticoides, en el intervalo 12-24h un mayor número de pacientes del grupo O&Hal2 definieron su dolor como leve comparado con los del grupo O&Dex. Este hecho podría haber influido en la mayor incidencia de NVPO en el grupo O&Dex en ese intervalo, aunque el consumo de morfina no se incrementó y ambas profilaxis fueron las más eficaces.
Durante las 2 primeras horas se observa un menor nivel de conciencia en las pacientes del grupo O&Dro, y quizás esto podría explicar el gran efecto antinauseoso del droperidol en URPA.
Las pacientes del grupo O&Hal2 sufrieron un mayor número de efectos secundarios. Es importante destacar la alta frecuencia de efectos secundarios de los neurolépticos y la sedación asociada a las dosis «altas» de haloperidol. No utilizamos dosis extremadamente altas, pero en pacientes sin delirio o con una alta sensibilidad a los neurolépticos, parece que estas dosis tienen un efecto muy marcado.
El diseño retrospectivo de nuestro trabajo representa una limitación debido a la imposibilidad de controlar factores que podrían influir en la aparición de NVPO, y la fiabilidad de algunas variables podría ponerse en duda. Pero encontramos grupos uniformes de pacientes para llevar a cabo el análisis y, excluyendo a aquellos que recibieron TIVA/anestesia regional y cirugías ambulatorias/urgentes, eliminamos algunos factores importantes que podrían influir en las NVPO. Al mismo tiempo, usando la escala de Apfel, los pacientes que no fueron excluidos siguen siendo de alto riesgo (Apfel ≥ 3), controlando de este modo un posible sesgo de selección provocado por los criterios de inclusión. No hubo diferencias entre grupos en factores relacionados con la cirugía y la anestesia, de modo que no afectaron a los resultados. El hecho de ser un centro con un gran interés en las NVPO y tener una completa historia clínica informatizada nos permite el acceso a muchas variables relacionadas con las NVPO, lo que hace posible tener una base de datos fiable y completa.
Tras estudiar las NVPO en nuestro centro, sabemos que estas ocurren principalmente después del alta de URPA, destacando la importancia de encontrar una profilaxis eficaz y duradera, y de llevar a cabo visitas postoperatorias. No conseguimos un buen control de las NVPO en los pacientes de alto riesgo con haloperidol 1mg en combinación, de modo que decidimos retirarlo de nuestra práctica clínica. En cualquier caso, son necesarios más estudios prospectivos diseñados con el fin de reafirmar nuestros resultados, hallar la dosis mínima eficaz de haloperidol y su tolerancia.
En pacientes de alto riesgo de NVPO intervenidas mediante cirugía altamente emetógena, la combinación O&Hal1 no es eficaz. A pesar de su eficacia, la alta incidencia de efectos secundarios asociados al uso de O&Hal2 debe ser valorada antes de decidir usar esta combinación.
FinanciaciónEste estudio ha sido financiado con la beca número TRA-107 otorgada por el Ministerio de Sanidad y Política Social.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Resultados preliminares de este estudio fueron presentados en el Congreso Europeo de Anestesiología y Reanimación (Euroanaesthesia Congress) en París, en junio del 2012.