El diagnóstico fotodinámico (DFD) con hexaminolevulinato se ha empezado a utilizar recientemente para mejorar la detección del cáncer vesical no músculo invasivo. Nuestro objetivo principal fue comparar el rendimiento diagnóstico de DFD frente a endoscopia con luz blanca convencional (LB) en nuestro medio.
Material y métodosSe realizó cistoscopia fluorescente con hexaminolevulinato en el momento de la RTU a 305 pacientes de 7 hospitales españoles. Todas las lesiones detectadas con LB y DFD fueron enumeradas y registradas en una base de datos online. Se analizó histopatológicamente cada lesión por separado. En 148 pacientes se tomaron además biopsias múltiples aleatorias (BMA).
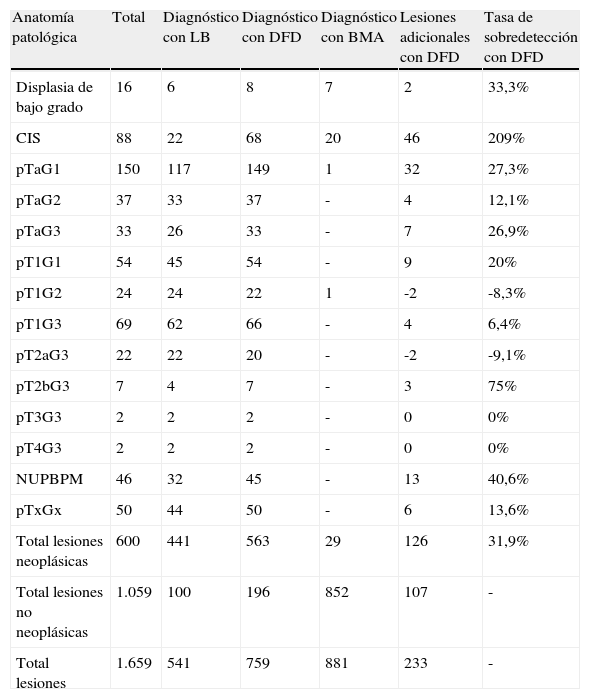
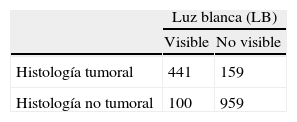
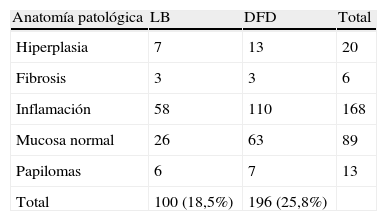
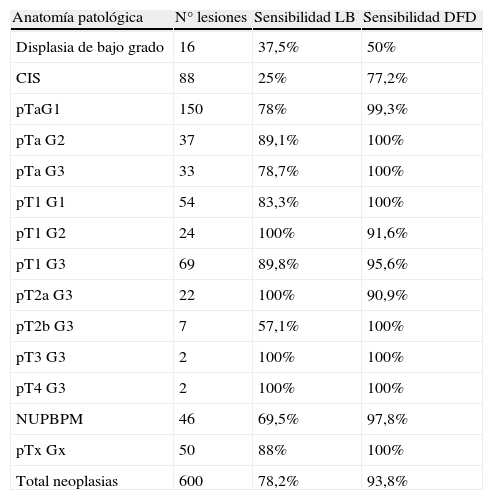
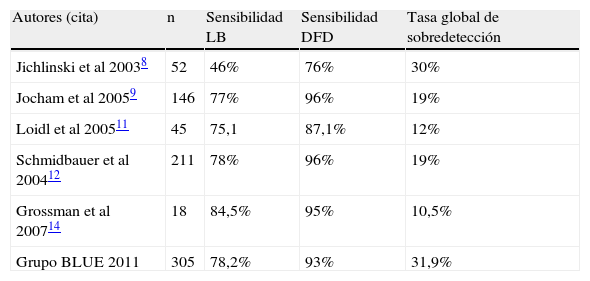
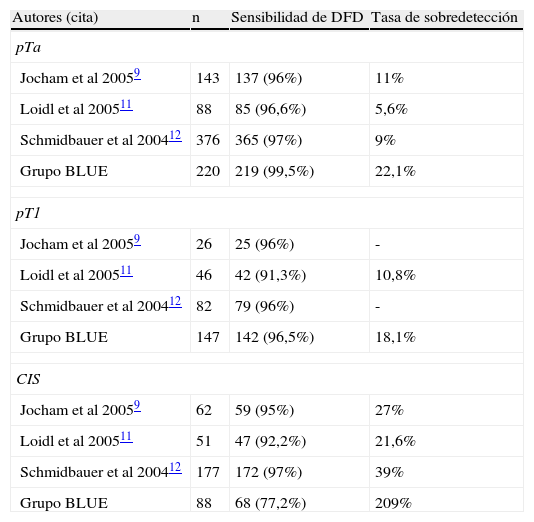
ResultadosSe biopsiaron un total de 1.659 lesiones: 522 identificadas con DFD y LB, 237 sólo con DFD, 19 sólo con LB y 881 BMA. De 600 neoplasias diagnosticadas DFD detectó 563, LB 441 y BMA 29 (20 CIS). La tasa media de sobredetección de DFD sobre LB fue del 31,9% globalmente, pero en el caso del CIS fue del 209%. La sensibilidad de DFD fue 93,8% y la de LB 78,2%. La especificidad de DFD fue 81,5% y la de LB 90,5%. En el 23% de los pacientes se detectó al menos una lesión neoplásica más con DFD que con LB.
ConclusiónLa RTU con hexaminolevulinato mejora el rendimiento diagnóstico y la calidad de la resección del cáncer vesical superficial, especialmente del CIS. La mayor sensibilidad de DFD es a costa de una menor especificidad. En nuestro estudio BMA rescató algunos falsos negativos de DFD para detectar CIS.
Photodynamic diagnosis (PDD) with hexaminolevulinate has been recently used to improve detection of non-muscle invasive bladder cancer. Our main purpose was to quantify the benefit of PDD vs. conventional white light cystoscopy (WL) in our area.
Material and methodsFluorescence-guided cystoscopy using hexaminolevulinate was performed at the time of the transurethral resection (TUR) in 305 patients from 7 Spanish hospitals. All lesions found with WL and PDD were numbered and recorded in an online database. Each lesion was sent separately for pathology analysis. Random biopsies were also obtained in 148 patients.
ResultsA total of 1659 lesions were biopsied: 522 were identified with PDD and WL, 237 only with PDD, 19 only with WL and 881 random biopsies. Of the 600 tumors, PDD detected 563, WL 441 and random biopsies 29 (20 CIS). The mean overdetection rate for PDD over WL was 31.9% for all types of lesions, but it was 209% for carcinoma in situ (CIS). Sensitivity was 93.8% for PDD and 78.2% for WL. Specificity was 81.5% for PDD and 90.5% for WL. In 23% of patients, PDD detected at least one additional neoplastic lesion compared to WL.
ConclusionsHexaminolevulinate fluorescence cystoscopy improves detection and resection of non-muscle invasive bladder cancer, especially of CIS. Sensitivity of PDD is higher than WL, but specificity is lower. In our study, random biopsies were able to detect some CIS not visible under PDD.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora