El síndrome inflamatorio multisistémico pediátrico temporal asociado a la COVID-19 es una presentación poco frecuente de la infección por SARS-CoV-2. Su manifestación más común es el choque cardiogénico, con un alto porcentaje de pacientes que requieren soporte vasoactivo e inotrópico.
En ocasiones, la disfunción miocárdica asociada puede ser tan grave que puede llevar a la muerte. Por lo tanto, terapias como la oxigenación por membrana extracorpórea (ECMO) se utilizan como una opción de apoyo temporal para la recuperación de estos pacientes. Sin embargo, esta herramienta es subutilizada.
En este artículo exponemos el caso de un adolescente que presentó síntomas gastrointestinales y fiebre, desarrollando posteriormente un choque cardiogénico refractario debido a un síndrome inflamatorio sistémico asociado a la COVID-19. Se identificó la presencia del SARS-CoV-2 mediante un aspirado traqueal, y debido a su inestabilidad hemodinámica, el paciente recibió terapia con ECMO, así como medicamentos esteroideos, inmunomoduladores e inotrópicos. Pasada una semana, el paciente se recuperó y presentó una función ventricular normal, con un desenlace favorable.
En conclusión, la terapia con ECMO en pacientes pediátricos con síndrome inflamatorio multisistémico asociado a la COVID-19 puede contribuir a una mejora en la supervivencia. Sin embargo, su uso es limitado y existe una escasez de reportes en la literatura, lo que genera deficiencias en la evidencia sobre su implementación.
Pediatric multisystem inflammatory syndrome temporally associated with COVID-19 is a rare presentation of SARS-CoV-2 infection. Its most common manifestation is cardiogenic shock, with a high percentage of patients requiring vasoactive and inotropic support.
Occasionally, the myocardial dysfunction can be severe enough to result in death. Therapies such as extracorporeal membrane oxygenation (ECMO) provide a transient support option for recovery; however, it is an underutilized tool.
In this article, we present the case of an adolescent who initially presented with gastrointestinal symptoms and fever, who subsequently developed refractory cardiogenic shock attributed to a systemic inflammatory syndrome associated with COVID-19. The presence of SARS-CoV-2 was identified through tracheal aspirate, and due to hemodynamic instability, the patient received ECMO therapy along with steroid medications, immunomodulators, and inotropes. After one week, the patient recovered ventricular function with a favorable outcome.
In conclusion, ECMO therapy in pediatric patients with systemic inflammatory syndrome associated with COVID-19 may contribute to improved survival. However, the low utilization of this therapy and limited reporting in the literature lead to deficiencies in the evidence supporting its implementation.
En diciembre de 2019, en la ciudad de Wuhan, se identificó un nuevo coronavirus altamente patógeno que se propagó rápidamente por todo el mundo. El 11 de marzo de 2020 la Organización Mundial de la Salud declaró una pandemia. Hasta la fecha, se han confirmado más de 650 millones de casos en todas las edades con mayores tasas de morbimortalidad en la población adulta1,2.
En la población pediátrica, la enfermedad por coronavirus de 2019 (COVID-19) generalmente se presenta de forma leve3. Sin embargo, a partir de abril de 2020, en el Reino Unido se describió una serie de casos con presentación clínica grave, caracterizada por hipotensión y disfunción orgánica, que afectaba a menos del 1% de los pacientes. Esta dolencia se denominó síndrome inflamatorio multisistémico pediátrico temporalmente asociado a la COVID-19 (SIMS-TAC)4. En otro estudio, se informó una incidencia de 2 casos por cada 100.000 menores de 21 años, y se asume que su presentación es posterior a la infección, ya que alcanza su punto máximo varias semanas después de las oleadas de COVID-195.
Luego de múltiples informes de casos en el mundo, se ha clasificado este síndrome en 3 fenotipos según su presentación clínica y similitudes con la enfermedad de Kawasaki (EK): SIMS-TAC sin superposición con EK, SIMS-TAC superpuesta con la EK y SIMS-TAC superpuesta con COVID-19 aguda6. El fenotipo de SIMS-TAC sin superposición con EK es el más predominante y está asociado con una mayor depresión cardiovascular, lo cual requiere un uso frecuente de inotrópicos y vasopresores7. En ocasiones, el tratamiento médico resulta insuficiente, lo que puede llevar a un desenlace fatal, descrito en el 1,8 al 9% de los casos8.
La terapia de oxigenación por membrana extracorpórea (ECMO) ha sido utilizada como una estrategia en cuidado crítico para brindar apoyo temporal en casos de disfunción cardíaca o pulmonar. Se implementa en instituciones de alta complejidad para el manejo de afecciones potencialmente reversibles que no logran mejoría con el tratamiento médico óptimo8. Por lo tanto, se convierte en una herramienta de gran utilidad para pacientes con SIMS-TAC. Sin embargo, hay pocos datos en la literatura sobre la aplicación de ECMO y su respuesta clínica9.
A continuación presentamos un caso reportado en Colombia de un adolescente que desarrolló SIMS-TAC con choque cardiogénico refractario y que requirió terapia ECMO venoarterial, y su respuesta clínica.
Descripción del caso clínicoPaciente masculino de 17 años sin antecedentes personales relevantes ni enfermedades familiares conocidas, con esquema de vacunación con 2 dosis para el síndrome respiratorio agudo severo por coronavirus tipo 2 (SARS-CoV-2), quien presentó cuadro clínico de 3 días de evolución que incluía: fiebre subjetiva, malestar general, astenia y adinamia, así como síntomas gastrointestinales con un aumento en las deposiciones y vómitos.
Debido al empeoramiento de sus síntomas, consultó a un centro de salud de primer nivel. Durante el examen físico, se encontró que el paciente presentaba inestabilidad hemodinámica y una hipoxemia grave. Se inició manejo con oxigenoterapia y administración de líquidos por vía intravenosa, pero la respuesta fue limitada. Ante la sospecha de una insuficiencia respiratoria aguda grave, se procedió a realizar una intubación orotraqueal y el paciente fue trasladado a un centro de alta complejidad en la ciudad.
En el segundo centro de atención, el paciente fue evaluado por un especialista en urgencias, quien al examinarlo documentó estertores diseminados y persistencia de la inestabilidad hemodinámica. Solicitó una radiografía de tórax que reveló infiltrados reticulares globales. Ante los hallazgos, el especialista sospechó un choque séptico, por lo que indicó manejo urgente con vasopresores, requiriendo dosis elevadas de norepinefrina y vasopresina, así como esteroides, y solicitó pruebas complementarias para tener un enfoque más preciso del cuadro clínico.
Debido al alto uso de vasopresores e inotrópicos, se consideró como diagnóstico diferencial un choque cardiogénico originado por una miocarditis, especialmente debido a la edad del paciente. Este diagnóstico se fortaleció al obtenerse un resultado positivo en la troponina y un informe de ecocardiograma que indicaba una miocardiopatía dilatada con fracción de eyección del ventrículo izquierdo (FEVI) del 10%. Dada la identificación de la disfunción miocárdica grave con un alto riesgo de mortalidad, el paciente fue remitido a una institución de alta complejidad con disponibilidad de terapia ECMO para realizar una canulación venoarterial como medida de rescate.
En la tercera institución se confirmó la presencia de insuficiencia cardíaca aguda con FEVI del 5% en un ecocardiograma de seguimiento. Se continuó investigando la causa principal con pruebas de detección de infecciones, incluyendo: hemocultivos, urocultivo, anticuerpos contra Chagas, citomegalovirus, antígeno de dengue, hepatotropos, anticuerpos para virus de la inmunodeficiencia humana, sífilis y Mycoplasma, todos los cuales arrojaron resultados negativos. El único hallazgo positivo fue la infección por SARS-CoV-2, confirmada a través de un panel viral realizado en una muestra de aspirado traqueal. Además, se descartaron diagnósticos diferenciales reumatológicos con pruebas negativas para anticuerpos antinucleares, anticuerpos dirigidos a antígenos extraíbles del núcleo, anti-ADN, anticuerpos anticitoplasma de neutrófilos y los niveles de los complementos C3 y C4, los cuales estaban dentro de los rangos normales de laboratorio.
Asociado a lo anterior, se documentó una marcada respuesta inflamatoria evidenciada por niveles aumentados de proteína C reactiva, procalcitonina positiva, ferritina por encima del rango de laboratorio, dímero D elevado y linfopenia. Estos hallazgos se consideraron indicativos de un mal pronóstico asociados a la infección por COVID-19.
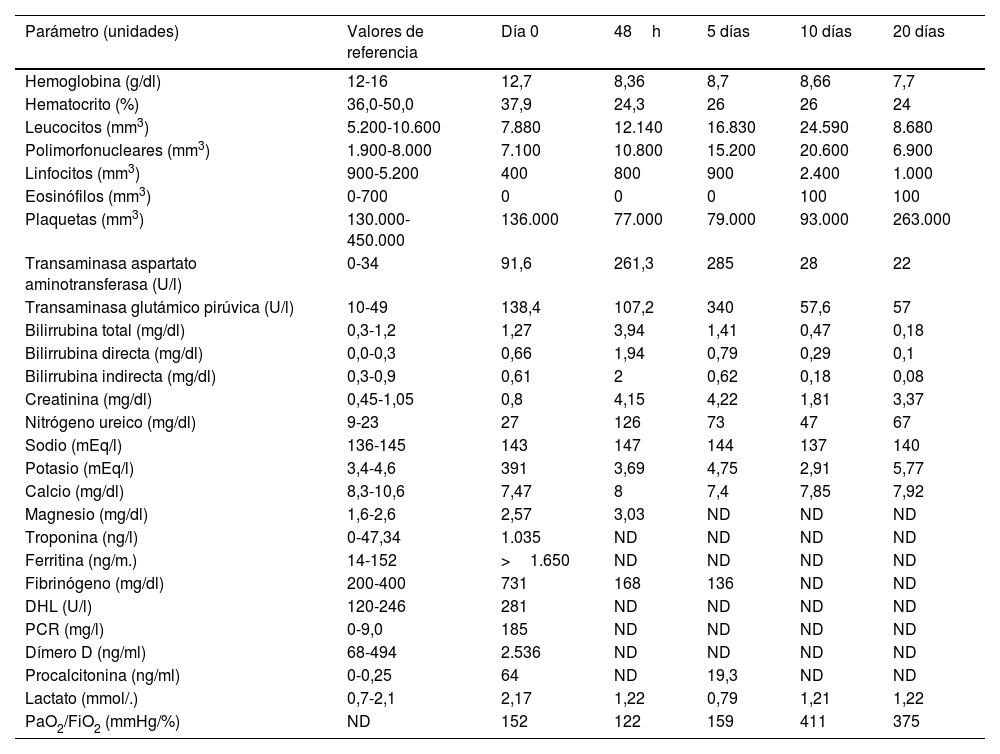
Dado que no se contaba con la disponibilidad de resonancia magnética cardíaca o biopsia endocárdica, el paciente fue evaluado por un especialista en enfermedades infecciosas. Con base en los hallazgos clínicos y los resultados de las pruebas complementarias (tabla 1), se consideró un posible síndrome de respuesta inflamatoria multisistémica con afectación cardíaca, renal, hepática, pulmonar y cutánea (presentó un rash morbiliforme generalizado, predominantemente en el tronco, y mucositis oral durante el seguimiento). Se recomendó el tratamiento con tocilizumab, esteroides e inmunoglobulina, pero lamentablemente no fue posible administrar esta última debido a la escasez de suministros a nivel nacional.
Paraclínicos del paciente y su evolución en el tiempo según curso clínico desde el ingreso a la terapia ECMO
| Parámetro (unidades) | Valores de referencia | Día 0 | 48h | 5 días | 10 días | 20 días |
|---|---|---|---|---|---|---|
| Hemoglobina (g/dl) | 12-16 | 12,7 | 8,36 | 8,7 | 8,66 | 7,7 |
| Hematocrito (%) | 36,0-50,0 | 37,9 | 24,3 | 26 | 26 | 24 |
| Leucocitos (mm3) | 5.200-10.600 | 7.880 | 12.140 | 16.830 | 24.590 | 8.680 |
| Polimorfonucleares (mm3) | 1.900-8.000 | 7.100 | 10.800 | 15.200 | 20.600 | 6.900 |
| Linfocitos (mm3) | 900-5.200 | 400 | 800 | 900 | 2.400 | 1.000 |
| Eosinófilos (mm3) | 0-700 | 0 | 0 | 0 | 100 | 100 |
| Plaquetas (mm3) | 130.000-450.000 | 136.000 | 77.000 | 79.000 | 93.000 | 263.000 |
| Transaminasa aspartato aminotransferasa (U/l) | 0-34 | 91,6 | 261,3 | 285 | 28 | 22 |
| Transaminasa glutámico pirúvica (U/l) | 10-49 | 138,4 | 107,2 | 340 | 57,6 | 57 |
| Bilirrubina total (mg/dl) | 0,3-1,2 | 1,27 | 3,94 | 1,41 | 0,47 | 0,18 |
| Bilirrubina directa (mg/dl) | 0,0-0,3 | 0,66 | 1,94 | 0,79 | 0,29 | 0,1 |
| Bilirrubina indirecta (mg/dl) | 0,3-0,9 | 0,61 | 2 | 0,62 | 0,18 | 0,08 |
| Creatinina (mg/dl) | 0,45-1,05 | 0,8 | 4,15 | 4,22 | 1,81 | 3,37 |
| Nitrógeno ureico (mg/dl) | 9-23 | 27 | 126 | 73 | 47 | 67 |
| Sodio (mEq/l) | 136-145 | 143 | 147 | 144 | 137 | 140 |
| Potasio (mEq/l) | 3,4-4,6 | 391 | 3,69 | 4,75 | 2,91 | 5,77 |
| Calcio (mg/dl) | 8,3-10,6 | 7,47 | 8 | 7,4 | 7,85 | 7,92 |
| Magnesio (mg/dl) | 1,6-2,6 | 2,57 | 3,03 | ND | ND | ND |
| Troponina (ng/l) | 0-47,34 | 1.035 | ND | ND | ND | ND |
| Ferritina (ng/m.) | 14-152 | >1.650 | ND | ND | ND | ND |
| Fibrinógeno (mg/dl) | 200-400 | 731 | 168 | 136 | ND | ND |
| DHL (U/l) | 120-246 | 281 | ND | ND | ND | ND |
| PCR (mg/l) | 0-9,0 | 185 | ND | ND | ND | ND |
| Dímero D (ng/ml) | 68-494 | 2.536 | ND | ND | ND | ND |
| Procalcitonina (ng/ml) | 0-0,25 | 64 | ND | 19,3 | ND | ND |
| Lactato (mmol/.) | 0,7-2,1 | 2,17 | 1,22 | 0,79 | 1,21 | 1,22 |
| PaO2/FiO2 (mmHg/%) | ND | 152 | 122 | 159 | 411 | 375 |
ND: no se disponía de control paraclínico para ese rango temporal.
A las 48h de iniciar la terapia con ECMO, el paciente experimentó un deterioro de su función renal, lo que requirió la realización de terapia de diálisis intermitente. A las 96h se le realizó un ecocardiograma de seguimiento, que mostró una mejora en la función ventricular con una FEVI del 28%. A pesar de esta mejoría, el estado clínico del paciente seguía siendo desfavorable, ya que presentaba sangrado, anemia y coagulopatía, manifestada por trombocitopenia, hipofibrinogenemia y tiempo de tromboplastina parcial prolongado, lo cual dificultaba la realización de la terapia de diálisis intermitente.
Se solicitó una consulta con el equipo de hematología debido a la sospecha de una posible coagulopatía por consumo o una coagulopatía inducida por heparina. Ante los hallazgos clínicos, el equipo consideró que era más factible una coagulopatía intravascular diseminada asociada con la disfunción multiorgánica. Se continuó el tratamiento con la administración de productos sanguíneos y se optó por una terapia de diálisis sostenida de baja eficiencia, ya que la anticoagulación era vital para el tratamiento con ECMO. Estas medidas contribuyeron a mejorar la evolución clínica del paciente.
Además, el equipo de hematología evaluó otros posibles diagnósticos diferenciales, y descartó el síndrome hemofagocítico y la linfohistiocitosis hemofagocítica basándose en la presentación clínica y los resultados de los análisis de laboratorio.
Después de una semana de terapia con ECMO, se observó una mejora notable, evidenciada por la reducción de las dosis de vasopresores. Se realizó un ecocardiograma de seguimiento que mostró una FEVI del 55% y se comprobó que el paciente tenía tolerancia a la reducción de los parámetros de la ECMO. Se decidió retirar la terapia, procedimiento que se llevó a cabo con éxito, lo que permitió comenzar a reducir la sedación y desconectar al paciente de la ventilación mecánica.
Luego del procedimiento, el paciente continuó presentando una buena evolución. Logró ser liberado de la ventilación mecánica con apoyo de una traqueostomía, la cual posteriormente pudo ser decanulada. Además, experimentó una mejoría en su función renal, lo que permitió retirar la terapia de diálisis y, tras proporcionar educación a sus familiares, darle de alta.
Se realizó un seguimiento telefónico a los 6 y 10 meses, durante los cuales el paciente informó que se encontraba en buenas condiciones. La traqueostomía había sido cerrada, ya no requería soporte renal y podía realizar algunas de sus actividades cotidianas.
DiscusiónEl SIMS-TAC es una enfermedad emergente en pediatría que requiere alta sospecha clínica por parte del equipo de salud, ya que sus síntomas y signos iniciales son altamente inespecíficos. En este caso, el paciente consultó por fiebre, la cual forma parte de los criterios diagnósticos y se ha reportado en el 100% de los pacientes, con una duración en promedio de entre 4 y 6 días. Además, el paciente presentó síntomas gastrointestinales, los cuales se han asociado en un 63,9% (con un rango del 60 al 100%), y síntomas cutáneos que se manifestaron en los días siguientes a la atención, con una prevalencia reportada del 65,6% (con un rango del 41 al 76%)7,10.
Se destaca que la fiebre, los trastornos gastrointestinales, los signos cutáneos y la depresión cardiovascular son los hallazgos más frecuentemente asociados al SIMS-TAC, a diferencia de lo que ocurre en los adultos, cuya presentación de COVID-19 se caracteriza por una predominancia de síntomas en el sistema respiratorio2,4–6.
La presencia de esta sintomatología en el momento de acudir al servicio de urgencias se ha asociado a cuadros graves de choque hemodinámico, que se ha reportado en hasta el 43,2% de los casos, siendo este hallazgo más frecuente en pacientes con mayor edad7.
El clínico, al enfrentarse a un escenario de choque indiferenciado, debe realizar intervenciones rápidas para identificar su causa y brindar un tratamiento de soporte específico. En el SIMS-TAC, se ha documentado la presencia de un choque cardiogénico refractario. En estos casos, es común el uso de medicamentos inotrópicos, los cuales se administran en el 84,6% de los pacientes con esta enfermedad en Estados Unidos y en el 76% de los pacientes en Colombia7,11,12.
La falla circulatoria en este tipo de casos es tan severa que se ha observado un requerimiento de ventilación mecánica en el 43,6% de los casos en Estados Unidos y en el 28% en Colombia12. Es importante destacar que el recurso de la ventilación con presión positiva se utiliza como un mecanismo para la estabilización cardiovascular más que para suplir una función respiratoria7,11,12.
Luego de brindar las medidas iniciales, es necesario realizar estudios de extensión en los pacientes con SIMS-TAC. Estos pacientes se caracterizan por presentar elevación de los marcadores inflamatorios (como la proteína C reactiva, la velocidad de sedimentación globular, la procalcitonina, la ferritina y la interleucina-6) y alteraciones hematológicas, como anemia, neutrofilia, linfopenia y trombocitopenia. Estos cambios son aún más pronunciados en aquellos pacientes que presentan el fenotipo asociado con hipotensión (SIMS-TAC sin superposición con EK)7,8,12, lo cual también se corroboró en nuestro caso clínico (tabla 1).
En cuanto al diagnóstico del SIMS-TAC, es importante enfatizar que se basa en parámetros clínicos13. El apoyo interdisciplinario de especialidades como hematología, reumatología e infectología es crucial para ayudar a diferenciar el diagnóstico de otras enfermedades con presentaciones clínicas similares14, como:
- -
Infecciones sistémicas como la sepsis bacteriana y el síndrome de choque tóxico estafilocócico o estreptocócico, en los cuales se suelen evidenciar cultivos positivos8,14.
- -
La COVID-19 aguda, en donde el SIMS-TAC se presenta en pacientes previamente sanos, a diferencia de la COVID-19 aguda que se asocia a infantes que tienen enfermedades crónicas y cuyos síntomas son predominantemente respiratorios15.
- -
La EK, que se diferencia por su grupo etario, ya que la EK es más frecuente en la población pediátrica, mientras que el SIMS-TAC predomina en infantes de mayor edad y adolescentes. Además, la presencia de choque y síntomas gastrointestinales, que son poco frecuentes en la EK, puede ayudar a distinguir entre ambas dolencias16,17.
- -
El lupus eritematoso sistémico, que se caracteriza por la presencia de marcadores inmunológicos específicos, así como un mayor compromiso renal y neurológico18.
- -
El síndrome hemofagocítico y la linfohistiocitosis hemofagocítica, que se caracterizan por la presencia de marcadores inmunológicos específicos, así como un mayor compromiso renal y neurológico19.
Después de considerar los diagnósticos diferenciales y definir su baja probabilidad, para confirmar el SIMS-TAC es necesario contar con la presencia de un nexo epidemiológico o el aislamiento del SARS-CoV-210,16.
En el caso de nuestro paciente, presentó un choque cardiogénico refractario con una función ventricular izquierda deprimida, lo cual ha sido reportado en series de casos en aproximadamente el 30-40% de los pacientes con SIMS-TAC7,11,12. Ante la falta de mejoría a pesar de los soportes y medidas farmacológicas instauradas, se tomó la decisión de implementar la ECMO venoarterial. Es importante destacar que el uso de esta terapia en pacientes con SIMS-TAC ha sido descrito en tan solo el 2,2% de los casos en una cohorte retrospectiva en Estados Unidos7.
El estudio MIS-CO nos ha brindado información valiosa sobre el comportamiento del síndrome inflamatorio multisistémico temporal asociado a la COVID-19 en nuestro entorno. En este estudio, se observa que la mortalidad es significativamente mayor en países en desarrollo en comparación con aquellos de altos ingresos (9 frente a 1,8%)12. Es importante destacar que el 76% de los pacientes requirieron soporte inotrópico, y no se describió ningún paciente que recibiera terapia ECMO. La implementación temprana de la ECMO podría haber mejorado las estadísticas de supervivencia.
Estos hallazgos también se reflejan a nivel mundial. En una encuesta realizada por Di Nardo et al.20 en población europea, se evidencia un bajo uso de la terapia ECMO en niños en comparación con su uso en adultos durante la segunda y tercera ola de COVID-19. Esto demuestra que la ECMO es subutilizada en la población pediátrica.
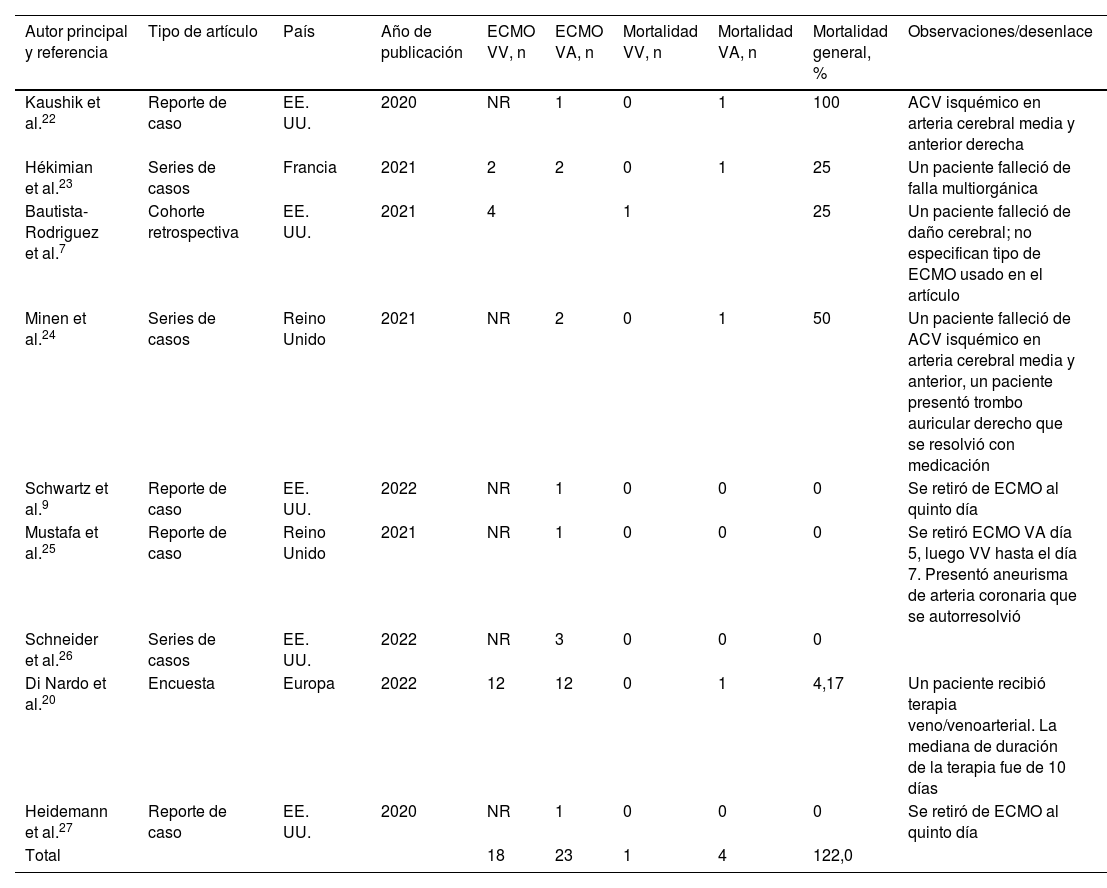
Realizando una búsqueda en la base de datos de PubMed utilizando los descriptores MESH «Pediatric multisystem inflammatory disease» AND «COVID-19» AND «ECMO» se encontraron 9 artículos que incluían pacientes en ECMO. Estos artículos describen un total de 41 casos, de los cuales 23 fueron tratados con ECMO venoarterial, 14 con ECMO venovenoso y 4 no especificaron el tipo de ECMO utilizado. Los países que más describen el uso de ECMO en estos casos son Estados Unidos y Reino Unido, con una tasa de supervivencia aproximada del 87%. Sin embargo, es importante destacar que la mayoría de estos artículos consisten en series y reportes de casos, por lo que brindan poca información detallada sobre el uso de esta terapia y sus limitaciones (tabla 2).
Artículos encontrados respecto a la presencia de síndrome inflamatorio multisistémico y ECMO
| Autor principal y referencia | Tipo de artículo | País | Año de publicación | ECMO VV, n | ECMO VA, n | Mortalidad VV, n | Mortalidad VA, n | Mortalidad general, % | Observaciones/desenlace |
|---|---|---|---|---|---|---|---|---|---|
| Kaushik et al.22 | Reporte de caso | EE. UU. | 2020 | NR | 1 | 0 | 1 | 100 | ACV isquémico en arteria cerebral media y anterior derecha |
| Hékimian et al.23 | Series de casos | Francia | 2021 | 2 | 2 | 0 | 1 | 25 | Un paciente falleció de falla multiorgánica |
| Bautista-Rodriguez et al.7 | Cohorte retrospectiva | EE. UU. | 2021 | 4 | 1 | 25 | Un paciente falleció de daño cerebral; no especifican tipo de ECMO usado en el artículo | ||
| Minen et al.24 | Series de casos | Reino Unido | 2021 | NR | 2 | 0 | 1 | 50 | Un paciente falleció de ACV isquémico en arteria cerebral media y anterior, un paciente presentó trombo auricular derecho que se resolvió con medicación |
| Schwartz et al.9 | Reporte de caso | EE. UU. | 2022 | NR | 1 | 0 | 0 | 0 | Se retiró de ECMO al quinto día |
| Mustafa et al.25 | Reporte de caso | Reino Unido | 2021 | NR | 1 | 0 | 0 | 0 | Se retiró ECMO VA día 5, luego VV hasta el día 7. Presentó aneurisma de arteria coronaria que se autorresolvió |
| Schneider et al.26 | Series de casos | EE. UU. | 2022 | NR | 3 | 0 | 0 | 0 | |
| Di Nardo et al.20 | Encuesta | Europa | 2022 | 12 | 12 | 0 | 1 | 4,17 | Un paciente recibió terapia veno/venoarterial. La mediana de duración de la terapia fue de 10 días |
| Heidemann et al.27 | Reporte de caso | EE. UU. | 2020 | NR | 1 | 0 | 0 | 0 | Se retiró de ECMO al quinto día |
| Total | 18 | 23 | 1 | 4 | 122,0 |
NR: No se reportaban casos de ECMO en esa modalidad en el artículo.
En cuanto a la terapia dirigida en el SIMS-TAC, los tratamientos más utilizados son la inmunoglobulina (91%), los corticosteroides (70,5%) y los antiplaquetarios y anticoagulantes (44%)8,10. En el caso de nuestro paciente, recibió corticosteroides a dosis altas y el inhibidor de interleucina-6 tocilizumab, así como terapia antiplaquetaria y anticoagulante. No obstante, no fue posible administrar la terapia de primera línea, que es la inmunoglobulina, debido a la falta de disponibilidad21.
Luego de una semana de recibir tratamiento con terapia ECMO, el paciente mostró signos de recuperación, incluyendo un aumento significativo de la FEVI junto con una modulación de la respuesta inflamatoria, lo que permitió retirar la terapia ECMO. Estos resultados son consistentes con los datos reportados en la literatura, donde la mayoría de los pacientes logran la decanulación a los 5 y 7 días, y se destaca que en el 91% de los casos la función del ventrículo izquierdo se normaliza dentro de los 30 días8,22,23.
Es importante mencionar que no se presentaron complicaciones cardiovasculares, como dilataciones coronarias, las cuales han sido más frecuentemente descritas en fenotipos similares a la EK (26 frente a 12%)7.
En el caso presentado, el paciente desarrolló una lesión renal aguda de acuerdo con la clasificación Kidney Disease Improving Global Outcomes, siendo de tipo iii multifactorial. Esta lesión se debió a diversos factores, como la respuesta inflamatoria causada por la infección por COVID-19, el choque cardiogénico y el uso de medicamentos vasoactivos. Como resultado, el paciente requirió terapia de reemplazo renal, lo cual ha sido documentado en aproximadamente el 5,1% de los pacientes con SIMS-TAC y el 11,5% en Colombia12. Sin embargo, esta terapia logró retirarse a los pocos meses sin que se observaran repercusiones adicionales en el paciente5,7,10.
ConclusionesEl SIMS-TAC es una complicación poco común pero potencialmente mortal que surgió durante la pandemia global de COVID-19. Esta enfermedad se caracteriza por una respuesta inflamatoria grave que puede afectar el sistema cardiovascular, provocando un choque hemodinámico y requiriendo medidas de rescate como la terapia de ECMO.
Aunque se han reportado casos de pacientes pediátricos que han recibido terapia ECMO, la información disponible en la literatura es limitada y se basa principalmente en reportes y series de casos, lo que implica un nivel de evidencia más bajo y un potencial sesgo de publicación. Por el momento, los resultados reportados hasta ahora han sido alentadores, con una mejora en la supervivencia cuando la terapia ECMO se combina con otros tratamientos antiinflamatorios.
Es importante destacar que se requiere una mayor investigación y recopilación de datos para obtener una comprensión más completa de la implementación y efectividad de la terapia ECMO en pacientes pediátricos con SIMS-TAC.
Consideraciones éticasPara la publicación del artículo se obtuvo el consentimiento informado del paciente y su familia, quienes eran sus representantes legales; además, para efectos de privacidad se omitieron todos los datos personales que pueden llevar a su identificación, siendo solamente mencionados aquellos de relevancia clínica.
FinanciaciónDeclaramos que ninguno de los autores ha recibido dinero durante la realización o publicación de este artículo.
Conflicto de interesesDeclaramos que ninguno de los autores posee conflictos de intereses.