Un hombre de 43 años, sin antecedentes médicos relevantes o factores de riesgo conocidos, desarrolló una probable coinfección sintomática por Legionella pneumophila y hantavirus variedad Andes, con la aparición de sintomatología abdominal y respiratoria, progresando hasta disfunción orgánica múltiple con falla respiratoria, miocárdica, renal y endotelial. ¿Estamos ante la primera coinfección descrita?
A 43-year-old man with no relevant medical history or known risk factors, who developed a symptomatic probable coinfection with Legionella pneumophila and hantavirus Andes lineage, with the appearance of abdominal and respiratory symptoms that progressed to multiple organ dysfunction with respiratory, myocardial, renal, and endothelial failure. Is this the first reported coinfection?
La enfermedad por hantavirus variedad Andes y la enfermedad pulmonar por Legionella pneumophila son dos infecciones infrecuentes que pueden manifestarse con sintomatología similar, siendo parte del diagnóstico diferencial del deterioro ventilatorio y la neumonía grave de causa atípica en pacientes en cuidados intensivos, particularmente en Chile1–3.
La variedad Andes del hantavirus es una enfermedad zoonótica transmitida a los humanos mediante el contacto con roedores infectados o sus excreciones, especialmente en áreas rurales o suburbanas, típicamente entre Valparaíso y Aysén. Se caracteriza por una fase inicial con síntomas catarrales inespecíficos, seguida, en un porcentaje menor de pacientes, por una fase cardiopulmonar que puede progresar al requerimiento de soporte ventilatorio invasivo y terapia de soporte extracorpóreo (ECMO), con una letalidad del 50% de los casos4.
Por su parte, la enfermedad por Legionella pneumophila es causada por una bacteria que se encuentra en agua dulce y que puede crecer en sistemas de agua artificiales, presentándose también con síntomas catarrales, como fiebre, escalofríos, dolores musculares y tos, pero también puede incluir síntomas como dolor abdominal, diarrea, náuseas y dolor de cabeza3. Para los casos que requieren manejo en la unidad de cuidados intensivos se ha reportado una mortalidad mayor al 30%5.
En este artículo se presenta el caso clínico de un paciente con probable coinfección por legionela y hantavirus variante Andes con su evolución clínica y análisis de la literatura.
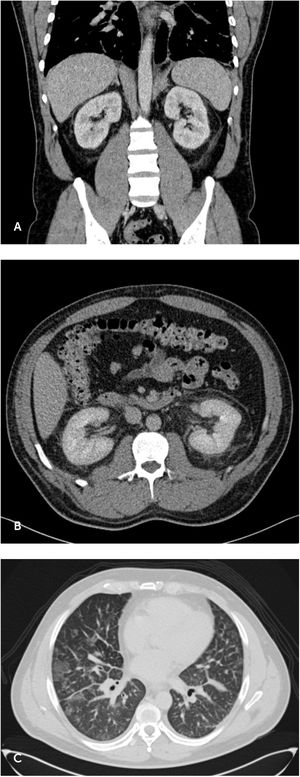
Caso clínicoUn hombre de 43 años, sin antecedentes mórbidos, de residencia y trabajo urbano, con agua potable, sin exposición reciente a áreas rurales, aire acondicionado, torres de enfriamiento o uso de hidromasajes en al menos las 8 semanas anteriores al cuadro clínico. Consulta en servicio de urgencias por compromiso del estado general asociado a fiebre de hasta 38°C, mialgias y dolor lumbar progresivo. Se le realiza una tomografía computada (TC) de abdomen que evidenció cambios edematosos perirrenales bilaterales (figura 1A) y áreas de vidrio esmerilado y nódulos a nivel pulmonar, informadas como posiblemente de origen inflamatorio infeccioso (figura 1B y C).
Se hospitalizó al paciente con sospecha de sepsis de origen abdominal versus respiratorio recibiendo inicialmente ceftriaxona como tratamiento. El estudio microbiológico incluyó hemocultivos, PCR multipatógeno de vías respiratorias altas para el estudio viral, PCR SARS-CoV-2 y antigenurias para Streptococcus pneumoniae y Legionella spp. Destaca como único resultado positivo antígeno urinario de Legionella spp. positivo, por lo que se rotó terapia a levofloxacino, completando 10 días de terapia.
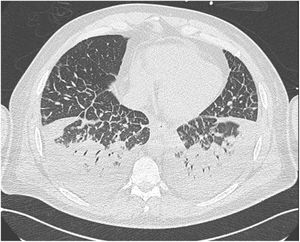
A pesar de una mejoría clínica inicial a las 24 horas de hospitalización, el paciente inició al tercer día de internación, un segundo quiebre clínico con deterioro ventilatorio progresivo, asociado a la aparición de infiltrados pulmonares bilaterales y signos de congestión pulmonar (figura 2), requiriendo ventilación mecánica no invasiva. Además, presentó disfunción renal progresiva con necesidad de terapia de reemplazo renal, iniciándose hemofiltración de alto volumen y terapia de hemoadsorción. Se observó evidencias ecocardiográficas de deterioro inicial en la relajación miocárdica y posterior disminución de la fracción de eyección hasta 35%, por lo que se inició terapia inotrópica. En el laboratorio se registró un aumento de hemoglobina hasta 14,8g/dl, leucocitosis sobre 26 000 céls/mm3, con presencia de inmunoblastos y disminución progresiva del recuento plaquetario hasta 49 000 plaquetas por microlitro (μl) (tabla 1). Se complementó el estudio con serología IgG e IgM y PCR para hantavirus por parte del laboratorio de referencia nacional para confirmación de esta enfermedad, resultando ambos positivos.
Resumen de resultados de hemogramas de paciente durante primera semana de hospitalización
| Pre-Ingreso | Día 1 | Día 2 | Día 3 | Día 4 | Día 5 | Día 6 | Día 7 | |
|---|---|---|---|---|---|---|---|---|
| Hemoglobina (g/dl) | 13 | 14,8 | 14,7 | 14,1 | 13,6 | 11,8 | 11,6 | 12,2 |
| Hematocrito (%) | 41 | 41,9 | 41,3 | 40,1 | 39,2 | 34,5 | 34,9 | 35,7 |
| Glóbulos blancos (céls/mm3) | 8 500 | 9 850 | 13 700 | 20 900 | 20 520 | 22 600 | 26 350 | 18 640 |
| Células especiales | Células plasmáticas | Inmunoblastos | Inmunoblastos | |||||
| Plaquetas | ||||||||
| (por μl) | 135 000 | 50 000 | 49 000 | 76 000 | 85 000 | 129 000 | 170 000 | 251 000 |
El deterioro clínico progresó hasta el quinto día de manejo, manteniéndose soporte ventilatorio no invasivo, terapia inotrópica y terapia de reemplazo renal, además de tratamiento antibiótico para legionelosis. El paciente inició recuperación de contractilidad miocárdica, con suspensión de terapia de sustitución renal, retiro de soporte ventilatorio, ascenso progresivo de recuento plaquetario y normalización de hemograma.
Fue dado de alta al décimo segundo día de hospitalización, con recuperación de las disfunciones multiorgánicas.
DiscusiónSe presenta la evolución clínica del caso de un paciente adulto joven, sin factores de riesgo identificables para ninguna de las dos enfermedades (hantavirus y legionelosis), que presentó evidencias clínicas y microbiológicas de una coinfección por ambos patógenos. Este sería el primer reporte de probable coinfección por ambos patógenos en la literatura médica hasta el momento.
La similitud en la presentación clínica de ambas enfermedades dificulta el diagnóstico diferencial. El manejo inicial del paciente se enfocó en la sepsis de foco abdominal frente a la respiratoria considerándose Legionella pneumophila como la alterativa diagnóstica ante las imágenes pulmonares asociadas a sintomatología abdominal. La detección del antígeno urinario para ésta permitió el primer ajuste temprano de manejo que impactó en la evolución clínica del paciente. La aparición de deterioro respiratorio sumado a la disfunción miocárdica progresiva, fueron cardinales en la sospecha adicional de la presentación de un síndrome cardiopulmonar por hantavirus, solicitándose sus estudios complementarios que terminaron planteando la coexistencia de ambos patógenos. Además, la coinfección en este caso puede dar respuesta a la aparición de síntomas infrecuentes para ambas enfermedades, por un lado, la disfunción miocárdica progresiva infrecuente para legionelosis5 y la disfunción renal para el hanta variante Andes4.
Si bien un resultado falso positivo para alguna de estas patologías pudiese ser planteable en el análisis del presente caso clínico, dos elementos principales hacen menos probable esta alternativa. Primero la presentación bifásica de la enfermedad es concordante con la diferencia de tiempos de incubación de la patología, no debiendo manifestarse juntas al ser de 5 a 6 días para legionela, con un rango de 2 a 14 días6, y, en general, posterior a la primera semana en el caso de hantavirus, con un rango de 4 a 30 días7. Lo segundo es el tipo de muestras estudiadas, donde el antígeno urinario para Legionella spp. tiene un alto valor predictivo positivo8, con sensibilidades reportadas de 69-100%, debido al subgrupo de pacientes infectados que no eliminan antígenos, y especificidades del 99-100%, siendo la estrategia diagnóstica del 97% de las enfermedades por Legionella pneumophila9, valores confirmados en el metaanálisis de Kawasaki el 202110. Si bien existen reportes de resultados falsos positivos en antigenuria en el contexto de infecciones por otras bacterias, estas no fueron rescatadas en nuestro paciente11, ni tampoco existió el antecedente de infección respiratoria previa que justificase una antigenuria persistente, al mismo tiempo que la lectura fue realizada en un laboratorio con realización habitual de esta clase de estudios. De igual forma para hantavirus, no solo se presentó con la evolución de un síndrome cardiopulmonar, sino que su resultado fue confirmado por el laboratorio de referencia nacional12, siendo una técnica en fases iniciales de síndrome cardiopulmonar con sensibilidad descrita del 94,9% y especificidad del 100%13.
El hantavirus es relevante en nuestro país en la medida que es parte de la circulación viral endémica con aparición de brotes epidémicos. El año 2022 tuvo una tasa de incidencia reportada de 0,16 por cada 100 000 habitantes, con los casos concentrados durante los meses de verano, principalmente en hombres y con una mediana de edad para ese año específico de 36 años14. Esto concuerda con lo publicado para síndrome cardiopulmonar por hantavirus con un 70-80% de los casos ocurridos en hombres y una mediana de edad de 34 años15. Si bien la incidencia de legionelosis en Chile se encuentra poco explorada, esta es una situación que no se limita a la realidad nacional, sino a un fenómeno mundial como describen Graham et al. en su metaanálisis16. Particularmente durante el año 2023 se emitió una alerta en Chile por el aumento de casos de legionela, lo que pone particular atención en el aumento de neumonía por patógenos atípicos como este.
Este caso pone de manifiesto la importancia de considerar diagnósticos diferenciales amplios en pacientes con síntomas inespecíficos y atípicos, incluso en ausencia de factores de riesgo conocidos. Además, resalta la necesidad de mantener un alto índice de sospecha clínica y utilizar pruebas diagnósticas complementarias para identificar la etiología de las infecciones y guiar el tratamiento adecuado.
ConclusiónEste primer reporte en la literatura médica destaca la posibilidad de una coinfección por hantavirus variedad Andes y Legionella pneumophila en pacientes con síntomas compatibles y deterioro clínico progresivo. La identificación temprana de ambas infecciones y el manejo clínico adecuado son esenciales para mejorar los resultados en pacientes con estas enfermedades potencialmente mortales.
Consideraciones éticasEste reporte de caso clínico se llevó a cabo de conformidad con el Código de Ética de la Declaración de Helsinki, resguardando la privacidad y confidencialidad de los datos del paciente.
Declaración de conflicto de interésNinguno de los autores de este trabajo presenta conflictos de interés relacionados con el tema presentado.