Introducción: La amniocentesis para el estudio cromosómico, es una estrategia de diagnóstico prenatal cuyas indicaciones para realizarla son: historia familiar de desórdenes genéticos, edad materna, la detección de malformaciones fetales, entre otras. El objetivo del presente trabajo fue determinar la frecuencia de alteraciones cromosómicas, en los resultados de estudios citogenéticos en líquido amniótico, enviados durante un período de siete años al Departamento de Genética de la Facultad de Medicina y Hospital Universitario, de la UANL.
Material y Métodos: Se realizó un estudio retrospectivo de los resultados citogenéticos, obtenidos en muestras de líquido amniótico, recibidas de abril del 2002 a mayo del 2009, cultivadas y procesadas bajo procedimientos convencionales estándares. Dos observadores analizaron de 15 a 20 metafases por caso, mediante un analizador de imágenes. Los resultados fueron comparados con la literatura.
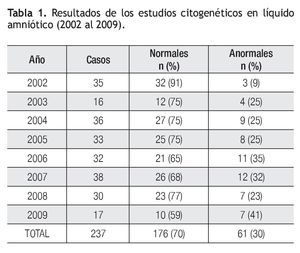
Resultados: Se recibieron 249 muestras, 70% fueron normales, 25% anormales y en 5% no se pudo obtener el resultado, por contaminación de células maternas o falla en el cultivo. Las alteraciones numéricas correspondieron al 77%, siendo la trisomía 18 la más frecuente, mientras que 23% fueron alteraciones estructurales, principalmente material cromosómico adicional de origen desconocido.
Conclusiones: La indicación de amniocentesis más frecuente fue la presencia de múltiples malformaciones y no edad materna, lo cual explica nuestro hallazgo de mayor frecuencia de trisomía 18 y no la trisomía 21, reportada en otras series. La confirmación del diagnóstico al nacimiento se realizó en seis casos, reflejando la importancia del seguimiento de los casos con estudios postnatales, que permitan corroborar el origen de la alteración y poder brindar una asesoría genética adecuada, con respecto a riesgos de recurrencia.
Introduction: Amniocentesis is the prenatal diagnostic strategy most performed in recent years. Among the indications for chromosomal studies are: family history of aneuploidy or any other genetic disorder, maternal age, as well as detection of a fetal malformation. Amniocentesis is performed with the objective of identifying abnormalities in the number or structure of chromosomes including trisomies of chromosomes 13, 18, and 21 and monosomy X. The objective of this study was to obtain the frequency of cytogenetic abnormalities in amniotic fluid samples that were sent during seven consecutive years to the Genetics Department.
Material and Methods: We carried out an observational, retrospective analysis of 249 consecutive amniotic fluid samples results that were received during the period from April 2002 to May 2009. The samples were cultured and processed using standard conventional procedures to obtain chromosomes in metaphase. Fifteen to twenty metaphases per patient were analyzed by two independent observers.
Results: Of the cases, 70% were normal and 25% had an abnormal result, in the remaining 5% no result was obtained because of maternal cell contamination and/or culture failure. Among the abnormal results, numeric chromosomic alterations were present in 77% with trisomy 18 being the most frequent. Structural chromosomal alterations were present in 23%; the main structural abnormalities found were derivative chromosomes with additional genomic material of unknown origin.
Conclusions: The finding of an increased frequency of fetuses affected with trisomy 18 differs from those observed in other centers where trisomy 21 is more common. This is because in most other prenatal diagnostic centers, the main indication for amniocentesis is the presence of multiple malformations and not maternal age. Postnatal follow-up of cases is important to corroborate the origin of the alteration to provide adequate genetic counseling with regard to risk of recurrence.
Introducción
El diagnóstico prenatal consiste en aplicar diversas estrategias diagnósticas, que permitan determinar en el embarazo temprano, si un producto está afectado por alguna malformación o trastorno genético, para ofrecer el tratamiento adecuado si lo tiene y de no ser así, brindarle a la pareja la oportunidad de interrumpir la gestación o prepararse para enfrentar a la compleja situación de tener un hijo afectado, por algún desorden congénito.1 Desde hace más de 40 años, las células del líquido amniótico obtenidas mediante amniocentesis, se han usado para diagnosticar durante la gestación, alteraciones cromosómicas, entre ellas, la primera en detectarse fue la trisomía 21.2
Las alteraciones cromosómicas se presentan en uno de cada 160 recién nacidos vivos, y consisten en anormalidades en el número o en la estructura de los cromosomas.3 Se denomina aneuploidía a la pérdida o ganancia de uno o varios cromosomas. La trisomía 21 con una frecuencia en México y en el mundo que varía de 1/550 a 1/800 nacidos vivos, constituye la aneuploidía más frecuente reportada en humanos, seguida por la trisomía 18 con una frecuencia de 1 en 6 000, y la 13 con frecuencia de 1 en 10 000.4,5 La probabilidad de encontrar una anormalidad cromosómica en el primer trimestre del embarazo, es mayor que en los recién nacidos vivos, se estima que las cromosomopatías se encuentran hasta en el 50% de los productos de aborto. Las alteraciones estructurales son rearreglos del material genético de un cromosoma o involucrando dos o más de ellos, pueden ser genéticamente balanceadas, en las cuales no existe cambio en la cantidad de material genético, o desbalanceadas en las cuales existe ganancia o pérdida de segmentos cromosómicos esenciales. La alteración estructural que se detecta más frecuentemente de manera prenatal, es la translocación recíproca balanceada.6
La mayoría de las trisomías autosómicas, por ejemplo el síndrome de Down o trisomía 21, ocurren como resultado de un fenómeno denominado no disyunción, durante la meiosis materna, que consiste en la falla de la separación de las dos copias de un cromosoma y la posterior segregación a un mismo ovocito.7 La probabilidad de que esto ocurra, se incrementa con la edad materna (EM), es por eso que la edad de la madre, constituye la principal indicación para el diagnóstico prenatal citogenético. Otra de las indicaciones para realizar una amniocentesis, es la presencia de ciertos hallazgos ultrasonográficos, que se asocian con un mayor riesgo de cromosomopatías, entre ellos se encuentran las anormalidades cardíacas, pieloectasia renal, quiste del plexo coroideo, aumento de translucencia nucal e higroma quístico. Los marcadores séricos maternos positivos también son indicación para realizar un examen cromosómico de líquido amniótico. La medición de sustancias como la alfa-fetoproteína, la proteína asociada al embarazo (PAP-A), la subunidad beta de gonadotropina coriónica, pueden encontrarse en niveles anormales, e indicar un riesgo incrementado para este tipo de desórdenes.8
Con el aumento del conocimiento público acerca de las pruebas de tamizaje prenatal, del número de médicos especialistas en embarazo de alto riesgo, de la disponibilidad de laboratorios especializados, así como de la proporción de mujeres con riesgo por edad materna que tienen hijos, el uso de la amniocentesis genética se ha incrementado considerablemente.9
En el Departamento de Genética de la Facultad de Medicina y Hospital Universitario "Dr. José Eleuterio González", se implementó la técnica de análisis cromosómico en líquido amniótico a partir de abril del 2002, como respuesta a la necesidad creciente de complementar la atención integral en aquellas pacientes, que requieren de un diagnóstico prenatal.
El objetivo del presente trabajo fue determinar la frecuencia de alteraciones cromosómicas, en los resultados de estudios citogenéticos en líquido amniótico enviados durante un período de siete años, al Departamento de Genética de la Facultad de Medicina y Hospital Universitario de la UANL.
Material y métodos
Se trató de un estudio retrospectivo en el cual se analizaron los registros electrónicos en forma anónima, de los resultados de muestras de líquido amniótico obtenido mediante amniocentesis, en el periodo de abril del 2002 a mayo del 2009, se obtuvo aprobación del Comité de Ética de la Facultad de Medicina de la Universidad Autónoma de Nuevo León, con la clave GN11-002.
En todos los casos, se establecieron seis cultivos primarios y uno de reserva de líquido amniótico, utilizando medio Amniomax , específico para amniocitos y se in específico amniocitos y se incubaron a 37ºC en una atmósfera de 5% de CO2 hasta la formación de las colonias celulares, aproximadamente siete a nueve días. Posteriormente, fueron procesadas para obtener preparaciones de cromosomas en metafase, mediante la adición de Colcemid® en una concentración de 10 μg/mL, el cual inhibe la formación del huso acromático. Una vez obtenidas las metafases fueron teñidas con la técnica de bandas GTG (patrón de bandas G con Tripsina y Giemsa), la cual utiliza tripsina como enzima proteolítica, que permite que el colorante Giemsa se una a secuencias ricas en A-T, esto para evidenciar las bandas oscuras (ricas en secuencias A-T) y claras (ricas en G-C) de cada par de cromosomas y compararlas con el patrón normal. Se analizaron de 15 a 20 metafases con una resolución de 400 a 450 bandas, se contó el número total de cromosomas por metafase y se analizó el patrón de bandas en seis de ellas,9 las imágenes se capturaron con la ayuda de microscopios de campo claro (Olimpus® BX51 y Zeiss® Axiolab), acoplado al analizador de imágenes Applied Imaging Cytovision® versión 3.9. El análisis se realizó por dos observadores independientes. En casos de mosaicismo, se aumentó la cuenta a 30 metafases, con éste número de células se descarta un mosaicismo mayor del 10% con un intervalo de confianza (IC) del 95%.8,9 En dos casos con anormalidades estructurales, se complementó el análisis cromosómico con la técnica de FISH, utilizando sondas específicas de los genes ELN (elastina) y RB (retinoblastoma) para los cromosomas 7 y 13, respectivamente. Se registró la frecuencia de casos anormales y su distribución, de acuerdo con la clasificación en tipos y subtipos de anormalidades cromosómicas.10
Resultados
Se recibieron 249 casos, la principal indicación del estudio fue alteraciones fetales detectadas mediante ultrasonido en un 55%. En un 20%, además de las anormalidades por ultrasonido se trató de mujeres mayores de 35 años, 10% anormalidades ultrasonográficas y/o marcadores séri cos anormales, 10% solo EM, en un 9.5% no se obtuvo el dato y en el restante porcentaje, fueron diversas las indicaciones para la realización del estudio.
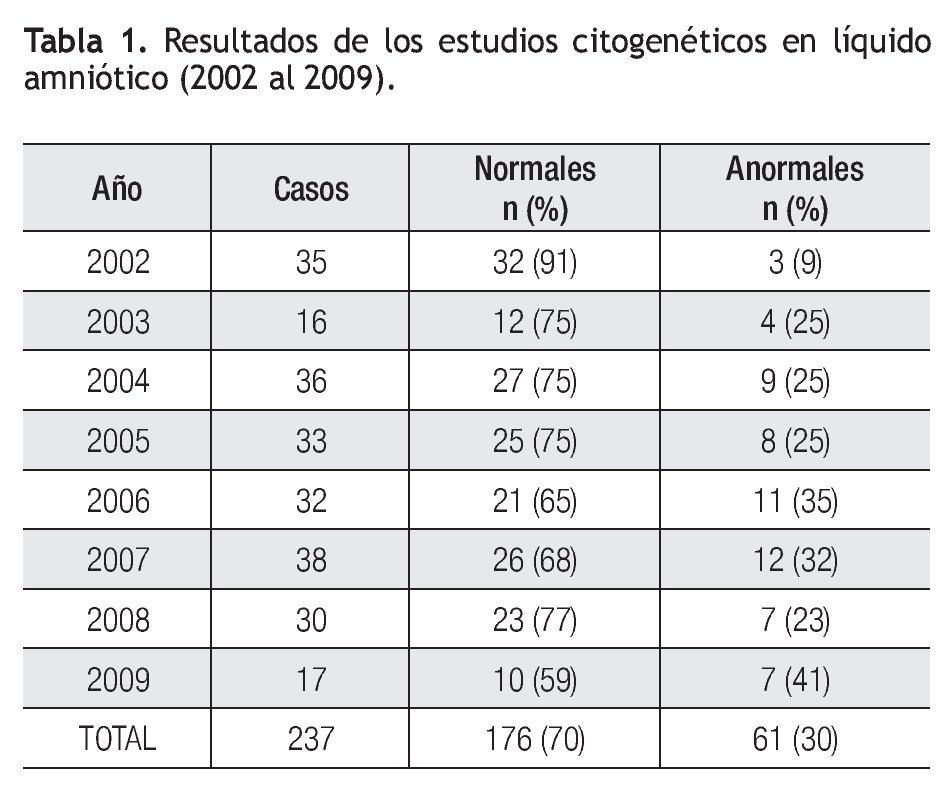
El análisis cromosómico resultó normal en el 70% (n=176), anormal en el 30% (n=61) y en el 5% (n=12) no se pudo obtener el resultado, debido a contaminación de células maternas y/o falla en el cultivo, los cuales se excluyeron para el análisis final. En la Tabla 1 se muestra el número de muestras recibidas por año.
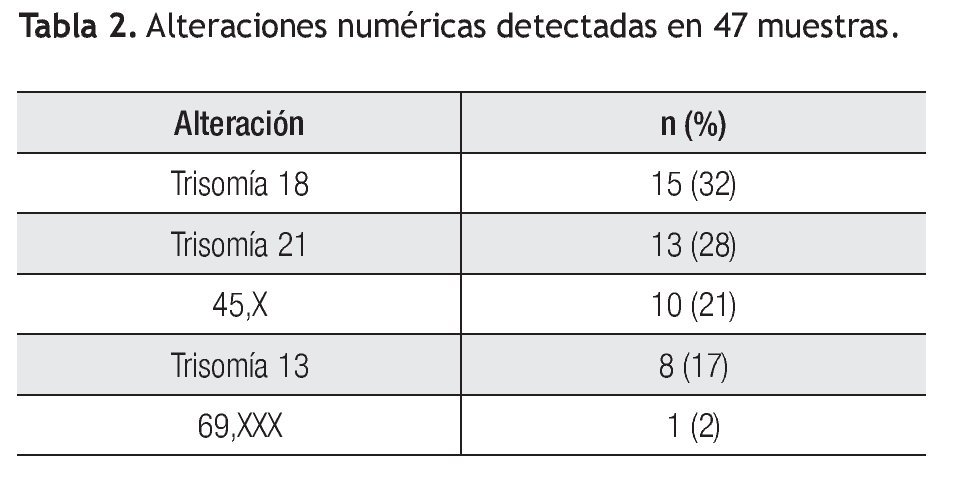
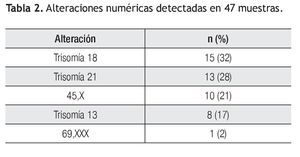
Las alteraciones en el número de cromosomas se presentaron en el 77% (n=47) del total de casos anormales, siendo la trisomía 18 la alteración más frecuente en 15 casos (32%), seguida de la trisomía 21 en 13 casos (28%), el complemento cromosómico de 45,X se observó en 10 productos (21%), la trisomía 13 en ocho (17%) y en un caso, se detectó un complemento triploide (Tabla 2).
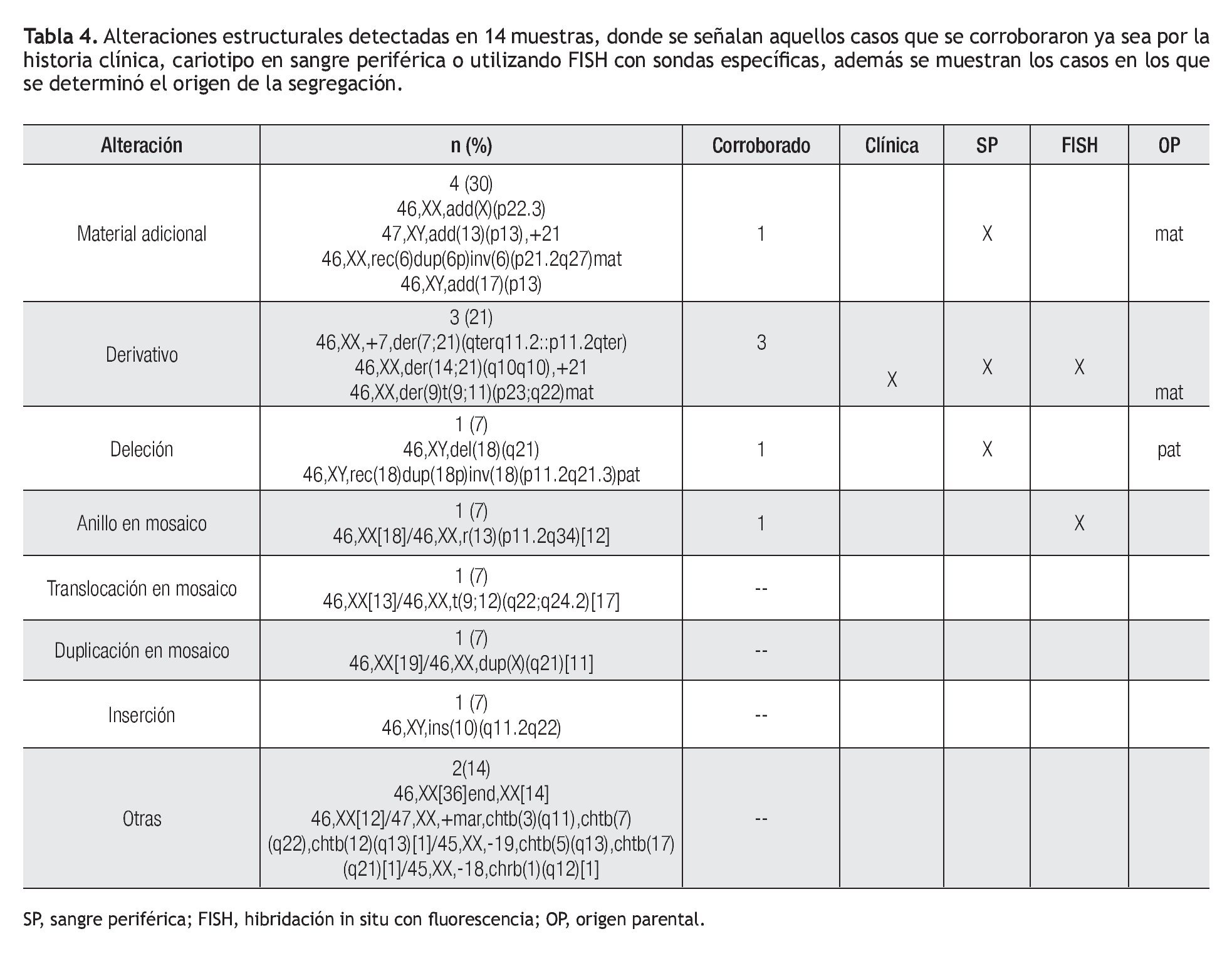
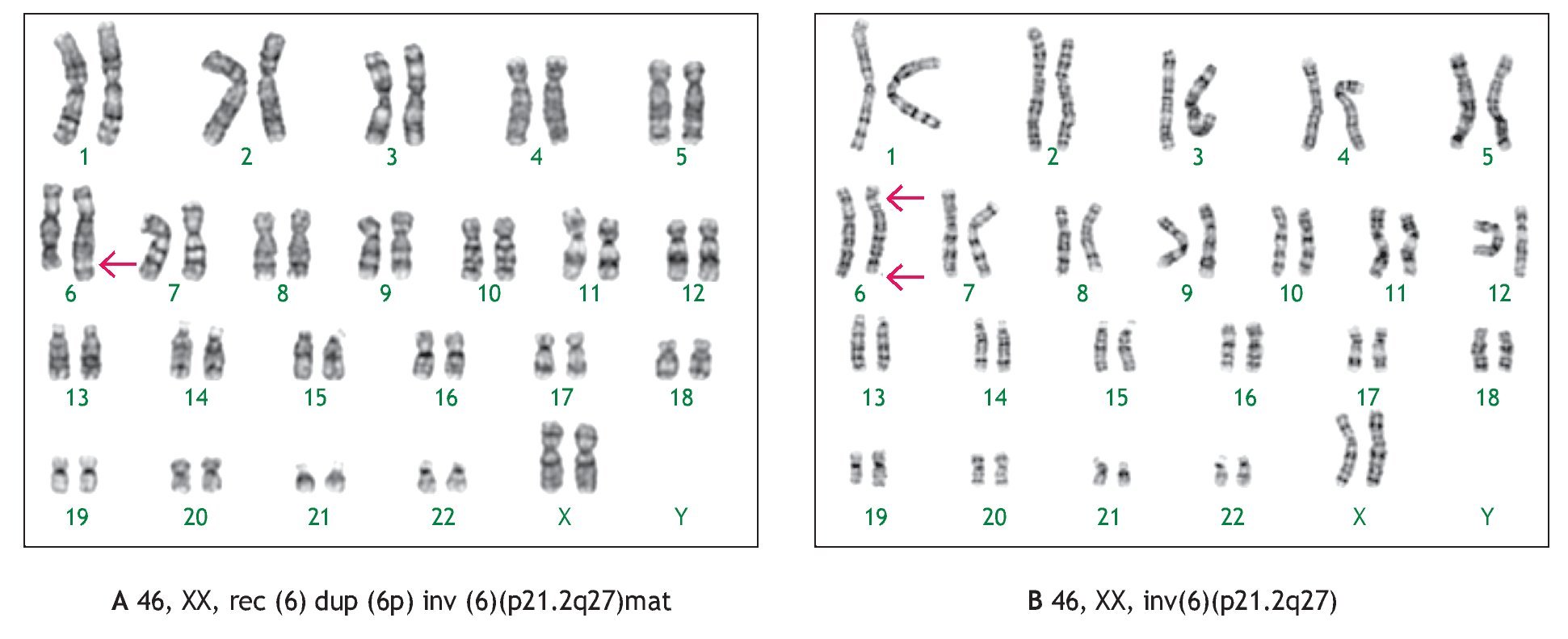
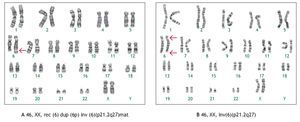
Las alteraciones cromosómicas estructurales se presentaron en 14 casos (23%), entre ellas el hallazgo más frecuente fue la presencia de material adicional en algún cromosoma, cuyo aspecto microscópico no permitió identificar su origen en cuatro casos (30%). Un ejemplo de esto se ilustra con el caso uno (Figura 1), en el cual se realizó la amniocentesis, debido a que el producto presentaba anomalías congénitas y retraso en el crecimiento intrauterino, el cariotipo se reportó con material adicional en el brazo largo de un cromosoma 6,46,XX,add(6)(q27). Se realizó cariotipo en ambos padres, en el cariotipo materno se identificó una inversión cromosómica pericéntrica 46,XX,inv(6)(p21.2q27). Al nacimiento se corroboró el resultado del cariotipo en sangre periférica del producto, observando una fórmula cromosómica 46,XX,rec(6)dup(6p)inv(6)(p21.2q27)mat, que demostró que el cromosoma 6 anormal, resultó de una recombinación en la meiosis entre el cromosoma invertido, con su contraparte normal.
Figura 1. Cariotipo del producto corroborado al nacimiento (sangre periférica), donde se señala el cromosoma recombinante compuesto por la duplicación del brazo corto de un cromosoma 6, como resultado de una inversión pericéntrica del cromosoma 6 de origen materno A). Cariotipo en sangre periférica de la madre, donde se muestra la inversión en el cromosoma 6 B).
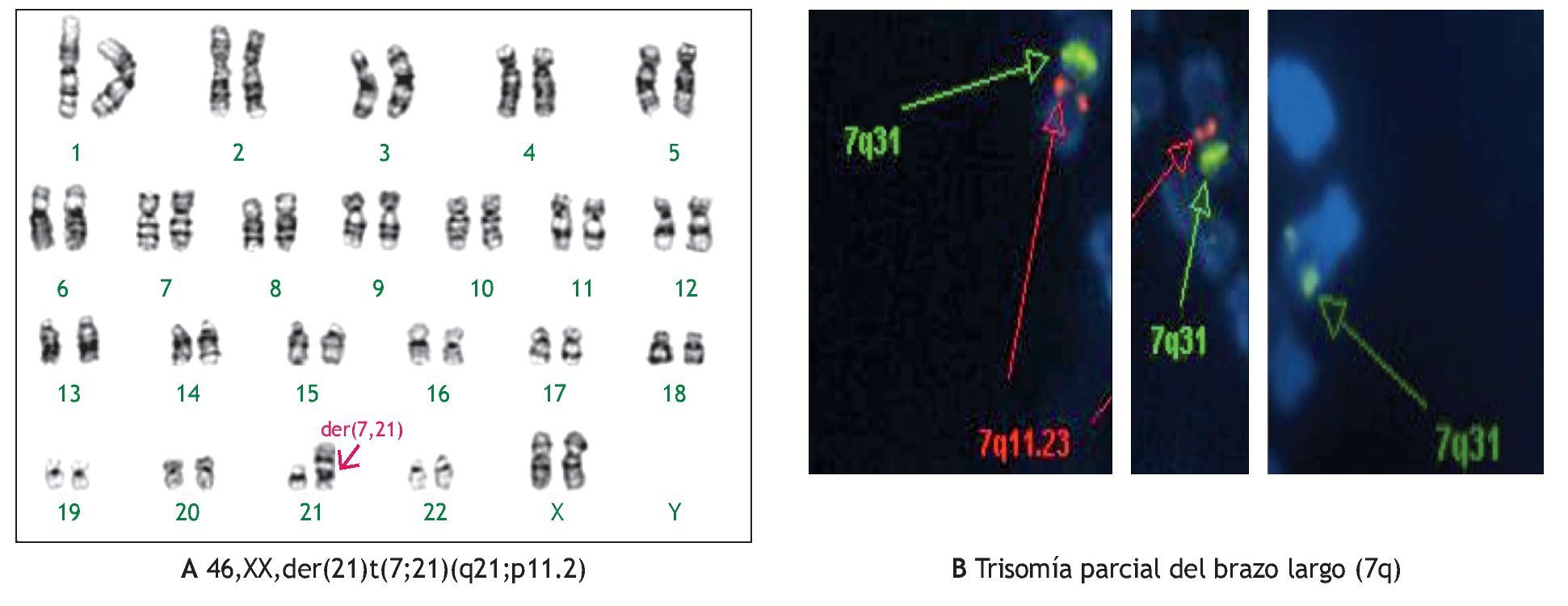
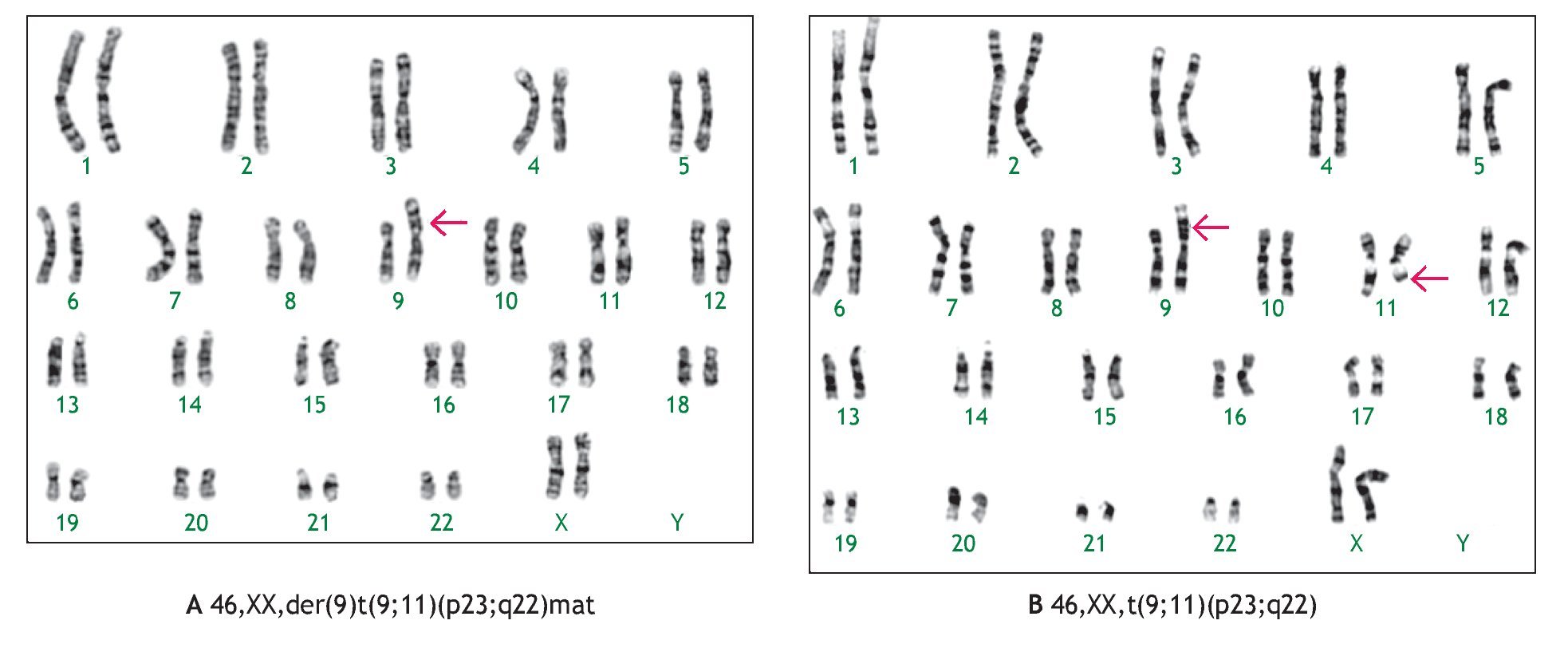
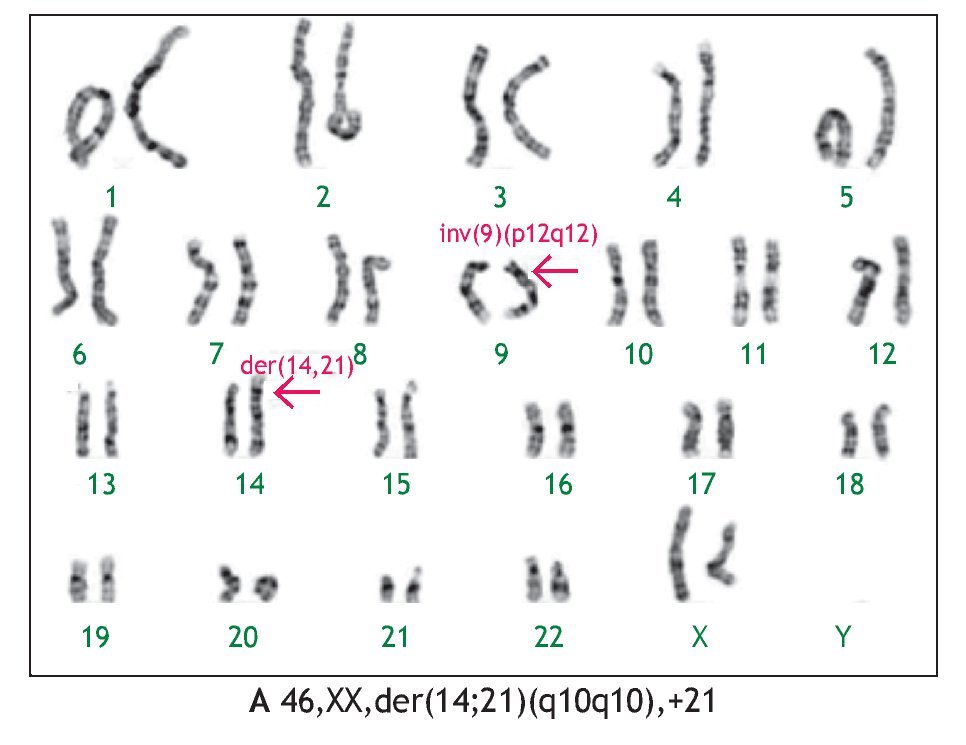
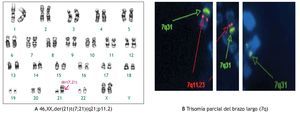
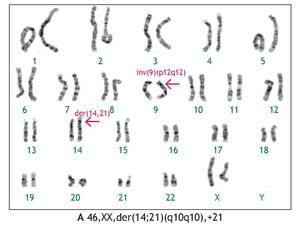
En tres casos (21%) se identificó la presencia de un cromosoma derivativo, que es aquel que presenta alteración en su estructura, ocasionada por más de un rearreglo en un mismo cromosoma. En la Figura 2, se muestra el caso de un producto con un cariotipo 46,XX,der(21)t(7;21) (q21;p11.2), en líquido amniótico y posteriormente, se confirmó en el recién nacido en sangre periférica, mediante la técnica de hibridación in situ con fluorescencia (FISH), utilizando una sonda específica de la región 7q31, en la que se identificó la presencia de tres señales verdes, lo que demostró la trisomía parcial del brazo largo del cromosoma 7. Otro caso, presentó un cromosoma derivativo debido a una translocación recíproca balanceada de origen materno entre los cromosomas 9 y 11, la fórmula cromosómica fue 46,XX,der(9)t(9;11)(p23;q22) mat (Figura 3). En uno más, se reportó un cariotipo de 46,XX,der(14;21)(q10q10),+21, que es compatible con el síndrome de Down consistente con los hallazgos clínicos del paciente (Figura 4).
Figura 2. Cariotipo del producto (líquido amniótico), donde se señala el cromosoma derivativo compuesto por un cromosoma 21 y parte del brazo largo de un cromosoma 7 A). Técnica de FISH mostrando tres señales verdes correspondientes a la región 7q31, corroborando así una trisomía parcial del brazo largo del cromosoma 7 B).
Figura 3. Cariotipo del producto (líquido amniótico), donde se señala el cromosoma derivativo compuesto por el cromosoma 9 y brazos largos de un cromosoma 11 (banda q22 a q ter) A). Cariotipo de la madre (sangre periférica), donde se muestra la translocación recíproca balanceada entre los cromosomas 9 y 11 B).
Figura 4. Cariotipo del producto (líquido amniótico), donde se señala el cromosoma derivativo compuesto por un cromosoma 14 y un cromosoma 21, también se señala una inversión en el cromosoma 9, considerada como una variante polimórfica normal.
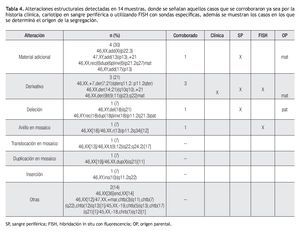
En otro caso, se identificó un cariotipo 46,XY,del(18) (q21), lo que indicó pérdida de material en el brazo largo de un cromosoma 18, se realizó cariotipo en ambos padres y se determinó que la alteración se originó a partir de una inversión en el padre, el cariotipo final resultante después del análisis postnatal fue 46,XY,rec(18)dup(18p) inv(18)(p11.2q21.3)pat. En la Tabla 3, se muestran las alteraciones estructurales detectadas en las 14 muestras (23%), donde se señalan aquellos casos que se corroboraron al nacimiento, ya sea por cariotipo en sangre periférica, por FISH utilizando sondas específicas, o por la historia clínica del paciente, además se muestran los casos en los que se determinó el origen de la anormalidad.
Discusión
Entre las estrategias de diagnóstico prenatal invasivo, la amniocentesis es la técnica que más se realiza dado su bajo índice de riesgo, tanto para la madre como para el feto, por encima de otros procedimientos como la biopsia de vellosidades coriales.3,12,13 En México, la amniocentesis genética se practica desde hace 25 años, pero existen escasas publicaciones al respecto.15,16 El Laboratorio de Citogenética del Departamento de Genética de la UANL, es un centro que recibe aproximadamente 50 muestras anuales de líquido amniótico de mujeres con embarazo de alto riesgo. Otros laboratorios nacionales e internacionales procesan entre 250 y 1 500 muestras,14,15 la cantidad de muestras recibidas en nuestra serie aún se encuentra por debajo de la media nacional e internacional, sin que po. damos establecer certeramente las causas, el hecho de que en nuestro estado la legislación impida la interrupción del embarazo y el bajo número de obstetras con entrenamiento en realizar amniocentesis, pudieran contribuir a esta observación.
En los últimos años, con la mejoría de las técnicas no invasivas, marcadores séricos y ultrasonográficos, se ha intentado reducir el número de amniocentesis o procedimientos invasivos a aquellos embarazos, con datos de alto riesgo de aneuploidía.12 Esto probablemente explique por un lado, la mayor cantidad de resultados anormales y la menor cantidad de estudios indicados, en los últimos años que se analizaron en nuestro estudio.
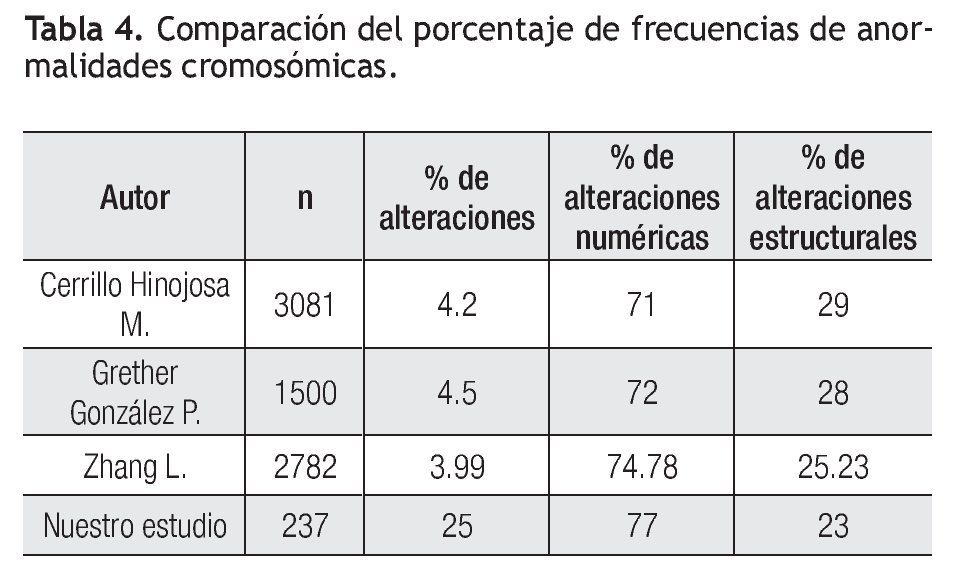
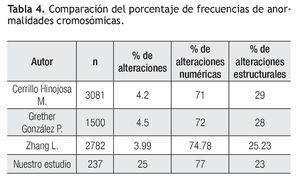
La frecuencia de anormalidades cromosómicas es superior a lo reportado por otros autores en México, esto puede deberse a que la principal indicación del estudio, es la presencia de alteraciones fetales mediante ultrasonido, sin embargo el porcentaje de alteraciones numéricas y estructurales, coincide con lo reportado en otros estudios (Tabla 4).
En nuestra serie de casos, la alteración cromosómica numérica que se detectó con mayor frecuencia fue la trisomía 18, contrario con lo informado por otros autores donde es la trisomía 21.2,15-17
El grupo más frecuente de anormalidades estructurales fue la presencia de material adicional de origen desconocido, lo cual también contrasta con lo encontrado que es la translocación recíproca balanceada.5 En ambos casos, las diferencias se explican por el hecho de que la principal indicación del estudio en nuestra casuística, es la presencia de malformaciones múltiples y no la EM como en otras series.
Cuando se identifica una anormalidad cromosómica en líquido amniótico, es importante brindar asesoramiento genético a la pareja. Esta actividad debe incluir necesariamente información a los padres sobre el diagnóstico, el pronóstico del producto, las opciones de seguimiento o terminación del embarazo, así como discutir las medidas que deberán tomarse al momento del nacimiento. Es importante mencionar, que el cariotipo debe repetirse al nacimiento sobre todo en aquellos casos en que el estudio quedó inconcluso, o para corroborar el origen de la alteración y poder brindar una asesoría genética adecuada, con respecto a riesgos de recurrencia. En las trisomías autosómicas, el riesgo de recurrencia en general se estima en 1%, de tal manera que el riesgo en futuros embarazos de los padres de un caso con este tipo de anormalidad, es bajo. Cuando se trata de rearreglos estructurales heredados de alguno de los padres, los riesgos son mayores y la probabilidad de un nuevo caso cromosómicamente anormal puede ser alta probabilidad, requiriendo en cada caso un asesoramiento genético individual para conocer los riesgos específicos.
Los estudios citogenéticos prenatales constituyen una herramienta diagnóstica importante, que influye en la toma de decisiones en el embarazo y permite al personal médico estar preparado, para recibir a un producto con un estado de salud comprometido y a los padres prepararse emocional, social y económicamente.
El presente trabajo denota la importancia del estudio citogenético prenatal, ante la sospecha de una alteración genética o malformaciones fetales. Es necesario crear una cultura de la detección temprana, que permita hacer el correcto seguimiento de los embarazos con complicaciones y brindar el asesoramiento genético adecuado.
Correspondencia: M en C. Viviana Maricela Gómez Puente.
Departamento de Genética, Facultad de Medicina, UANL. Av. Francisco I. Madero y Dr. Eduardo Aguirre Pequeño s/n Colonia Mitras Centro, Monterrey, Nuevo León C.P. 64460.
Correo electrónico:vivigomez@gmail.com
Recibido: Abril 2011.
Aceptado: Noviembre 2011