Journal Information
Vol. 129. Issue 15.
Pages 582-587 (October 2007)
Vol. 129. Issue 15.
Pages 582-587 (October 2007)
DOI: 10.1157/13111712
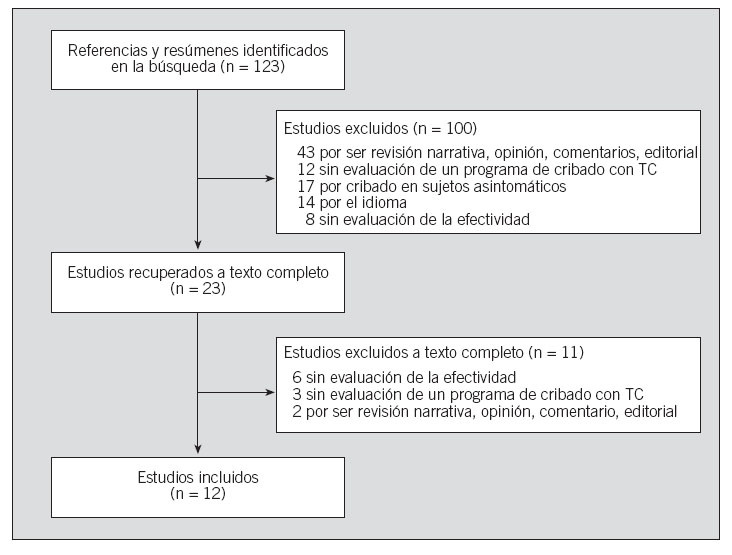
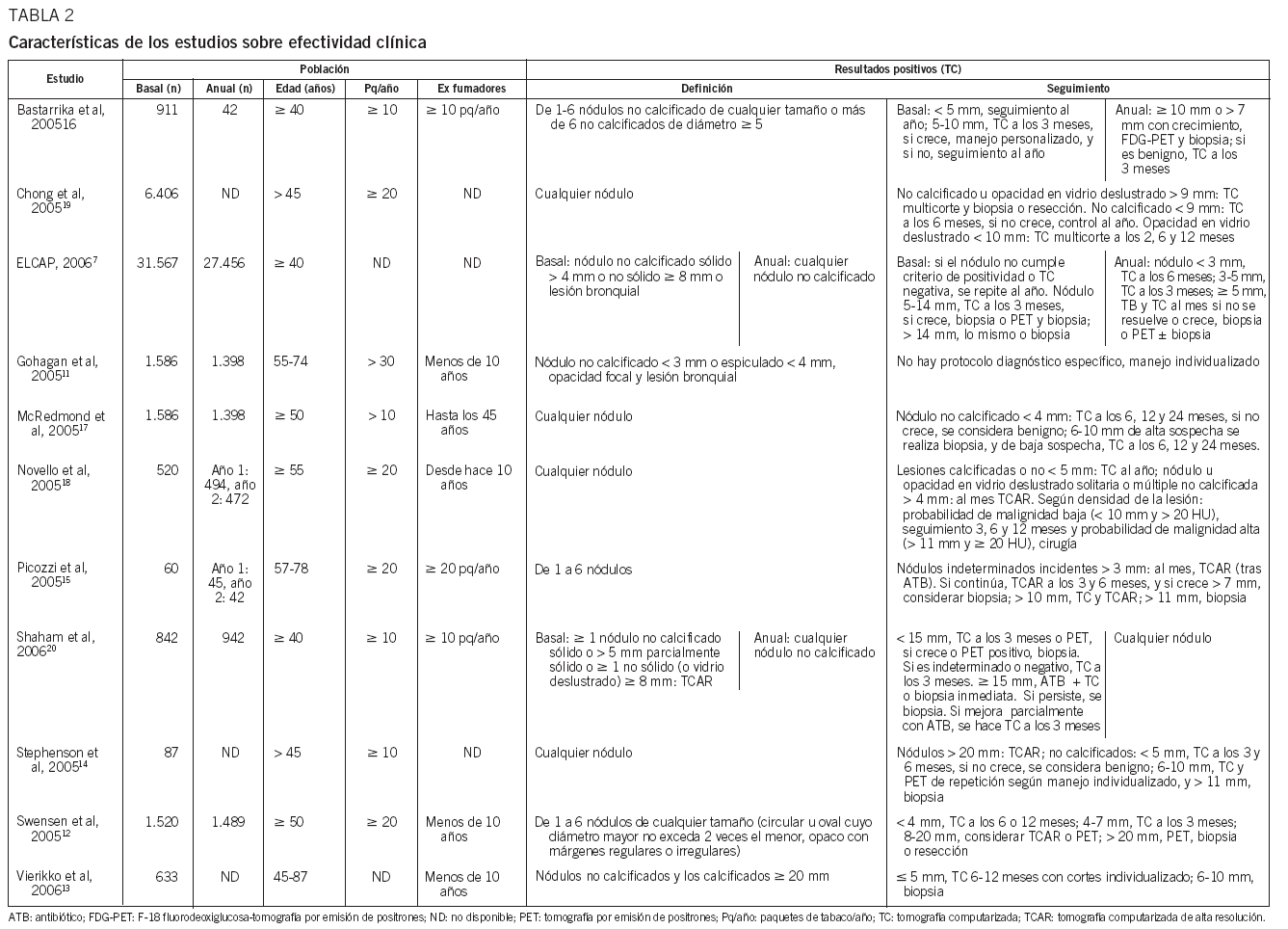
Cribado de cáncer de pulmón con TC de tórax: revisión sistemática
CT screening for lung cancer; sistematic review
Visits
2394
This item has received
Article information
These are the options to access the full texts of the publication Medicina Clínica
Subscriber
Subscribe
Purchase
Contact
Phone for subscriptions and reporting of errors
From Monday to Friday from 9 a.m. to 6 p.m. (GMT + 1) except for the months of July and August which will be from 9 a.m. to 3 p.m.
Calls from Spain
932 415 960
Calls from outside Spain
+34 932 415 960
E-mail