Evaluar la asociación entre niveles séricos de procalcitonina (PCT) y proteína C reactiva (PCR), en los 3 primeros días de postoperatorio, y la aparición de infección intraabdominal postoperatoria.
MétodoEstudio observacional prospectivo que incluye a 67 pacientes intervenidos quirúrgicamente de cáncer colorrectal, gástrico y pancreático. Los niveles séricos de PCT y PCR se midieron antes de la cirugía y a las 24, 48 y 72 h de la misma. Se registraron los valores de PCT y PCR, así como su fiabilidad para la detección de infección intraabdominal postoperatoria.
ResultadosLa incidencia de infección intraabdominal postoperatoria fue de 13,4%. Los valores de PCR a las 72h, los valores de PCT a las 24, 48 y 72h y el cociente entre el valor de PCR a las 72h y el valor de PCR a las 48h (PCR D3/PCR D2) se asociaron significativamente con la aparición de infección intraabdominal postoperatoria. La sensibilidad más alta correspondió al valor de PCT a las 72h (88,9%); la especificidad más alta y el valor predictivo positivo (VPP) más alto, al cociente PCR D3/PCR D2 (96,49 y 71,4%, respectivamente); el valor predictivo negativo (VPN) más alto, al valor de PCT a las 72 h y a las 24 h (97,7 y 96%, respectivamente).
ConclusiónLos valores de PCT se asocian significativamente con la aparición de infección intraabdominal postoperatoria en los 3 primeros días de postoperatorio. Su sensibilidad y VPP son bajos, pero su VPN es alto, incluso a las 24h de la cirugía.
to evaluate the association between serum levels of procalcitonin and C-reactive protein, on the first 3 postoperative days, and the appearance of postoperative intra-abdominal infection.
MethodProspective observational study including 67 patients operated on for colo-rectal, gastric and pancreatic cancer. Serum levels of procalcitonin and C-reactive protein were analyzed before surgery and daily until the third postoperative day. Values of procalcitonin (PCT) and C-reactive protein (CRP) were recorded as well as their accuracy for detection of postoperative intra-abdominal infection (PIAI).
ResultsThe incidence of postoperative intra-abdominal infection was 13.4%. CRP serum levels at 72h, PCT serum levels at 24, 48 and 72h and the ratio between serum levels of CRP at 72hours and serum levels of CRP at 48hours (CRP D3/CRP D2) were significantly associated with the appearance of postoperative intra-abdominal infection. The highest sensitivity corresponded to PCT at 72hours (88.9%); the highest specificity and positive predictive value corresponded to the ratio CRP D3/CRP D2 (96.49% and 71.4%, respectively); the highest negative predictive value to procalcitonin at 72h and 24h.
ConclusionsSerum levels of PCT are significantly associated with the appearance of postoperative intra-abdominal infection. Sensitivity and predictive positive values are low, but negative predictive value is high, even at 24h after surgery.
Ocasionalmente, la infección intraabdominal postoperatoria (IIAP) se presenta como un cuadro de abdomen agudo y resulta fácil de diagnosticar. Sin embargo, la mayor parte de las veces se manifiesta con una sintomatología larvada e inespecífica y la exploración abdominal puede ser equívoca. Además, las pruebas de laboratorio habitualmente utilizadas durante el postoperatorio, como el recuento leucocitario, son poco sensibles y específicas. Todo ello conduce a que la IIAP se suela diagnosticar tardíamente, habitualmente entre el sexto y noveno día de postoperatorio1, a pesar de que la mayor parte de sus causas, como las dehiscencias de sutura, pueden producirse mucho antes. Si existiese un marcador apropiado, la IIAP podría diagnosticarse de una manera más precoz, seguramente con una notable mejoría del pronóstico de estos pacientes. Hasta ahora, se han analizado fundamentalmente 2 proteínas, la proteína C reactiva (PCR) y la procalcitonina (PCT)2–6. La PCR es un marcador inespecífico de inflamación, pero, en algunos estudios recientes, se ha visto que a partir del 4.° día de postoperatorio sus niveles se asocian significativamente con la aparición de infección postoperatoria7,8. La PCT, aunque puede elevarse en diversos procesos inflamatorios de etiología no infecciósa9–12, es un marcador bastante específico de infección. Hasta ahora se ha utilizado para valorar el pronóstico de pacientes con sepsis13, para seleccionar pacientes que necesitan tratamiento con antibióticos14,15 y para valorar el pronóstico de pacientes con pancreatitis aguda16 e incluso para predecir la infección de la necrosis pancreática17. Reith et al. fueron los primeros autores en observar que la PCT se eleva significativamente en pacientes con infección postoperatoria4 y, posteriormente, otros autores han encontrado hallazgos similares5,18–21. A pesar de ello, su papel en el diagnóstico de la infección postoperatoria todavía no ha sido bien evaluado y su utilidad sigue siendo controvertida. Así, recientemente se han publicado 4 artículos que estudian el valor de la PCT en el diagnóstico de la IIAP, en 2 de ellos se concluye que es superior a la PCR22,23 y en los otros 2 se concluye que no lo es24,25. Con el fin de analizar la evolución de los niveles séricos de ambas proteínas en los 3 primeros días de postoperatorio y evaluar si existe asociación entre los mismos y la aparición de infección intraabdominal postoperatoria se planteó un estudio prospectivo, todavía no finalizado, cuyos resultados preliminares se muestran en este artículo.
Pacientes y métodosSe llevó a cabo un estudio observacional prospectivo en el que se incluyó a 67 pacientes operados de cáncer colorrectal, páncreas o estómago, de forma consecutiva, entre el 1 de enero y el 30 de junio de 2011 en el Servicio de Cirugía del Complejo Hospitalario de Pontevedra (CHOP) Los criterios de exclusión fueron la edad inferior a 18 años, la cirugía de urgencia o paliativa, la existencia de infección preoperatoria y niveles preoperatorios de PCT superiores a 0,5ng/ml. Ninguno de los pacientes fue operado por laparoscopia. Para cada paciente se registraron los datos de edad, sexo, clasificación ASA, tipo de tumor, tipo de intervención quirúrgica, complicaciones postoperatorias y estancia postoperatoria. Los pacientes fueron evaluados diariamente hasta el alta y fueron revisados en consulta a los 30 días de la cirugía. La PCT y la PCR fueron medidas el día anterior a la cirugía y a las 24, 48 y 72h de la misma (D0, D1, D2 y D3, respectivamente). Las extracciones de sangre se hicieron entre las 8 y las 10:00h am. La PCR se determinó por un método de inmunoturbidometría, utilizando un analizador Beckman Coulter Au 5420 (Fullerton, California, USA. La PCT se determinó con un inmunoanalizador multiparamétrico VIDAS® (BRAHMS, Hennigsdorf,Alemania) mediante un método de enzimainmunoensayo. Se calcularon los cocientes entre el valor obtenido en un momento determinado y los valores obtenidos en los momentos precedentes, exceptuando el D0. De este modo se calcularon 3 cocientes para cada una de las 2 variables: D3/D2, D3/D1 y D2/D1. Se consideró que existía infección intraabdominal postoperatoria cuando ocurrió uno de los siguientes26:
- a)
líquido purulento a través de un drenaje colocado en la cavidad peritoneal
- b)
cultivo positivo del exudado obtenido de forma aséptica de la cavidad peritoneal
- c)
evidencia de infección por examen directo (reintervención), por estudio histopatológico (identificación de gérmenes) o por examen radiológico.
Para el análisis estadístico se utilizaron los paquetes informáticos IBM SPSS (Statistical Package for Social Sciences Inc., Chicago, Illinois, EE. UU.) versión 20.0 para Mac y MedCalc versión 12.2.1 para Windows (MedCalc Software, Marlakerke, Bélgica).
Se utilizó el test exacto de Fisher para comparar variables cualitativas. Para comparar variables cuantitativas entre grupos se utilizaron los test de Kruskall-Wallis y de Mann-Whitney. Para las comparaciones intragrupo se utilizó el test de los signos de Wilcoxon.
Se consideró que había significación estadística para valores de p inferiores a 0,05. La precisión diagnóstica de la PCR y de la PCT para la detección de la IIAP se evaluó mediante la construcción de curvas ROC para cada día, obteniendo un punto de corte óptimo para el que se calcularon los valores de sensibilidad, especificidad y valores predictivos. El estudio fue autorizado por el Comité Ético de Investigación Clínica de Galicia.
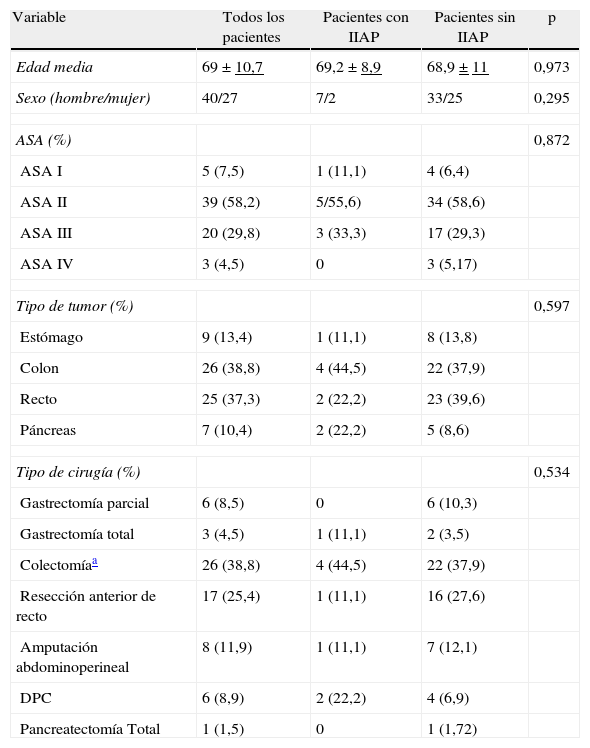
ResultadosEn el periodo de tiempo objeto del estudio se operó a otros 8 pacientes que fueron excluidos por no estar completos los valores de PCR o PCT (3 casos), por valor preoperatorio de PCT superior a 0,5ng/ml (3 casos), por cirugía paliativa (un caso) o por rechazo a participar en el estudio (un caso). Cuarenta pacientes (59,7%) eran varones y 27 (40,3%) eran mujeres, con una edad media de 69 años y una mediana de 68 (rango 42-89). En la tabla 1 se resumen los datos correspondientes a tipo de tumor, cirugía realizada y clasificación ASA.
Variables demográficas y tipo de cirugía
| Variable | Todos los pacientes | Pacientes con IIAP | Pacientes sin IIAP | p |
| Edad media | 69±10,7 | 69,2±8,9 | 68,9±11 | 0,973 |
| Sexo (hombre/mujer) | 40/27 | 7/2 | 33/25 | 0,295 |
| ASA (%) | 0,872 | |||
| ASA I | 5 (7,5) | 1 (11,1) | 4 (6,4) | |
| ASA II | 39 (58,2) | 5/55,6) | 34 (58,6) | |
| ASA III | 20 (29,8) | 3 (33,3) | 17 (29,3) | |
| ASA IV | 3 (4,5) | 0 | 3 (5,17) | |
| Tipo de tumor (%) | 0,597 | |||
| Estómago | 9 (13,4) | 1 (11,1) | 8 (13,8) | |
| Colon | 26 (38,8) | 4 (44,5) | 22 (37,9) | |
| Recto | 25 (37,3) | 2 (22,2) | 23 (39,6) | |
| Páncreas | 7 (10,4) | 2 (22,2) | 5 (8,6) | |
| Tipo de cirugía (%) | 0,534 | |||
| Gastrectomía parcial | 6 (8,5) | 0 | 6 (10,3) | |
| Gastrectomía total | 3 (4,5) | 1 (11,1) | 2 (3,5) | |
| Colectomíaa | 26 (38,8) | 4 (44,5) | 22 (37,9) | |
| Resección anterior de recto | 17 (25,4) | 1 (11,1) | 16 (27,6) | |
| Amputación abdominoperineal | 8 (11,9) | 1 (11,1) | 7 (12,1) | |
| DPC | 6 (8,9) | 2 (22,2) | 4 (6,9) | |
| Pancreatectomía Total | 1 (1,5) | 0 | 1 (1,72) | |
DPC: duodenopancreatectomía cefálica; IIAP: infección intraabdominal postoperatoria.
Veintitrés pacientes (34,3%) presentaron alguna complicación. De las 26 complicaciones evidenciadas, 14 (53,8%) fueron infecciones. Entre las complicaciones no infecciosas, la más frecuente fue el ileo prolongado, que se presentó en 5 pacientes (7,4%). Once pacientes presentaron algún tipo de infección en el postoperatorio, lo que representa una incidencia del 16,4% (tabla 2). Cuatro pacientes tuvieron infección incisional superficial; uno, infección asociada a catéter venoso central y 9, infección intraabdominal (13,4%). De estas últimas, 7 fueron abscesos y 2 fueron peritonitis difusas. En 3 de los abscesos se constató su relación con una dehiscencia de sutura (2 en pacientes con colectomía y uno en un paciente con pancreatectomía cefálica). Los abscesos intraabdominales fueron diagnosticados mediante TC entre el día 8 y el 35 de postoperatorio, con una mediana de 8 días. Hubo cultivo positivo en todas las infecciones, excepto en 2 abscesos intraabdominales, que se trataron únicamente con antibióticos, y en 2 infecciones incisionales superficiales, en las que no se tomó muestra. Cinco pacientes (7,4%) fueron reintervenidos, uno por hemoperitoneo, uno por evisceración, 2 por dehiscencia de sutura con peritonitis y uno por absceso intraabdominal. No hubo mortalidad. Al comparar el grupo de pacientes con infección intraabdominal (9) con el grupo de pacientes sin infección intraabdominal (58) se observó que no había diferencias significativas en cuanto a edad (p=0,971), sexo (p=0,208), clasificación ASA (p=0,665), tipo de tumor (p=0,597) ni tipo de cirugía (p=0,534).
Infecciones postoperatorias
| N.° de paciente | Tipo de cirugía | Tipo de infección | Día/método diagnóstico | Cultivos | Tratamiento |
| 2 | AAP | Absceso intraabdominal | 8 TC | Escherichia coli | Drenaje percutáneo |
| 12 | Colectomía izquierda | Absceso intraabdominal | 8 TC | No | Antibiótico |
| 19 | DPC | Absceso intraabdominal | 8 TC | Candida albicans | Drenaje percutáneo |
| 24 | Colectomía izquierda | Absceso intraabdominal | 35 TC | No | Antibiótico |
| 27 | Colectomía derecha | Absceso intraabdominal | 18 TC | Enterococcus faecium | Cirugía |
| 34 | gastrectomía total | Dehiscencia sutura | 4 salidas contenido intestinal y TC | Enterococus faecalis; Proteus mirabilis | Cirugía |
| 34 | Gastrectomía total | Infección incisional superficial | 7 inspección | Enterococus faecalis | Drenaje |
| 48 | Resección anterior | dehiscencia sutura | 8 tacto rectal TC | Bacteroides fragilis; Escherichia coli | Cirugía |
| 48 | Resección anterior | Infección incisional superficial | 12 inspección | no | Drenaje |
| 55 | Colectomía | Absceso intraabdominal | 8 TC | Escherichia coli | Drenaje perutáneo |
| 60 | DPC | Absceso intraabdominal | 14 TC | Enterococus faecalis Enterococcus faecium | drenaje percutáneo |
| 60 | DPC | Infección incisional superficial | 5 inspección | No | Drenaje |
| 64 | AAP | Infección incisional superficial | 8 inspección | Bacillus sp. | Drenaje antibiótico |
| 70 | Colectomía | Catéter venoso central | 6 cultivo | Escherichia coli | Antibiótico retirada cateter |
AAP: amputación abdomino-perineal de recto; DPC: duodenopancreatectomía cefálica; TC: tomografía computarizada.
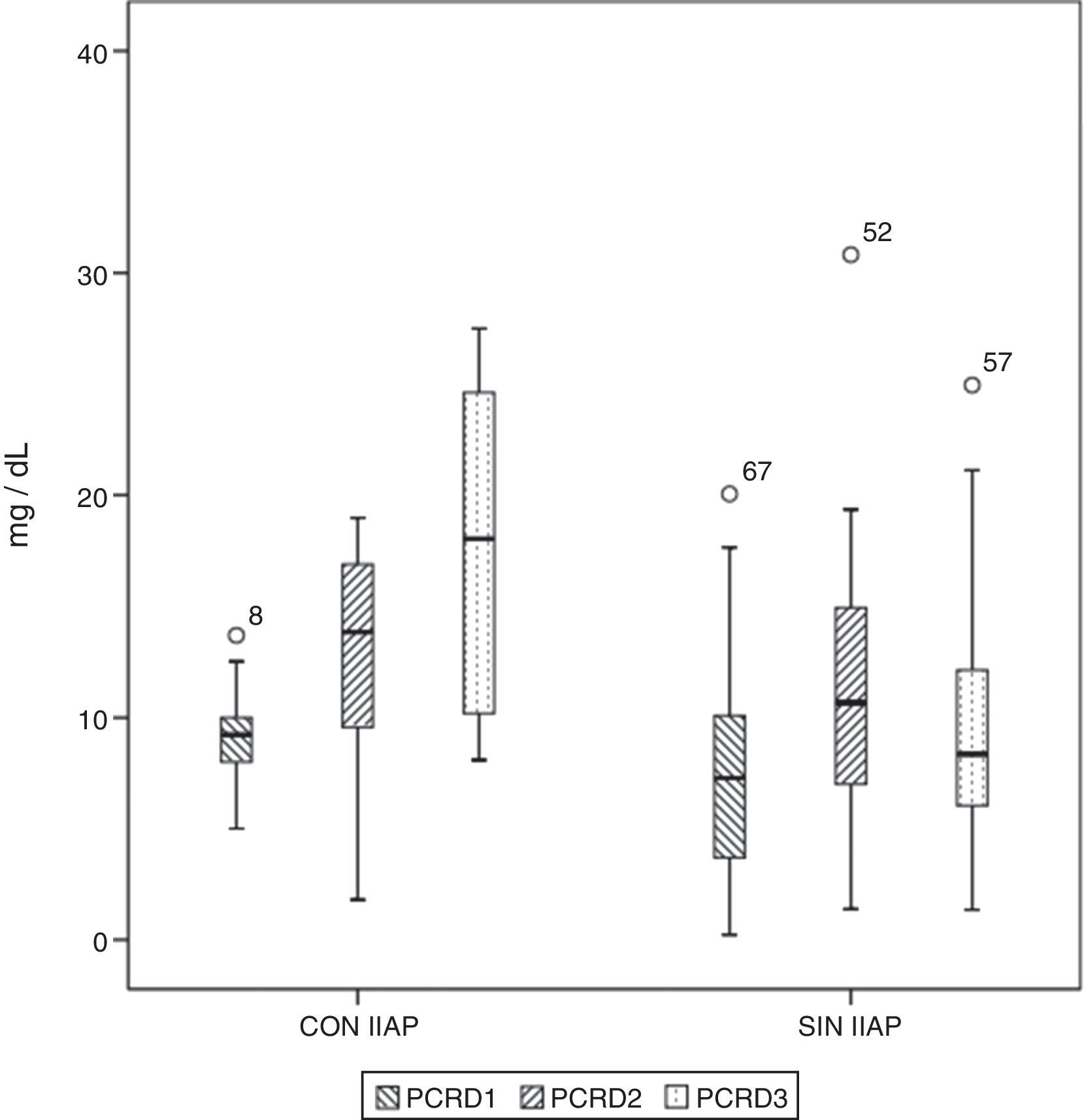
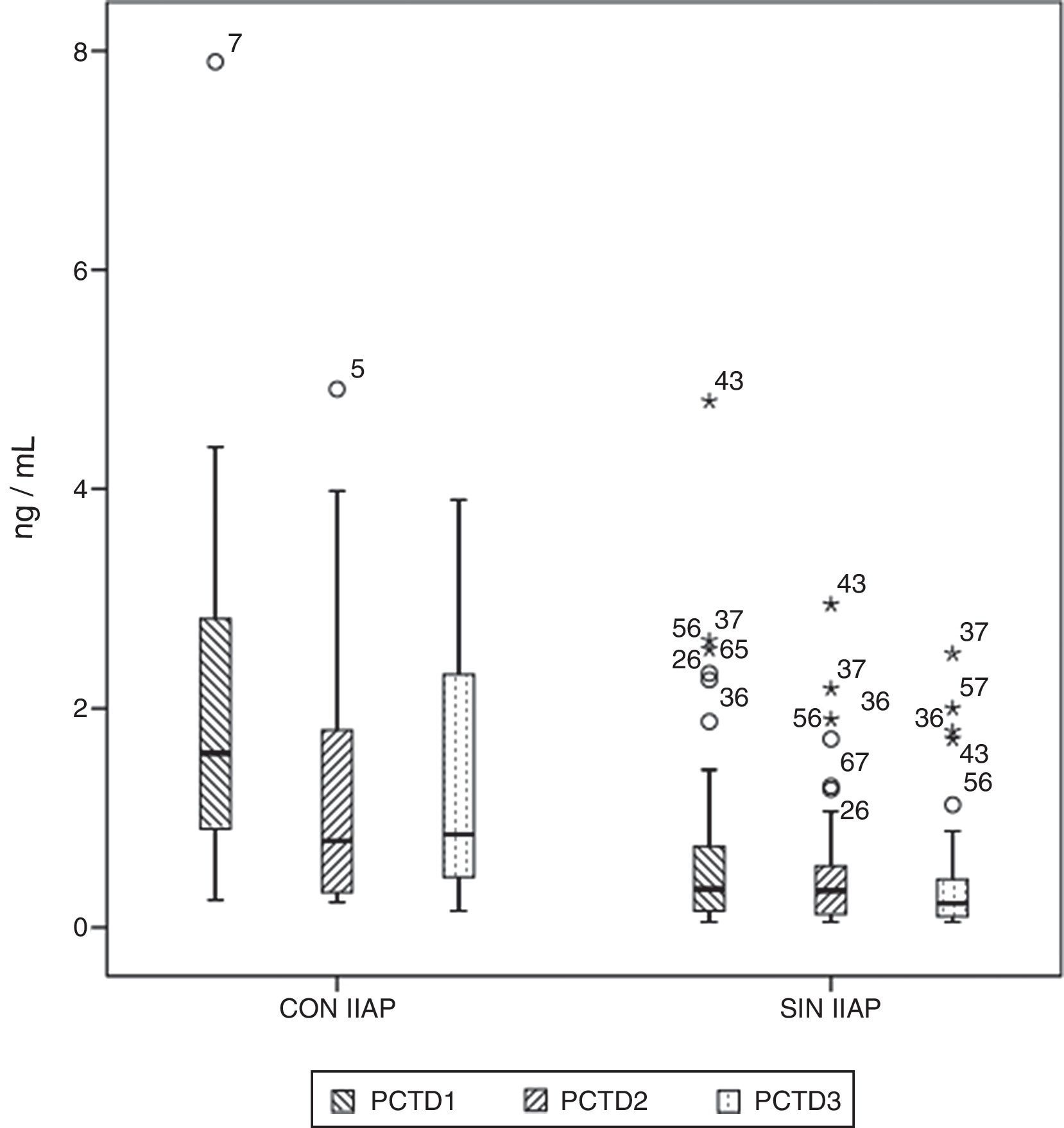
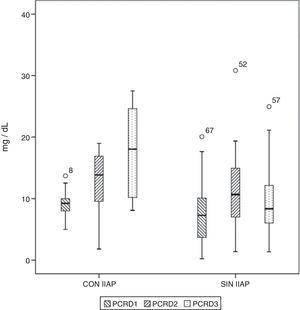
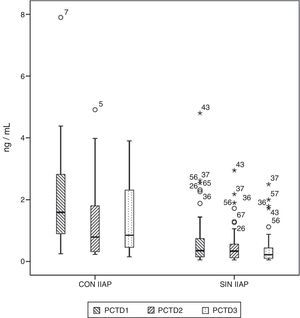
Los niveles séricos basales de PCR y PCT no fueron diferentes en ambos grupos de pacientes (p=0,330 y p=0,569, respectivamente). Los niveles de PCR y PCT aumentaron tras la cirugía en 98,5 y 97% de los pacientes, respectivamente. Ambos marcadores se elevaron en el 100% de los pacientes que tuvieron IIAP. En el período de tiempo estudiado, en los pacientes que no tuvieron IIAP, la PCR alcanzó su máximo a las 48 h, con una mediana de 10,67mg/d, mientras que en los pacientes con IIAP el pico se alcanzó a las 72 h, con una mediana de 18,03mg/dl (fig. 1). La máxima concentración de PCT, en los 3 primeros días de postoperatorio, se alcanzó a las 24h en ambos grupos, con medianas de 0,35 ng/ml, para los pacientes sin IIAP, y 1,59ng/ml, para los pacientes con IIAP (fig. 2). No hubo diferencias significativas en los valores de PCT, a las 24, 48 y 72h, en función del tipo de cirugía (p=0,613, p=0,774, p=0,764, respectivamente). Tampoco hubo diferencias significativas en los valores de PCR, en ninguna de las determinaciones postoperatorias, en función del tipo de cirugía (p=0,320; p=0,586; p=0,741).
Diagrama de cajas que muestra los valores de proteína C reactiva (PCR) en pacientes con y sin infección intraabdominal postoperatoria (IIAP). Las cajas muestran los percentiles 25, 50 y 75 y los valores mínimos y máximos. Los símbolos o representan los valores extremos. Los números indican el número de orden del paciente.
Diagrama de cajas que muestra los valores de proteína C reactiva (PCT) en pacientes con y sin infección intraabdominal postoperatoria (IIAP). Las cajas muestran los percentiles 25, 50 y 75 y los valores mínimos y máximos. Los símbolos o representan los valores extremos. Los números indican el número de orden del paciente.
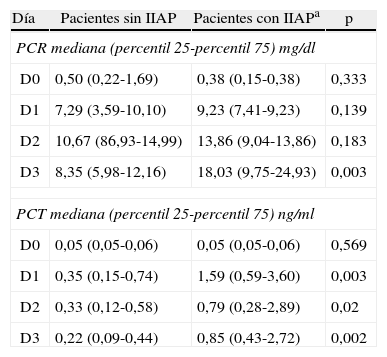
Los niveles séricos de PCR no fueron significativamente diferentes en ambos grupos de pacientes a las 24 y 48h de la cirugía (p=0,139 y p=0,183, respectivamente) sin embargo, a las 72h de postoperatorio estaban significativamente más elevados en los pacientes con IIAP (p=0,003).
Los niveles séricos de PCT estaban significativamente más elevados en los pacientes con IIAP a las 24, 48 y 72h de la cirugía (p=0,003; p=0,02 y p=0,002, respectivamente). En la tabla 3 se muestran los valores de PCR y PCT en ambos grupos de pacientes.
Valores de PCR y PCT en pacientes con y sin infección intraabdominal postoperatoria
| Día | Pacientes sin IIAP | Pacientes con IIAPa | p |
| PCR mediana (percentil 25-percentil 75) mg/dl | |||
| D0 | 0,50 (0,22-1,69) | 0,38 (0,15-0,38) | 0,333 |
| D1 | 7,29 (3,59-10,10) | 9,23 (7,41-9,23) | 0,139 |
| D2 | 10,67 (86,93-14,99) | 13,86 (9,04-13,86) | 0,183 |
| D3 | 8,35 (5,98-12,16) | 18,03 (9,75-24,93) | 0,003 |
| PCT mediana (percentil 25-percentil 75) ng/ml | |||
| D0 | 0,05 (0,05-0,06) | 0,05 (0,05-0,06) | 0,569 |
| D1 | 0,35 (0,15-0,74) | 1,59 (0,59-3,60) | 0,003 |
| D2 | 0,33 (0,12-0,58) | 0,79 (0,28-2,89) | 0,02 |
| D3 | 0,22 (0,09-0,44) | 0,85 (0,43-2,72) | 0,002 |
IIAP: infección intraabdominal postoperatoria; PCR: proteína C reactiva; PCT: procalcitonina.
El único cociente que se asoció significativamente con la aparición de IIAP fue el PCR D3/PCR D2, con una mediana de 1,29 para los pacientes que tuvieron IIAP, y de 0,88 para los pacientes que no tuvieron IIAP (p=0,003).
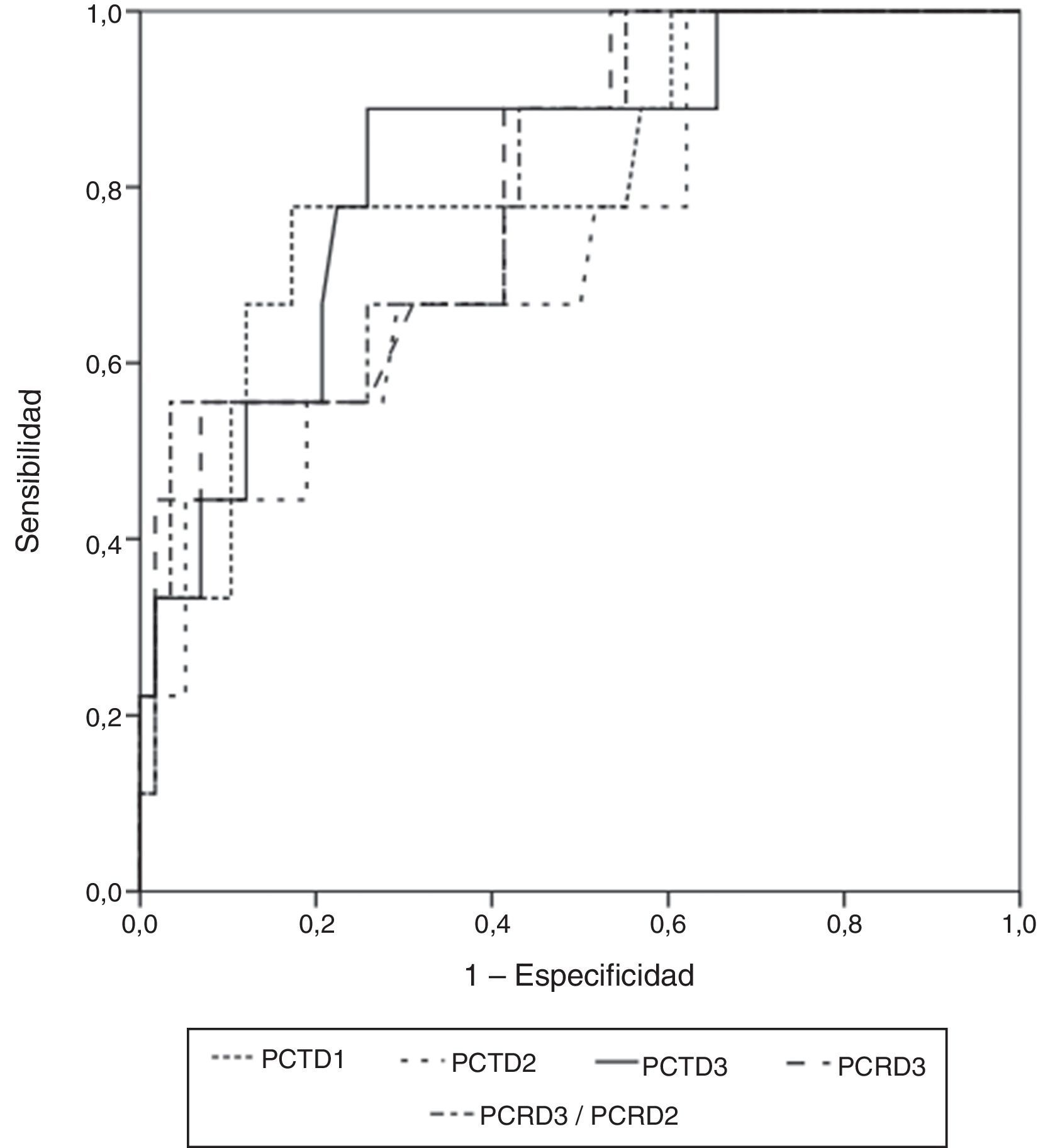
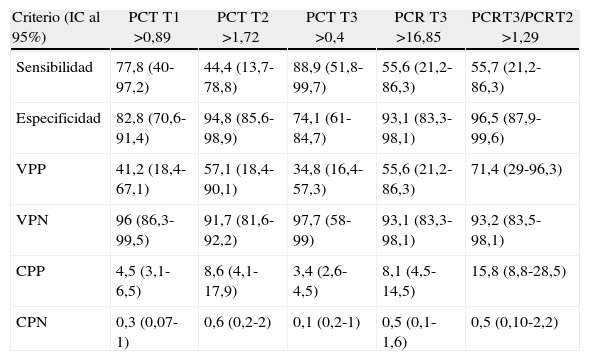
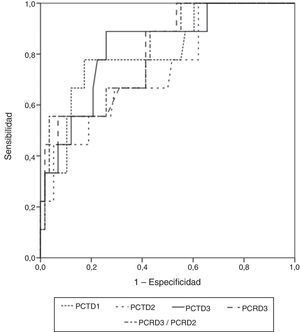
El área más amplia bajo la curva ROC correspondió a la determinación de PCT a las 72h (0,829 IC95%: 0,717-0,910; error típico: 0,0742; p=0,0001) (fig. 3). En la tabla 4 se muestran los puntos de corte óptimo, los valores de sensibilidad, especificidad y los valores predictivos.
Valores de sensibilidad, especificidad, VPP, VPN y cocientes de probabilidad
| Criterio (IC al 95%) | PCT T1 >0,89 | PCT T2 >1,72 | PCT T3 >0,4 | PCR T3 >16,85 | PCRT3/PCRT2 >1,29 |
| Sensibilidad | 77,8 (40-97,2) | 44,4 (13,7-78,8) | 88,9 (51,8-99,7) | 55,6 (21,2-86,3) | 55,7 (21,2-86,3) |
| Especificidad | 82,8 (70,6-91,4) | 94,8 (85,6-98,9) | 74,1 (61-84,7) | 93,1 (83,3-98,1) | 96,5 (87,9-99,6) |
| VPP | 41,2 (18,4-67,1) | 57,1 (18,4-90,1) | 34,8 (16,4-57,3) | 55,6 (21,2-86,3) | 71,4 (29-96,3) |
| VPN | 96 (86,3-99,5) | 91,7 (81,6-92,2) | 97,7 (58-99) | 93,1 (83,3-98,1) | 93,2 (83,5-98,1) |
| CPP | 4,5 (3,1-6,5) | 8,6 (4,1-17,9) | 3,4 (2,6-4,5) | 8,1 (4,5-14,5) | 15,8 (8,8-28,5) |
| CPN | 0,3 (0,07-1) | 0,6 (0,2-2) | 0,1 (0,2-1) | 0,5 (0,1-1,6) | 0,5 (0,10-2,2) |
CPN: cociente de probabilidades del negativo; CPP: cociente de probabilidades del positivo; IC: intervalo de confianza; PCR: proteína C reactiva; PCT: procalcitonina;VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Este estudio muestra que la cirugía del cáncer gastrointestinal induce una elevación de los niveles séricos de PCR y PCT en prácticamente todos los pacientes y que la máxima concentración se alcanza antes para la PCT que para la PCR. Ambas proteínas son marcadores útiles para la predicción de la infección intraabdominal postoperatoria, con un valor predictivo negativo (VPN) muy alto, ya en los 3 primeros días de postoperatorio, aunque el valor predictivo positivo (VPP) es bajo. Considerando valores aislados, la PCT es un marcador más válido para la predicción de IIAP que la PCR, pero si consideramos la evolución de los valores en el tiempo, observamos que la relación entre los valores de PCR a las 72h y los valores de PCR a las 48h de la cirugía tiene un VPP bastante alto, mayor que el que tienen las determinaciones aisladas de PCR y PCT. Los resultados de nuestro estudio también muestran que la elevación de los niveles séricos de PCR y PCT precede en varios días al diagnóstico clínico y radiológico de la IIAP, que en la mayor parte de los casos tuvo lugar a partir del 8.° día de postoperatorio. La elevación significativa de los valores de PCT en los pacientes que tienen IIAP se produce ya a las 24h. A partir de los resultados de este estudio no se puede deducir cuál es el motivo por el que ocurre esto, pero podría ser debido a una mayor contaminación intraoperatoria o a la traslocación bacteriana producida por isquemia de las anastomosis.
El principal punto débil de nuestro estudio es el bajo número de pacientes y que se incluyeron cánceres de distinto tipo. No obstante, creemos que los resultados siguen siendo válidos, ya que tanto en nuestro estudio como en otros publicados previamente18,20, en los pacientes con cirugía gastrointestinal, no se han encontrado diferencias significativas en los valores de PCT en función del tipo de cirugía. La relevancia clínica de este estudio estriba en la utilidad de la PCT y de la PCR en la predicción precoz de la IIAP, lo que potencialmente permite adelantar su diagnóstico, ya que en los pacientes con valores altos de PCT se pueden llevar a cabo exploraciones radiológicas, como la TC con contraste intraluminal e intravenoso, antes de que haya sospecha clínica de infección. De este modo se podría disminuir la morbimortalidad asociada con el retraso en el diagnóstico de la IIAP, sobre todo para las dehiscencias de sutura27. Particularmente relevante es el hallazgo de que tanto la PCR como la PCT tienen un alto VPN, lo que permite identificar pacientes con muy baja probabilidad de que desarrollen una IIAP, ya en los 3 primeros días de postoperatorio, y, por lo tanto, facilita el alta precoz segura en pacientes con cirugía oncológica digestiva.
Coincidiendo con los resultados obtenidos en nuestro estudio, otros autores han mostrado que tanto la PCR2,4,7,28 como la PCT4,29 se elevan de forma significativa en prácticamente todos los pacientes tras cirugía gastrointestinal. Nuestro estudio se limitó a los 3 primeros días de postoperatorio y no permite constatar en qué momento se normalizan, sin embargo, otros autores que analizaron la evolución de ambas proteínas durante un período de tiempo más largo han visto que la PCT se normaliza a los 5-7 días y la PCR, a los 7-10 días de la cirugía29.
Aunque la PCR es un marcador inespecífico de inflamación, diversos autores han mostrado que su elevación persistente a partir del tercer día de postoperatorio es un buen predictor de infección postoperatoria2,7,22,28. De forma similar, en nuestro estudio la PCR únicamente muestra una relación significativa con la aparición de infección intraabdominal postoperatoria en el tercer día de postoperatorio. Ortega-Deballon et al. mostraron que los niveles séricos de PCR en el cuarto día de postoperatorio son un buen predictor de dehiscencia de sutura en cirugía colorrectal; para un punto de corte de 125mg/l, la sensibilidad fue de 81,8%, la especificidad de 64,4% y el VPN de 95,8%2. García-Granero et al. obtuvieron resultados similares para los valores correspondientes al tercero, cuarto y quinto días de postoperatorio22. Nuestro estudio también muestra que la PCR en el tercer día de postoperatorio es un buen predictor de infección intraabdominal postoperatoria, con valores similares de sensibilidad, especificidad y VPN, pero para un punto de corte algo mayor que los referidos por estos autores.
La utilidad de la PCT como marcador de infección postoperatoria también ha sido mostrada previamente por otros autores en diversos tipos de cirugía, tanto cardiotorácica30,31 como abdominal4–6,18–21,22–24. En el ya mencionado estudio de García-Granero et al.22 se vio que los valores séricos de PCT entre el tercero y quinto días de postoperatorio eran un buen predictor de dehiscencia anastomótica mayor, con una sensibilidad superior al 90%, un VPN mayor del 99% y un VPP inferior al 17%, pero no de dehiscencia menor (las que no precisaron drenaje percutáneo ni cirugía) en pacientes con cirugía de cáncer colorrectal. Sin embargo, en nuestro trabajo consideramos cualquier IIAP, independientemente de que precisara drenaje o no, y la PCT en el tercer día de postoperatorio sigue siendo un buen predictor de infección, con valores de sensibilidad y VPN muy similares. Otro estudio reciente, que incluye a 114 pacientes con cirugía colorrectal, en el que también se consideran todas las infecciones del sitio quirúrgico, muestra unos resultados similares a los de nuestro trabajo, aunque con valores algo menores para la sensibilidad y el VPN23. Casi todos los estudios publicados hasta el momento coinciden con el nuestro en que la PCT es mejor predictor de infección postoperatoria que la PCR5,22–24, pero recientemente se ha publicado uno, con 100 pacientes operados de cáncer colorrectal, en el que se concluye que la PCT no es mejor predictor de infección postoperatoria que la PCR25. Tanto nuestro estudio como los publicados previamente coinciden en que el VPP de la PCT es bajo22,23 y, por lo tanto, la PCT, por sí sola, no es válida para el diagnóstico de la IIAP; sin embargo, puede permitir la selección de pacientes en los que llevar a cabo estudios de imagen, como la TC con contraste, antes de que la infección se sospeche clínicamente. Un hallazgo interesante de nuestro estudio, que no ha sido publicado con anterioridad, es que el cociente entre los niveles de PCR a las 72h y los niveles de PCR a las 48h de la cirugía también se asocia significativamente con la aparición de IIAP, con el mayor VPP, superior al 70%, si bien hay que interpretar con cautela este hallazgo, ya que el intervalo de confianza es muy amplio, lo que resta validez a este dato.
En conclusión, nuestro estudio sugiere que los niveles séricos de PCT en los 3 primeros días de postoperatorio son un buen marcador de IIAP, con un VPN muy alto, que permite predecir precozmente la ausencia de IIAP con seguridad. El cociente entre los valores de PCR a las 72h y los valores de PCR a las 48h combinan un VPN alto con un VPP altos.
No obstante, es necesario corroborar estos resultados con estudios que incluyan un mayor número de pacientes y confirmar la utilidad de ambas proteínas con estudios prospectivos aleatorizados en los que en un grupo de pacientes se indiquen precozmente pruebas diagnósticas, como la TC, en función de los niveles séricos.
FinanciaciónParcialmente con una beca de la Fundación José Luis Castaño.
Conflicto de interesesNo hay conflictos de intereses.