Estudiar el papel de la ecografía intraoperatoria en el diagnóstico de nuevas metástasis hepaticas en la era de la tomografía computarizada (TC) con multidetectores y su impacto en el acto quirúrgico.
Pacientes y métodoEntre febrero de 2005 y abril de 2006 se estudió de forma prospectiva, en sesiones multidisciplinarias (cirujanos, radiólogos y oncólogos), a los pacientes con metástasis hepáticas resecables de cáncer colorrectal. Los hallazgos preoperatorios de la TC se compararon con los de la ecografía intraoperatoria, su correlación histológica y el resultado final de la intervención quirúrgica.
ResultadosSe estudió a 45 pacientes candidatos a cirugía curativa, con un total de 171 metástasis hepáticas. La TC detectó correctamente 115 lesiones con una sensibilidad del 67%, un valor predictivo positivo del 97%, una tasa de falsos negativos del 33% y una tasa de falsos positivos del 2%. En 5 ocasiones los hallazgos intraoperatorios condicionaron un cambio en el acto quirúrgico programado: en 3 pacientes eran irresecables (tasa de resecabilidad del 93%) y 2 pacientes precisaron de resecciones más amplias de las previamente programadas.
ConclusionesLa TC con multidetectores como prueba de imagen preoperatoria y las sesiones multi-disciplinarias son el factor más importante en la toma de decisiones en la cirugía de las metastasis hepáticas y nos permiten obtener una alta tasa de resecabilidad. La ecografía intraoperatoria hepatica nos permite encontrar un mayor número de metastasis y realizar una correcta delimitación anatómica y, en ocasiones, condiciona un cambio en el acto quirúrgico programado.
To study the performance of the intraoperative ecography in the diagnosis of new liver metastases in the era of computerized tomography (CT) with multidetectors and its impact on the surgical operation.
Patients and methodBetween February 2005 and April 2006 patients with resectable liver metastases where studied prospectively in a multidisciplinary meeting (surgeons, radiologist, oncologist). The preoperative CT findings were compared with the intraoperative findings and ultrasound study and the results of the surgical operation.
ResultsForty-five candidates for curative surgery had a total of 171 hepatic lesions. CT correctly detected 115 lesions with a sensitivity of 67%, and a positive predictive value of 97%, with a false negative rate of 33% and false positive rate of 2%. In 5 patients intraoperative findings were the cause of changing the surgical procedure, three patients were unresectable (rate of resectability of 93%) and two patients needed a larger hepatic resection.
ConclusionsCT with multidetectors and multidisciplinary meetings are the most important factors in the decision making of surgery of liver metastases with a high resectability rate. Intraoperative ecography is useful for the detection of 10% more liver metastases, but rarely involves a change in the surgical procedure.
El tratamiento quirúrgico de las metástasis hepáticas (MH) del cáncer de colon y recto (CCR) es la terapia de elección y actualmente la única opción con intención curativa1,2. La cirugía, junto con la quimioterapia, obtiene unas tasas de supervivencia a los 5 años del 20 al 40% y una tasa de supervivencia libre de enfermedad (ausencia de recidiva a los 5 años) del 20-30%1–9. No obstante, en sólo el 15-25% de los pacientes con MH de CCR serán resecables, con lo que un 75-85% de los pacientes no serán quirúrgicos1. Por tanto, las técnicas de imagen preoperatorias son esenciales para seleccionar a los pacientes candidatos a cirugía y decidir la técnica quirúrgica5.
En estos últimos años los cambios en la técnica quirúrgica se han acompañado de importantes avances en las técnicas de imagen: tomografía computarizada con multidetectores (TCMD), resonancia magnética (RM), ecografía con contraste y tomografía por emisión de positrones (PET). En la actualidad la más utilizada es la TCMD por estar más disponible en los centros y ser más económica. No obstante, la ecografía intraoperatoria (EIO) está aceptada como el estándar para establecer el número, la localización, el tamaño, las relaciones y la caracterización de los nódulos hepáticos.
Estos avances han contribuido a aumentar la tasa de resecabilidad en los pacientes con MH de CCR candidatos a cirugía curativa, según los estudios preoperatorios desde el 50% hasta el 80%5–9.
El objetivo principal de este trabajo es estudiar la sensibilidad, el valor predictivo positivo, la tasa de falsos negativos y la tasa de falsos positivos de la TCMD preoperatoria comparada con los hallazgos intraoperatorios (inspección, exploración bimanual y EIO) e histológicos; actualizando trabajos anteriores y evaluando el papel de la quimioterapia neodyuvante. El segundo objetivo del trabajo es analizar si estos hallazgos intraoperatorios modifican la intervención programada.
Pacientes y métodoDurante el período comprendido entre febrero de 2005 y abril de 2006, se realizó un estudio prospectivo de todos los pacientes con MH por CCR candidatos a cirugía con intención curativa según los estudios preoperatorios. Todos los pacientes fueron informados detalladamente y firmaron el consentimiento para participar en el estudio. A todos los pacientes se les realizó TCMD en 3 fases, y los estudiaron los mismos 2 radiólogos. En caso de tener un estudio realizado en otro centro se les realizó una nueva TCMD en nuestro hospital para completar el estudio. Cada caso se discutió en una sesión multidisciplinaria clínico-radiológica semanal, con revisión de la TC, para valorar su posible resecabilidad. La sesión multidisciplinaria clínico-radiológica estaba formada por oncólogos, cirujanos y radiólogos. Todas las piezas resecadas fueron revisadas por los mismos 2 patólogos.
Los hallazgos de la TCMD preoperatoria, exploración bimanual, EIO, lesiones no resecables destruidas por radiofrecuencia y el resultado del estudio histológico se recogieron de forma prospectiva en una base de datos. Se anotaba en cada una de las exploraciones el número de nódulos, el segmento donde se localizaban, el diámetro, el tipo de nódulo (MH, quiste, hemangioma u otros) y si habían recibido quimioterapia neoadyuvante, y posteriormente se compararon los datos obtenidos.
La técnica de estudio con TCMD fue idéntica en todos los pacientes. Después de la administración de contraste intravenoso se realizó un estudio dinámico hepático. Se utilizó un tomógrafo de 10 detectores por fila (Mx8000 Philips Medical Systems, Holanda). Tras la administración de 150ml de contraste yodado (Ultravist 300mg/ml Schering, Alemania) a una velocidad de entrada de 3,5ml/s, se adquirieron imágenes del parénquima hepático en apnea, a los 35s (fase arterial tardía), 65s (fase portal) y 5min (fase de equilibrio); con un grosor de corte de 2mm, un incremento de 1mm y un pitch de 1,3 (hélice de 10/1,5). Se utilizó una potencia de 120kW y una intensidad 160mA. La hélice realizada a los 65s se aprovechó para hacer un estudio de todo el abdomen. El tiempo total del estudio fue menor de 10min.
Se analizó el comportamiento de las lesiones encontradas en las diferentes fases del estudio. La primera fase del estudio permite la detección de lesiones hipervasculares y obtener un mapa vascular de las arterias hepáticas. La fase que permite una mejor valoración de las metástasis hipovasculares (como es el caso del CCR) es la fase portal. La fase de equilibrio se utiliza para determinar la captación tardía de contraste o la ausencia de captación. Las MH se definieron como lesiones de aspecto hipodenso en fase portal con realce en la fase tardía, volviéndose isodensas con respecto al parénquima hepático. Se consideró una lesión como hemangioma cuando presentaba un realce nodular periférico en fase arterial y realce centrípeto en las siguientes fases, persistiendo hiperdenso en la fase de equilibrio. Las lesiones que no presentaban realce de contraste en ninguna de las fases se catalogaron como quistes. Las lesiones que no cumplían estas características se consideraron como indeterminadas pero sospechosas.
Todos los procedimientos quirúrgicos fueron realizados por el mismo equipo quirúrgico, con amplia experiencia en cirugía hepática y en la realización de exploración de ecografía intraoperatoria. Se evaluó la resecabilidad intraoperatoria mediante inspección, exploración bimanual y EIO. El estudio ecográfico intraoperatorio se realizó siguiendo siempre la misma técnica descrita por Makuuchi et al10. Para la ecografía se utilizó una sonda intraoperatoria multifrecuencia de 5, 6,5 y 7,5MHz y una consola BK Medical, 2102 Hawk, Herlev, Dinamarca. En los pacientes con MH multinodulares bilaterales, se realizó resección del lóbulo con mayor afección y metastasectomía o bien destrucción por radiofrecuencia de las MH contralaterales. Cool Tip Radionics, Tyco, Bouder, Estados Unidos.
El número total de MH fue definido como la suma de los hallazgos histológicos, lesiones destruidas por radiofrecuencia y lesiones detectadas intraoperatoriamente en los casos irresecables. Se consideró verdaderos positivos las lesiones hepáticas con localización similar en la TC y los hallazgos histológicos. Se consideró falsos negativos las lesiones detectadas de forma intraoperatoria y/o histopatológica, pero no detectadas por la TC. Se consideró falsos positivos las lesiones hepáticas benignas en los hallazgos intraoperatorios o histológicos y erróneamente clasificadas como metástasis por la TC.
La sensibilidad se definió como el número de MH correctamente detectadas por la TC dividido por el número de MH identificadas en el acto quirúrgico y en el estudio histológico. La tasa de falsos positivos se definió como el número de falsos positivos detectados por la TC dividido por el total de lesiones detectadas como metástasis por la TC (verdaderos positivos más los falsos positivos). La tasa de falsos negativos se definió como el número de falsos negativos en la TC dividido por el número total de metástasis. El valor predictivo positivo se definió como el número de metástasis correctamente identificadas por la TC dividido por el número total de metástasis identificadas por la TC. Se ha realizado el análisis estadístico aplicando la prueba de la χ2 para la comparación de las variables discontinuas.
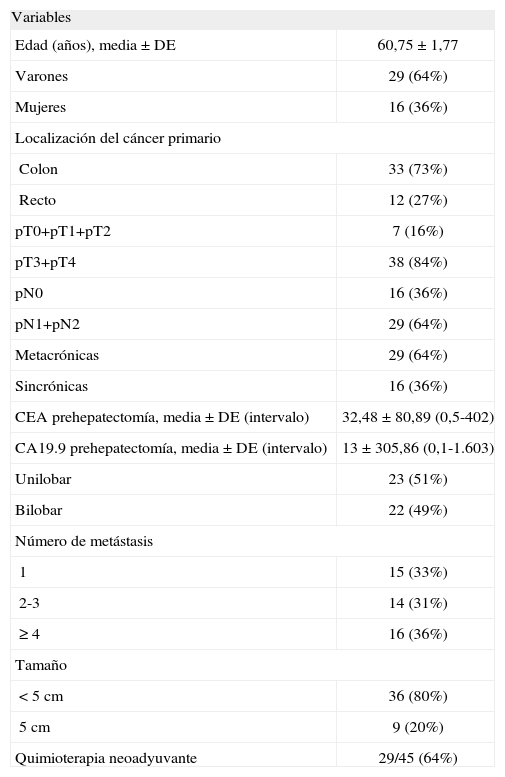
ResultadosSe estudió en nuestro centro un total de 45 pacientes consecutivos con MH de CCR y se consideró que eran candidatos a cirugía curativa según los estudios preoperatorios. El grupo estaba formado por una mayoría de varones, con una mediana de edad de 63 años y un rango de 38-81 años. La mayoría de los tumores primarios asentaban en el colon, atravesaban la serosa y tenían adenopatías locorregionales positivas. La mayoría de las MH se descubrieron después del CCR y se distribuían en ambos lóbulos hepáticos. La mayoría de los pacientes presentaban MH múltiples y menores de 5cm. La tabla 1 muestra el resto de las características de la serie.
Características de los pacientes (n = 45). Estadificación del tumor primario según la clasificación TNM de la UICC
| Variables | |
| Edad (años), media ± DE | 60,75 ± 1,77 |
| Varones | 29 (64%) |
| Mujeres | 16 (36%) |
| Localización del cáncer primario | |
| Colon | 33 (73%) |
| Recto | 12 (27%) |
| pT0+pT1+pT2 | 7 (16%) |
| pT3+pT4 | 38 (84%) |
| pN0 | 16 (36%) |
| pN1+pN2 | 29 (64%) |
| Metacrónicas | 29 (64%) |
| Sincrónicas | 16 (36%) |
| CEA prehepatectomía, media ± DE (intervalo) | 32,48 ± 80,89 (0,5-402) |
| CA19.9 prehepatectomía, media ± DE (intervalo) | 13 ± 305,86 (0,1-1.603) |
| Unilobar | 23 (51%) |
| Bilobar | 22 (49%) |
| Número de metástasis | |
| 1 | 15 (33%) |
| 2-3 | 14 (31%) |
| ≥ 4 | 16 (36%) |
| Tamaño | |
| < 5cm | 36 (80%) |
| 5cm | 9 (20%) |
| Quimioterapia neoadyuvante | 29/45 (64%) |
DE: desviación estándar.
Los datos expresan n (%), excepto donde se indica.
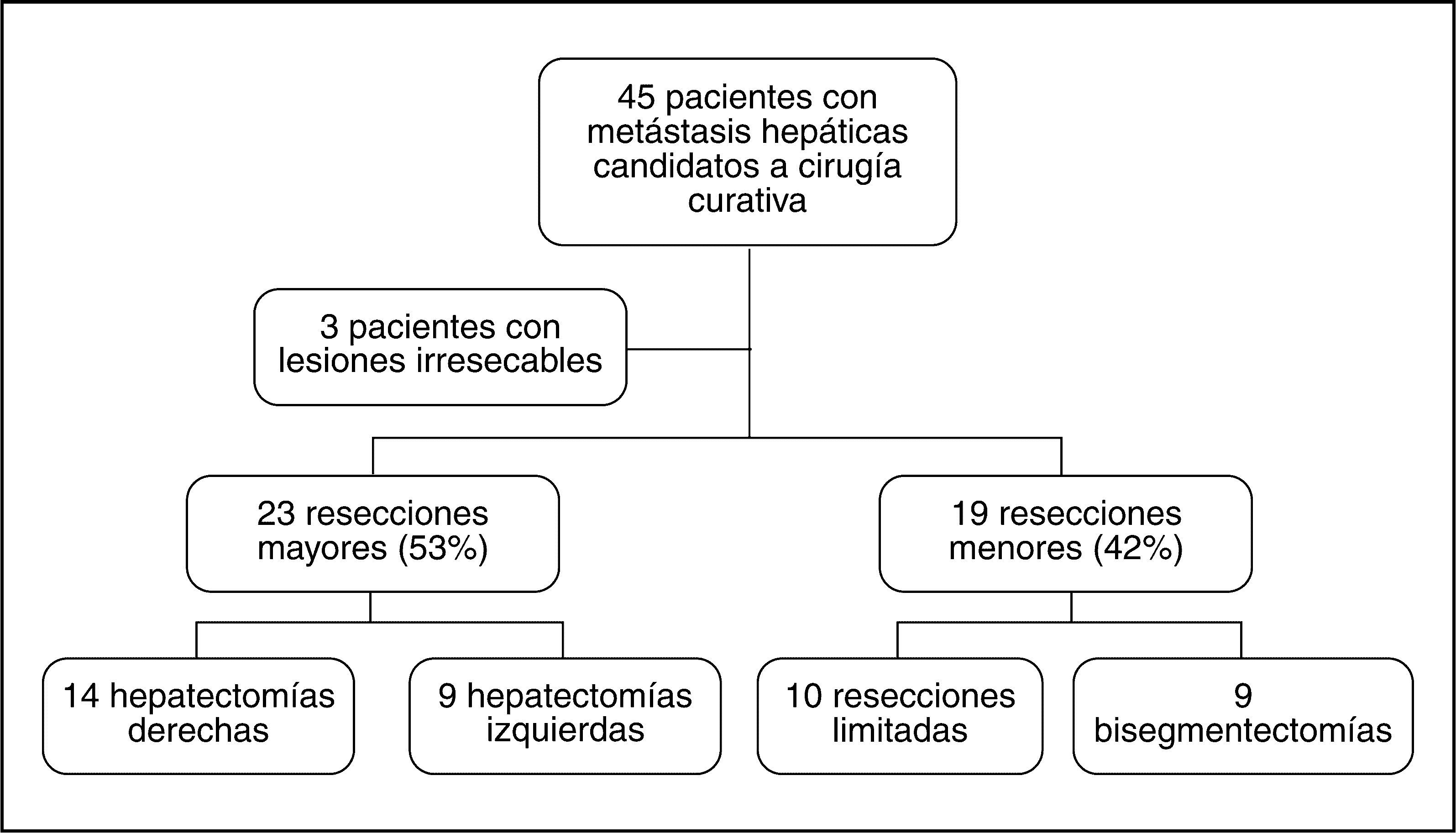
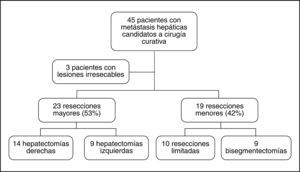
En las 45 intervenciones (fig. 1) hubo 3 casos de irresecabilidad debido a los hallazgos intraoperatorios (inspección, exploración bimanual y EIO). Las causas fueron: en el primer paciente, en que el estudio preoperatorio había detectado 4 MH, en el acto quirúrgico se encontraron otras 5 MH no detectadas en la TC (falsos negativos), que imposibilitaban la realización de una resección curativa. En el segundo caso, en que el estudio preoperatorio había detectado 2 MH, se encontraron otras 4 MH (falsos negativos) y afección de los ganglios hiliares hepáticos; y en el tercer caso, en que el estudio preoperatorio había detectado 2 MH, se encontró una MH nueva (falso negativo) y carcinomatosis peritoneal que afectaba al epiplón mayor, parietocólico izquierdo y subfrénico derecho. Las intervenciones realizadas se presentan en la figura 1.
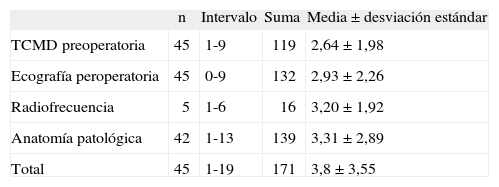
El número total de MH fue 171, con una media ± desviación estándar de 3,8 ± 3,55 MH por paciente. Se detectaron 119 MH por la TC en el estudio preoperatorio, y la media por paciente fue de 2,64 ± 1,98 MH. La TC informó correctamente de 115 MH, según su correlación con los estudios intraoperatorio e histopatológico. Hubo 4 falsos positivos: 2 quistes, 1 hemangioma y una lesión inexistente.
Hubo 56 falsos negativos, lesiones no informadas en la TC preoperatoria y encontradas intraoperatoriamente o en el estudio histológico en 18 pacientes. En los 3 pacientes con lesiones no resecables se encontró 10 nuevas lesiones. Otras 10 lesiones se destruyeron por radiofrecuencia y no hubo estudio histológico. De las 36 lesiones restantes, se comprobó que en 24 (66%) casos se trataba de lesiones con un diámetro inferior a 1cm y en 23 (64%) casos no se detectaron tampoco en la exploración intraoperatoria y fueron hallazgos histológicos. La media fue de 3,31 ± 2,89 MH en los 42 casos resecados.
En un caso la EIO no fue de gran utilidad, pues no se visualizaron las MH debido a que se trataba de un paciente con un hígado con abundantes cicatrices de fibrosis, congestión venosa y un importante componente esteatósico después de quimioterapia neoadyuvante. En la TCMD preoperatoria se había detectado 6 MH, 3 menores de 1cm, la EIO no detectó las MH infracentimétricas y los hallazgos histológicos fueron 13 MH, de las cuales 7 eran menores de 1cm (tabla 2).
Resultados
| n | Intervalo | Suma | Media ± desviación estándar | |
| TCMD preoperatoria | 45 | 1-9 | 119 | 2,64 ± 1,98 |
| Ecografía peroperatoria | 45 | 0-9 | 132 | 2,93 ± 2,26 |
| Radiofrecuencia | 5 | 1-6 | 16 | 3,20 ± 1,92 |
| Anatomía patológica | 42 | 1-13 | 139 | 3,31 ± 2,89 |
| Total | 45 | 1-19 | 171 | 3,8 ± 3,55 |
TCMD: tomografía computarizada con multidetectores.
La sensibilidad de la TC helicoidal con MD fue del 67% (115/171), con un valor predictivo positivo del 97% (115/119). La tasa de falsos positivos fue del 2% (4/115) y la tasa de falsos negativos fue del 33% (56/171).
El 64% (29/45) de los pacientes habían recibido quimioterapia neoadyuvante. De estos 29 pacientes, el 38% (11/29) presentaba falsos negativos en la TC. Esto representa el 61% (11/18) de los 18 pacientes con falsos negativos, sin diferencias respecto a los que no habían recibido quimioterapia neoadyuvante (p = 0,97) y el 71% (40/56) del total de nodulos falsos negativos.
Se realizaron cambios en el acto quirúrgico en 5 (11%) ocasiones, ya que los hallazgos intraoperatorios determinaron que no se pudiera realizar la intervención previamente planificada. Hubo 3 casos irresecables (explicados previamente); la tasa de resecabilidad llegó al 93% (intervención quirúrgica con intención curativa). Una paciente programada para una resección limitada del segmento IV fue sometida a una hepatectomía izquierda debido a la proximidad del pedículo izquierdo a la lesión. En otra paciente se asoció una resección limitada del segmento III a la HD ampliada, previamente programada, debido al hallazgo de otra nueva MH contralateral.
DiscusiónEl estudio preoperatorio con una prueba de imagen no invasiva, con un alto valor predictivo positivo y baja tasa de falsos positivos, acompañado de sesiones multidisciplinaras regulares son clave para una correcta evaluación de los pacientes con MH para una mejor selección de los pacientes candidatos a cirugía curativa. Esto nos permite aumentar la tasa de resecabilidad hasta el 93%, frente al 50-80% publicado en otros estudios2,4–7.
Los avances en las técnicas de imagen preoperatorias, en nuestro estudio con la TCMD y en otras publicaciones con RM11,12, permiten detectar las MH en un mayor número y con más precisión. A pesar de esto, nuestro estudio presenta una menor sensibilidad respecto a estudios precedentes. En el estudio de Valls et al13 del año 2001, la TC helicoidal tuvo una sensibilidad del 85,1% con una tasa de resecabilidad del 94,1%. La menor sensibilidad en la detección preoperatoria de nuestro estudio puede deberse a la mayor agresividad actual en las indicaciones de la cirugía curativa2-3,14,15. La media ± desviación estándar de MH fue de 3,31 ± 2,89 en los 42 pacientes resecados. En nuestra experiencia, también se usó quimioterapia neoadyuvante con mucha frecuencia (64%). La quimioterapia sistémica ocasiona una alteración del parénquima hepático16–19 y una disminución en el tamaño de las MH, lo que dificulta el estudio ecográfico y la localización de las MH.
El uso de los nuevos quimioterápicos y su administración preoperatoria permiten la conversión de MH no resecables en resecables. Pero los efectos de estos fármacos también causan alteraciones en el parénquima hepático y el posible aumento en la morbilidad y la mortalidad tras la resección hepática16. Estudios recientes, cómo los de Aloia et al17, indican que el uso de oxaliplatino induce cambios vasculares18. Los resultados del estudio de Vauthey et al19 asocian la utilización de irinotecan con la esteatohepatitis, lo cual se acompaña de un aumento de la mortalidad a 90 días, particularmente en los pacientes sometidos a una resección mayor combinada con radiofrecuencia19. Ambos cambios histológicos, la congestión sinusoidal y la esteatohepatitis dificultan mucho los estudios del parénquima hepático con ecografía.
A pesar de los avances en las pruebas de imagen preoperatorias, la EIO es de obligada ejecución en el acto quirúrgico. Debido a que permite detectar un mayor número de metástasis, con una mejor caracterización de la lesión en tamaño y relaciones anatómicas, lo que nos permite una mejor identificación del plano de resección10.
La exploración intraoperatoria, y principalmente la EIO, permite diagnosticar un mayor número de MH, pero en pocas ocasiones esto se traduce en un cambio en el acto quirúrgico programado (5/45; 11%). Los nuevos hallazgos respecto al estudio preoperatorio suelen tratarse de lesiones infracentimétricas (24/46; 52%), que habitualmente sólo son detectadas en el estudio histológico (23/46; 50%). Sin embargo, identificar las MH ocultas en los pacientes sometidos a quimioterapia preoperatoria puede estar dificultado por los cambios histológicos, principalmente la esteatosis hepática. Revisiones retrospectivas apuntan a que una reducción del volumen de las MH respecto al inicial podría ser indicativo de alto riesgo de presentar MH ocultas20,21.
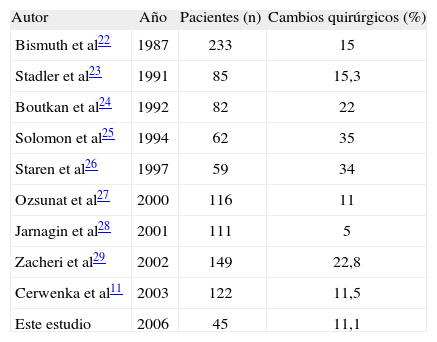
En estudios precedentes, la EIO determinaba un cambio en el acto quirúrgico programado del 5-35% de los casos11,22–29. En nuestro estudio estos cambios afectaron al 11% de las intervenciones. Cronológicamente, debido a los avances en las técnicas de imagen, se observa una disminución de la necesidad de cambiar el procedimiento quirúrgico previamente decidido. Pero hay que tener en cuenta que simultáneamente se ha producido una ampliación muy importante de los criterios de selección de los pacientes candidatos a cirugía curativa, así como un aumento en la utilización de la quimioterapia neoadyuvante que también exige una mayor sensibilidad a las exploraciones radiológicas preoperatorias (tabla 3).
Series publicadas que analizan los cambios en el acto quirúrgico por los hallazgos de la ecografia intraoperatoria
| Autor | Año | Pacientes (n) | Cambios quirúrgicos (%) |
| Bismuth et al22 | 1987 | 233 | 15 |
| Stadler et al23 | 1991 | 85 | 15,3 |
| Boutkan et al24 | 1992 | 82 | 22 |
| Solomon et al25 | 1994 | 62 | 35 |
| Staren et al26 | 1997 | 59 | 34 |
| Ozsunat et al27 | 2000 | 116 | 11 |
| Jarnagin et al28 | 2001 | 111 | 5 |
| Zacheri et al29 | 2002 | 149 | 22,8 |
| Cerwenka et al11 | 2003 | 122 | 11,5 |
| Este estudio | 2006 | 45 | 11,1 |
En nuestra experiencia, las sesiones muldisciplinarias (cirujano-radiólogo-oncólogo) con una buena prueba de imagen preoperatoria (TCMD) son el factor más importante en la toma de decisiones y nos permite aumentar la tasa de resecabilidad hasta el 93%. Pero la EIO, en manos de cirujanos expertos, consigue detectar un mayor número de metástasis y en ocasiones, aproximadamente en el 10% de los casos, puede modificar la actitud quirúrgica planificada preoperatoriamente.