La osteocondromatosis múltiple hereditaria se caracteriza por el crecimiento de múltiples tumores benignos, cartilaginosos, que crecen en forma de exostosis predominantemente en las metáfisis de los huesos largos. Se ha descrito una prevalencia de 1/50,000 individuos.
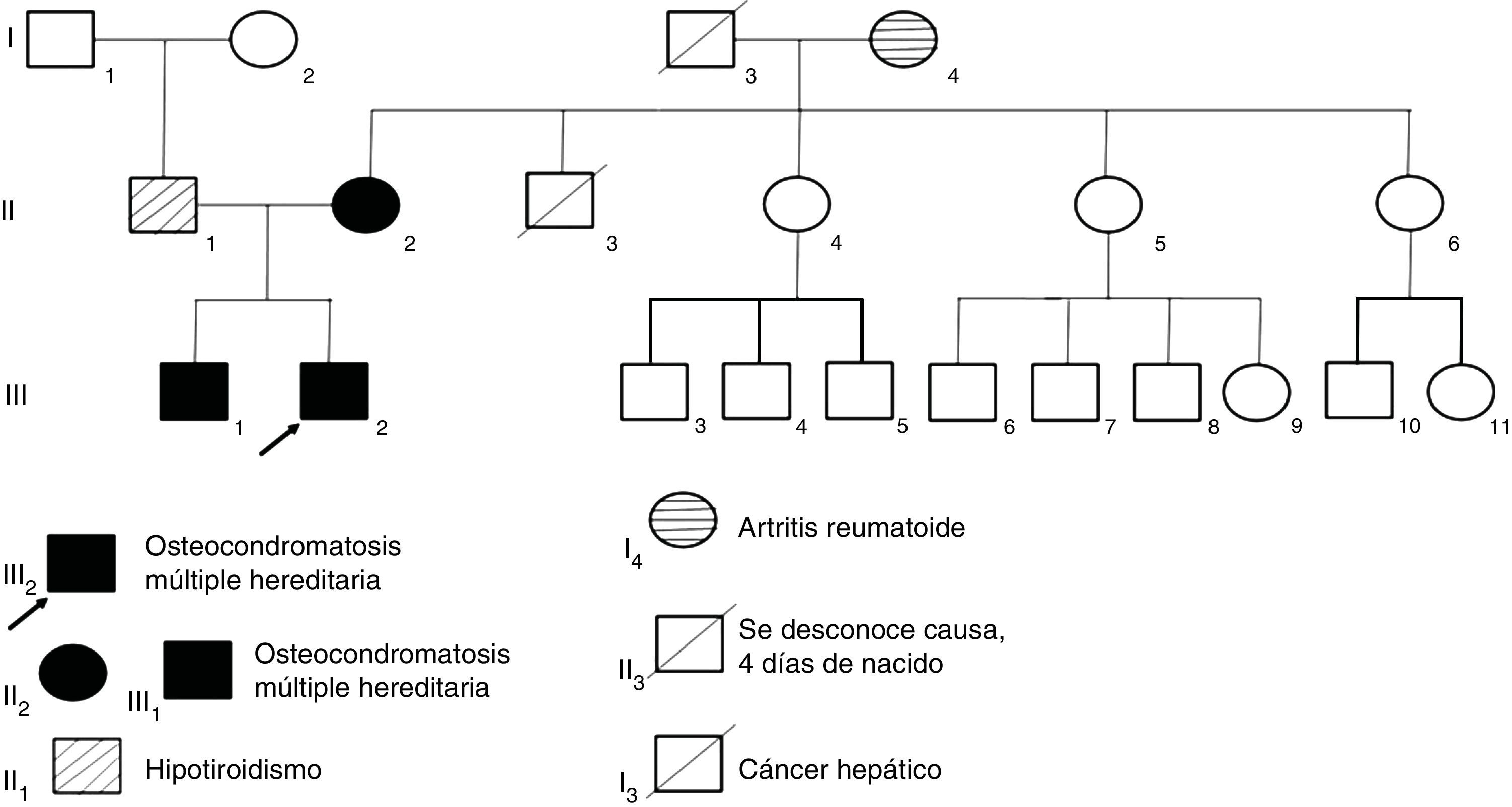
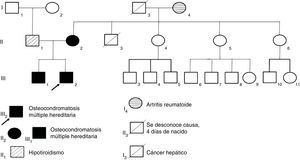
Casos clínicosSe presenta la información clínica y patrón hereditario autosómico dominante, en el que están afectados los genes de exostosina (familia de genes EXT) en tres miembros de una familia con osteocondromatosis múltiple. Los tres pacientes han presentado alteraciones en los arcos de movimiento de muñecas, hombros o tobillo. El diagnóstico clínico fue confirmado con estudios radiológicos y no hay evidencia de que las lesiones se hayan malignizado.
ConclusionesEsta entidad requiere de supervisión periódica, corrección quirúrgica de las deformaciones que limiten la función, vigilancia de la transformación maligna y consejería genética.
Multiple hereditary osteochondromatosis is characterized by the growing of benign cartilaginous tumors in form of exostosis, predominately in the metaphysis of long bones. It is described with a prevalence of 1/50,000 individuals.
Case reportsThis article presents the clinical information and its autosomal dominant inheritance pattern where exotoxin genes (EXT gene family) were affected in a three-member family with multiple hereditary osteochondromatosis. The three patients showed altered arcs of movement of wrists, shoulders and ankles. Clinical diagnosis was confirmed with radiology and malignancy was ruled out in all patients.
ConclusionsThis disease requires frequent medical evaluation, surgical bone correction when the normal function is involved, surveillance for malignant transformation, and genetic counseling.
La osteocondromatosis múltiple hereditaria (OMH) también se ha denominado como exostosis cartilaginosa múltiple, exostosis hereditaria múltiple, osteocondromatosis congénita, osteocondromatosis familiar, osteocondromatosis hereditaria, condrodisplasia hereditaria deformante y aclasia diafisaria1. Es una entidad autosómica dominante que se caracteriza por el crecimiento de múltiples tumores benignos llamados osteocondromas. Estos se conforman de hueso cartilaginoso que crece de la metáfisis de los huesos largos hacia afuera, y pueden ir en número desde dos hasta cientos2. La OMH consiste en un defecto de la actividad osteoclástica de las metáfisis de los huesos durante el proceso de remodelación en la niñez o adolescencia temprana. Durante el desarrollo esquelético, aumentan de tamaño y gradualmente se osifican; dejan de crecer al alcanzar la maduración esquelética después de la cual no aparecen nuevos ostoecondromas1. En la metáfisis se desarrollan protuberancias óseas benignas recubiertas por cartílago.
La OMH fue descrita por primera vez por John Hunter en 1839 al reportar un paciente en su libro Lectures on the Principles of Surgery3. Los estudios realizados han encontrado que su prevalencia es de 1/50,000 individuos4–6. En la actualidad se sabe que, a nivel molecular, los genes de exostosina (familia de genes EXT) expresan glucoproteínas que participan en el transporte, proliferación y diferenciación de los condrocitos7. Se ha descrito que el gen EXT1 está localizado en el cromosoma 8q24, donde se producen del 44-66% de las mutaciones de la OMH. El EXT2 se localiza en el cromosoma 11p11-p12. En este gen se puede presentar hasta el 30% de las mutaciones. El EXT3 se localiza en el cromosoma 19p y pudiera contener algunas mutaciones que condicionan este padecimiento8.
La media de edad de presentación de OMH es de 3 años y el 96% de los casos han sido diagnosticados antes de 12 años de edad4. Por lo general, los osteocondromas se establecen y se desarrollan en el periodo de crecimiento óseo natural de la persona9. Estos se forman a partir del desplazamiento de la parte lateral del platillo de crecimiento, con proliferación diagonal al eje largo del hueso y hacia fuera de la articulación vecina; comúnmente presentan forma de hongo y varían en tamaño de 1 a 20cm. La capa externa de la cabeza del osteocondroma está formada por cartílago hialino benigno de grosor variable delimitada por pericondrio10. Se pueden producir acortamientos de las extremidades, escoliosis, fracturas patológicas o pseudoartrosis, coxa valga bilateral, ensanchamiento progresivo de la metáfisis proximal del fémur, acortamiento del cúbito con deformación del radio/subluxación radio-humeral, valgo de rodillas y tobillos, así como disminución de la estatura debido a las deformaciones y angulaciones11,12.
La localización más común de los osteocondromas es en huesos largos, principalmente en húmero proximal, fémur distal y proximal, tibia y peroné; sin embargo, también pueden verse afectados huesos de la columna, la pelvis, las costillas y las escápulas13,14.
Las deformaciones que se diagnostican con frecuencia son coxa valga bilateral, ensanchamiento progresivo de la metáfisis proximal del fémur, acortamiento del cúbito con deformación del radio/subluxación radio-humeral, valgo de rodillas y tobillos, disminución de la estatura debido a las deformaciones, y angulaciones8. Sin embargo, la presentación más usual es la de una inflamación que no genera dolor, o la aparición de una masa de crecimiento lento2. El dolor y el déficit motor son secundarios a un efecto de masa. La complicación más temida es el desarrollo de condrosarcoma, que puede presentarse hasta en el 25% de los casos11.
El método de imagen de elección para evaluar al paciente con osteocondromas es la radiografía simple2. Generalmente la radiografía muestra una excrecencia, ya sea pedunculada o sésil, con márgenes bien definidos que surge de la metáfisis y se aleja de la epífisis2. A veces, se genera un ensanchamiento de la metáfisis. Algunos osteocondromas que surgen de la superficie del hueso contienen corteza y capa esponjosa, y parecerían ser una continuación del hueso de origen15.
El objetivo del presente estudio fue caracterizar la OMH en tres integrantes de una familia, así como establecer el patrón hereditario observado, y proporcionar asesoramiento genético. Este se ofrece con el objetivo de que las familias cuenten con información sobre la naturaleza, la herencia y las implicaciones de este padecimiento, para ayudarlos a tomar decisiones médicas y personales.
2Casos clínicosSe presentaron tres casos de familiares con diagnóstico OMH. La madre, con una mutación de novo, presentó trasmisión autosómica dominante a los hijos (fig. 1). El padre de los niños no presentó problemas osteoarticulares aparentes, pero contó con antecedentes de hipotiroidismo, por lo que ha requerido terapia de remplazo con levotiroxina.
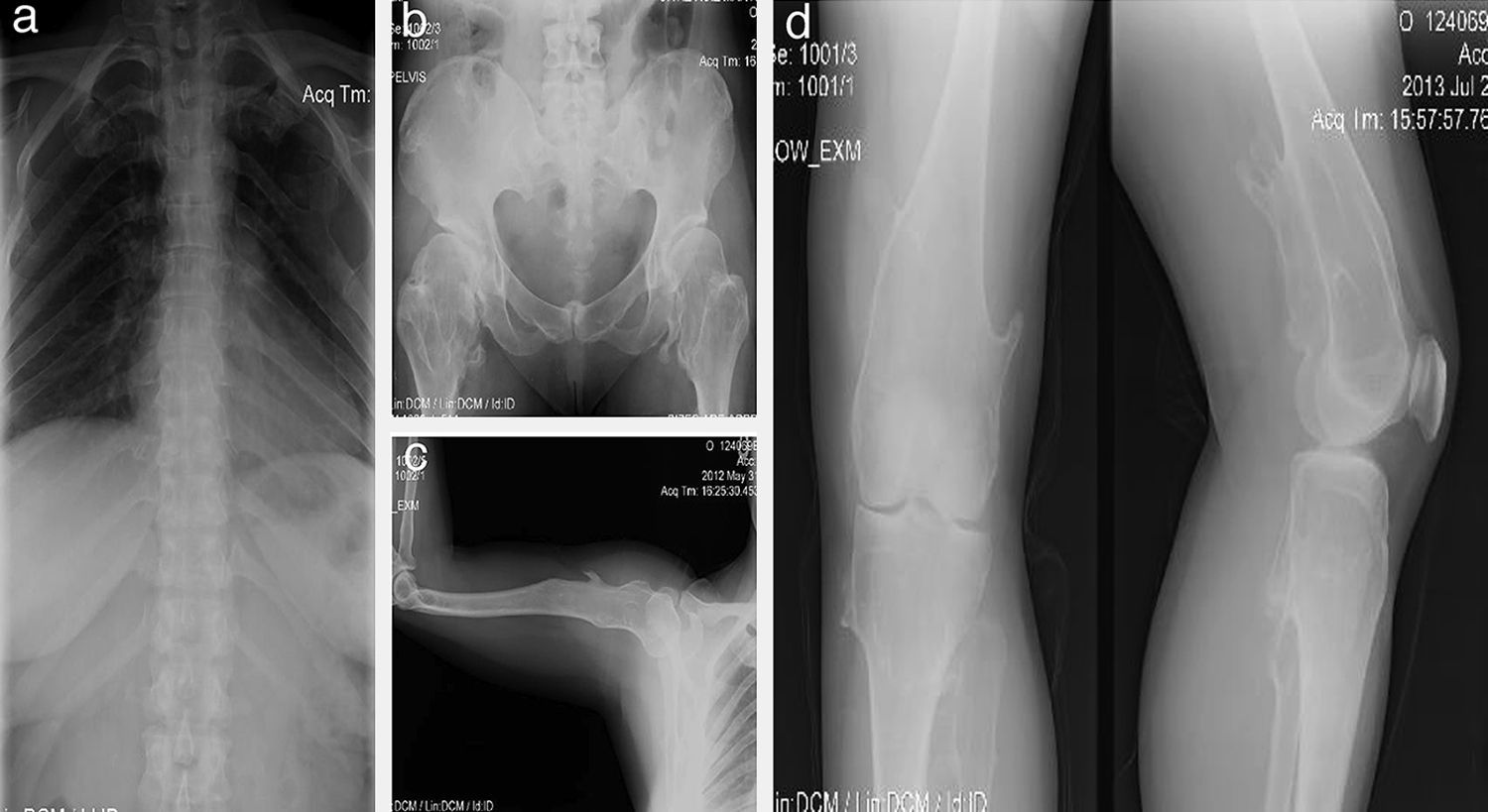
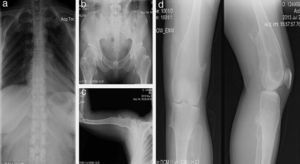
Paciente de sexo femenino, de 40 años de edad; desde que nació los padres percibieron muchos chasquidos articulares al cargarla, sin dolor aparente. A los 3 años de edad se detectó protuberancia incapacitante en rodilla izquierda que le producía dolor al caminar, por lo que requirió cirugía. A los 16 años desarrolló una deformidad en los tobillos (región maleolar externa de 4×4×3cm y región de tibia) que le producía dolor, por lo que ameritó cirugía correctiva. A los 20 años presentó engrosamiento y deformidad de las muñecas, que llegó a medir 4×5×2cm. Al final de su crecimiento óseo se determinó que la longitud del brazo derecho era 2cm mayor que la del izquierdo (fig. 2).
Caso 1 (II2). Paciente femenino de 40 años (madre) que presenta excrecencias óseas (exostosis) con manifestaciones en la unión esterno-costal de las primeras costillas y la parte superior del arco costal posterior (a), protuberancias óseas en cuellos femorales y región intertrocantérica con deformidad ósea (b), exostosis en región proximal de húmero (c) y tercio distal de fémur bilateral en región postero-medial y en borde postero-externo de tibia izquierda (d).
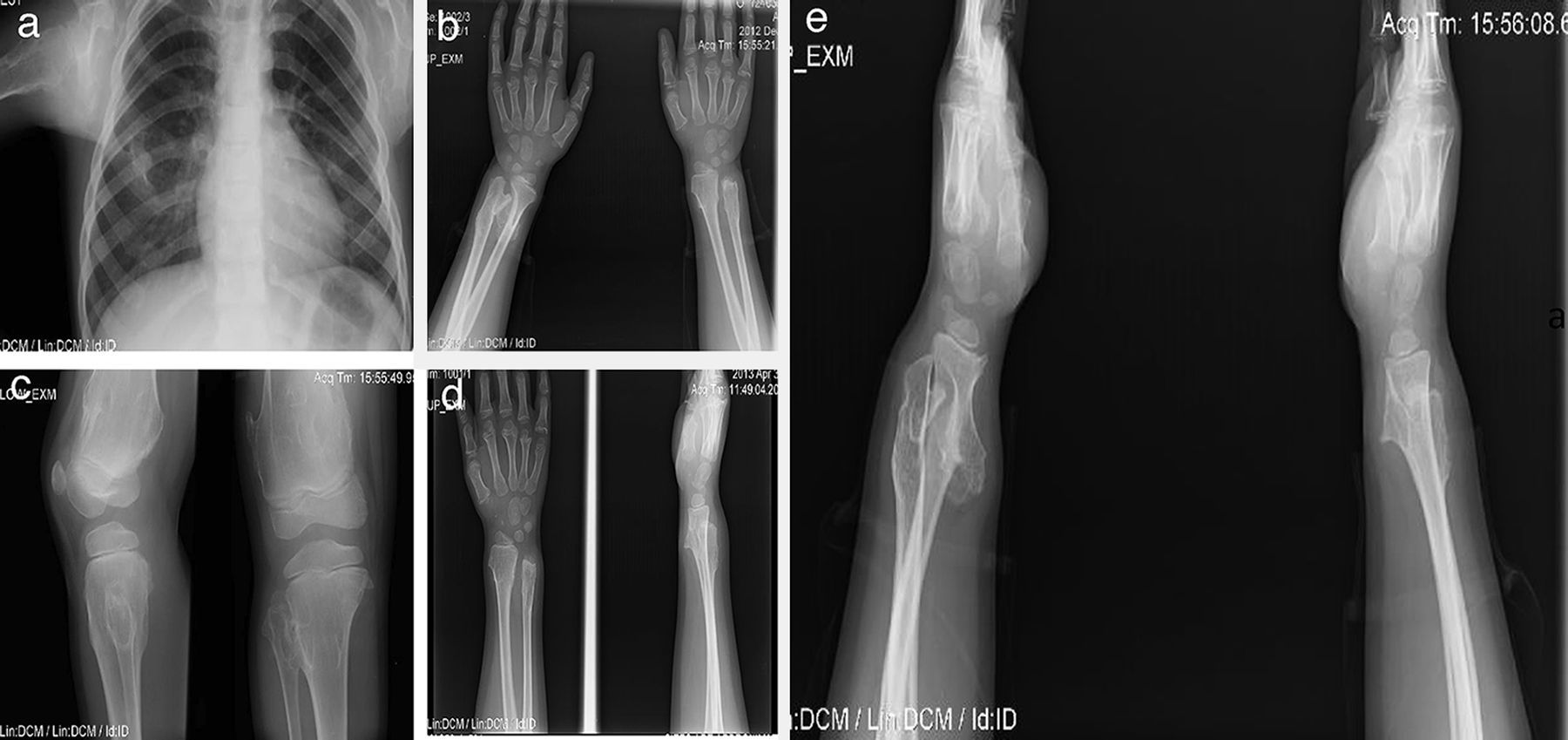
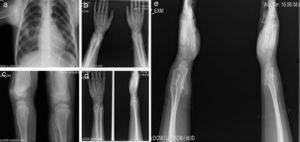
Paciente de sexo masculino de 12 años con antecedentes de hipotiroidismo subclínico que no requirió tratamiento en el primer año de vida. Los osteocondromas se manifestaron desde los 2 años como una deformidad en el tobillo sin fracturas. Posteriormente han aparecido nuevas lesiones en hombro, tibia, muñeca y fémur. Presentó limitaciones en el arco de movimiento articular en muñeca y hombro y dolor ocasional en la movilización de las mismas articulaciones. Su crecimiento ha sido satisfactorio, con estatura en el P50 y sin acortamiento de miembros inferiores (fig. 3).
Caso 2 (III1). Paciente masculino de 12 años con exostosis en cuello y tercio proximal de húmero, quinto arco costal anterior derecho (a), en región anterolateral de ambos cúbitos, lo que sugiere una deformidad tipo III de la clasificación de Masada (b), tercio distal de fémur con ensanchamiento metadiafisiario (c), y protuberancias en región anterolateral de tibia y cúbito derechos, las cuales aumentaron de tamaño al año siguiente con mayor volumen de las lesiones de ambos cúbitos, principalmente el derecho (d, e).
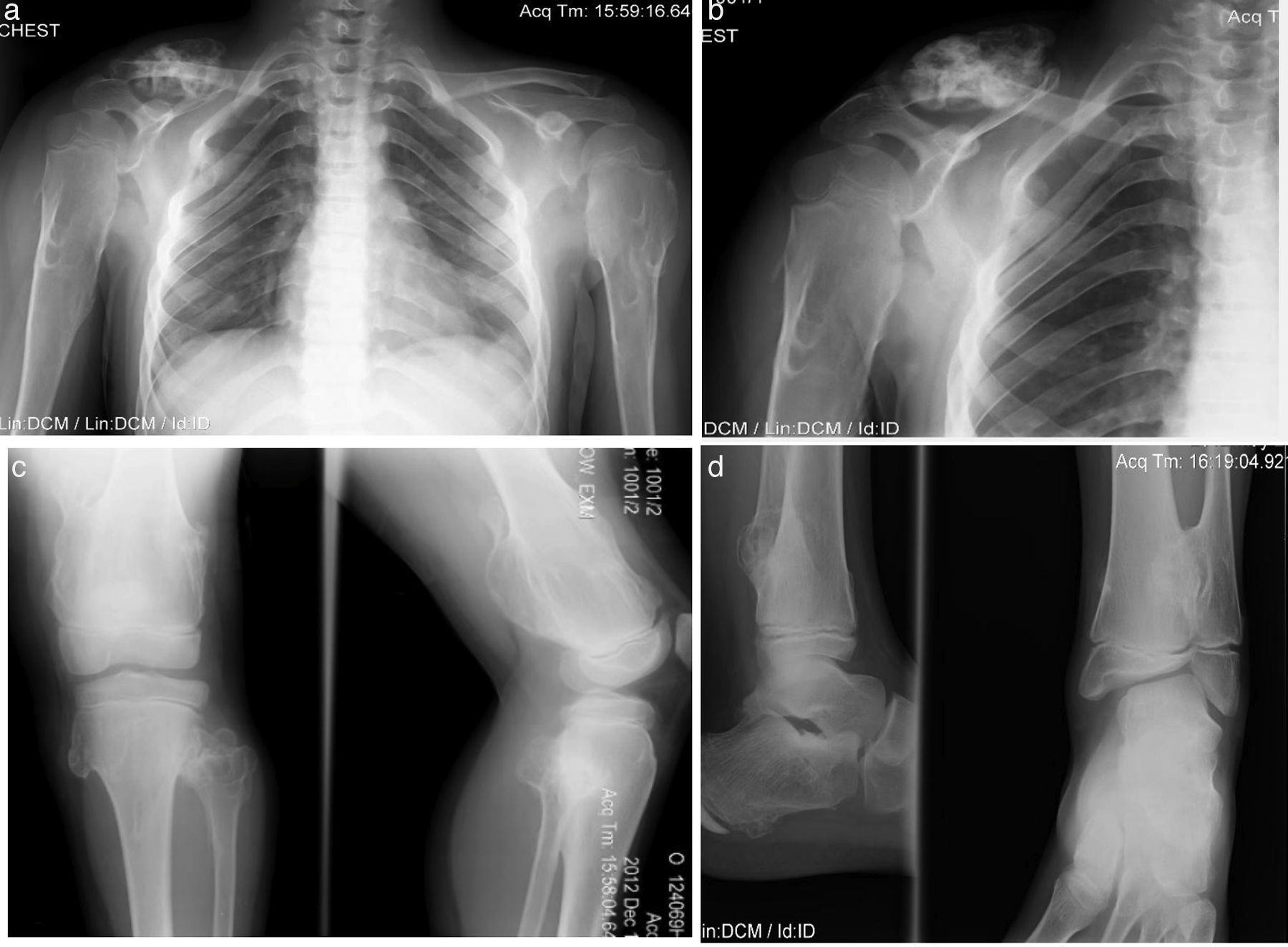
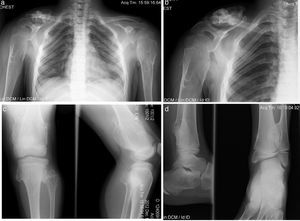
Paciente de sexo masculino de 8 años de edad con diagnóstico de hipotiroidismo subclínico desde los 8 meses hasta los 2.5 años, que se pudo normalizar. Se estableció el diagnóstico de OMH a los 2 años de edad, con lesiones en húmeros y muñecas. Su crecimiento ha sido satisfactorio, sin acortamiento de miembros inferiores, con peso y talla en el P50. Solo ha presentado disminución del arco de movimiento en muñecas y hombros y dolor ocasional en algunos movimientos articulares (fig. 4).
Caso 3 (III2). Paciente masculino de 8 años que presenta lesiones osteocartilaginosas con patrón heterogéneo de predominio radiolúcido en región clavicular derecha (a), exostosis en submetafisiarias en región proximal de húmero derecho (b), tercio distal de fémures (c), porciones proximal y distal de tibia y peroné (c, d). Hay deformidad con ensanchamiento medular en húmeros y fémures, principalmente. Las regiones fisiarias no están comprometidas.
En los pacientes se identificaron lesiones óseas múltiples, con osteocondromas en metáfisis y epífisis de huesos largos, cortos y planos, de diversos tamaños y formas, habitualmente con una imagen sésil de base amplia de implantación, con cortical superpuesta y unida a la cortical ósea y un capuchón o formación de “cabeza de hongo” (IV-V) (figs. 2–4).
3DiscusiónLa pérdida de los dos alelos del gen EXT1 se ha relacionado con osteocondroma, sugiriendo un mecanismo ausencia de supresión tumoral8,16. Otros genes de la familia de los EXT que se han asociado con la OMH son los genes similares al EXT (EXTL1, EXTL2 y EXTL3), los cuales se consideran homólogos con los genes EXT1 y EXT2. El sulfato de heparán es una de las proteínas que se ve alterada por la falta de procesamiento. En un estudio de 36 familias chinas se encontró que predominaron las mutaciones en EXT2 (33%), y en segundo lugar las de EXT1 (14%). Los tipos de mutaciones predominantes fueron los cambios de pauta de lectura y las mutaciones sin sentido (80%). Estas mutaciones pudieran estar produciendo codones de terminación prematuros, y por lo tanto proteínas incompletas no funcionales. Este estudio muestra que el patrón de mutaciones puede variar entre las poblaciones17. De acuerdo con Wuyts y colaboradores, la penetrancia es del 96% en mujeres y del 100% en hombres1. La persona afectada tiene el 50% de probabilidad de transmitir el rasgo de la entidad a su descendencia.
En el diagnóstico diferencial de los síndromes derivados de la mutación de genes EXT se puede encontrar el síndrome de Langer-Giedion, donde las exostosis se combinan con retraso mental, anomalías de cráneo y extremidades distales. En el síndrome de Potocki-Shaffer se presentan alteraciones craneofaciales, retraso mental y exostosis en epífisis que afectan un solo lado del cuerpo18. En la displasia epifisaria hemimélica se presentan lesiones cartilaginosas hacia las epífisis en forma unilateral hemimélica, produciendo crecimiento focal de las porciones media y lateral de la epífisis. Afecta con más frecuencia al tarso y al carpo, y a extremidades inferiores19. En el osteosarcoma, la lesiones son generalmente en las metáfisis de los huesos largos y rodillas; en la radiografías se observa la destrucción ósea en las secciones cortical y medular, con bordes mal definidos e invasión de tejidos blandos20.
Una de las complicaciones más graves es la transformación maligna (condrosarcoma). Sin embargo, no se han determinado las pautas que se deben seguir para realizar el tamiz1. Los datos de alarma para identificar la malignización son crecimiento del tumor con irregularidad de los márgenes, presencia de una masa de tejido laxo acompañante, presencia de dolor, erosión del hueso y calcificación irregular y dispersa2. Los datos radiológicos de alarma de estas lesiones incluyen lesiones radiolúcidas con calcificaciones nodulares de forma circular o de anillos21. En las fases más avanzadas se pudieran encontrar erosiones en el córtex del endotelio. Ninguno de los casos estudiados ha mostrado cambios que hagan sospechar de la malignización de las lesiones.
El tratamiento que en la actualidad ha demostrado efectividad y mejores resultados es la cirugía. Esta se reserva para los afectados que presentan síntomas y/o deformidades causadas por los osteocondromas. Los procedimientos que se llevan a cabo incluyen la escisión tumoral, osteotomías correctivas, procedimientos para alinear o aumentar de tamaño los huesos, la epifisiodesis y hemiepifisiodesis21–24. De los tres miembros de la familia descritos, el caso II2 fue el único que ha requerido múltiples cirugías paliativas por dolor o funcionalidad (conservación del arco de movimiento de la extremidad).
La OMH se hereda de manera autosómica dominante y es genéticamente heterogénea. En alrededor del 90% de los pacientes afectados se han encontrado mutaciones de línea germinal de los genes supresores de tumores EXT1 o EXT2. El diagnóstico se establece clínica y radiológicamente. Se ofreció asesoramiento genético a la familia con el fin de informar sobre el riesgo de recurrencia y sobre las implicaciones clínicas de este padecimiento, con el fin de brindarles un seguimiento oportuno y adecuado.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.