El aumento de la presión intraabdominal es un problema clínico frecuente en pacientes críticos, en pacientes sometidos a cirugía abdominal, y especialmente tras la cirugía de un aneurisma de aorta abdominal roto. El aumento mantenido de la presión intraabdominal puede conllevar un fallo orgánico por hipoperfusión, cumpliendo criterios de síndrome compartimental abdominal.
Es de vital importancia su identificación por la elevada morbimortalidad que asocia. Tras la cirugía de un aneurisma de aorta abdominal roto se recomienda la monitorización de la presión intraabdominal cada 4 h para conseguir un diagnóstico precoz.
Un manejo médico intensivo puede reducir la incidencia de síndrome compartimental abdominal. Cuando este se establece, el tratamiento de elección es la laparotomía descompresiva. Un correcto manejo posterior del abdomen abierto, mediante terapias de cierre abdominal temporal es crucial para mejorar el pronóstico en estos pacientes.
The increase in intra-abdominal pressure is a common problem in critically ill patients, as well as patients subjected to abdominal surgery, and particularly after surgery of an abdominal aortic aneurysm rupture. The persistent increase in intra-abdominal pressure can lead to organ failure due to hypoperfusion, thus fulfilling the criteria of abdominal compartment syndrome.
Its identification is of vital importance, due to its associated morbidity and mortality. It is recommended to monitor the intra-abdominal pressure every 4hours after surgery of an abdominal aortic aneurysm rupture, in order to make an early diagnosis.
Intensive medical management can reduce the incidence of abdominal compartment syndrome. When this diagnosis is established, the treatment of choice is decompression laparotomy. The correct management after open abdomen is crucial in order to improve the prognosis of these patients.
El síndrome compartimental abdominal (SCA) es una entidad clínica que consiste en un aumento de la presión de la cavidad intraabdominal a consecuencia frecuentemente de maniobras de resucitación agresivas y en pacientes con sangrados mayores intraabdominales. Se asocia a una hipoperfusión de las estructuras y órganos intraabdominales lo que puede desencadenar un fallo multiorgánico y la muerte. En nuestra especialidad, es especialmente frecuente tras la rotura de un aneurisma de aorta abdominal, ya sea tratado con cirugía abierta convencional o mediante técnicas endovasculares.
FisiopatologíaLa asociación entre la hipertensión intraabdominal (HIA) y el SCA con la aparición de isquemia mesentérica y/o fallo renal ha sido demostrada en muchos estudios. La rápida resolución de esta situación de hipoperfusión de los órganos intraabdominales juega un papel importante en la supervivencia de los pacientes1,2.
El conocimiento de la importancia de la HIA y SCA en la fisiopatología de complicaciones postoperatorias tras cirugía vascular ha aumentado en los últimos tiempos.
Desde el siglo XIX se empiezan a conocer las alteraciones que produce en los pacientes graves un aumento de la presión intraabdominal (PIA).
Wendt en 1913 fue el primero en designar un nombre para esta entidad «síndrome de hipertensión intraabdominal»3.
En 2004 se crea la sociedad mundial multidisciplinaria del síndrome compartimental abdominal («World Society of the Abdominal Compartment Syndrome»; www.wsacs.org) quienes publicaron en 2006 un consenso de definiciones y una guía de práctica clínica en 2007. Dichas guías fueron actualizadas en 2012-2013 tras la realización de estudios basados en la evidencia4–6.
Tras estudios en pacientes críticos en unidades de cuidados intensivos, las guías actualizadas describen que «la PIA normal en pacientes críticos adultos es aproximadamente 5-7mmHg».
La HIA se define como «una PIA>12mmHg mantenida o prolongada en el tiempo», siendo importante en esta definición la palabra «mantenida», pues no sería suficiente un único valor elevado para definir esta situación. La definición del SCA utilizaba previamente el concepto de presión de perfusión abdominal (PPA) que es la presión arterial media menos la PIA, siendo patológica una PPA<60mmHg.
Definición actualizadaTras la última actualización del consenso sobre HIA y SCA, se define el SCA como «una PIA>20mmHg mantenida o prolongada en el tiempo, con o sin un PPA<60mmHg, y que se asocie a una disfunción/fallo orgánico de nueva aparición».
Se introduce nuevamente en esta definición la palabra «mantenida» y además incluye la necesidad de «disfunción/fallo orgánico» que es necesario constatar para definir esta situación.
Medición de la presión intraabdominalExisten diferentes métodos para la medición de la PIA. En la actualidad rara vez se mide la PIA de forma predeterminada en todos los pacientes que ingresan en una unidad de cuidados intensivos. Sin embargo, la HIA/SCA en pacientes graves es frecuente, por lo que estudios recientes sugieren que debería convertirse en una medida de monitorización habitual7.
La exploración física es insuficiente para detectar la elevación de la PIA, con sensibilidades reportadas del 40-60%8. El diagnóstico de HIA/SCA depende por tanto necesariamente de la medida de la PIA.
El método de medida de la PIA debe ser exacto y reproducible. El catéter intraperitoneal sería conceptualmente ideal, pero existen gran variedad de alternativas mucho menos invasivas y con menores complicaciones. Estas incluyen la medida de la PIA de manera intravesical, intragástrica, vía rectal e intrauterina. En la actualidad el más utilizado es el método intravesical9.
Las mediciones intermitentes pueden ser poco eficaces para detectar un síndrome compartimental abdominal agudo donde los cambios en la presión intraabdominal pueden ocurrir en un periodo de tiempo corto, por lo que es conveniente la medición continua de la presión intraabdominal9.
Además de la técnica, se deben seguir diferentes principios para hacer la medida reproducible. La PIA debe expresarse en «mmHg» (1mmHg=1,36 cmH2O) y debe medirse al final de la espiración y en ausencia de contracción de la musculatura abdominal. El paciente debe estar en decúbito supino completo, sin inclinación del cabecero, y con el punto cero de la regla de medición en la línea media-axilar y a la altura de la cresta ilíaca10.
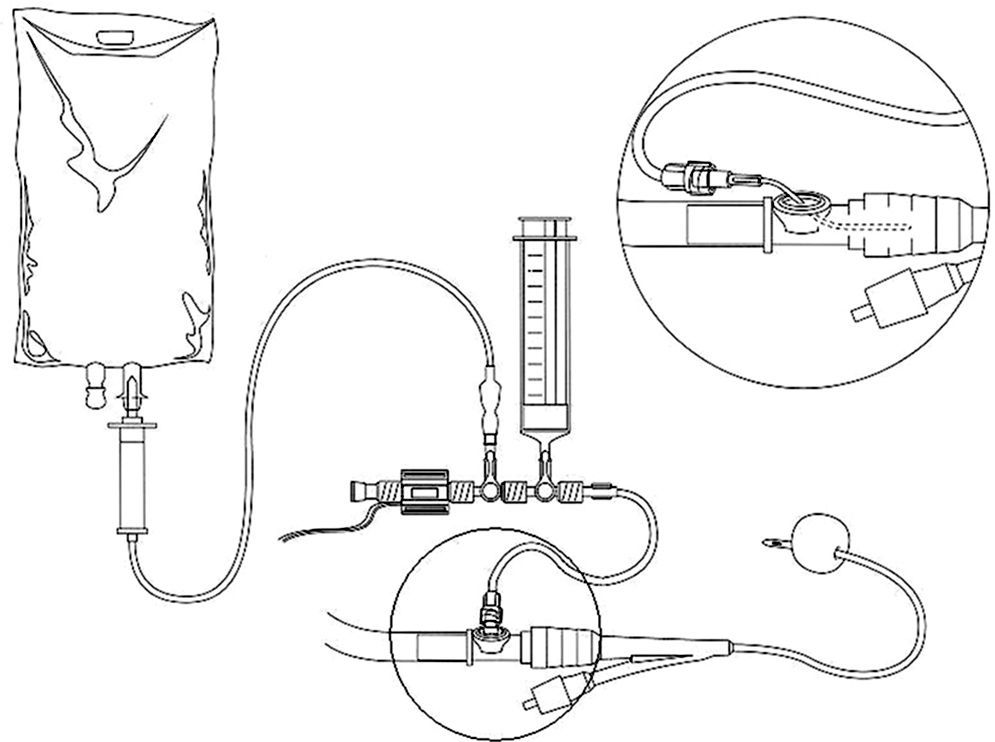
El método intravesical de medida consiste en colocar una sonda tipo Foley en la vejiga. Esta debe encontrarse completamente evacuada. A través de una llave de 3 vías; una rama de esta se conecta al sistema de drenaje urinario y la otra al sistema de medición de presión ubicada en la porción distal de la sonda vesical estéril (Foley), se infunden 100ml de suero salino fisiológico al 0,9% (60-150ml). Seguidamente se varía la posición de la llave y se deja pasar la solución necesaria para que el tramo de la escala quede libre de burbujas de aire. Una vez logrado lo anterior, la sonda vesical se comunica con la escala de medición y el menisco de agua-orina comienza a descender hasta alcanzar el valor de la presión intraabdominal (fig. 1).
Factores de riesgoLa HIA aparece en aproximadamente 20-40% de los pacientes que ingresan en unidades de cuidados intensivos y en hasta un 50% de los pacientes intervenidos por aneurisma de aorta abdominal roto (AAAr).
Son muchos los factores de riesgo que han sido demostrados como independientes para el desarrollo de HIA/SCA. Los principales factores de riesgo que pueden predisponer a su desarrollo en paciente intervenidos de un AAA o AAAr son:11
- -
Cirugía abdominal abierta y cierre primario.
- -
Hemoperitoneo o hematoma retroperitoneal no drenado (frecuente tras la reparación endovascular de un AAAr).
- -
Insuficiencia respiratoria aguda, especialmente con presión intratorácica elevada (ventilación mecánica, uso de PEEP, etc.).
- -
Obesidad (índice de masa corporal >30).
- -
Resucitación masiva con fluidos (> 5 litros/24 h).
- -
Politransfusión (> 10 unidades de concentrados de hematíes/24 h).
- -
Acidosis (pH<7,2).
- -
Coagulopatía (recuento plaquetario<55.000/mm3, TP>15 segundos o<50%, APTT>2 veces por encima de valores normales o INR>1,5).
La aparición de HIA/SCA va a depender por tanto de varios factores. El AAAr por sí solo supone un elevado riesgo de desarrollar HIA/SCA ya que se combinan el sangrado retroperitoneal, el edema intestinal secundario a la evisceración quirúrgica, en el caso del abordaje transperitoneal, y el shock hipovolémico y la consiguiente politransfusión.
La administración de cristaloides durante las maniobras de reanimación se ha demostrado como un factor de riesgo independiente en traumatismos abdominales. En la cirugía aórtica esto no ha sido demostrado, aunque hay razones para creer que este hecho pueda tener importancia en cualquier paciente con un sangrado intraabdominal y que en estos casos una hipotensión permisiva reduzca el riesgo de HIA/SCA12.
Se ha demostrado que los pacientes que reciben menos de una unidad de plasma por cada dos concentrados de hematíes durante la reparación de un AAAr tienen cuatro veces mayor mortalidad que los que reciben más plasma. Esto pone de manifiesto la importancia de protocolos de trasfusión masiva13.
El SCA es una complicación frecuente tras la reparación de AAAr y puede ocurrir tanto tras la reparación abierta como tras la reparación endovascular. La aparición de una PIA>20mmHg ocurre en aproximadamente el 50% de los pacientes tratados mediante cirugía abierta y de estos, aproximadamente el 20% desarrollan disfunción o fallo orgánico, cumpliendo criterios de SCA14. Los pacientes tratados mediante técnicas endovasculares suelen ser con frecuencia pacientes más estables y quizás en relación con esto y a que no se manipulan las vísceras, presentan sangrados menores y por tanto tienen menor riesgo de desarrollar SCA7. Sin embargo, se ha visto que en centros donde se tratan la mayoría de los AAAr de manera endovascular, la incidencia de SCA se acerca al de la reparación abierta. No hay estudios aleatorizados, pero hay publicaciones que asocian este hecho a la hemorragia mantenida a través de arterias lumbares y/o de la arteria mesentérica inferior hacia el saco aneurismático. Se recomienda la ligadura abierta de estos vasos cuando se instaura un SCA tras EVAR en AAAr14.
Tratamiento y prevenciónDada la elevada frecuencia y las graves complicaciones secundarias al SCA, todos los médicos involucrados en el tratamiento y seguimiento de pacientes intervenidos de AAAr deberían ser conscientes de los factores de riesgo que predisponen a la HIA y al SCA, de la presentación clínica, de las mejores medidas para un diagnóstico precoz y del manejo de esta situación.
La identificación de las situaciones de riesgo para desarrollar un SCA son de vital importancia para evitar, mediante una intervención precoz, un desenlace fatal hacia el fallo multiorgánico y la muerte del paciente.
Las pruebas de imagen rutinarias, como la tomografía axial computerizada no son imprescindibles, ya que los hallazgos son la mayoría de las veces subjetivos y no diagnósticos de HIA/SCA15.
Las medidas de prevención y de tratamiento de la HIA/SCA recomendadas en el documento de consenso actual tienen bajo grado de evidencia (1C-1D), ya que se basan en estudios de cohortes, sin grupos de control para comparar y existen pocos estudios aleatorizados y bien diseñados5.
El documento de consenso «no puede recomendar la profilaxis del HIA/SCA mediante el uso del abdomen abierto». Recomiendan «el cierre primario y la monitorización de la PIA en todos los pacientes críticos con algún factor de riesgo conocido», así como «el uso de protocolos de monitorización y de manejo de la PIA frente a no hacerlo» con un grado de evidencia 1C5.
Únicamente se debe mantener un abdomen abierto tras una cirugía abdominal cuando el abdomen está tenso y con dificultad para cerrarlo.
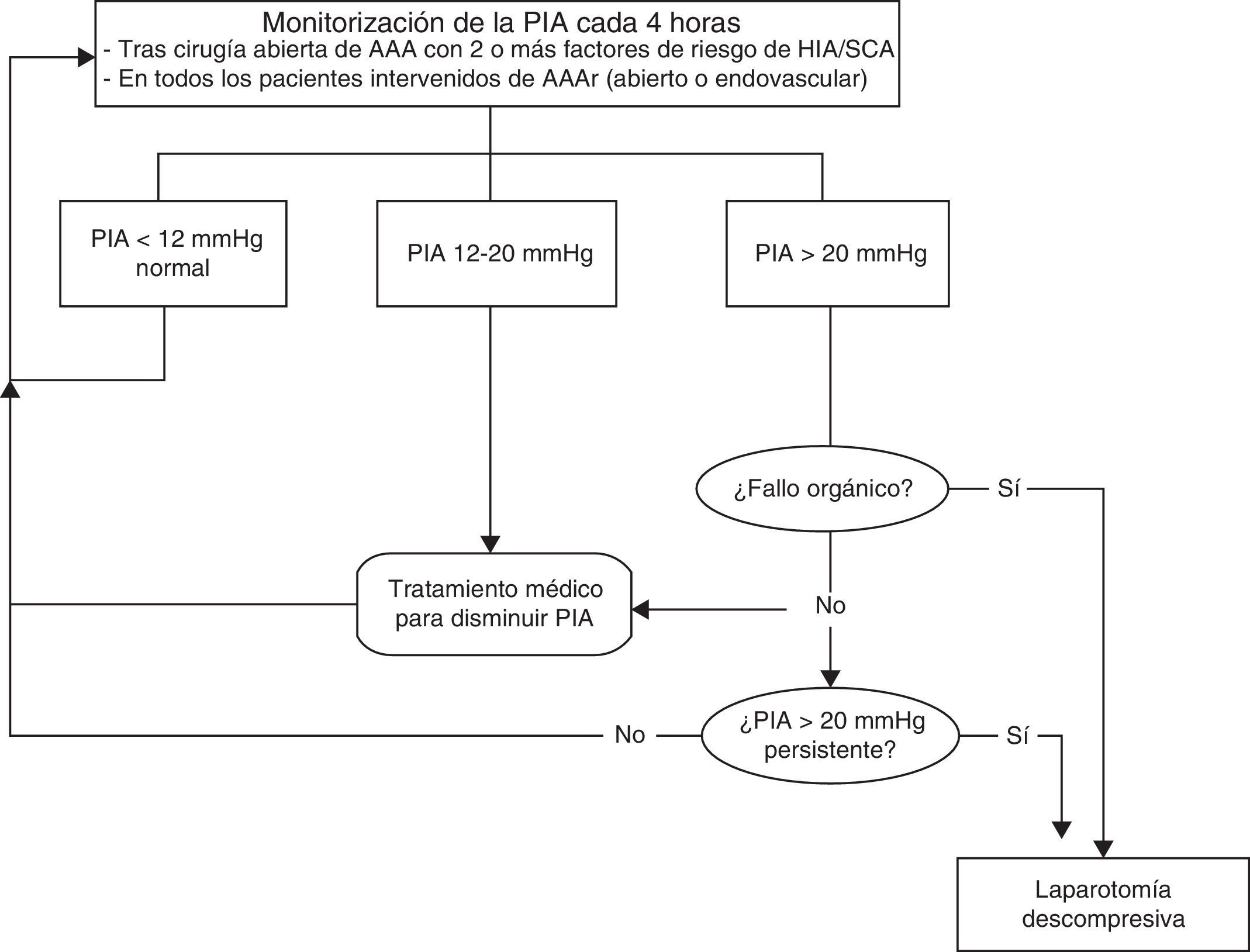
Se recomienda la monitorización inicial de la PIA en pacientes críticos que ingresan en unidades de cuidados intensivos siempre que se cumplan 2 o más factores de riesgo para el desarrollo de HIA/SCA. La monitorización de la PIA es una práctica costo-efectiva y segura. En pacientes intervenidos de AAAr (abierto o endovascular) se recomienda la monitorización de la PIA cada 4 h en todos los casos. Un buen método para la medida y de fácil uso es la medición intravesical con sonda Foley16.
El manejo de un aumento inicial de la PIA debe ser conservador y posteriormente, si es necesario por persistencia de PIA elevadas o fallo orgánico, se indica la descompresión abdominal.
Existen varias escalas que correlacionan la PIA y la aparición de sintomatología, y que determinan a partir de la cual estaría indicada la descompresión abdominal. Actualmente, según la World Society of the Abdominal Compartment Syndrome, se recomienda la descompresión abdominal ante PIA superiores a 20mmHg y clínica compatible con SCA e iniciar el tratamiento médico para reducir la PIA desde cifras superiores a 12mmHg (fig. 2).
El tratamiento conservador inicial se basa en medidas quirúrgicas que deben actuar a diferentes niveles: - diminuir el contenido intraluminal: el íleo paralítico es frecuente en pacientes graves y tras una cirugía abdominal. El aumento del contenido intraluminal puede producir el aumenta de la PIA. Diversas medidas terapéuticas pueden ayudar a reducir la PIA en este caso, como la corrección de alteraciones electrolíticas, la colocación de sonda nasogástrica o rectal, la administración de enemas y/o el uso de fármacos gastrocinéticos11. - Mejorar la compliance de la pared abdominal: el dolor y la agitación aumentan el tono muscular de la pared abdominal y elevan la PIA, por lo que una adecuada sedoanalgesia es fundamental. Se pueden utilizar relajantes musculares17. La posición corporal puede modificar la PIA; se recomienda el decúbito supino con la cabecera a menos de 20°, evitando el decúbito prono. - Optimizar la administración de fluidos. La administración masiva de fluidos es uno de los principales factores de riesgo asociados al desarrollo de HIA/SCA. Se debe intentar conseguir un balance negativo de fluidos y considerar la administración de coloides o sueros salinos hipertónicos. Se pueden administrar fármacos diuréticos si el paciente está hemodinámicamente estable18.
La respuesta a las medidas no quirúrgicas se refleja al conseguir mantener una PIA<15mmHg. El fracaso de estas medidas, con una PIA>20mmHg persistente (con o sin PPA<60mmHg) y una nueva disfunción/fracaso de órganos, obliga a considerar la descompresión quirúrgica abdominal inmediata.
La descompresión abdominal se realiza mediante la laparotomía e instauración de un abdomen abierto. Una vez se ha decidido la laparotomía descompresiva se debe evitar la hipovolemia, ya que puede derivar en hipotensión severa durante la intervención quirúrgica de abertura del abdomen y esto provocar una mayor hipoperfusión de la pared intestinal.
Tras la laparotomía descompresiva es importante el manejo del abdomen abierto (AA).
El manejo del AA tiene como objetivos principales la prevención de la formación de adherencias entre los intestinos y con la pared abdominal y la prevención de la «lateralización de la pared abdominal».
El AA ofrece diversos beneficios, pero también se asocia a alta morbilidad (fístula enteroatmosférica) y mortalidad (sepsis abdominal)19.
Después del cierre abdominal temporal, la primera meta es el cierre primario de la fascia de forma retardada.
Un método que cumple los objetivos del manejo del AA es el cierre de la herida con terapia de presión negativa (VAC) y tracción de la fascia con malla. Esta técnica, descrita por primera vez en 2007, combina la colocación de un plástico que separa los intestinos de la pared abdominal, con succión para drenaje, con el fin de prevenir adherencias, y la colocación de una malla de Prolene que se sutura a la fascia para prevenir la lateralización de la pared20.
Múltiples estudios prospectivos han observado que esta técnica permite un cierre primario retardado de la pared abdominal en aproximadamente el 90% de los pacientes que sobreviven al AA, y con una mediana de 15 días tras la cirugía inicial21. Otras opciones asociadas a la terapia VAC y utilizadas para prevenir la lateralización de la pared abdominal son las suturas para la retención de la fascia o el uso de parches de Velcro no permeable «parche de Wittmann»22, cuyos resultados parecen ser algo inferiores respecto al uso de mallas de Prolene.
ConclusiónLa HIA y el SCA son un problema clínico importante y frecuente tras la cirugía del AAAr, ya sea abierta o endovascular, y que deben tenerse en cuenta con la finalidad de aumentar la supervivencia.
La monitorización de la PIA es el método de elección para el diagnóstico y seguimiento de pacientes con riesgo de SCA.
El manejo inicial del SCA debe incluir un manejo médico intensivo. En caso de fallo orgánico o persistencia de PIA elevadas, el tratamiento quirúrgico se basa en la laparotomía descompresiva.
Un correcto manejo del abdomen abierto es fundamental para conseguir disminuir la morbimortalidad asociada a esta situación. El cierre de la herida con terapia de presión negativa (VAC) y tracción de la fascia con malla ha demostrado buenos resultados.
Las guías de consenso se basan en estudios pequeños y unicéntricos por lo que el grado de evidencia de las recomendaciones es bajo. Se necesitan más estudios multicéntricos para conseguir mayor evidencia. Se deben realizar más estudios específicos en pacientes sometidos a cirugía vascular y con cohortes más grandes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.