El asma bronquial es una de las enfermedades de mayor prevalencia en todo el mundo. Se trata de una enfermedad multifactorial en la que interaccionan factores hereditarios y ambientales, con un patrón hereditario complejo. Se han ligado diferentes cromosomas o regiones cromosomales al adecimiento de asma: 5q23 ligado a la producción de IgE total, niveles de eosinófilos, IL-4, IL-5, IL-13; CD14 receptor de endotoxina; complejo mayor de histocompatibilidad; el 11q13 cadena pesada del receptor de IgE de alta afinidad; 12q para asma; 13q para atopia y asma; y ADAM33 que codifica una metaloproteasa asociada con asma1,2. Además se conocen genes de respuesta ala tratamiento farmacológico del asma, son los llamados farmacogenes, que hacen aún más extenso el polimorfismo de los genes ligados a esta enfermedad3-5.
Diferentes factores desencadenantes alérgicos y no alérgicos interactúan y dan lugar a la aparición de inflamación crónica de las vías aéreas que cursa con episodios recurrentes de dificultad respiratoria con tos y sibilantes torácicos asociados con obstrucción al flujo aéreo, que es a menudo reversible espontáneamente o con tratamiento.
Una característica del asma, aunque no exclusiva de esta enfermedad, es la hiperreactividad de la vía aérea a una variedad de sustancias inhaladas, aire frío, irritantes, hiperventilación o ejercicio6. Contribuyen a esta respuesta el polimorfismo genético, la inflamación de la vía aérea, y el ritmo circadiano. La exposición a alergenos, cursa con una respuesta inflamatoria alérgica inmediata que con frecuencia se acompaña de una respuesta tardía. Esta respuesta inflamatoria da lugar a un aumento de la HBI, que en ocasiones puede ser transitoria como sucede con la exposición estacional a pólenes, volviendo a la normalidad semanas después de cesar la exposición al alergeno. Sin embargo, la exposición continuada a diferentes pólenes o a alergenos perennes que sensibilizan al individuo pueden mantener una inflamación crónica con alteraciones persistentes de la HBI.
La inflamación de la vía aérea puede comenzar durante la infancia y cuando se cronifica lleva a un remodelación de la pared bronquial que hace irreversible la obstrucción empeorando el pronóstico de la enfermedad7,8. Las características típicas de la inflamación alérgica son la activación de mastocitos y basófilos dependiente de IgE y la eosinofilia tisular. Todo ello es consecuencia de una determinada respuesta inmunológica de los individuos atópicos con un predominio de la respuesta mediada por linfocitos T CD4 + del subgrupo Th2. Estas células Th2 tienen un patrón de producción de citocinas fundamentalmente I-L4, IL-5 e IL-13, frente a la producción caracteristica de IFN-γ e IL-2 por parte de la subpoblación de linfocitos T CD4 + Th1.
Se ha demostrado que la existencia de factores de riesgo (características personales y ambientales) es determinante en la aparición de asma. La atopia (definida como la predisposición genética para el desarrollo de una respuesta IgE para alergenos comunes) es junto con los antecedentes familiares de asma, el factor de riesgo de predisposición más importante para su desarrollo1. La exposición a alergenos ambientales es imprescindible, primero para el desarrollo de sensibilización en individuos atópicos y, después como precipitante de la reacción alérgica en la vía aérea dando lugar a la aparición de los síntomas de asma. La formación de anticuerpos IgE específicos de aeroalergenos (p. ej., ácaros, hongos, pólenes, epitelios de animales) normalmente no aparece hasta los dos o tres años de vida. A partir de esta edad, el asma inducida por aeroalergenos va aumentando su prevalencia hasta alcanzar su pico máximo en la segunda década de la vida9,10. El desarrollo de asma en un individuo atópico con IgE específica frente a un aeroalergeno determinado, está condicionado por la existencia de factores individuales de origen genético por una parte y factores ambientales por otra, entre ellos la exposición a niveles suficientes del alergeno, imprescindibles para el desarrollo de la reacción alérgica a nivel bronquial. La unión de IgE específica que se encuentra en la membrana de los mastocitos de la mucosa bronquial al unirse al alergeno provoca la liberación de sus mediadores con el desarrollo de una respuesta inflamatoria que da lugar a edema de la mucosa y contracción del músculo liso bronquial con aumento de secreciones bronquiales, tos, dificultad respiratoria y sibilantes torácicos.
En pacientes con asma, particularmente en niños, las infecciones virales de las vías respiratorias altas juegan un papel importante en las exacerbaciones. Esto parece estar relacionado, al menos en parte, con la interacción entre sensibilización alérgica, exposición a alergenos e infección viral, actuando como cofactores en la inducción de episodios agudos de asma11,12.
La inmunoterapia específica con alergenos consiste en la administración de extractos alergénicos para modificar la respuesta inmunológica a ellos y así disminuir o abolir los síntomas asociados a su exposición. El tratamiento es específico, con y para los alergenos responsables de los síntomas. La inmunoterapia específica fue introducida por Leonard Noon en 1911 para el tratamiento de la fiebre del heno. La mayoría de los principios básicos descritos por Noon y Freedman en 1911 siguen hoy en día siendo válidos13,14.
MECANISMO DE ACCION DE LA INMUNOTERAPIA
La inmunoterapia específica actúa modificando la respuesta inmunológica del individuo a un determinado alergeno. Produce un aumento en la subpoblación de linfocitos T CD4 + Th1 específicos con aumento de la transcripción de INF-γ después de la exposición al alergeno y sin cambios en el número de células que expresan mRNA para IL-4 e IL-5. Estudios de la respuesta tardía inducida por alergenos en la piel y la mucosa de la nariz indican que la inmunoterapia produce un descenso en el reclutamiento de células CD4 + y una reducción en la eosinofilia local. Además el estudio de estas biopsias sugiere que esta respuesta puede estar amplificada y mantenida por la producción de IL-12 un potente inductor de la respuesta Th1. Este aumento de células Th1 se correlaciona con una mejoría de los síntomas y una disminución de los requerimientos de medicación coincidiendo con la exposición al alergeno15-17. Este aumento en células Th1 podría estar producido también por la generación de células T CD8 + específicas de alergeno que se ha observado en los tejidos después de inmunoterapia18. En inmunoterapia con pólenes de gramíneas y también con ácaros se ha observado un descenso en la producción de IL-419.
No se conoce el mecanismo exacto que produce estos cambios, pero parece que la naturaleza del alergeno la dosis y la célula presentadora de antígeno son factores determinantes. Bajas dosis de alergeno presentadas por células B o células dendríticas favorecen una respuesta Th2. Sin embargo, dosis altas presentadas por macrófagos favorecen una respuesta Th120. La modificación del alergeno y el uso de adyuvantes también puede ser importante en el tipo de respuesta obtenida.
Estos cambios en la respuesta inmunológica dan lugar a variaciones en los niveles de IgE e IgG específica con variaciones en la liberación de histamina de los basófilos y descenso en la sensibilidad del órgano diana, que pueden estar relacionados con variaciones en el factor liberador de histamina o aparición de diferentes isoformas de IgE con distintas propiedades fisiológicas21,22. El papel de las variaciones de los anticuerpos IgG está por precisar.
EFICACIA DE LA INMUNOTERAPIA EN EL TRATAMIENTO DEL ASMA
La eficacia clínica de la inmunoterapia se explica por los cambios observados en los órganos diana tras la exposición al alergeno, sobre todo los cambios en las células efectoras de la inflamación. Diferentes estudios muestran un descenso de mastocitos en el órgano diana y la piel con disminución de niveles de histamina, PGD2, LTC 4 y eosinófilos en el lavado broncoalveolar durante la estación polínica en pacientes tratados con inmunoterapia23-26.
La exposición a alergenos produce inflamación en la vía aérea de los individuos alérgicos que puede ser transitoria como sucede en el asma estacional semanas después de cesar la exposición27,28. Pero, cuando la exposición es mantenida como sucede con el asma alérgica por alergenos perennes, la inflamación crónica puede acabar en una remodelación de la vía aérea con cambios irreversibles29. Esto sugiere que la inmunoterapia puede ser más efectiva en pacientes con asma de corta evolución y en aquellos con asma alérgica estacional que en individuos con asma persistente de larga evolución por alergenos perennes que hayan hecho alteraciones irreversibles en la vía aérea.
Los objetivos fundamentales del tratamiento con inmunoterapia son reducir la respuesta a la exposición a los alergenos y prevenir el desarrollo de asma persistente. Ya que el inicio del asma suele ser con frecuencia en la niñez y la adolescencia y que la atopia es uno de los factores predisponentes mas importantes para el padecimiento de asma la inmunoterapia debe considerarse como el tratamiento imprescindible del asma alérgico en niños.
Se han llevado a cabo numerosos trabajos para valorar la eficacia de la inmunoterapia en el tratamiento del asma. Aunque menos numerosos, se encuentran muchos estudios aleatorios, algunos se han llevado a cabo en niños observando fundamentalmente la eficacia clínica de este tratamiento.
EFICACIA CLINICA DE LA INMUNOTERAPIA
Abramson et al llevaron a cabo en 1999 un meta-análisis sobre eficacia de este tratamiento en 62 estudios aleatorios de inmunoterapia en asma escritos en lengua inglesa entre 1954 y 1998. Los extractos utilizados fueron en 28 estudios de ácaros, en 15 de pólenes, en 9 de epitelios, en 2 Cladosporium, en 3 polvo doméstico y en 5 múltiples alergenos. De los trabajos valorados incluían niños y adolescentes 37 (60 %) y 13 eran únicamente de pacientes con edades entre 4 y 18 años. Se observó una mejoría clínica con disminución de la medicación requerida en la mayoría de los estudios. La eficacia de la inmunoterapia mostraba resultados más homogéneos con mayor significación en este grupo de edad30. La mayoría de los estudios recogen la disminución de los síntomas de asma y de la medicación requerida para su control. Esta mejoría se mostraba significativa en mas de un 70 % de los trabajos revisados con pólenes y en el 60 % de los que valoraban eficacia clínica con inmunoterapia de dermatophagoides. Cuatro de 5 estudios que valoraban mejoría del asma con inmunoterapia de alergenos de perro o gato comunican mejoría de asma, pero solo uno demuestra mejoría significativa.
La eficacia clínica de la inmunoterapia con pólenes se ha demostrado en la mayoría de los trabajos publicados y es más evidente en pacientes monosensibilizados ej gramíneas. Un estudio doble ciego controlado con placebo en pacientes alérgicos a gramíneas o múltiples especies de pólenes indica que los pacientes alérgicos a gramíneas mostraban mejoría significativa pero no los pacientes alérgicos a múltiples pólenes31.
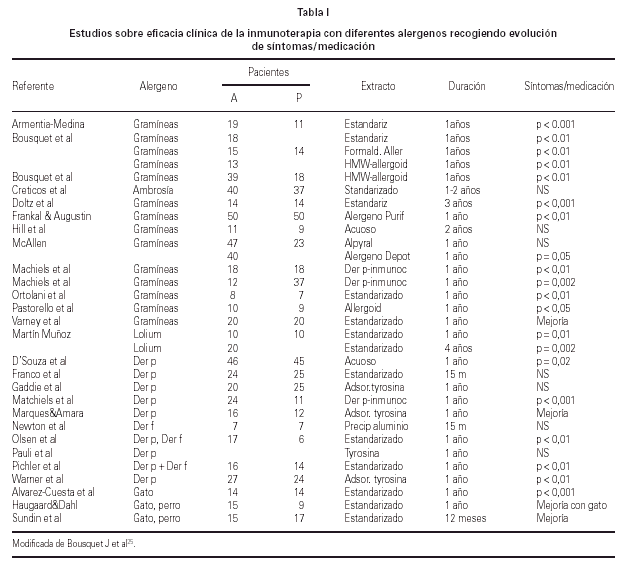
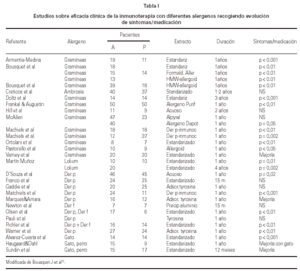
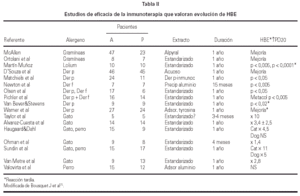
En los últimos años se han llevado a cabo estudios sobre eficacia de inmunoterapia con extractos estandarizados para el tratamiento del asma alérgica por hongos y alguno de ellos en niños ha observado mejoría del asma32. La tabla I muestra el resultado de la eficacia clínica de la inmunoterapia con diferentes alergenos estacionales o perennes.
Nuestro grupo de trabajo llevó a cabo un estudio de inmunoterapia subcutánea vs placebo, con extracto de lolium perenne estandarizado, en niños de 6 a 14 años con asma estacional por alergia a pólenes de gramíneas con al menos dos años de evolución. Se trata de un grupo de pacientes asmáticos con síntomas de asma durante al menos las dos últimas primaveras y diagnóstico clínico confirmado mediante historia clínica y exploración física, prick tests positivo e IgE específica igual o superior a un CAP clase 3 para polen de lolium perenne. Además mostraban un test de provocación bronquial con lolium perenne positivo. Se estudio la evolución clínica mediante recogida de síntomas y medicación requerida, de la sensibilidad cutánea mediante titulación a punto final en prick, de la sensibilidad conjuntival mediante provocación conjuntival y la evolución de la HBI frente a metacolina y de la HBE frente lolium perenne con valoración de respuesta inmediata y tardía33.
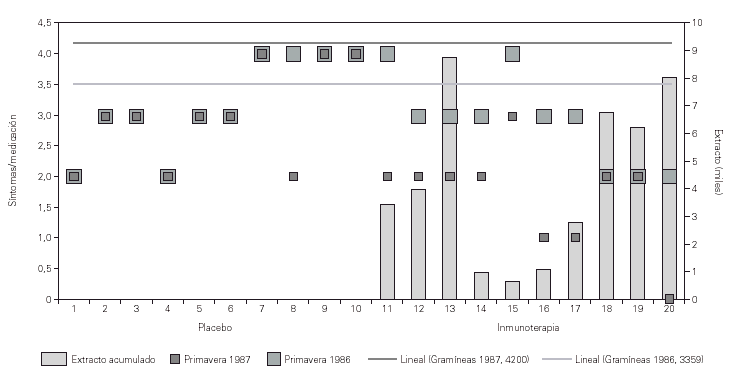
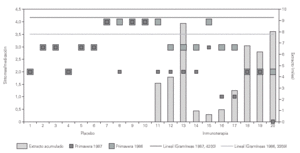
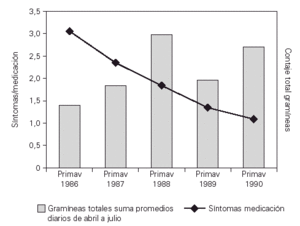
El análisis de los resultados tras el primer año de tratamiento mostraba una mejoría clínica significativa (p = 0,01) de los síntomas de asma con disminución en la utilización de tratamiento farmacológico broncodilatadores, cromoglicato y corticoides inhalados y/o sistémicos en el grupo con inmunoterapia activa frente al grupo placebo. Esta mejoría se observó al terminar la fase de iniciación de la inmunoterapia aún con bajas dosis acumuladas de extracto y, con contajes de gramíneas estacionales superiores a los de la primavera anterior, 3.359 vs 4.200 pólenes de gramíneas/m3 de aire (suma de promedios diarios del 1 de Abril al 31 de julio de cada año)33 (fig. 1).
Figura 1.--Eficacia de la inmunoterapia en niños con asma polínico. Estudio doble ciego inmunoterapia vs placebo. Valoración de síntomas/medicación requerida durante las primaveras de 1986 y 1987, antes y después del inicio de inmunoterapia. Se observó mejoría significativa en el grupo de tratamiento activo (p = 0,001). El recuento de gramíneas es la suma de promedios diarios en Madrid del 1 de abril al 31 de julio de cada año.
La eficacia de la inmunoterapia aumenta al aumentar el extracto acumulado por el paciente a lo largo del tratamiento en general la eficacia aumenta con el tiempo total de tratamiento y se acepta que la eficacia es optima por encima de los tres años, entre 3 y 5 años de mantenimiento de la inmunoterapia34,35.
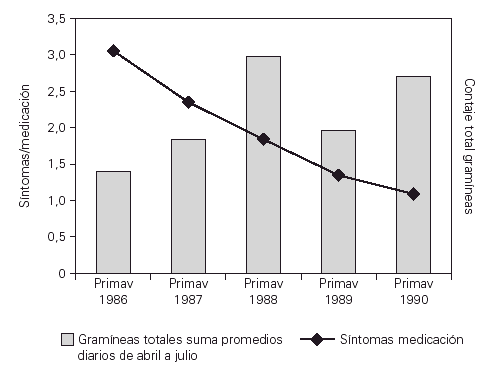
Una vez valorada la eficacia en el estudio doble ciego, todos los pacientes pasaron a tratamiento activo. La valoración de los síntomas y la medicación requerida a lo largo de los cuatro años de tratamiento mostraba una reducción progresiva. Al finalizar el tratamiento ninguno de los niños tuvo crisis de asma durante la primavera y no precisaron de tratamiento farmacológico, solo cuatro pacientes tuvieron asma desencadenado por ejercicio (P = 0,002)33 (fig. 2).
Figura 2.--Evolución clínica con inmunoterapia a lo largo de los cuatro años de inmunoterapia se observó mejoría clínica con clara disminución de los síntomas y de la necesidad de tratamiento farmacológico P = 0,002.
MODIFICACIONES EN LA RESPUESTA BRONQUIAL AL ALERGENO CON INMUNOTERAPIA
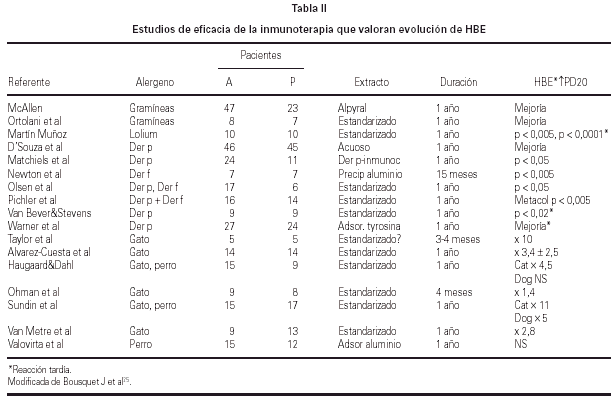
La eficacia de la inmunoterapia se ha asegurado además mediante la demostración de disminución de la respuesta bronquial inmediata al alergeno (HBE) y desaparición de la reacción asmática tardía en la mayoría de los casos36-40 (tabla II).
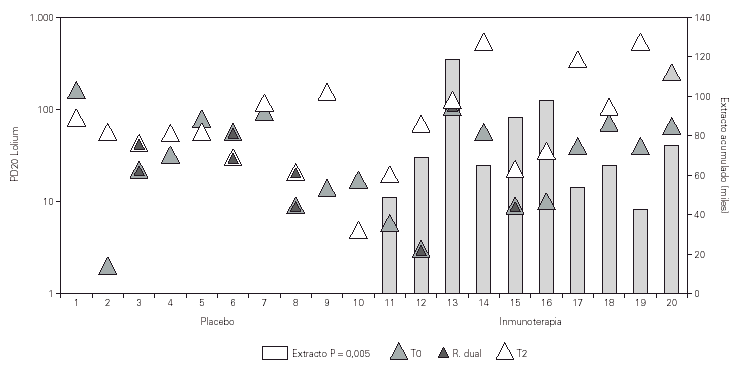
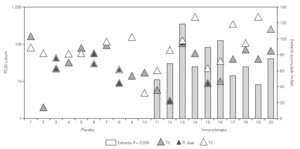
El análisis HBE entre los dos grupos de tratamiento, activo y placebo, de nuestro estudio mostraba una clara disminución (p = 0,005) en el invierno siguiente al inicio del tratamiento con desaparición además de la reacción bronquial tardía en todos los pacientes con tratamiento activo que la mostraban antes de iniciar la inmunoterapia (p = 0,0001)33 (fig. 3).
Figura 3.--Evolución de la reactividad bronquial frente a lolium perenne con inmunoterapia. Los dos grupos no mostraban diferencias basales en la HBE. Tras un año de inmunoterapia el grupo con tratamiento activo mostró una mejoría significativa de la HBE (p = 0,005). La reacción dual desapareció tras inmunoterapia solo en el grupo de tratamiento activo (p = 0,0001).
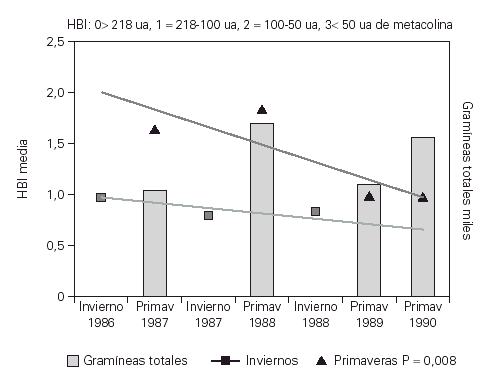
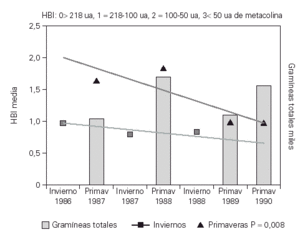
El estudio de la HBI con metacolina a lo largo de los inviernos mostraba una disminución aunque esta no era significativa. La HBI mostró una disminución progresiva a lo largo de las primaveras que se hizo significativa a partir de la tercera primavera del estudio (p = 0,008)33 (fig. 4).
Figura 4.--Evolución de la HBI frente a metacolina con inmunoterapia en los inviernos y las primaveras del estudio. Se aprecia una clara disminución de la HBI a lo largo de las primaveras del estudio p = 0,008.
PERSISTENCIA DE LA MEJORIA DEL ASMA TRAS INMUNOTERAPIA
Según la Organización Mundial de la Salud la inmunoterapia es el único tratamiento etiológico del asma alérgica y el único que modifica el curso natural de la enfermedad. Algunos estudios han valorado la persistencia de la mejoría del asma tras inmunoterapia. Johnston y Dutton en 1968 comunicaron la evolución de 130 niños asmáticos a lo largo de 16 años. Sesenta y siete niños habían seguido tratamiento con inmunoterapia. Al cabo de 16 años el 72 % de este grupo no tenía asma, 17 % tenía asma leve, 10 % asma moderada y 2 % asma severa frente a un 22 % sin asma, 7 % asma leve, 51 % asma moderada y 20 % de asma grave en el grupo sin inmunoterapia41. Grammer en 1984 demostró la persistencia del efecto de un curso corto de 4 semanas de inmunoterapia con polen de ambrosía tras un año de seguimiento42. Jacobsen en 1997 publicó un seguimiento de 6 años tras 3 de inmunoterapia con pólenes de árboles; la mayoría de los niños estaban igual o mejor que al finalizar la inmunoterapia de su rinitis y asma43. Otro estudio compara la persistencia de los efectos en niños asmáticos de 3 años de inmunoterapia vs tratamiento farmacológico al cabo de 10 años; los niños que habían recibido inmunoterapia mostraba un porcentaje significativamente mayor de remisión44. Shaikh encontró una mejoría más rápida con budesonida que desapareció al suspender el tratamiento, frente a una mejoría más lenta pero persistente tras un año de seguimiento con inmunoterapia45.
También se ha demostrado persistencia en la mejoría de la HBE junto con la mejoría clínica de asma en niños 5 años después de finalizar un ciclo de 3 años de inmunoterapia tras tres años con extractos estandarizados de perro o gato46.
La inmunoterapia es el tratamiento etiológico del asma alérgica en los primeros años de su evolución. Su eficacia depende sobre todo de una correcta indicación, de la utilización de extractos estandarizados, de la cantidad de extracto acumulada y de la precocidad de su inicio.