Los pacientes críticos sin una grave inmunosupresión es una población en la que la aspergilosis invasiva (AI) es una enfermedad en alza. El tratamiento crónico con corticoides, la enfermedad pulmonar obstructiva crónica y la cirrosis hepática son factores de riesgo repetidamente identificados en las series publicadas. No obstante, debido a la inespecificidad de los síntomas y signos en el paciente crítico y a la relativa baja capacidad diagnóstica de las pruebas complementarias, el diagnóstico de la AI supone un reto para el especialista en medicina intensiva. La aplicación de algoritmos diagnósticos adaptados al paciente crítico, cuya activación dependerá del aislamiento de Aspergillus en una muestra respiratoria, es la metodología diagnóstica más eficaz en esta población. Entre los elementos diagnósticos, la determinación de galactomanano en el líquido broncoalveolar es la prueba diagnóstica que ha demostrado más utilidad. Una vez establecida la sospecha el tratamiento debe iniciarse precozmente. El voriconazol, la anfotericina B y el isavuconazol son los tratamientos más eficaces. Aunque el voriconazol y la anfotericina B son los fármacos con mayores evidencias científicas, adolecen de problemas con relación a efectos adversos y dificultades farmacocinéticas. Por ello, el isavuconazol, que ha demostrado una elevada eficacia y seguridad en otras poblaciones, supone una potencial alternativa de extremado interés para el paciente crítico.
Critically ill patients without severe immunosuppression make up a population in which invasive aspergillosis (IA) has been identified as an emergent pathology. Chronic treatment with corticosteroids, chronic obstructive pulmonary disease, and liver cirrhosis are repeatedly identified risk factors. However, due to the non-specificity of the symptoms and signs in the critical patient, and the relative low diagnostic capacity of the complementary tests, the diagnosis of the IA is a challenge for the specialist in critical care medicine. The application of diagnostic algorithms adapted to critical patients, in whom activation will depend on the isolation of Aspergillus in a respiratory specimen, is the most efficient diagnostic methodology in this population. Among the diagnostic approaches, the determination of galactomannan in bronchoalveolar fluid is the most useful diagnostic test. Once the suspicion is established, treatment should be started as soon as possible. Voriconazole, amphotericin B, and isavuconazole are the most effective treatments. Although voriconazole and amphotericin B are the drugs with the most scientific evidence, they are related with adverse effects and pharmacokinetic difficulties. Therefore, isavuconazole, which has shown high efficacy and safety in other populations, is a potential alternative of great interest for critically ill patients.
Aspergillus puede provocar diferentes cuadros infecciosos (agudos o crónicos) y no infecciosos en el ser humano. De entre las formas infecciosas de la aspergilosis invasiva (AI), la más frecuente en la población general y en el paciente crítico es la aspergilosis pulmonar invasiva (API). La API es una enfermedad grave que afecta generalmente a pacientes con alteraciones graves de la inmunidad; es una enfermedad con una elevada mortalidad que en enfermos críticos puede superar en la actualidad el 50%2. No obstante, esta elevada mortalidad ha descendido en los últimos años (era cercana al 100% en la década de los 90) debido a los avances en el diagnóstico que han permitido la instauración precoz del tratamiento y los nuevos antifúngicos con elevada actividad frente a este hongo filamentoso de los que se dispone. La API es causada por la inhalación de las conidias del moho Aspergillus, el cual tiene como hábitat el suelo. El órgano más afectado por la AI es el pulmón, lo cual es comprensible por el modo de transmisión; otros órganos comprometidos en orden de importancia son los riñones, el corazón, el tracto gastrointestinal, el hígado y el bazo.
EpidemiologíaAunque son muchas las especies de este moho, pocas han sido descritas como patógenas para el hombre33. Aspergillus fumigatus es el causante de la mayor parte de las infecciones invasivas en el ser humano (> 80%), seguido de Aspergillus niger, Aspergillus flavus y Aspergillus terreus2,8. Las esporas (conidias) de Aspergillus viajan fácilmente como aerosoles por vía aérea, la forma casi universal de transmisión. A. fumigatus se caracteriza por su rápida replicación y por tener conidias de un tamaño muy pequeño, lo que explica que sea la especie que más frecuentemente causa infecciones respiratorias.
La defensa natural se basa en las barreras de las mucosas y en la función de los macrófagos y neutrófilos. Aunque los seres humanos inhalamos continuamente estas esporas, son eliminadas eficientemente por nuestro sistema inmunitario en la inmensa mayoría de las ocasiones. Por ello, los pacientes inmunodeprimidos son especialmente vulnerables a este hongo y son ellos los que sufren con mayor frecuencia infecciones graves como la AI51. El aislamiento de Aspergillus es más frecuente cuando se llevan a cabo obras de renovación de los hospitales, habiéndose descrito brotes en Unidades de Cuidados Intensivos por existencia de este hongo en los sistemas de aire acondicionado.
Los principales factores de riesgo para desarrollar AI se resumen en la tabla 1 y pueden dividirse en factores de riesgo alto, medio y bajo. El principal factor de riesgo para desarrollar API es la neutropenia, siendo mayor el riesgo cuanto más prolongada e intensa (< 500 neutrófilos/mm3) sea la misma. Clásicamente, la mayor incidencia de AI se observa en pacientes con enfermedades hematológicas malignas, especialmente en los pacientes con trasplantes alogénicos de progenitores hematopoyéticos23. Sin embargo, en la UCI, los factores de riesgo predominantes para el desarrollo de AI son la enfermedad pulmonar obstructiva crónica (EPOC) y el tratamiento con corticoides. En un trabajo realizado en 1.753 pacientes ingresados en 73 UCI españolas, los dos factores que se asociaron significativamente en el análisis multivariante con el aislamiento de Aspergillus fueron el tratamiento con esteroides (OR: 4,5, IC del 95%: 1,73-11) y la EPOC (OR: 2,9, IC del 95%: 1,06-8,08)22. Igualmente, pueden estar en riesgo aquellos pacientes que presentan enfermedades autoinmunes y reciben tratamiento con diversos fármacos inmunosupresores, incluidos los corticoides. La hepatopatía crónica es también considerada un factor de riesgo moderado para el desarrollo de API25. Los enfermos críticos presentan una alteración de la respuesta inmunitaria con depresión de la función del sistema mononuclear fagocítico, lo cual ocurre especialmente en la fase tardía de la disfunción multiorgánica, que podemos considerar un factor de riesgo de grado bajo para el desarrollo de la API (tabla 1). Se ha demostrado que esta inmunodepresión afecta especialmente a los macrófagos alveolares, lo que explica que esta situación se asocie a un mayor riesgo de infección pulmonar3.
Factores de riesgo para la aspergilosis invasiva
| Riesgo alto | Riesgo intermedio | Riesgo bajo |
|---|---|---|
| Neutropenia (< 500/mm3) | Tratamiento prolongado con corticoides antes del ingreso en UCI.Trasplante autógeno de precursores hematopoyéticos | Gran quemado. |
| Leucemia aguda mieloblástica | Otras neoplasias hematológicas | Trasplante hepático |
| Trasplante alogénico de precursores hematopoyéticos | Enfermedad obstructiva crónica, especialmente con esteroides inhalados | Tratamiento esteroideo <7 días |
| Trasplante pulmonar sin profilaxis | Cirrosis hepática | Estancia en UCI prolongada (> 21 días) |
| Fallo hepático agudo sobre crónico | Malnutrición | |
| Cáncer de órgano sólido | Poscirugía cardiaca | |
| Infección por VIH | Casi ahogamiento | |
| Trasplante pulmonar con profilaxis | Síndrome de disfunción multiorgánico | |
| Tratamiento inmunosupresor sistémico | Influenza (especialmente H1N1) |
El ser receptor de un trasplante de órgano sólido es también un factor de riesgo reconocido para el desarrollo de AI. De ellos, el trasplante hepático y el pulmonar son los que presentan una mayor incidencia46. En el trasplante hepático se estima una incidencia entre el 1 y el 9%15. En esta población los factores de riesgo que elevan significativamente el riesgo de padecer una API son el retrasplante, la insuficiencia renal, la necesidad de trasplante por fallo hepático fulminante y la infección por citomegalovirus24.
Por último, recientemente se ha descrito la asociación de AI con casos graves de gripe, en especial con el virus de la influenza A (H1N1)38. Una hipótesis es que el virus H1N1, una cepa virulenta, puede originar un daño difuso de la mucosa respiratoria que facilita la invasión del hongo.
ClínicaLas series de necropsias publicadas sobre pacientes críticos muestran que la AI es una de las enfermedades más frecuentemente no diagnosticadas en vida del paciente16,50,52. Esta baja capacidad de diagnóstico se debe, en parte, a la falta de eficacia de las pruebas y los algoritmos diagnósticos, pero probablemente el factor más importante es la ausencia de sospecha clínica ante un paciente que es aparentemente inmunocompetente. Tal y como se ha comentado previamente, existen unas poblaciones específicas (bronquitis crónica, bronquiectasias, tratamiento crónico con corticoides, cirrosis hepática) en las que la AI debe ser considerada. No obstante, cada vez existe más evidencia (molecular y clínica) de la existencia de un compromiso o disfunción del sistema inmunitario en todo paciente crítico. Se ha descrito una prevalencia de citocinas antiinflamatorias, la presencia de anergia inmunológica y la existencia de apoptosis en las células inmunes. De especial interés parece ser la expresión de HLA-DR en la superficie de los monocitos, que se ha correlacionado con una mala respuesta clínica a la infección, la aparición de infecciones oportunistas e incluso con una mayor mortalidad34,43. Esta disfunción inmunitaria adquirida sería la base etiopatogénica de la elevada prevalencia de AI en los pacientes críticos afectados de neumonía grave por virus influenza del tipo A38. Lamentablemente no disponemos de ninguna herramienta diagnóstica asistencial que permita identificar al paciente crítico con disfunción inmunitaria y realizar por tanto una búsqueda proactiva de infecciones oportunistas. Partiendo de los factores de riesgo conocidos y de una sospecha clínico-epidemiológica de disfunción inmunitaria deberemos establecer los parámetros de sospecha clínica de AI. En el paciente crítico supuestamente inmunocompetente el tratamiento con corticoides (de novo o previo), la presencia del síndrome de distrés respiratorio del adulto y una mayor gravedad de la enfermedad aguda se han relacionado con la presencia de Aspergillus en muestras respiratorias35.
La afectación pulmonar es la forma clínica más frecuente de la AI en el paciente crítico, siendo anecdótica la presentación cutánea, rino-orbitaria, cardiaca, meníngea o en forma de fungemia. La sintomatología de la aspergilosis pulmonar es totalmente inespecífica y probablemente depende más de la extensión de la infección que de su etiología. Los síntomas que con más frecuencia se recogen en la literatura son la fiebre persistente o recurrente a pesar del tratamiento antibiótico, la disnea y la hemoptisis54; no obstante, estos síntomas aparecen con menor frecuencia si comparamos la población no neutropénica con la neutropénica14. Bien sea por una sospecha clínica o de forma accidental al analizar una muestra respiratoria extraída por otro motivo, el siguiente paso es habitualmente la detección de Aspergillus. Si la primera dificultad residía en establecer la sospecha clínica y, por tanto, buscar al hongo, el segundo escalón diagnóstico consiste en discernir entre una colonización y una infección invasiva.
Diagnóstico de la aspergilosis invasivaAl igual que en los pacientes inmunocomprometidos, el diagnóstico de confirmación de la AI requiere de un estudio histológico del tejido afectado, maniobra diagnóstica que por su invasividad y potenciales efectos adversos no se efectúa con frecuencia. Por este motivo, la aproximación a la AI se realiza mediante la suma de una serie de criterios epidemiológicos, clínicos, radiológicos y analíticos.
La European Organization for Research and Treatment of Cancer/Mycosis Study Group (EORTC/MSG) estableció unos criterios diagnósticos de AI para el paciente oncohematológico15. Sin embargo, estos criterios no representan bien al paciente crítico, por lo que en 2006 Vandewoude et al. desarrollaron un nuevo algoritmo diagnóstico, adaptado a las circunstancias epidemiológicas y clínicas del paciente crítico, mediante el algoritmo la AI en el paciente podía ser catalogada como AI probada (confirmación histológica), putativa o colonización59. Seis años más tarde, Blot et al. compararon el nuevo algoritmo con el de la EORTS/MSG en un estudio multicéntrico que incluyó a 524 pacientes (tanto críticos como inmunocomprometidos) con una muestra respiratoria positiva para Aspergillus (tabla 2). En el 22% de los pacientes se realizó un estudio histológico que permitió comprobar la eficacia del algoritmo: especificidad 61%, sensibilidad 92%, valor predictivo positivo 20-50% y valor predictivo negativo 87-94% (para una prevalencia del 20-50%). Los criterios de la EORTC/MSG fueron incapaces de clasificar al 79% de los pacientes (AUC 57%, IC del 95%, 46-68%) frente a una AUC para el nuevo algoritmo del 76% (IC del 95%, 67-87%). La aplicación del nuevo algoritmo supuso un incremento del 32% en la capacidad diagnóstica de la AI en la UCI7.
Criterios diagnósticos de la aspergilosis pulmonar
| Aspergilosis pulmonar probada |
| Observación de hifas en el análisis microscópico de una muestra de tejido estéril, junto a evidencia histológica de invasión tisular o aislamiento de Aspergillus en cultivo |
| Probable (putativa) aspergilosis pulmonar (debe cumplir los cuatro criterios) |
| 1. Cultivo positivo de muestra respiratoria de tracto inferior (criterio de entrada en el algoritmo) |
| 2. Signos y síntomas compatibles (al menos uno de ellos) |
| a. Fiebre refractaria al tratamiento antibiótico durante al menos 3 días |
| b. Reaparición o intensificación de la fiebre tras un periodo libre de la misma de al menos 48 h y bajo tratamiento antibiótico y sin otra causa aparente |
| c. Dolor pleurítico |
| d. Roce pleural |
| e. Disnea |
| f. Hemoptisis |
| g. Progresión del deterioro respiratorio a pesar de tratamiento antibiótico y soporte ventilatorio |
| 3. Imágenes anormales en la radiografía o en la TAC de tórax |
| 4. Cualquiera de las dos siguientes: |
| a. Factores de riesgo del huésped (al menos uno de los siguientes): |
| i. Neutropenia (< 500 neutrófilos/mm3) previa al ingreso o en la estancia en UCI |
| ii. Proceso neoplásico (hematológico o sólido) tratado con agentes citotóxicos |
| iii. Tratamiento corticoideo (equivalente a> 20 mg/día de prednisona) |
| iv. Inmunodeficiencia congénita o adquirida |
| b. Cultivo semicuantitativo de BAL con Aspergillus (+ o++) y sin bacterias, junto a la observación de hifas en la tinción |
| Colonización pulmonar porAspergillus |
| Presencia de Aspergillus en muestra respiratoria en ausencia de criterios diagnósticos de aspergilosis probada o probable |
En 2007 Bulpa et al. publicaron unos criterios diagnósticos adaptados al paciente con EPOC; recientemente, este algoritmo ha mostrado ser el más eficaz para identificar la AI en el paciente crítico con EPOC9,31. Realizaremos, a continuación, una revisión de los últimos avances en las herramientas diagnósticas de la AI del paciente crítico.
Diagnóstico radiológico de la aspergilosis invasivaLos hallazgos radiológicos típicos en la AI del paciente neutropénico reflejan un patrón de invasión vascular propio en estos pacientes. Sin embargo, en el paciente crítico la conservación de la capacidad defensiva determina un patrón histológico basado en la invasión de la mucosa bronquial y el parénquima, y por tanto las manifestaciones radiológicas son más inespecíficas42.
Los hallazgos más frecuentes en la AI del paciente crítico no neutropénico son las condensaciones mal delimitadas y parcheadas (63-76%), y en segundo lugar los nódulos (10-33%), sobre todo distribuidos a lo largo del árbol bronquial. Signos como el «air crescent sign» o el signo del halo invertido solo se detectan en el 0,8-3,6% de los casos9,30.
Por tanto, aunque la aparición de anomalías radiográficas en la radiografía simple o en la tomografía computarizada torácica constituye uno de los criterios diagnósticos de la AI posible (o putativa), no se consideran una clara ventaja en el diagnóstico específico de la AI del paciente crítico.
Aislamiento de AspergillusLa presencia de Aspergillus en una muestra respiratoria de un paciente crítico es el criterio imprescindible de entrada para el diagnóstico de una API probable. Sin embargo, también puede indicar una contaminación de la muestra o una colonización del árbol bronquial. Aunque será imprescindible la valoración de este resultado con el resto de elementos diagnósticos (factores de riesgo, clínica, radiografía, pruebas microbiológicas complementarias), es posible analizar algunos aspectos que nos permitan sopesar el hallazgo. En primer lugar, deberemos considerar la reproducibilidad del aislamiento; la presencia de al menos dos muestras positivas se asoció a un diagnóstico de API probable o probada en un 56,7% de los casos en un estudio retrospectivo español realizado en 245 pacientes con presencia de Aspergillus en muestras respiratorias4. No obstante, el seguimiento de 67 pacientes de la misma serie en los que Aspergillus se consideró colonización mostró una progresión a infección en el 25,5% de los casos (sobre todo en aquellos con antecedente de EPOC)5. En segundo lugar, debemos sopesar la calidad de la muestra analizada. Aunque no existen estudios que comparen la capacidad diagnóstica de una muestra de vías aéreas inferiores (lavado broncoalveolar [LBA]) frente a un aspirado bronquial o un esputo, el diagnóstico de API parece más frecuente cuando la muestra positiva se ha obtenido de forma invasiva4.
BiomarcadoresActualmente, el galactomanano (GM) y el β(1,3)-D-glucano (BDG) siguen siendo los biomarcadores con un uso más extendido. Recientemente se ha publicado una serie retrospectiva que incluyó 15 casos de AI probada, en la que se comprobó la utilidad (sensibilidad del 93% y especificidad del 76%) de la determinación sincronizada por espectrometría de masas de una serie de disacáridos procedentes del hongo. La principal ventaja detectada fue un adelanto de hasta 25 días (mediana de 3 días) en el diagnóstico de la AI40.
La determinación mediante técnica de ELISA del antígeno fúngico GM constituye uno de los criterios diagnósticos de AI según la EORTC/MSG15. Sin embargo, en el paciente no neutropénico su capacidad diagnóstica se reduce ostensiblemente6. En 2008 Meersseman et al. demostraron la utilidad en pacientes críticos de la determinación de GM en el LBA frente a la misma en suero (sensibilidad en suero del 42% frente a un 88% en el LBA con un punto de corte ≥ 0,5)39. Al igual que en trabajos anteriores, estos resultados se han vuelto a corroborar en 37 pacientes no neutropénicos con AI probada en los que un punto de corte de 0,7 en el LBA obtuvo una sensibilidad del 73% y una especificidad del 89% (la sensibilidad en suero fue inferior al 40% para un punto de corte ≥ 0,5 e inferior al 25% para ≥ 1)60. Sin embargo, el GM tiene ciertas limitaciones, ya que algunas medicaciones habituales (piperacilina-tazobactam, amoxicilina-clavulánico), el uso de cristaloides basados en acetato, algunas circunstancias del paciente (insuficiencia renal, mucositis) o la presencia de otros hongos (Penicillium, Histoplasma o Blastomyces) pueden producir falsos positivos47.
El BDG es un componente de la pared de la mayoría de los hongos a excepción de Cryptococcus y de los cigomicetos. La determinación de BDG en suero es superior a la de GM, pero resulta similar o incluso inferior cuando se compara con GM en el LBA1. Su principal virtud diagnóstica reside en su elevado valor predictivo negativo (82-95%), que permitiría obviar o retirar el tratamiento antifúngico55. No obstante, la determinación de BDG es económicamente costosa y además conlleva un proceso laborioso y lento en el laboratorio. Además de que el resultado positivo podría deberse a una infección por Candida, existen numerosas circunstancias que podrían provocar falsos positivos: pacientes en hemodiálisis, tratamiento con amoxicilina-clavulánico, azitromicina, inmunoglobulinas o albúmina, uso de filtros de celulosa e incluso una infección por bacterias grampositivas23.
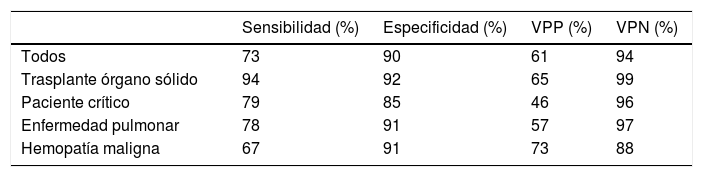
La tecnología de flujo lateral (lateral flow device [LFD]) es un ensayo inmunocromatográfico que mediante un anticuerpo monoclonal (mAb JF5) detecta, tanto en suero como en el LBA, una glicoproteína extracelular producida por Aspergillus cuando se encuentra en fase de crecimiento. Entre sus ventajas destacan el tiempo de ejecución (15min), la posibilidad de realizarla a pie de cama (point-of-care) y un coste inferior al de la determinación de GM y BDG. Solo tiene reacción cruzada con antígenos procedentes de Penicillium. Una revisión publicada en 2017 recoge los resultados en sensibilidad y especificidad del LFD en el LBA en todas las poblaciones estudiadas (tabla 3)27. Actualmente, se encuentra en investigación la aplicación de una técnica similar frente a antígenos de Aspergillus presentes en la orina17.
Capacidad diagnóstica de la técnica de flujo lateral (lateral flow-device) en la aspergilosis invasiva sobre muestras de lavado broncoalveolar
| Sensibilidad (%) | Especificidad (%) | VPP (%) | VPN (%) | |
|---|---|---|---|---|
| Todos | 73 | 90 | 61 | 94 |
| Trasplante órgano sólido | 94 | 92 | 65 | 99 |
| Paciente crítico | 79 | 85 | 46 | 96 |
| Enfermedad pulmonar | 78 | 91 | 57 | 97 |
| Hemopatía maligna | 67 | 91 | 73 | 88 |
Adaptado de Heldt y Hoenigl27.
No existe literatura en la que específicamente se mencione el rendimiento de la PCR de Aspergillus en el paciente crítico32. Sin embargo, existen resultados positivos en el paciente oncohematológico y en el paciente con trasplante de órgano sólido. Se debe destacar la mayor posibilidad de falsos negativos en el caso de especies distintas de A. fumigatus44. Recientemente, se han obtenido buenos resultados con la aplicación de la PCR múltiple, tanto panfúngica58 como combinada con la determinación de ADN de bacterias, Septifast®53 (Roche Diagnostic, Mannheim, Alemania) e incluso para la detección de resistencias a los antifúngicos11.
TratamientoEl tratamiento antifúngico de la AI que afecta a un paciente crítico debe iniciarse siempre por vía intravenosa y de forma precoz una vez que exista sospecha fundamentada de dicha infección. Un análisis secundario del estudio que comparó dos dosis de anfotericina B liposomal mostró que la supervivencia fue significativamente superior cuando el tratamiento se inició en caso de API posible en comparación con los casos probados y probables12.
Los fármacos con actividad frente a Aspergillus y que tienen indicación para el tratamiento de la AI pertenecen a las familias de los azoles, los polienos y las equinocandinas. El voriconazol, el itraconazol, el posaconazol y, más recientemente, el isavuconazol son los azoles de los que disponemos en la práctica clínica para el empleo en el caso de AI. El voriconazol está actualmente indicado como tratamiento de primera línea en la población general y en la AI del enfermo crítico21,49,57.
En un ensayo clínico aleatorizado y abierto, el voriconazol mostró superioridad respecto a la anfotericina B desoxicolato empleada a 1mg/kg en el tratamiento de la API: la mortalidad a las doce semanas fue significativamente menor en el grupo tratado con voriconazol (el 70,8% frente al 57,9%)28. Otros estudios observacionales han confirmado la utilidad clínica del voriconazol en el tratamiento de la API. Un estudio retrospectivo con pacientes críticos hematológicos con API y que requerían ventilación mecánica concluyó que el empleo del voriconazol se asoció a una menor mortalidad10.
Sin embargo, es necesario tener presente que el voriconazol interacciona con un elevado número de fármacos y que es necesario realizar la monitorización de sus concentraciones plasmáticas. El voriconazol se metaboliza y, a su vez, inhibe las enzimas del citocromo P450: CYP2C19, CYP2C9 y CYP3A4. Por ello los inhibidores o inductores de estas isoenzimas pueden incrementar o reducir, respectivamente, las concentraciones plasmáticas del voriconazol, y este tiene el potencial de incrementar las concentraciones plasmáticas de sustancias que se metabolizan a través de estas isoenzimas CYP450. Esto afecta a un elevado número de fármacos, lo que es de gran importancia especialmente en el paciente crítico y en el trasplantado. Además, existe una gran variabilidad intersujeto de las concentraciones séricas del voriconazol dependiendo de la edad, la dosis, la enfermedad de base, la función hepática y el polimorfismo genético del CYP2C1961. Así, cifras ≤ 1mg/l se asocian a fallo terapéutico y concentraciones ≥ 5,5mg/l a toxicidad. En un ensayo clínico con voriconazol en el que, aleatoriamente, los pacientes recibieron la dosis estándar del antifúngico o fueron monitorizados para conocer la concentración sérica de voriconazol a partir del cuarto día de tratamiento, la tasa de respuesta clínica fue superior en el grupo monitorizado, en el que además la necesidad de cesar el tratamiento por aparición de efectos adversos fue significativamente inferior48. Estas dificultades para mantener concentraciones terapéuticas del voriconazol son más evidentes en el enfermo crítico. Así, un estudio prospectivo mostró que en el 55% de los pacientes ingresados en la UCI los niveles no se encontraban dentro de los rangos deseados (1,5-5,5mg/l), hallándose en niveles infraterapéuticos el 80% de ellos29. Por todo ello, las guías recientes de práctica clínica recomiendan la monitorización de las concentraciones valle del voriconazol una vez se alcance el estado de equilibrio.
Además, el vehículo utilizado en la formulación intravenosa del voriconazol es la ciclodextrina sódica, que se asocia principalmente a toxicidad neurológica; puede acumularse en pacientes con insuficiencia renal, no aclarándose adecuadamente con los sistemas de depuración extrarrenal. Por todo ello, en caso de insuficiencia renal (aclaramiento de creatinina <50ml/min) debe evaluarse cuidadosamente el riesgo-beneficio de su administración. Este hecho limita con frecuencia el uso del voriconazol en pacientes críticos que desarrollan fracaso renal y necesitan técnicas de depuración extrarrenal. También hay que considerar la resistencia de Aspergillus al voriconazol (concentración mínima inhibitoria> 2mg/l), que, aunque en España es muy infrecuente, sí alcanza tasas altas en algunos países europeos y se detecta especialmente en aislamientos de pacientes de alto riesgo18,19.
El posaconazol es activo frente a Aspergillus y ya se dispone de su formulación intravenosa. Sin embargo, no existen ensayos clínicos que lo hayan evaluado en el tratamiento de la API, por lo que no se recomienda su uso en primera línea. Puede ser una alternativa en tratamientos de rescate, aunque no hay datos en pacientes que no responden al voriconazol. Se recomienda monitorizar su concentración y debe tenerse en cuenta el elevado número de moléculas con las que interacciona49,56.
El isavuconazol es un antifúngico que, como todos los azoles, impide la síntesis del ergosterol a través de la inhibición de la 14-α-lanosterol desmetilasa. Es activo frente a Candida y Aspergillus, incluidas las especies A. fumigatus, A. flavus, A. terreus, A. niger y Aspergilus nidulans. Además, es activo contra Histoplasma capsulatum, Coccidioides immitis, Blastomyces dermatitidis, Cryptococcus y Trichosporon. Frente a los mucorales, Fusarium y Scedosporium apiospermum su actividad es variable. El metabolismo primario es hepático. Es un substrato de las enzimas CYP3A4 y CYP3A5 del citocromo P450. Tiene un gran volumen de distribución y su unión a proteínas es del 99,3%. Se requiere una dosis de carga para alcanzar la concentración estacionaria. La biodisponibilidad oral es muy elevada (98%). Presenta menos interacciones que otros azoles, como el voriconazol o el posaconazol. Es un inhibidor del CYP3A4, por lo que si se administra con potentes inhibidores como lopinavir/ritonavir se puede elevar significativamente la concentración del isavuconazol. Por el contrario, la coadministración con inductores del CYP3A4, como la rifampicina, la carbamazepina o los barbitúricos, puede disminuir las concentraciones del isavuconazol. El isavuconazol puede incrementar las concentraciones de la atorvastatina, la ciclosporina, el sirolimús, el tacrolimús, el midazolam, el micofenolato mofetilo y la digoxina41. Por lo tanto, podría ser necesaria la monitorización de sus concentraciones plasmáticas o el ajuste de las dosis49. La formulación intravenosa del isavuconazol no contiene ciclodextrina, lo cual facilita su uso en pacientes con insuficiencia renal grave.
La Food and Drug Administration y la Agencia Europea de Medicamentos han aprobado recientemente el isavuconazol para el tratamiento de la AI y la mucormicosis invasiva en pacientes de 18 años o mayores. Hoy en día se considera el tratamiento de primera línea en el caso de AI, al igual que el voriconazol21,56.
El estudio SECURE es un ensayo clínico doble ciego, multicéntrico de no inferioridad, que comparó el isavuconazol con el voriconazol para el tratamiento de IFI, mayoritariamente API, causada por hongos filamentosos. El objetivo primario fue registrar la mortalidad por cualquier causa a los 42 días desde la administración de la primera dosis, definiéndose un margen de no inferioridad del 10% para la diferencia entre tratamientos36. Se incluyó a 527 pacientes adultos con sospecha de IFI a los que, de manera aleatoria, se administró isavuconazol o voriconazol (1:1). La mayoría de los pacientes presentaban neoplasias hematológicas (84%), el 20% eran receptores de un trasplante alogénico de progenitores hemopoyéticos y el 66% presentaba neutropenia al comienzo del tratamiento. No se incluyó a pacientes ingresados en la UCI. Aproximadamente, el 93% de las IFI eran AI, siendo la mayoría (un 40%) probables. La mortalidad cruda a los 42 días de tratamiento fue del 19% en el grupo que recibió isavuconazol y del 20% en el del voriconazol (diferencia del −1% [−7,8 a 5,7] con un intervalo de confianza del 95%), observándose la no inferioridad del isavuconazol. En cuanto a las variables secundarias, la respuesta global al tratamiento fue similar para el grupo que recibió el isavuconazol y el que recibió el voriconazol. La mortalidad en el día 84 desde el inicio del tratamiento fue similar en ambos grupos.
La mayoría de los pacientes incluidos en este ensayo clínico presentaban hemopatías malignas y en la actualidad faltan datos en otras poblaciones con riesgo de desarrollar aspergilosis, tales como pacientes con EPOC y los enfermos críticos en situación de disfunción multiorgánica. Por ello, en las recientes guías de la Sociedad Española de Infecciosas y Microbiología Clínica (SEIMC) se considera el voriconazol el tratamiento de elección en caso de AI del enfermo crítico y el isavuconazol como la alternativa en caso de que no se pueda emplear el voriconazol por efectos adversos o contraindicaciones como la insuficiencia renal grave con necesidad de depuración extrarrenal21.
La anfotericina B es muy activa frente a Aspergillus excepto en A. terreus, que es resistente a este polieno. Se prefiere utilizar como anfotericina B liposomal por asociarse a menos efectos adversos que la anfotericina B desoxicolato o que la anfotericina B complejo lipídico. Un ensayo clínico que incluyó a 201 pacientes (93% con neoplasia hematológica y 73% neutropénicos) comparó dos dosis de anfotericina B liposomal (3mg/kg/día y 10mg/kg/día): la eficacia fue similar pero la toxicidad fue menor en los pacientes que recibieron 3mg/kg. Con esta dosificación la curación clínica fue del 50% y la supervivencia a las 12 semanas alcanzó el 71%13. En la actualidad la anfotericina es el tratamiento alternativo a los azoles (voriconazol o isavuconazol) y dada la menor toxicidad se recomienda emplear la formulación liposomal21,56.
Ninguna de las equinocandinas actualmente comercializadas tiene indicación en primera línea para la AI y se consideran como tratamiento de rescate y preferentemente en combinación. Un ensayo clínico aleatorizado y doble ciego, en el que se incluyó a pacientes con neoplasia hematológica y trasplante de progenitores hematopoyéticos, comparó la monoterapia con voriconazol frente a la terapia combinada con voriconazol más anidulafungina. En este estudio no hubo diferencia entre ambos brazos en el objetivo primario (mortalidad cruda a las 6 semanas). Sin embargo, la mortalidad a las 6 semanas fue significativamente inferior en el grupo de tratamiento combinado en el subgrupo de pacientes en los que el diagnóstico de AI se realizó por positividad de GM sérico. En este estudio no están representados los pacientes críticos. De hecho, la necesidad de ventilación mecánica fue un criterio de exclusión37.
Finalmente, existe la posibilidad de combinar varios antifúngicos, tomando como base teórica el distinto mecanismo de acción de las familias de estos fármacos (el voriconazol más una equinocandina). En la práctica clínica, el 40-60% de los pacientes críticos con AI reciben un tratamiento combinado26. Es controvertido el impacto en el pronóstico de la terapia combinada sobre la monoterapia, aunque parece que el tratamiento combinado puede ser superior a la monoterapia cuando se emplea como tratamiento de rescate20,45. Un ensayo clínico aleatorizado y doble ciego comparó la monoterapia con voriconazol frente a la terapia combinada con voriconazol más anidulafungina. En este estudio no se observaron diferencias en el objetivo primario (mortalidad cruda a las 6 semanas). Sin embargo, la mortalidad a las 6 semanas fue significativamente inferior en el grupo de tratamiento combinado, en el subgrupo de pacientes en los que el diagnóstico de AI se realizó por positividad de GM sérico. En este estudio no están representados los pacientes críticos. De hecho, la necesidad de ventilación mecánica fue un criterio de exclusión.
ConclusionesEl diagnóstico y el tratamiento de la AI en el enfermo crítico constituyen un reto para el médico intensivista. La ausencia de síntomas y signos clínicos específicos y la modesta rentabilidad de las pruebas diagnósticas hacen que sea necesario un alto grado de sospecha. Por ello, recomendamos que siempre que se realice un LBA en un paciente crítico con enfermedad respiratoria infecciosa y factores de riesgo para AI (aunque sean moderados o bajos) debe solicitarse la determinación de GM. El tratamiento debe iniciarse precozmente, pues el retraso en su inicio se asocia a mayor mortalidad. El voriconazol y el isavuconazol son en la actualidad los tratamientos de elección. El voriconazol, sin embargo, presenta una serie de limitaciones para su empleo en el paciente crítico, como son el elevado número de interacciones o la imposibilidad de empleo por vía intravenosa en caso de fracaso renal con aclaramiento de creatinina por debajo de 30ml/min, aunque se instaure una técnica de depuración extrarrenal. Estos inconvenientes no los presenta el isavuconazol, que tiene una farmacocinética muy predecible. Por ello, el isavuconazol es una alternativa muy atractiva para el tratamiento de la AI en el enfermo crítico. Lamentablemente, no existen aún datos publicados sobre su uso en enfermos críticos. Por todo ello, son necesarios estudios bien diseñados que ratifiquen la eficacia y la seguridad del isavuconazol en la AI del paciente crítico.
Conflicto de interesesPaula Ramírez ha impartido conferencias subvencionadas por las compañías Pfizer, MSD, Gilead y Astellas. José Garnacho Montero ha impartido conferencias subvencionadas por las compañías MSD, Gilead y Astellas.