Los receptores de un trasplante de órgano sólido (TOS) tienen un riesgo significativo de desarrollar infecciones fúngicas invasivas (IFI). El tratamiento es difícil debido a las potenciales interacciones existentes entre los antifúngicos y los inmunosupresores, así como por el riesgo de hepatotoxicidad y de daño renal asociados al uso del voriconazol y de la anfotericinaB, respectivamente. El isavuconazol es un nuevo antifúngico triazólico con excelente biodisponibilidad oral, farmacocinética predecible y lineal, buena tolerancia y escasos efectos adversos que ha sido aprobado para el tratamiento de la aspergilosis invasiva (AI) y de la mucormicosis.
Se ha revisado la experiencia existente con el uso del isavuconazol en pacientes con TOS. De acuerdo con los estudios publicados, y a pesar de que existe una importante variabilidad entre pacientes y entre los distintos tipos de TOS, el isavuconazol presenta una significativa menor interacción con el tacrolimus y es menos hepatotóxico que el voriconazol.
El isavuconazol puede ser una alternativa al voriconazol para reducir de forma significativa los efectos secundarios asociados al tratamiento de la IFI en el TOS. Sería de gran interés la realización de futuros ensayos clínicos con este antifúngico tanto para el tratamiento como para la profilaxis de la IFI en estos pacientes.
Solid organ transplant (SOT) recipients have a high risk for developing invasive fungal infections (IFI). Treatment is difficult due to the interaction between the antifungal and immunosuppressant drugs, as well as the risk of hepatotoxicity and kidney failure associated with voriconazole and amphotericinB, respectively. Isavuconazole is a new antifungal triazole agent with excellent oral bioavailability, predictable and linear pharmacokinetics, good tolerance and low adverse effects. It has been approved for the treatment of invasive aspergillosis and mucormycosis.
A review is presented of the reported experience in the use of isavuconazole in SOT. According to the published studies, isavuconazole has a significantly lower risk of interaction with tacrolimus, and is less hepatotoxic than voriconazole. Nevertheless, there is a significant variability between patients, and between each type of SOT.
Isavuconazole reduces the side effects associated with the treatment of IFI in SOT. It would be of great interest the implementation of future clinical trials with isavuconazole for the treatment and/or prophylaxis of IFI in these patients.
El isavuconazol es el fármaco más reciente de la familia de los antifúngicos triazólicos de segunda generación, antimicóticos que se caracterizan por su espectro de acción extendido y su disponibilidad tanto en forma oral como intravenosa11,17. En marzo de 2015 fue aprobado por la Agencia Americana del Medicamento (Food and Drug Administration [FDA]) para el tratamiento de la aspergilosis invasiva (AI) y la mucormicosis. En octubre de 2015 la Agencia Europea del Medicamento (EMA) estableció que este antimicótico era el indicado para el tratamiento de la AI y de la mucormicosis en pacientes para los que la anfotericinaB no era apropiada. Además de una farmacocinética predecible, buena tolerancia y escasos efectos adversos (se ha descrito una baja incidencia de síntomas gastrointestinales, cefalea, edema periférico y acortamiento del intervalo QT dosis-dependiente)11,12, la formulación oral del isavuconazol presenta una excelente biodisponibilidad y buena difusión a los tejidos, incluyendo el sistema nervioso central10,14,16,17. Estudios in vitro y estudios experimentales en animales también confirmaron la acción sinérgica entre el isavuconazol y la micafungina en el tratamiento de la AI5,13.
Los receptores de un trasplante de órgano sólido (TOS) son un grupo de pacientes con un riesgo significativo de desarrollar infecciones fúngicas invasivas (IFI), causadas fundamentalmente por los géneros Candida y Aspergillus y, con una menor incidencia, por hongos mucorales1,2. La morbimortalidad asociada a estas infecciones es muy elevada y se requiere un tratamiento rápido, multidisciplinar y acertado1,2. El tratamiento de elección de la AI en los pacientes con TOS es el voriconazol1,2, pero la potencial hepatotoxicidad2,7, así como la inhibición del citocromo CYP3A4 y la consiguiente elevación de las concentraciones séricas de los fármacos inmunosupresores (tacrolimus, ciclosporina y sirolimus/everolimus), hace que su administración sea problemática en estos pacientes2,4. La anfotericinaB liposomal es el antifúngico de elección para el tratamiento de la mucormicosis, mientras que el posaconazol se utiliza como fármaco de segunda línea1,2. Sin embargo, la elevada incidencia de fracaso renal asociada a la anfotericinaB y las interacciones entre el posaconazol y los fármacos inmunosupresores (algunas guías recomiendan una reducción de la dosis de tacrolimus en un 60-75%) hacen que la administración de estos antifúngicos en el TOS no esté exenta de riesgos2.
Los datos actualmente disponibles indican que el isavuconazol es un inhibidor menos potente del citocromo CYP3A4 que el voriconazol y el posaconazol3,4. Por este motivo, el isavuconazol tiene un perfil más manejable con respecto a las interferencias con la medicación inmunosupresora, especialmente el tacrolimus. Estudios en faseI en sujetos sanos indicaron que la concentración sérica máxima del tacrolimus, el sirolimus y la ciclosporina aumentó un 42, un 65 y un 6%, respectivamente, si los sujetos recibían concomitantemente isavuconazol3. Sin embargo, la experiencia con el isavuconazol en el TOS es todavía muy escasa. Un estudio monocéntrico reciente evaluó las concentraciones séricas de tacrolimus en 55 receptores de TOS consecutivos (20 renales, 18 hepáticos, 9 cardiacos y 8 pulmonares) antes y después de haber recibido profilaxis con isavuconazol (si bien la ficha técnica no recoge la administración de este antifúngico como profilaxis)15. Sus autores observaron que el isavuconazol se asoció con pequeños —pero significativos— aumentos de las concentraciones séricas de tacrolimus, y con una marcada variabilidad entre pacientes; en general, tras suspender el isavuconazol la relación concentración en sangre/dosis diaria (C/D) del inmunosupresor se redujo en un 13% y se tuvo que incrementar en aproximadamente 1,3 veces la dosis diaria de tacrolimus. Estos autores también observaron que la interacción entre el isavuconazol y el tacrolimus fue mayor entre los receptores de un trasplante hepático: la disminución C/D de tacrolimus en los trasplantados hepáticos fue de casi un 36%, significativamente muy superior a los otros tipos de TOS. Los hallazgos de este estudio podrían explicarse por la mayor reducción en la función hepática que tienen los receptores de un trasplante hepático en comparación con otros TOS. Kim et al.6 describieron el caso de un trasplante pulmonar que al recibir isavuconazol a lo largo de ocho semanas por una mediastinitis por Aspergillus fumigatus necesitó una reducción del 72% de la dosis habitual de tacrolimus para mantener sus concentraciones séricas en rangos terapéuticos. No se diagnosticaron efectos adversos. Hoy día, por la considerable variabilidad existente entre los distintos receptores y entre los diferentes tipos de TOS, se recomienda un control sérico periódico de las concentraciones de los fármacos inmunosupresores, ajustando la dosis administrada según resultados6,15. El isavuconazol también presentó significativamente menos efectos adversos hepatobiliares que el voriconazol en el ensayo clínico SECURE (23 [9%] vs. 42 [16%], p=0,016)8, y en el estudio VITAL menos del 10% de los pacientes reclutados experimentaron un aumento de las enzimas hepáticas9. Considerando estos datos, el isavuconazol es menos hepatotóxico que el voriconazol y su uso podría ser más seguro en el paciente con TOS y, específicamente, en el trasplantado hepático. En contra de lo que ocurre con el voriconazol y el posaconazol, la formulación intravenosa del isavuconazol no contiene el excipiente sulfobutil éter β-ciclodextrina sódica (SBECD), lo que facilitaría su uso en pacientes con insuficiencia renal moderada o grave10,17. Este aspecto es muy importante en el TOS, particularmente en el caso del trasplante renal, ya que estos pacientes reciben con frecuencia medicaciones nefrotóxicas, como los antivirales (ganciclovir y/o aciclovir), que interactúan con los anticalcineurínicos (tacrolimus y ciclosporina). Por último, tampoco se han descrito hasta este momento con el isavuconazol los efectos secundarios asociados al voriconazol, como son las alteraciones visuales, las alucinaciones y la fotosensibilidad11. Presentamos a continuación el caso clínico de un receptor de trasplante intestinal, diagnosticado de una AI, que recibió isavuconazol tras desarrollar dos cuadros de hepatitis aguda colestásica inducida por voriconazol, y que mostraba un mal control de las concentraciones séricas de tacrolimus.
Caso clínicoVarón de 46 años sometido a un trasplante intestinal aislado en noviembre de 2011 por una poliposis adenomatosa rectocólica familiar que requirió una panproctocolectomía. El tratamiento inmunosupresor de inducción se realizó con alemtuzumab (anticuerpo monoclonal anti-CD52) y con un bolo de metilprednisolona en la reperfusión del injerto, y tacrolimus como tratamiento inmunosupresor de mantenimiento. En los días posteriores al trasplante desarrolló una infección de la malla quirúrgica por Pseudomonas aeruginosa multirresistente que requirió la retirada de la malla y el cierre de la herida quirúrgica por segunda intención. Entre junio y septiembre de 2015 recibió tratamiento con una combinación de sofosbuvir, ledipasvir y ribavirina por una hepatitis crónica activa secundaria al virus de hepatitisC (VHC), alcanzando una respuesta viral sostenida. Además, en junio de 2016 se le diagnosticó un rechazo celular tardío de grado3 que requirió tratamiento con bolos de metilprednisolona (1g al día durante tres días), basiliximab (anticuerpo monoclonal anti-CD25) y timoglobulina (inmunoglobulina de conejo antitimocitos humanos). Como consecuencia de la intensa inmunosupresión recibida desarrolló una enteritis del injerto por citomegalovirus (CMV) refractaria al tratamiento, por la que recibió diferentes ciclos de valganciclovir y foscarnet. Debido al desarrollo de efectos secundarios graves inducidos por los antivirales, se decidió iniciar un tratamiento anti-CMV con leflunomida, con negativización de la carga viral del CMV.
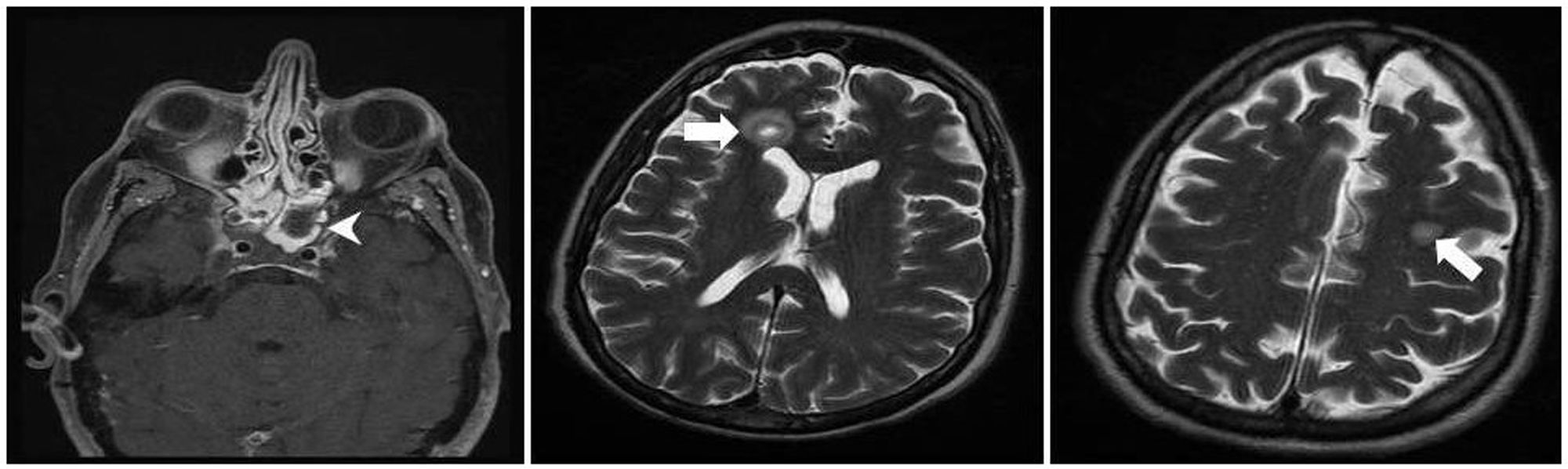
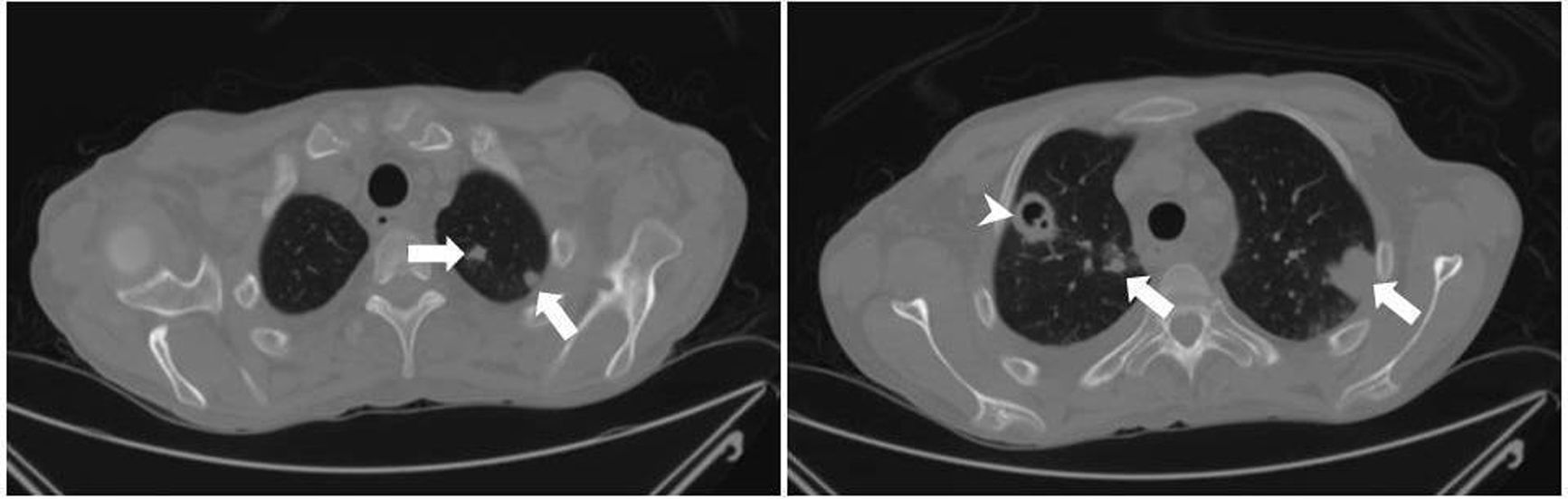
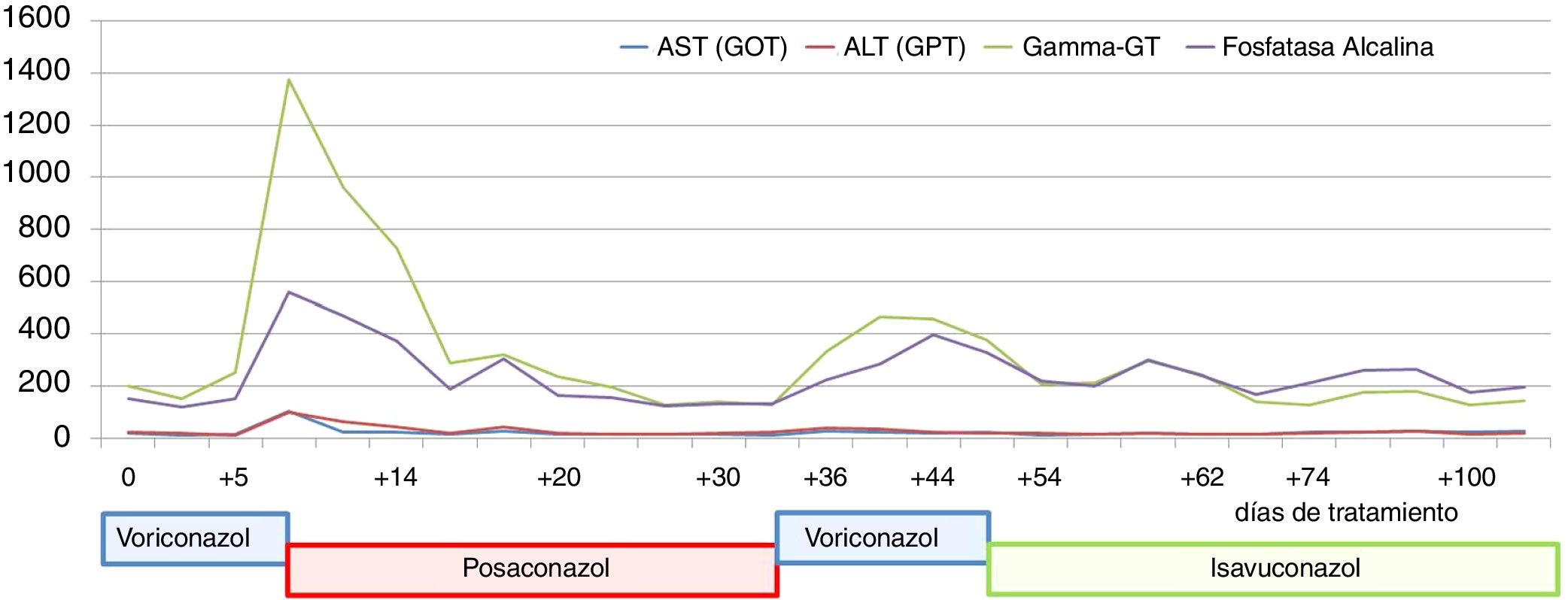
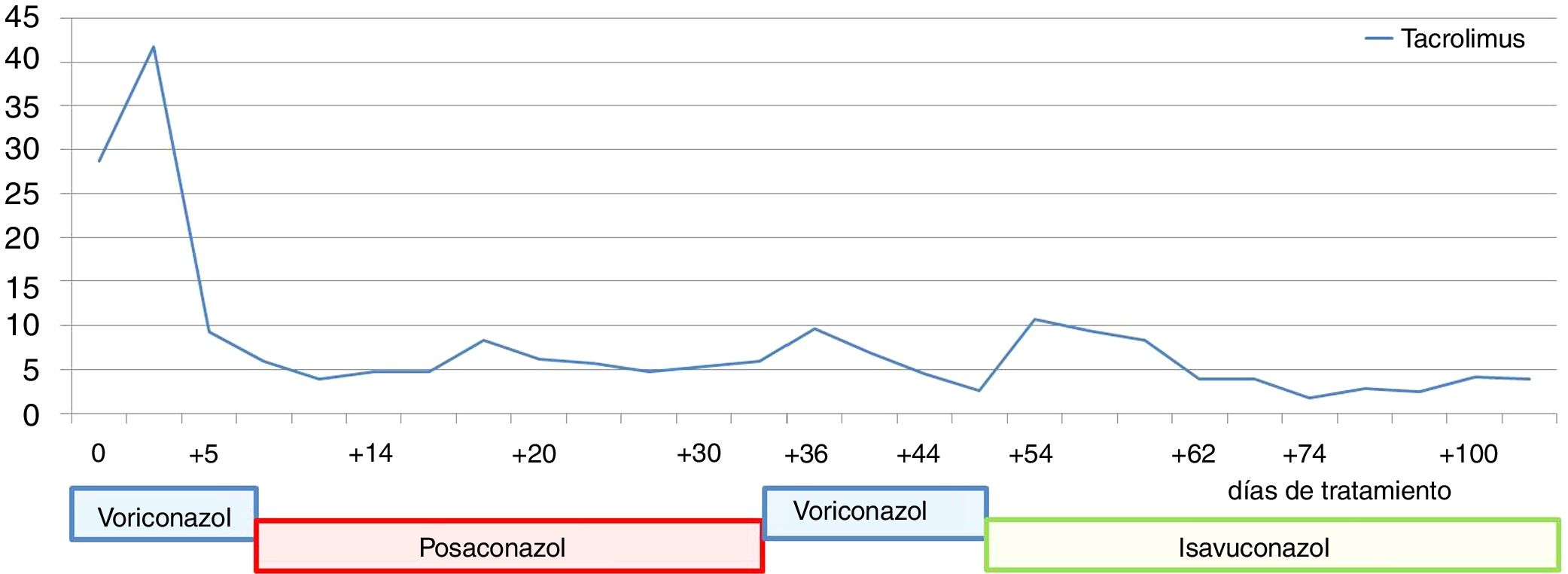
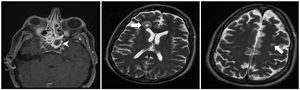
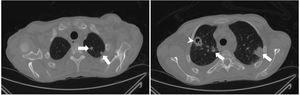
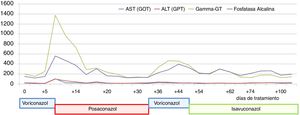
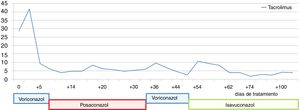
En julio de 2017 el paciente acudió al hospital por cefalea intensa y proptosis del ojo derecho (OD). En la exploración oftalmológica se observó una ptosis palpebral y proptosis del OD de hasta 3mm, que se acompañaba de una anisocoria pupilar con midriasis arreactiva y oftalmoplejía. En la tomografía axial computarizada de cráneo se describió una lesión de partes blandas en la base de la órbita derecha, mientras que en la resonancia magnética nuclear se observaron múltiples nódulos anulares y bilaterales, localizados en cerebro y cerebelo, compatibles con abscesos por hongos, y una lesión focal e hipocaptante, que se extendía desde el seno esfenoidal derecho hacia el ápex orbitario y la punta del seno cavernoso derecho, compatible con un foco de invasión por hongos (fig. 1). Se completó el estudio con una radiografía torácica, en que se visualizaron varias lesiones pulmonares bilaterales cavitadas; una tomografía axial computarizada de tórax confirmó los hallazgos (fig. 2). Por la alta sospecha de IFI, se inició tratamiento con anfotericinaB liposomal (3mg/kg/24h) y voriconazol (400mg cada 12h durante las primeras 24h, seguido de 200mg cada 12h). Se realizó una rinofibroscopia en la que se visualizó una lesión de color negruzco infiltrativa que parecía provenir de la región etmoidal; en las biopsias de la lesión se observaron abundantes estructuras fúngicas, que se identificaron como A.fumigatus. Se comprobó la sensibilidad a los antifúngicos por E-test; con la aplicación de los puntos de corte establecidos por el European Committee on Antimicrobial Susceptibility Testing (EUCAST) la cepa fue catalogada como sensible a voriconazol (concentración mínima inhibitoria [CMI] 0,38μg/ml), posaconazol (CMI 0,094μg/ml), itraconazol (CMI 1μg/ml) y caspofungina (CMI 0,016μg/ml), pero con sensibilidad intermedia a la anfotericinaB (CMI 1,5μg/ml). En los días posteriores a iniciar el tratamiento con voriconazol el paciente presentó una elevación de la γ-glutamil transpeptidasa (GGT) y de la fosfatasa alcalina hasta 1.400UI/l y 600UI/l, respectivamente (fig. 3), así como concentraciones séricas muy elevadas de tacrolimus (41ng/ml) (fig. 4). Se decidió cambiar el voriconazol por posaconazol (dosis de carga de 300mg cada 12h, seguido de 300mg cada 24h) y se suspendió el tacrolimus. Fue valorado conjuntamente por neurocirugía y otorrinolaringología, que desestimaron el tratamiento quirúrgico, y se reinstauró el tacrolimus a un 70% de la dosis. Tras aproximadamente 1mes de tratamiento con posaconazol se reinstauró el tratamiento con voriconazol, ya que se habían normalizado las enzimas hepáticas. Sin embargo, a las dos semanas la GGT aumentó a 500UI/ml y la fosfatasa alcalina a 400UI/ml, mientras que las concentraciones séricas de tacrolimus se habían duplicado (figs. 3 y 4). Se decidió cambiar el tratamiento antifúngico a isavuconazol (200mg cada 8h durante los dos primeros días [carga de 6 dosis en total], seguido de 200mg cada 24h). El mes y medio siguiente, mientras el paciente siguió recibiendo tratamiento con isavuconazol, no se detectaron elevaciones de las enzimas hepáticas y las concentraciones séricas de tacrolimus se mantuvieron en rangos terapéuticos (figs. 3 y 4). Actualmente, el paciente sigue en tratamiento con isavuconazol, pendiente de control clínico y radiológico.
Resonancia magnética craneal con lesión focal e hipocaptante que se extendía desde el seno esfenoidal derecho hacia el ápex orbitario y la punta del seno cavernoso derecho (punta de flecha). Se observaron múltiples nódulos anulares y bilaterales en cerebro y cerebelo, compatibles con abscesos por hongos (flecha).
El isavuconazol posee una excelente biodisponibilidad cuando es administrado por vía oral, farmacocinética predecible, buena tolerancia y escasos efectos adversos. Actualmente está aprobado por la FDA y la EMA para el tratamiento de la AI y de la mucormicosis.
Los receptores de un TOS tienen un riesgo significativo de desarrollar IFI, que se acompaña de una elevada morbimortalidad. El tratamiento es particularmente difícil en esta población: el voriconazol y el posaconazol, además de una importante interacción con los inmunosupresores, que obliga a un control sérico periódico de estos fármacos y a un reiterado ajuste de las dosis administradas, se acompañan de un significativo riesgo de hepatotoxicidad, y la anfotericinaB liposomal provoca una elevada incidencia de insuficiencia renal. Pese a que la experiencia del uso del isavuconazol en receptores de un TOS es todavía escasa, este antifúngico presenta una significativa menor inhibición del citocromo CYP3A4 y, por consiguiente, una interacción reducida con la medicación inmunosupresora, una menor incidencia de hepatotoxicidad que el voriconazol, y su formulación intravenosa podría ser utilizada en pacientes con insuficiencia renal moderada o grave. Por este motivo, el isavuconazol reduce de forma significativa los efectos secundarios asociados al tratamiento habitual de la IFI en el TOS. Son necesarios más estudios del uso del isavuconazol en esta población, principalmente su uso en el tratamiento y la profilaxis de la IFI y en combinación con otros antifúngicos.
Conflicto de interesesJMA ha recibido honorarios por conferencias en simposios organizados por los laboratorios Pfizer, Merck Sharp & Dohme (MSD), Astellas y Gilead, y ha participado en reuniones de asesoramiento en antifúngicos para los laboratorios MSD, Astellas, Pfizer y Gilead.
Los otros dos autores declaran no tener ningún conflicto de intereses.