Actualmente son escasos los estudios sobre candidemia en el enfermo gran quemado. Estos pacientes, sumamente graves, además de compartir los factores de riesgo para infecciones fúngicas presentes en los pacientes críticos, poseen ciertas características que los hacen especialmente susceptibles, como son la pérdida de la barrera cutánea por las quemaduras extensas, la colonización de las mismas y el uso de hidroterapia u otras terapias tópicas (ocasionalmente con antimicrobianos). Además, el aumento de la supervivencia en el quemado crítico conseguido en las últimas décadas debido a los avances terapéuticos ha favorecido el incremento de las infecciones invasivas por Candida, por lo que existe un interés cada vez mayor por implementar un diagnóstico más precoz y preciso, así como un tratamiento más eficaz que reduzca la morbimortalidad de la candidemia en los pacientes quemados graves. Todos los aspectos sobre predisposición y riesgos infecciosos en el enfermo quemado, patogenia de la candidemia, alteración inmunitaria subyacente, epidemiología local y sensibilidad a los antifúngicos, factores de riesgo de candidiasis invasiva, evolución y factores pronóstico, además de las infecciones por otras levaduras no-Candida son incluidos en la presente revisión. Finalmente se incorporan datos concretos sobre la experiencia local en el manejo de la candidemia del paciente quemado grave que pueden servir para dimensionar el problema y ponerlo en el marco de la perspectiva real.
Currently, there are few studies on candidaemia in the severely burned patient. These patients share the same risk factors for invasive fungal infections as other critically ill patients, but have certain characteristics that make them particularly susceptible. These include the loss of skin barrier due to extensive burns, fungal colonisation of the latter, and the use of hydrotherapy or other topical therapies (occasionally with antimicrobials). In addition, the increased survival rate achieved in recent decades in critically burned patients due to the advances in treatment has led to the increase of invasive Candida infections. This explains the growing interest in making an earlier and more accurate diagnosis, as well as more effective treatments to reduce morbidity and mortality of candidaemia in severe burned patients. A review is presented on all aspects of the burned patient, including the predisposition and risk factors for invasive candidiasis, pathogenesis of candidaemia, underlying immunodeficiency, local epidemiology and antifungal susceptibility, evolution and prognostic factors, as well as other non-Candida yeast infections. Finally, we include specific data on our local experience in the management of candidaemia in severe burned patients, which may serve to quantify the problem, place it in context, and offer a realistic perspective.
La lesión térmica es un tipo muy grave y particular de traumatismo que requiere cuidados selectos en unidades especializadas. Hace más de una década ya se estimaba que en los Estados Unidos (EE. UU.) de Norteamérica aproximadamente 2,5 millones de personas al año sufrían quemaduras que requerían de atención médica23. Más de 100.000 de estos pacientes eran hospitalizados y entre ellos se producían unas 12.000 muertes por año debido a las graves quemaduras.
Es un hecho bien conocido que los pacientes con quemaduras graves se encuentran predispuestos a muchos tipos de complicaciones infecciosas16, y que estas son el principal contribuidor en la morbimortalidad de estos enfermos. Las razones que explican este incremento de susceptibilidad a la infección incluyen un déficit inmunitario generalizado debido a la función alterada tanto de los sistemas inmunes celular como humoral, la pérdida de la barrera protectora de la piel y el masivo síndrome de respuesta inflamatoria sistémica causante de un desequilibrio sistémico general11. El sistema de vigilancia de infección nosocomial de los Centros para Control y Prevención de Enfermedades de los EE. UU. llegó a la conclusión en el año 2001 de que, entre todas la unidades de cuidados intensivos, los centros de quemados tenían las tasas más elevadas de infección hematógena diseminada primaria en pacientes con presencia de catéteres vasculares centrales (CVC)14. Debido a la variabilidad geográfica en la microbiología de distintos centros, el conocimiento de los microorganismos frecuentemente encontrados en cada unidad de pacientes quemados (epidemiología local) es un elemento primordial para tratar más eficazmente estas infecciones. Las razones que apoyan un protocolo de antibioterapia empírica adaptada en cada unidad de quemados se fundamentan en las diferencias en cuanto a localización geográfica, clima, raza y composición genética, prevalencia de comorbilidades, estados de inmunodeficiencia (infección por VIH, pacientes oncohematológicos, etc.) y la flora microbiana local. Por tanto, las unidades de pacientes quemados deberían rutinariamente estudiar y conocer mejor los principales microorganismos aislados que producen colonización o infecciones en sus enfermos5.
La escisión quirúrgica precoz con extenso desbridamiento de los tejidos necróticos y los injertos cutáneos de cobertura con sustitutos de la piel han disminuido las tasas de mortalidad asociadas con las grandes quemaduras. Los avances en el cuidado de los pacientes quemados también han incluido la antibioterapia de amplio espectro, la nutrición parenteral y enteral, los paquetes de medidas en el control de la sepsis, las medidas de reanimación adecuada, el soporte crítico en las disfunciones de órganos y las técnicas quirúrgicas perfeccionadas de cobertura cutánea.
Los mecanismos de defensa del huésped en los pacientes quemados se encuentran gravemente alterados, con un decremento en las respuestas tanto del sistema inmunitario innato como del adaptativo16,58. Como resultado de todo ello los pacientes quemados tienen un elevado riesgo de desarrollar infecciones oportunistas graves con amenaza vital durante su estancia en las unidades críticas de grandes quemados (UCGQ), donde casi el 70% de las muertes se relacionan con sepsis derivadas de infecciones locales o sistémicas. Aunque las infecciones bacterianas siguen siendo la principal causa de sepsis en las UCGQ, las infecciones fúngicas representan una amenaza creciente debido al uso generalizado de antibacterianos sistémicos de amplio espectro, a la aplicación de antimicrobianos tópicos para el control de la colonización bacteriana y a los propios avances en el tratamiento del paciente quemado (que han ampliado considerablemente la supervivencia de los enfermos más graves, exponiéndolos a complicaciones infecciosas)12,41,43,55,56.
Los patógenos fúngicos más frecuentemente aislados en pacientes quemados son Candida, Aspergillus, Fusarium y, ocasionalmente, los mucorales. Aunque los hongos filamentosos causan graves infecciones fúngicas invasivas (IFI) en pacientes quemados57, las especies del género Candida siguen siendo el principal agente causal de las IFI en estos pacientes, por lo que representan un grave problema infeccioso asociado con el incremento de la morbimortalidad, la duración de la estancia hospitalaria y de los costes sanitarios33. Es probable que los costes asociados a la candidiasis invasiva (CI) en pacientes quemados sean similares a los de otros pacientes críticos pero, hasta la fecha, no se dispone de estudios al respecto o que muestren el coste-efectividad de determinados fármacos antifúngicos en la candidemia de grandes quemados, como se ha comunicado para otros pacientes críticos no neutropénicos29,30.
Factores de riesgo de la candidemia y la candidiasis invasivaActualmente la candidemia en pacientes con graves quemaduras se asocia con una elevada morbimortalidad, sobre todo cuando el tratamiento antifúngico administrado empíricamente es inapropiado10,65. Por ello, la identificación de los factores de riesgo específicos en el desarrollo de una candidemia y un mejor diagnóstico, más rápido y preciso, de la infección por Candida son cruciales28; sin embargo, hasta el momento no se han publicado estudios específicamente diseñados para establecer los factores de riesgo de IFI por Candida en grandes quemados.
Entre los grupos de alto riesgo para padecer IFI se incluye habitualmente a los pacientes quemados47,48. Las heridas por quemadura constituyen una puerta de entrada ideal para la infección invasiva mientras inducen paralelamente una disfunción inmunitaria substancial6. El riesgo se incrementa con el tamaño de la quemadura ya que la extensión de la superficie de la quemadura corporal (SQC) ha sido correlacionada con la inmunosupresión y la atrofia mucosa gastrointestinal, lo que favorece la translocación de levaduras22,62. Además, la naturaleza agresiva del tratamiento de la quemadura expone al paciente a otros múltiples factores favorecedores de IFI, que incluyen los dispositivos biomédicos permanentes, tales como CVC (venosos y arteriales), sondas urinarias, tubos endotraqueales, nutrición parenteral total (NPT), ventilación mecánica prolongada, tratamiento con corticoides sistémicos, tratamiento de soporte con aminas vasoactivas y agentes inotrópicos, y antibacterianos de amplio espectro10,20. Los pacientes quemados portadores de CVC tienen el riesgo más alto para el desarrollo de una candidemia que cualquier otro grupo de pacientes hospitalizados6,43. Además, la administración de determinados fármacos puede incrementar las posibilidades de sufrir una infección fúngica. El propofol, frecuentemente administrado a pacientes críticos como agente sedante, ha sido asociado con un mayor riesgo de IFI debido a su vehículo lipídico (que promueve la gemación de Candida y reduce el acceso o la permeabilización de los antifúngicos hacia el interior de las levaduras)19. También la albúmina humana, administrada con frecuencia a pacientes quemados críticos, se ha asociado con un rápido inicio y diseminación de las infecciones fúngicas de origen profundo54. Además, los pacientes con una puntuación>10 en la escala del Acute Physiology and Chronic Health Evaluation (APACHE) II o con ventilación mecánica>48h tienen mayor riesgo de desarrollar una IFI22.
Independientemente de los procedimientos terapéuticos, los pacientes quemados también pueden compartir otros factores de riesgo como la hiperglucemia asociada a la lesión térmica, la inmunosupresión, la edad avanzada, el fallo renal agudo, el shock, los trastornos de coagulación y comorbilidades como la diabetes mellitus, mientras que son menos frecuentes las neoplasias, la neutropenia o el trasplante de órganos6,10,22. En cuanto al papel de los dispositivos médicos permanentes, no está claro si son factores de riesgo independientes o son considerados como «parte de la enfermedad». En el pasado ya se había sugerido que el riesgo de candidemia se incrementaba con una mayor área total de superficie de la quemadura, la hiperglucemia asociada a la misma, el uso de CVC, la aparición de bacteriemia y el uso de tratamiento antibiótico previo, la edad avanzada del paciente y una estancia hospitalaria prolongada6,15,43,62.
En un reciente estudio retrospectivo unicéntrico de cohortes, cuyo objetivo era identificar los factores asociados con la candidemia probada en esta especial población de pacientes, el análisis estadístico seleccionó la edad (más jóvenes, curiosamente), el sexo femenino, las complicaciones gastrointestinales que requirieron cirugía, las complicaciones tromboembólicas y el traumatismo por inhalación como variables favorecedoras de la infección diseminada por Candida (a los pacientes con estos factores de riesgo se les reconoció como potenciales beneficiarios de la profilaxis antifúngica)26. Probablemente el hallazgo de una menor edad como factor de riesgo asociado a candidemia fue debido a que los pacientes de mayor edad con una gran SQC tuvieran menos posibilidades de sobrevivir que los más jóvenes con una SQC semejante.
En otros estudios prospectivos observacionales, los principales factores predisponentes para el desarrollo de fungemia nosocomial fueron la protección gástrica con inhibidores de la bomba de protones como el omeprazol (incrementando tres veces el riesgo), la NPT, los drenajes quirúrgicos y la presencia de un CVC20,46. La importancia de la bacteriemia y del tratamiento antibacteriano previo como factores de riesgo de IFI también se ha confirmado en los estudios referidos: la mitad de los pacientes tenían hemocultivos bacterianos positivos antes del primer episodio de fungemia y el 93% de ellos habían recibido antibacterianos de amplio espectro20. En los pacientes quemados el foco de origen más frecuente de la IFI es la herida por quemadura, aunque otros orígenes de la IFI como el tracto gastrointestinal, urinario y respiratorio también deben ser considerados56.
Epidemiología local, especies de Candida y perfil de resistenciasLas complicaciones sépticas causadas por infecciones fúngicas en pacientes quemados representan un desafío diagnóstico y terapéutico, y se asocian con altas tasas de mortalidad43. Como principal patógeno fúngico, Candida albicans es el cuarto patógeno más frecuente aislado en hemocultivos en el contexto de los cuidados de pacientes críticos, y acontece en el 8-10% de todas las infecciones hematógenas diseminadas nosocomiales en los EE. UU.6,10,65. Sin embargo, debido a los esfuerzos realizados en el control de estas infecciones con diferentes estrategias antifúngicas (profilaxis, terapia empírica precoz, tratamientos dirigidos), se está observando una tendencia creciente en el aislamiento de otras especies de Candida, incluso las de menor sensibilidad a los azoles, aunque la proporción de estas especies en hemocultivos de pacientes críticos, como los quemados, varía considerablemente según las series y estudios2.
En esta línea, los estudios epidemiológicos poblacionales más recientes sobre candidemia han permitido conocer de forma más actual y precisa cuál es la distribución de especies de Candida según distintas geografías, centros hospitalarios, servicios y especialidades, así como prototipos de pacientes. Nuestro país ha contribuido de manera destacada al conocimiento de la epidemiología poblacional, general y local, de la candidemia, siendo dos los grandes estudios que constituyen el eje de varias de las referencias más relevantes al respecto: FUNGEMYCA45 y CANDIPOP50. C. albicans fue la especie más frecuentemente aislada y supuso casi el 45% de los 1.377 aislamientos en los 1.357 episodios de fungemia en el primer estudio44, y un porcentaje similar entre los 781 aislamientos (de entre 767 pacientes, 14 de ellos con fungemia mixta) en el segundo estudio31. Curiosamente, entre las especies de Candida no-C. albicans aisladas en ambos estudios, Candida parapsilosis ocupó el segundo lugar con un 29 y 24% respectivamente en cada estudio poblacional. En el estudio FUNGEMYCA la incidencia fue de 0,92 episodios por cada 1.000 ingresos, siendo la incidencia de C. albicans la más alta con 0,41 episodios por cada 1.000 ingresos, seguida de C. parapsilosis «sensu stricto» con 0,22. En el estudio CANDIPOP la incidencia anual calculada fue de 8,1 casos por cada 100.000 habitantes, 0,89 por cada 1.000 ingresos y 1,36 por cada 10.000 pacientes-días. En ambos estudios Candida glabrata y Candida tropicalis ocuparon la tercera y cuarta posición en cuanto a porcentaje de aislamientos y frecuencia en la candidemia. Sin embargo, esta distribución mostró cambios y diferencias notables entre ciudades, centros hospitalarios, salas o unidades de hospitalización y poblaciones de pacientes, con cambios notables en la población pediátrica o entre los pacientes críticos. En el grupo infantil la especie más frecuente entre los 200 aislamientos de 197 episodios fue C. parapsilosis «sensu stricto» con el 43%, seguida de C. albicans (36%) y C. tropicalis27. En el subestudio de pacientes críticos del CANDIPOP, de los 773 casos de candidemia, 752 de los cuales se incluyeron en la cohorte global, 168 (22,3%) tuvieron lugar en pacientes adultos ingresados en unidades médicas o quirúrgicas de enfermos críticos51. El rango de orden de los aislamientos de Candida fue el siguiente: C. albicans (52%), C. parapsilosis (23,7%), C. glabrata (12,7%), C. tropicalis (5,8%), Candida krusei (4%), y otras especies (1,8%). Como es bien sabido, las distintas especies de Candida se asocian a diferentes tipos de evolución, complicaciones y morbimortalidad de la candidemia.
Además de esta dinámica epidemiológica cambiante, y sus repercusiones pronósticas, estos estudios han permitido conocer y monitorizar el grado de resistencia a los antifúngicos, y más concretamente en el porcentaje de resistencias a los azoles, especialmente al fluconazol. Salvando las posibles diferencias metodológicas, la normativa de clasificación de los organismos oficiales y la época en cuestión, las tasas de sensibilidad al fluconazol fueron del 92% en los aislamientos de Candida del estudio FUNGEMYCA45 y casi del 80% en los del estudio CANDIPOP50. En el estudio FUNGEMYCA la sensibilidad al fluconazol fue similar en casi todas las áreas geográficas. Aunque la resistencia en C. albicans fue diez veces mayor en pacientes con edad superior a 64 años, la tasa global de resistencia a fluconazol (concentración mínima inhibitoria>32mg/l) había disminuido respecto a la obtenida en otro estudio de una década antes (3,7 frente a 2,5%) principalmente en C. albicans (3 frente a 1,6%)44. En el estudio CANDIPOP el 80% de los aislamientos fueron sensibles al fluconazol; este descenso en comparación con otros estudios se podría explicar por la mayor tasa de aislamientos de C. glabrata, especie con menor tasa de sensibilidad a este azol31. Con el uso de puntos de corte especie-específicos y puntos de corte epidemiológicos, las tasas de resistencia in vitro a voriconazol y posaconazol fueron bajas (<2%). En el caso de C. tropicalis la tasa de resistencia a los azoles estaba en torno al 20-30% de los aislamientos (el 23,2% para el fluconazol y el 26,8% para el voriconazol)25. Por todo ello, la disminución de la sensibilidad al fluconazol de los aislamientos hispánicos de Candida aconseja una monitorización estrecha en futuros estudios poblacionales. La resistencia a las equinocandinas fue excepcional (2%), al igual que la resistencia a la anfotericina B, también muy infrecuente. La secuenciación de las regiones hot spot de los genes FKS1 o FKS2 en aislamientos resistentes a las candinas mostró las mutaciones puntuales ya descritas en estudios previos.
En la población pediátrica la tasa de resistencia al fluconazol fue baja, menor al 5%, y aun menor en neonatos respecto a otros grupos de edad27. Por el contrario, en la población adulta de enfermos críticos la sensibilidad global al fluconazol fue del 79,2%51. Basándose en la metodología EUCAST, el 27,6% de los aislamientos de Candida fueron no-sensibles al fluconazol en el subgrupo de pacientes con neoplasias oncológicas y hematológicas, tasa inferior a la serie global del estudio CANDIPOP (32,6%)52.
Debido a las diferencias en cuanto a las especies de Candida aisladas y porcentajes variables de sensibilidad a los azoles según centro, servicio de ingreso, tipo de paciente, identificación y porcentaje de los aislamientos, área geográfica y momento temporal demostradas en estos estudios poblaciones, se han intentado diseñar herramientas predictivas a manera de score que permitan predecir e identificar los episodios de candidemia causados por especies no sensibles al fluconazol utilizando sencillos criterios clínicos. A partir del estudio CANDIPOP se extrajo una cohorte de derivación, siendo validado el score en una cohorte externa de pacientes adultos con candidemia en seis hospitales terciarios de tres países distintos. La herramienta predictiva se basó en tres variables seleccionadas por un modelo de regresión logística junto a la gravedad de la enfermedad21. Los factores que se asociaron de forma independiente a aislamientos no sensibles al fluconazol fueron el estado receptor de un trasplante (odds ratio ajustada [ORA] de 2,13), la hospitalización en una unidad con alta prevalencia (≥15%) de aislamientos no sensibles al fluconazol (ORA: 7,53), y tratamiento previo con azoles durante al menos 3 días (ORA: 2,04). El área bajo la curva ROC fue de 0,76, y usando 2 puntos como punto de corte del score de predicción de no sensibilidad al fluconazol la herramienta tuvo una sensibilidad del 82,1%, una especificidad del 65,6% y un valor predictivo negativo del 93%. Así, la herramienta predictiva ayuda a excluir aislamientos de Candida no sensibles al fluconazol, y ello podría mejorar la selección del tratamiento empírico de la candidemia en un futuro inmediato.
Dado que los pacientes quemados graves han estado escasamente representados en los estudios arriba mencionados, y puesto que la presentación clínica de los episodios de candidemia causados por C. albicans u otras especies del género es indistinguible, el diferente perfil de sensibilidad a los antifúngicos de las distintas especies debe ser tenido en cuenta en los enfermos con lesión térmica y situación crítica. Por ello, identificar los factores de riesgo para cualquier candidemia, así como reconocer las especies sensibles o resistentes al fluconazol, es crucial para guiar adecuadamente el tratamiento empírico inicial. Según el estudio de Cheng et al.15, los factores de riesgo más importantes para la candidemia causada por C. albicans son la edad avanzada, los procedimientos invasivos asociados con cuidados críticos y la sepsis aguda; para otras especies del género, el más sobresaliente sería la quimioterapia del cáncer en asociación con leucopenia y trombocitopenia, con esta última como un hallazgo común entre los pacientes quemados críticos. En otro estudio epidemiológico, C. albicans fue la especie más frecuente en pacientes que recibían corticoides, soporte de aminas vasoactivas e inotrópicas, perfusión de albúmina, NPT y protección gástrica con omeprazol, mientras que C. parapsilosis fue más común en pacientes receptores de terapia de reemplazo renal (hemodiálisis, diálisis peritoneal)20. Otro estudio adicional también ha comunicado diferencias significativas en los factores predisponentes entre la candidemia causada por C. albicans y otras especies del género, estando estas últimas asociadas con una estancia hospitalaria más prolongada antes del desarrollo de la candidemia y un número mayor de días totales en el uso de antibióticos1.
Factores pronósticos en el paciente quemadoHasta un 30-63% de los pacientes quemados tienen al menos un cultivo positivo para Candida, y la incidencia de candidemia u otras formas de CI varía del 2-21% en los enfermos con lesión térmica, con una mortalidad cruda asociada del 30-90%18,64. En los pacientes críticos en general, y por supuesto en los quemados graves en particular, el retraso o la ausencia de tratamiento antifúngico y de medidas de soporte son predictores de muerte independientes en la CI y representan un aspecto clave en la práctica clínica. La demora en más de 12h en la administración de antifúngicos desde la toma de sangre para hemocultivos incrementa la mortalidad en 2,09 veces según se afirma en el estudio de Morrell et al.40. Otro estudio retrospectivo multicéntrico confirmó y expandió estos hallazgos al mostrar que la mortalidad se incrementaba con cada día adicional en que el tratamiento empírico con fluconazol se retrasaba y que, por el contrario, el inicio precoz de la terapia con el azol se asociaba a una disminución de la estancia en las unidades de pacientes críticos28. Así, el tratamiento antimicrobiano inadecuado es un determinante independiente de mortalidad hospitalaria. Este hecho es relevante, por cuanto la fungemia se encuentra entre los síndromes infecciosos con tasas más elevadas de tratamiento empírico inapropiado8, con la omisión del propio tratamiento empírico como la causa más frecuente de error, seguida de una demora en el diagnóstico o incluso de un diagnóstico erróneo40. En un trabajo más reciente, pero muy controvertido en sus resultados e interpretación, los dos factores terapéuticos asociados a mejor supervivencia de la candidemia fueron el uso inicial de las equinocandinas y la retirada del CVC4. Este estudio consistió en la revisión de los ensayos aleatorizados para el tratamiento de la CI mediante la evaluación del impacto de factores relacionados con el huésped, el microorganismo y el tratamiento antifúngico respecto a la mortalidad y la curación clínica. En total se recogieron datos de 1.915 pacientes de siete ensayos clínicos, con una mortalidad global de los datos acumulados del 31% y una tasa de éxito terapéutico del 67%. En el análisis de regresión logística se identificaron como predictores de mortalidad la edad elevada, APACHE II alto, el uso de inmunosupresores y la infección por C. tropicalis. Por el contrario, la retirada del CVC (OR: 0,50) y el tratamiento inicial con equinocandinas (OR: 0,65) se asociaron con una disminución de la mortalidad. Es evidente que para que estas conclusiones sean válidas se debería aceptar que toda candidemia se origina en el propio CVC y por ello su retirada puede ser una actitud eficaz, lo que excluye las candidemias de origen endógeno, donde la retirada del CVC no es una medida eficaz en el control de la fungemia, y mucho menos necesaria.
Cuando se evalúan los pacientes con shock séptico atribuido a la infección por Candida y los determinantes evolutivos y factores pronósticos, la demora en el manejo adecuado de la candidemia y el control del foco aún cobran mayor relevancia. En un estudio retrospectivo unicéntrico de cohortes en 224 pacientes ingresados con shock séptico y candidemia, la mortalidad fue del 63,5% durante la hospitalización35. La tasa de mortalidad hospitalaria en pacientes con adecuado control del foco y tratamiento antifúngico administrado en las primeras 24h de inicio del shock fue del 52,8%, comparada con la tasa de mortalidad del 97,6% en pacientes en los que no se consiguieron estos objetivos (p <0,001). El análisis multivariado de regresión logística mostró que la demora en el tratamiento antifúngico (ORA: 33,75) y el fracaso en el control del foco (ORA: 77,40) eran factores independientes asociados a una mayor mortalidad intrahospitalaria.
La administración de NPT en pacientes con candidemia se ha mostrado también como un predictor independiente de mortalidad; además se ha comunicado en algún estudio retrospectivo que la candidemia por especies de Candida diferentes de C. albicans se asocia a menor incidencia de shock séptico, y que las causadas por C. albicans y C. glabrata tienen un peor pronóstico3. Esta correlación entre mortalidad y la especie de Candida aislada se refleja también en otros estudios, donde la mortalidad causada por C. parapsilosis fue la más baja (36%) y la debida a C. krusei la más elevada (55%)7. También se ha observado que el recuento bajo de plaquetas, el sondaje urinario, la enfermedad inflamatoria intestinal y el origen nosocomial de la fungemia son variables de riesgo independientes asociadas con un peor pronóstico20.
En uno de los subanálisis del estudio poblacional CANDIPOP, la mortalidad acumulada a los 7 y 30 días del primer episodio de candidemia en pacientes críticos fue del 16,5 y 47%, respectivamente51. El análisis multivariante mostró que un tratamiento antifúngico apropiado precoz y la retirada del CVC (OR: 0,27), el APACHE II (OR: 1,11) y el foco abdominal (OR: 8,15) fueron las variables asociadas de forma independiente a mortalidad precoz (0-7 días). Los factores determinantes de mortalidad tardía (8-30 días) fueron la edad (OR: 1,04), la intubación (OR: 7,24), la terapia de reemplazo de función renal (OR: 6,12) y el foco primario de la candidemia (OR: 2,51). Por lo tanto, la precocidad en la instauración de un tratamiento antifúngico apropiado y el control del foco de origen son esenciales para disminuir la mortalidad, especialmente la precoz.
Todo lo anterior destaca la importancia de una buena adherencia y cumplimiento de las guías de manejo de la candidemia y de sus estándares de calidad: tratamiento precoz y apropiado, elección adecuada del agente antifúngico (equinocandinas frente a fluconazol), control del foco, retirada del CVC si está indicado, repetición de los hemocultivos a las 48-72h para evaluar el «aclaramiento» de la candidemia, revisión oftalmológica, considerar la realización de ecocardiografía si se sospecha de endocarditis, diagnóstico precoz de metástasis sépticas a distancia, planteamiento de ajuste del tratamiento antifúngico («desescalonamiento») ante mejora y estabilidad clínica y hemodinámica, etc.13,42,66. A pesar de todo, después de varias décadas, la mortalidad general en la CI sigue estando en torno al 40%, incluso cuando los pacientes reciben tratamiento antifúngico apropiado36.
Sin embargo, muchos de estos estudios que sugieren que el control del foco de infección fúngica y el uso precoz de tratamiento antifúngico apropiado son determinantes mayores en la supervivencia de la candidemia y la CI son observacionales y retrospectivos; aunque es plausible que estos factores sean beneficiosos y deseables en el manejo de estas IFI por levaduras, tales estrategias no han sido validadas en estudios prospectivos. Otras estrategias más refinadas incluyen el tratamiento guiado por reglas de predicción basadas en factores de riesgos clínicos, la presencia de colonización por Candida y los resultados del cribado y monitorización mediante biomarcadores de cinética fúngica38. Sin embargo, ninguna de estas estrategias de forma simple o combinada ha mostrado que pueda reducir la mortalidad o duración de la estancia en estudios prospectivos. Además, estas reglas de predicción no son generalmente aplicables más allá de los centros o contextos y pacientes en los que fueron evaluadas, y pocas veces incluyen enfermos críticos quemados graves13, sin olvidar que la utilidad clínica de las herramientas predictivas y escalas de riesgo se ve afectada por la baja prevalencia de la CI y la candidemia en algunos centros y unidades especiales17,49.
Patogénesis característica y singular de la candidemia en pacientes quemadosPese a la existencia de una extensa bibliografía acerca de la candidemia nosocomial, son escasos los estudios que se ocupan de esta fungemia en el gran quemado. Estos pacientes, además de compartir los factores de riesgo para infecciones fúngicas presentes en los pacientes críticos, poseen ciertas características que los hacen especialmente susceptibles, como son la pérdida de la barrera cutánea por las quemaduras extensas, la colonización de las mismas y el uso de hidroterapia u otras terapias tópicas (ocasionalmente con antimicrobianos) como tratamiento del paciente quemado.
Existen dos vías principales por las que Candida alcanza el torrente sanguíneo en los enfermos quemados: por vía endógena, a través de la barrera mucosa del tracto gastrointestinal, y por vía exógena, a través de la piel y tejidos blandos (en este caso, desde la propia herida por la quemadura o sus cirugías posteriores). Otros focos putativos pueden incluir el tracto genitourinario, las soluciones intravenosas contaminadas y las manos del personal sanitario63. El tracto intestinal es todavía considerado la fuente de candidemia más importante ya que las especies de Candida forman parte de la microbiota intestinal normal. La inmunosupresión de los pacientes quemados junto con la alteración del peristaltismo intestinal promueven el sobrecrecimiento de levaduras y su ulterior translocación desde la luz intestinal al torrente sanguíneo. Este mecanismo se encuentra particularmente facilitado en el contexto del shock y de la consiguiente hipoperfusión de la mucosa intestinal. Este origen de la candidemia es apoyado por estudios moleculares que muestran que las cepas infectantes en sangre son las mismas que las de la propia flora del paciente, y que la densidad de colonización intestinal es un buen predictor de la candidemia. La capacidad de las especies de Candida de adherirse no solo a las membranas mucosas sino también a las superficies endoteliales y a las superficies abióticas de los dispositivos médicos permanentes es posiblemente la representación de un importante atributo de virulencia que favorecería la invasividad de las levaduras endógenas. Sin embargo, considerando las tendencias actuales que implican un inicio precoz de la alimentación enteral en pacientes quemados, esta vía de adquisición puede ser algo menos relevante de lo hasta ahora aceptado37.
La penetración a través de la piel representa un foco primario muy importante en pacientes quemados, y puede resultar de la herida térmica en sí misma o de la contaminación de los CVC adyacentes a la piel colonizada. Aunque la colonización por sí sola no es un criterio predictor seguro sobre qué pacientes desarrollarán fungemia, la candidemia es muy infrecuente en un paciente libre de colonización por levaduras. Sheridan et al.59 revisaron retrospectivamente la colonización e infección por Candida en 962 niños con quemaduras y encontraron que los 17 pacientes con candidemia tenían la misma especia aislada en los cultivos de la herida por quemadura que la recuperada en los hemocultivos, mientras que en solo el 35% de los cultivos de heces se aisló la misma especie de Candida que en sangre.
Otro de los elementos clave en la patogénesis de la candidemia en el paciente quemado son los efectos inmunológicos que ejerce la propia lesión térmica. Esta inmunosupresión especial es parcialmente responsable de promover una mayor susceptibilidad a la infección en el paciente quemado, además de los efectos de disrupción de la función de barrera de una epidermis intacta. Los linfocitos T CD4+ desempeñan aparentemente un rol significativo en la protección y mantenimiento de una barrera mucosa intacta frente a las infecciones por Candida, de ahí que la esofagitis candidiásica fuera frecuente en pacientes con sida y bajos recuentos de células T CD4+, como ocurría en la época previa al tratamiento antirretroviral eficaz. Sin embargo, los neutrófilos son la defensa celular primaria del huésped frente a la invasión por Candida. Los pacientes quemados tienen una disminución de linfocitos T CD3+, CD4+ y CD8+, con inversión del cociente normal CD8+/CD4+; además, la función fagocitaria se encuentra significativamente menguada en pacientes quemados16. Otros factores de inmunosupresión, como el consumo de componentes de la vía clásica y/o alternativa del complemento, pueden representar importantes mecanismos adyuvantes por los cuales la infección podría perpetuarse, como es el caso de una toxina específica del quemado, identificada como un complejo lipoproteico formado por la polimerización inducida por el calor de varios polipéptidos cutáneos9,22. Aunque los mecanismos de inmunosupresión mediada por el complejo lipoproteico todavía no se encuentran del todo aclarados, es conocido que se comportan como potentes inhibidores del crecimiento celular dependiente de la interleucina-2, y así parece cómo al menos parte de la acción inmunosupresora de este complejo daría lugar a la alteración de la activación de las células T24.
Por todo ello, los pacientes quemados presentan un considerable grado de inmunosupresión y defectos tanto en la función de las células T (importantes para la prevención de la colonización y la invasión superficial de las levaduras) como en la fagocitosis (relevante en la prevención de la invasión profunda y la diseminación hematógena), todos los cuales se encuentran asociados invariablemente a un riesgo elevado de infección fúngica63. En el estudio de Fazal y Al-Ghoul se muestra cómo la lesión térmica junto con la sepsis contribuyen a una depleción substancial de células T CD4+ intestinales a causa de fenómenos de apoptosis, que conllevan una disfunción inmunitaria en ocasiones irreversible24.
La herida por quemadura es estéril nada más producirse, pero en las primeras 48h es colonizada, primeramente por bacterias. Las complejas interacciones entre bacterias y hongos en las heridas térmicas pueden limitar el crecimiento fúngico inicialmente pero la ubicuidad ambiental de los hongos junto con la pérdida de barreras protectoras hacen particularmente vulnerables a los pacientes quemados32. Además, la lesión térmica suprime la inmunidad celular que, junto a la combinación con antibacterianos de amplio espectro, facilita el sobrecrecimiento de Candida en las superficies mucosas. La disrupción mucosa propia de las quemaduras también estimula la translocación fúngica, debido a que la atrofia mucosa gastrointestinal se correlaciona con el porcentaje de SQC, y el íleo asociado complica frecuentemente a aquellos enfermos quemados con>25% de la SQC. Los linfocitos de la lámina propia poseen una papel relevante en la inmunidad mucosa intestinal frente a C. albicans, a través de un incremento en la concentración de anticuerpos IgA específicos en el moco intestinal. Se han encontrado cultivos positivos de C. albicans en ganglios linfáticos 12h después de la quemadura con persistencia de estas levaduras en los ganglios regionales durante cierto tiempo después60. Por ello, la amplia introducción de antibacterianos tópicos eficaces en los quemados ha sido ligada también con el incremento de las tasas de infección fúngica de las heridas por quemadura. Como resultado del extenso sangrado que ocurre durante la escisión precoz de la herida por quemadura, las transfusiones sanguíneas constituyen un factor de riesgo potencial adicional para la infección bacteriana y fúngica debido a su efecto inmunosupresor39. En la era donde la estrategia del manejo quirúrgico de la quemadura camina hacia la escisión precoz y un pronto cierre mediante coberturas, debería ser incierto que el tamaño y extensión de la misma constituyera un factor de riesgo tan esencial para la colonización e infección de la superficie lesionada, como la duración de la estancia hospitalaria y la resistencia a los antimicrobianos tópicos y sistémicos.
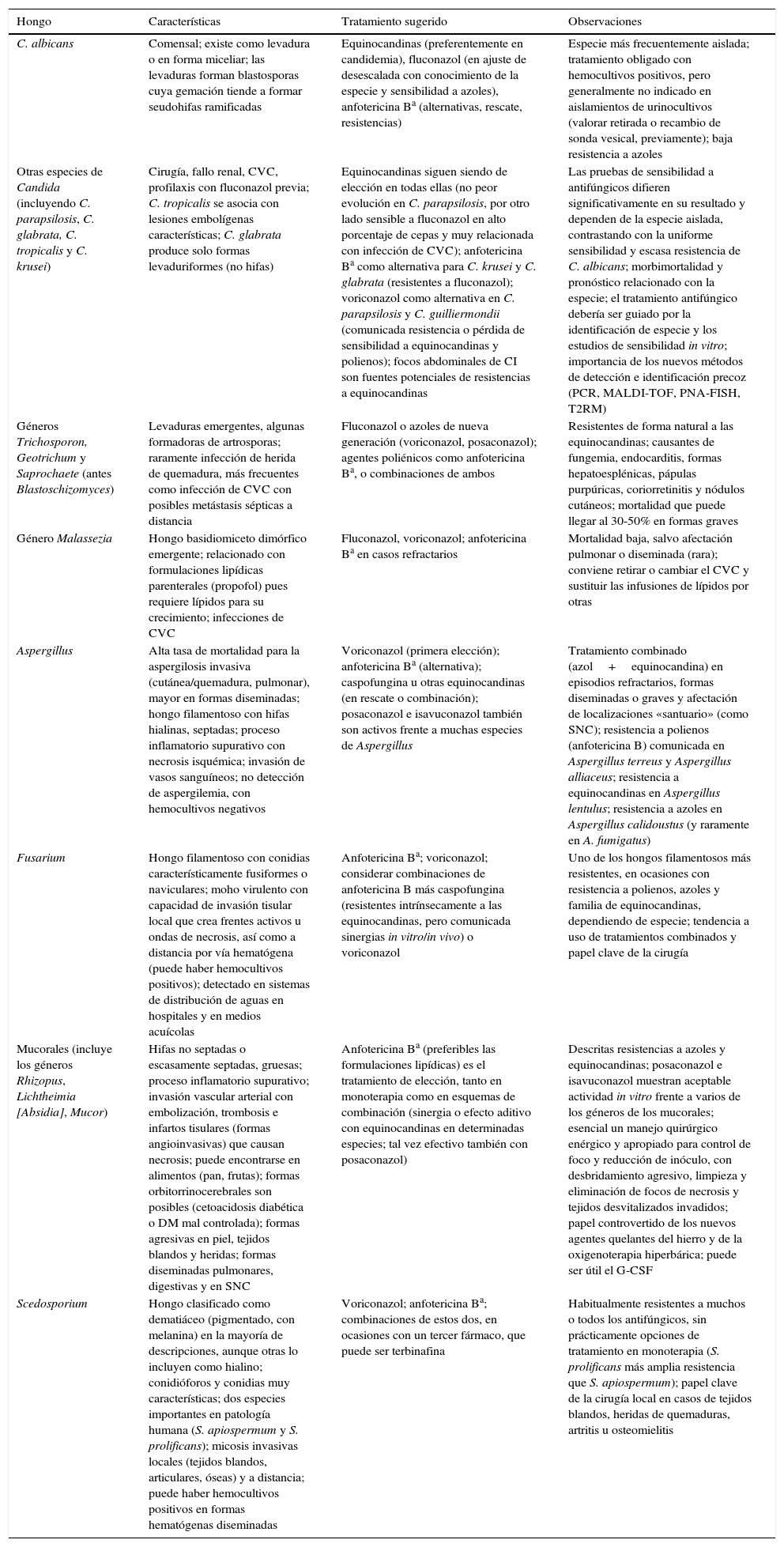
En la tabla 1 se resumen las principales características clínico-epidemiológicas y los aspectos de manejo más relevantes de las IFI por hongos levaduriformes en pacientes quemados.
Características clínico-epidemiológicas y terapéuticas de las infecciones fúngicas más relevantes en pacientes quemados graves
| Hongo | Características | Tratamiento sugerido | Observaciones |
|---|---|---|---|
| C. albicans | Comensal; existe como levadura o en forma miceliar; las levaduras forman blastosporas cuya gemación tiende a formar seudohifas ramificadas | Equinocandinas (preferentemente en candidemia), fluconazol (en ajuste de desescalada con conocimiento de la especie y sensibilidad a azoles), anfotericina Ba (alternativas, rescate, resistencias) | Especie más frecuentemente aislada; tratamiento obligado con hemocultivos positivos, pero generalmente no indicado en aislamientos de urinocultivos (valorar retirada o recambio de sonda vesical, previamente); baja resistencia a azoles |
| Otras especies de Candida (incluyendo C. parapsilosis, C. glabrata, C. tropicalis y C. krusei) | Cirugía, fallo renal, CVC, profilaxis con fluconazol previa; C. tropicalis se asocia con lesiones embolígenas características; C. glabrata produce solo formas levaduriformes (no hifas) | Equinocandinas siguen siendo de elección en todas ellas (no peor evolución en C. parapsilosis, por otro lado sensible a fluconazol en alto porcentaje de cepas y muy relacionada con infección de CVC); anfotericina Ba como alternativa para C. krusei y C. glabrata (resistentes a fluconazol); voriconazol como alternativa en C. parapsilosis y C. guilliermondii (comunicada resistencia o pérdida de sensibilidad a equinocandinas y polienos); focos abdominales de CI son fuentes potenciales de resistencias a equinocandinas | Las pruebas de sensibilidad a antifúngicos difieren significativamente en su resultado y dependen de la especie aislada, contrastando con la uniforme sensibilidad y escasa resistencia de C. albicans; morbimortalidad y pronóstico relacionado con la especie; el tratamiento antifúngico debería ser guiado por la identificación de especie y los estudios de sensibilidad in vitro; importancia de los nuevos métodos de detección e identificación precoz (PCR, MALDI-TOF, PNA-FISH, T2RM) |
| Géneros Trichosporon, Geotrichum y Saprochaete (antes Blastoschizomyces) | Levaduras emergentes, algunas formadoras de artrosporas; raramente infección de herida de quemadura, más frecuentes como infección de CVC con posibles metástasis sépticas a distancia | Fluconazol o azoles de nueva generación (voriconazol, posaconazol); agentes poliénicos como anfotericina Ba, o combinaciones de ambos | Resistentes de forma natural a las equinocandinas; causantes de fungemia, endocarditis, formas hepatoesplénicas, pápulas purpúricas, coriorretinitis y nódulos cutáneos; mortalidad que puede llegar al 30-50% en formas graves |
| Género Malassezia | Hongo basidiomiceto dimórfico emergente; relacionado con formulaciones lipídicas parenterales (propofol) pues requiere lípidos para su crecimiento; infecciones de CVC | Fluconazol, voriconazol; anfotericina Ba en casos refractarios | Mortalidad baja, salvo afectación pulmonar o diseminada (rara); conviene retirar o cambiar el CVC y sustituir las infusiones de lípidos por otras |
| Aspergillus | Alta tasa de mortalidad para la aspergilosis invasiva (cutánea/quemadura, pulmonar), mayor en formas diseminadas; hongo filamentoso con hifas hialinas, septadas; proceso inflamatorio supurativo con necrosis isquémica; invasión de vasos sanguíneos; no detección de aspergilemia, con hemocultivos negativos | Voriconazol (primera elección); anfotericina Ba (alternativa); caspofungina u otras equinocandinas (en rescate o combinación); posaconazol e isavuconazol también son activos frente a muchas especies de Aspergillus | Tratamiento combinado (azol+equinocandina) en episodios refractarios, formas diseminadas o graves y afectación de localizaciones «santuario» (como SNC); resistencia a polienos (anfotericina B) comunicada en Aspergillus terreus y Aspergillus alliaceus; resistencia a equinocandinas en Aspergillus lentulus; resistencia a azoles en Aspergillus calidoustus (y raramente en A. fumigatus) |
| Fusarium | Hongo filamentoso con conidias característicamente fusiformes o naviculares; moho virulento con capacidad de invasión tisular local que crea frentes activos u ondas de necrosis, así como a distancia por vía hematógena (puede haber hemocultivos positivos); detectado en sistemas de distribución de aguas en hospitales y en medios acuícolas | Anfotericina Ba; voriconazol; considerar combinaciones de anfotericina B más caspofungina (resistentes intrínsecamente a las equinocandinas, pero comunicada sinergias in vitro/in vivo) o voriconazol | Uno de los hongos filamentosos más resistentes, en ocasiones con resistencia a polienos, azoles y familia de equinocandinas, dependiendo de especie; tendencia a uso de tratamientos combinados y papel clave de la cirugía |
| Mucorales (incluye los géneros Rhizopus, Lichtheimia [Absidia], Mucor) | Hifas no septadas o escasamente septadas, gruesas; proceso inflamatorio supurativo; invasión vascular arterial con embolización, trombosis e infartos tisulares (formas angioinvasivas) que causan necrosis; puede encontrarse en alimentos (pan, frutas); formas orbitorrinocerebrales son posibles (cetoacidosis diabética o DM mal controlada); formas agresivas en piel, tejidos blandos y heridas; formas diseminadas pulmonares, digestivas y en SNC | Anfotericina Ba (preferibles las formulaciones lipídicas) es el tratamiento de elección, tanto en monoterapia como en esquemas de combinación (sinergia o efecto aditivo con equinocandinas en determinadas especies; tal vez efectivo también con posaconazol) | Descritas resistencias a azoles y equinocandinas; posaconazol e isavuconazol muestran aceptable actividad in vitro frente a varios de los géneros de los mucorales; esencial un manejo quirúrgico enérgico y apropiado para control de foco y reducción de inóculo, con desbridamiento agresivo, limpieza y eliminación de focos de necrosis y tejidos desvitalizados invadidos; papel controvertido de los nuevos agentes quelantes del hierro y de la oxigenoterapia hiperbárica; puede ser útil el G-CSF |
| Scedosporium | Hongo clasificado como dematiáceo (pigmentado, con melanina) en la mayoría de descripciones, aunque otras lo incluyen como hialino; conidióforos y conidias muy características; dos especies importantes en patología humana (S. apiospermum y S. prolificans); micosis invasivas locales (tejidos blandos, articulares, óseas) y a distancia; puede haber hemocultivos positivos en formas hematógenas diseminadas | Voriconazol; anfotericina Ba; combinaciones de estos dos, en ocasiones con un tercer fármaco, que puede ser terbinafina | Habitualmente resistentes a muchos o todos los antifúngicos, sin prácticamente opciones de tratamiento en monoterapia (S. prolificans más amplia resistencia que S. apiospermum); papel clave de la cirugía local en casos de tejidos blandos, heridas de quemaduras, artritis u osteomielitis |
CI: candidiasis invasiva; CVC: catéter vascular central; DM: diabetes mellitus; G-CSF: factor estimulante de colonias granulocíticas; SNC: sistema nervioso central.
Además de la candidiasis diseminada, ocasionalmente se han descrito en pacientes quemados infecciones causadas por otros géneros de levaduras, como las tricosporonosis, geotricosis y sacaromicosis34,61, así como infecciones por hongos filamentosos (especies de Aspergillus, Fusarium y Mucor, entre otros), aislados en diferentes muestras de estos pacientes, fundamentalmente exudados o biopsias de quemaduras. El perfil clínico de estas otras IFI, al menos las causadas por levaduras diferentes del género Candida, puede ser similar al de la candidemia o CI, un tanto inespecífico, difícil de distinguir sindrómicamente y afectando u originándose bien en la herida por quemadura o en los CVC. Aunque las IFI emergentes por otras levaduras (Trichosporon, Saprochaete, Geotrichum, Malassezia, Saccharomyces, Hansenula y Rhodotorula, habitualmente aislados como colonizadores de piel y mucosas) son infrecuentes como micosis nosocomiales, su importancia reside en la virulencia de su comportamiento, en el grado de profunda y prolongada inmunosupresión del huésped en el que asientan y en las opciones limitadas del tratamiento antifúngico debido a su perfil de amplia resistencia. La contribución del género Cryptococcus en las infecciones fúngicas de los pacientes quemados es excepcional.
Aunque la IFI por hongos filamentosos es más infrecuente, con una incidencia del 1,7% en algún estudio, la mortalidad es mayor que la causada por levaduras. Entre estos mohos, el género Aspergillus destaca por su frecuencia, mayor en número de aislamientos en comparación con los mucorales y las especies de Fusarium, si bien todos ellos son particularmente virulentos e invasivos. La mayoría de estas IFI por mohos se producen sobre la herida por quemadura en aquellos enfermos con mayor extensión de SQC, mayor gravedad, uso amplio y dilatado de antibacterianos, y estancias más prolongadas en las unidades de enfermos críticos. En una de las series más extensas publicadas, el 30% de los pacientes con aspergilosis de la herida por quemadura fallecieron57.
En otro estudio retrospectivo multicéntrico que revisó todos los pacientes quemados con cultivos fúngicos positivos ingresados en alguno de los 15 centros hospitalarios con unidades de quemados críticos durante un periodo de dos años, las tasas de IFI oscilaron entre el 0,7 y el 24%, variando según la unidad. De nuevo, se observó que la mortalidad fue más elevada en pacientes con IFI por Aspergillus u otros mohos en los cultivos, respecto a las levaduras. Los pacientes fueron divididos en tres grupos, dependiendo de la estrategia de tratamiento: profilaxis únicamente (tópica o con nistatina oral), tratamiento no sistémico incluyendo escisión de la quemadura más agentes tópicos, y tratamiento antifúngico sistémico. Los pacientes que necesitaron tratamiento sistémico mostraron la tasa de mortalidad más alta (21,2%), tendieron a ser de mayor edad y tuvieron una SQC más extensa, así como una alta incidencia de lesión térmica por inhalación6.
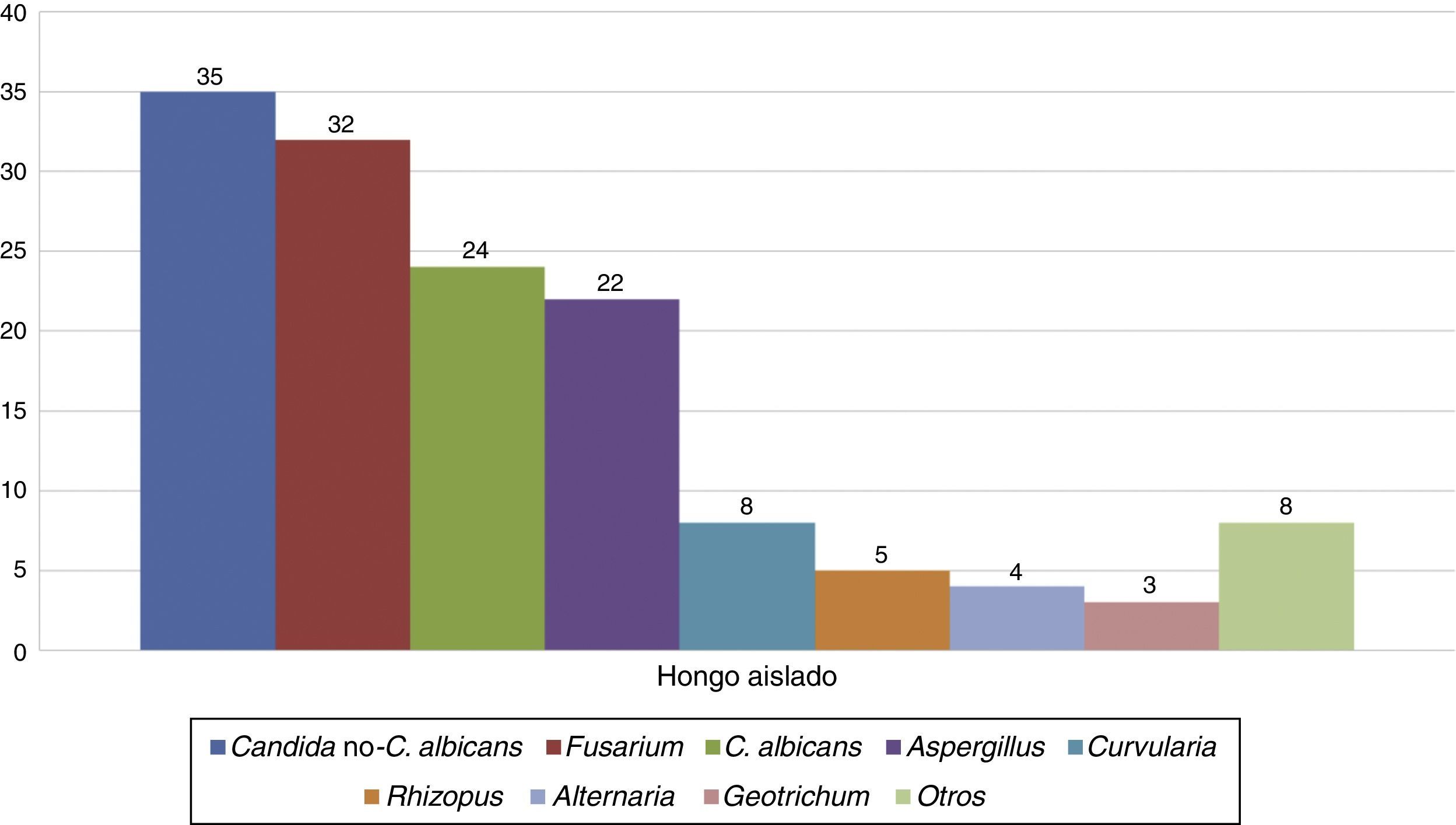
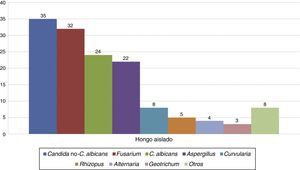
En la figura 1 se muestran los aislamientos fúngicos en pacientes quemados ingresados en el Galveston Shriners Hospital (Texas) durante 2006-2008. C. albicans, otras especies del género y el género Fusarium fueron los patógenos fúngicos aislados con mayor frecuencia12. En la tabla 1 se resumen las principales características clínico-epidemiológicas y los aspectos de manejo más relevantes de las IFI por hongos filamentosos en pacientes quemados.
Géneros o especies de hongos aislados en heridas por quemadura de pacientes ingresados en el Shriners Hospital for Children, Galveston (Texas; EE. UU.), durante el periodo 2006-2008 (n=108 pacientes). En algunos pacientes se aisló más de una especie de hongo. Adaptada de Branski et al.12.
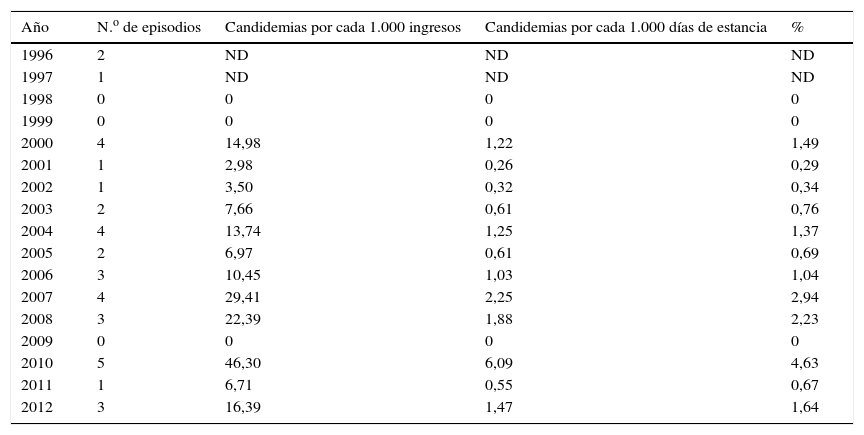
Para concluir esta puesta al día de la IFI en los pacientes quemados graves (predominantemente causada por el género Candida y otras levaduras), seguidamente se expone de forma resumida un estudio observacional retrospectivo realizado en nuestro centro (Hospital Universitario y Politécnico La Fe), un hospital terciario de referencia con una UCGQ53. Durante los 13 años analizados en el estudio (1996-2012) se diagnosticaron 36 episodios de candidemia (incidencia media del 1,19%). La incidencia varió entre 0,26 y 6,09 episodios/1.000 días de estancia en los distintos años del estudio (tabla 2). El 55,6% de los pacientes fueron varones y la edad media global al diagnóstico de la candidemia fue 37,33 años (desviación estándar [DE]: 2,92). La mayoría de los pacientes (63,9%) se encontraban ingresados en la UCGQ cuando presentaron el episodio. La estancia media hospitalaria de estos pacientes fue de 75,05 días (DE; 9,99) y la mediana de días desde el momento del ingreso hasta el desarrollo de la candidemia fue de 25 días (rango intercuartílico [RIQ]; 19). Los pacientes incluidos en el estudio tenían escasa comorbilidad previa. La media de SQC de los pacientes evaluados fue del 41,50% (DE; 3,693); el 55,6% presentaron quemaduras en cara, el 13,9% en cuero cabelludo, el 80,6% en tronco, el 94,4% en miembros superiores y el 91,7% en miembros inferiores. En la mayor parte de los pacientes coexistían las quemaduras de segundo y tercer grado, si bien se registraron quemaduras de segundo grado en 30 pacientes y de tercer grado en 33 pacientes. El CVC se estableció como potencial foco de la candidemia en 13 pacientes (36,1%), la piel (herida de quemadura) en 8 casos (22,2%) y el tracto urinario en 3 (8,3%). En el momento de la candidemia la mediana del índice APACHE II fue de 20 (RIQ: 19). En torno a un 80% de los pacientes presentaron infecciones bacterianas previas o concomitantes a la candidemia. Todos los pacientes recibieron antibióticos en el mes previo a la candidemia y la mayoría presentaron los factores de riesgo que están ampliamente descritos en la literatura (ingreso en UCGQ, ventilación mecánica, NPT, sonda vesical, CVC, etc.).
Incidencia de candidemia en pacientes quemados graves del Hospital Universitario y Politécnico La Fe en un periodo de 13 años
| Año | N.o de episodios | Candidemias por cada 1.000 ingresos | Candidemias por cada 1.000 días de estancia | % |
|---|---|---|---|---|
| 1996 | 2 | ND | ND | ND |
| 1997 | 1 | ND | ND | ND |
| 1998 | 0 | 0 | 0 | 0 |
| 1999 | 0 | 0 | 0 | 0 |
| 2000 | 4 | 14,98 | 1,22 | 1,49 |
| 2001 | 1 | 2,98 | 0,26 | 0,29 |
| 2002 | 1 | 3,50 | 0,32 | 0,34 |
| 2003 | 2 | 7,66 | 0,61 | 0,76 |
| 2004 | 4 | 13,74 | 1,25 | 1,37 |
| 2005 | 2 | 6,97 | 0,61 | 0,69 |
| 2006 | 3 | 10,45 | 1,03 | 1,04 |
| 2007 | 4 | 29,41 | 2,25 | 2,94 |
| 2008 | 3 | 22,39 | 1,88 | 2,23 |
| 2009 | 0 | 0 | 0 | 0 |
| 2010 | 5 | 46,30 | 6,09 | 4,63 |
| 2011 | 1 | 6,71 | 0,55 | 0,67 |
| 2012 | 3 | 16,39 | 1,47 | 1,64 |
C. albicans fue la especie aislada más frecuentemente (61,1%), seguida de C. parapsilosis (27,8%), C. krusei (5,6%), C. glabrata (2,8%) y C. tropicalis (2,8%). El 82,4% de las especies colonizadoras coincidieron con la especie causante de la candidemia. Las candidemias causadas por C. krusei, C. glabrata o C. tropicalis fueron todas observadas después del año 2004. Se observó una menor sensibilidad o resistencia al fluconazol solo en 5 aislamientos (13,9%). De estos 5 casos, y excluyendo los dos episodios por C. krusei, los tres restantes correspondieron a dos aislamientos de C. albicans y un aislamiento de C. glabrata. La mediana de hemocultivos positivos fue de 2 (RIQ 1), y la mediana de tiempo de crecimiento de 30,45h (RIQ: 19,35). En el 80,6% de los casos la candidemia fue causada por una única especie de Candida (pudiendo existir, no obstante, bacteriemia concomitante) y en tres casos la fungemia fue multiespecie.
En el 97,2% de los casos se instauró tratamiento antifúngico empírico, siendo este correcto en un 88,9% de los episodios. La mediana de tiempo transcurrido hasta el inicio de un tratamiento correcto fue de 24h (RIQ 36). El fluconazol fue utilizado en 19 pacientes (52,7%). Teniendo en cuenta todos los grupos de antifúngicos, todas las vías de administración, y que algunos se prescribieron simultáneamente, la duración media del tratamiento antifúngico fue de 18,89 días (DE 2,39). Además del tratamiento antifúngico, en el 83,3% de los casos se retiraron o cambiaron los dispositivos instrumentales (CVC o sonda vesical) potencialmente infectados o causantes de la candidemia.
De los 36 pacientes de nuestra serie, 19 (52,7%) se curaron de la candidemia y 17 (47,2%) fallecieron. La mediana de días hasta el momento de la muerte se situó en 5 (RIQ 59). De los 17 fallecidos, 16 de ellos (44,4%) murieron en los 30 días posteriores a la candidemia y la mortalidad atribuible fue del 30,6%. La mortalidad fue precoz en el 58,8% de los pacientes y tardía en el 41,2% restante. Solo en un paciente se observó recidiva y en 5 enfermos (13,9%) se cumplieron criterios diagnósticos de candidemia de brecha o intercurrente. La asociación entre la mortalidad y la especie de Candida o posibles focos causantes de la candidemia no alcanzó significación estadística, probablemente a causa del escaso tamaño muestral. Los factores asociados con un incremento de la mortalidad fueron aquellos relacionados con infección grave y shock.
Tras esta experiencia de un solo centro, limitada en número de casos pero dilatada en el tiempo, aconteciendo antes y después de la llegada de los nuevos antifúngicos (azoles de espectro extendido y equinocandinas), puede concluirse que el diagnóstico de la candidemia y de la CI en el paciente quemado crítico es susceptible de mejora en rapidez y precisión, y que el manejo médico y quirúrgico supone todavía un verdadero desafío que aconseja el trabajo en equipo con una visión complementaria y multidisciplinar.
Conflicto de interesesA.R. no tiene nada que declarar. CGV y MS son consultores de las compañías farmacéuticas Astellas Pharma, Gilead, MSD y Pfizer, y ocasionalmente han dictado conferencias subvencionadas por las citadas empresas o han recibido ayudas para la investigación.