Las infecciones fúngicas causadas por levaduras son poco frecuentes en la actualidad en los receptores de órgano sólido. La más común es la candidiasis (2%), que suele presentarse en el primer mes postrasplante en pacientes con factores de riesgo. Se han descrito factores de riesgo comunes y otros específicos de cada tipo de trasplante, lo que permite realizar estrategias de profilaxis dirigida de gran eficacia. La presentación clínica predominante es la fungemia, así como las infecciones cercanas al injerto. La criptococosis es más tardía, su incidencia no ha disminuido y no se conocen los factores de riesgo. En presencia de infecciones muy precoces ha de considerarse la posibilidad de transmisión con el injerto. La criptococosis suele manifestarse como meningitis, neumonía o infección diseminada. Es preciso excluir siempre la posibilidad de complicaciones asociadas como la hipertensión intracraneal y la reconstitución inmune.
Dada la carencia de ensayos terapéuticos específicos en esta población, las recomendaciones de tratamiento antifúngico se basan en la información derivada de la población general. Es importante, sin embargo, considerar de forma cuidadosa el riesgo de interacciones medicamentosas, sobre todo entre azoles e inhibidores de la calcineurina. Tanto la candidiasis como la criptococosis incrementan significativamente la mortalidad de los pacientes receptores de órgano sólido.
Invasive yeast diseases are uncommon nowadays in solid organ transplant recipients. Invasive candidiasis (2%) usually presents during the first month after transplantation in patients with risk factors. Both common and transplant-specific risk factors have been identified, allowing very efficacious targeted prophylaxis strategies. The most common clinical presentations are fungaemia and local infections near the transplantation area. Cryptococcosis is usually a late infection. Its incidence remains stable and the specific risk factors have not been identified. When cryptococcosis is detected very early, transmission with the allograft should be considered. The most common clinical presentations include meningitis, pneumonia, and disseminated infection. Intracranial hypertension and immune reconstitution syndrome have to be considered.
No therapeutic clinical trials have been conducted in solid organ transplant recipients, thus treatment recommendations are derived from data obtained from the general population. It is particularly important to consider the possibility of drug-drug interactions, mainly between azoles and calcineurin inhibitors. Both invasive candidiasis and cryptococcosis increase the mortality significantly in solid organ transplant recipients.
Los pacientes con un trasplante de órgano sólido (TOS) tienen un riesgo elevado de sufrir infecciones fúngicas invasoras (IFI) como consecuencia de la inmunosupresión a que son sometidos y de aspectos relacionados con la propia cirugía. Globalmente, las IFI más frecuentes son las causadas por hongos levaduriformes, principalmente por especies de Candida y Cryptococcus. Ambos tipos de infecciones serán revisadas en este trabajo.
CandidiasisEpidemiologíaAproximadamente el 2% de los pacientes con TOS desarrollan una candidiasis invasora (CI). Afortunadamente la frecuencia de CI en el TOS ha ido descendiendo en las últimas décadas, pero sigue suponiendo más del 50% de todas las IFI en esta población. La incidencia de CI varía según el órgano trasplantado. En el estudio TRANSNE32, uno de los mayores estudios epidemiológicos de IFI en TOS realizados hasta la fecha, la incidencia de candidiasis fue del 1,8% en el trasplante renal, del 4,1% en el trasplante cardiaco, del 4,7% en el trasplante pulmonar, del 5,7% en el trasplante hepático, del 8% en el trasplante pancreático y del 26,7% en el trasplante intestinal. La infección por Candida representó el 85% de todas las IFI en trasplantados intestinales, el 76% en los pancreáticos, el 68% en los hepáticos, el 49% en los renales y cardiacos y el 23% en los pulmonares. Candida albicans fue la especie más frecuentemente aislada (46,2%), seguida de Candida glabrata (24,8%), Candida parapsilosis (8,6%) y Candida tropicalis (4,4%).
La mortalidad de un paciente TOS con CI es muy elevada (superior al 60% en algunas series)28,32. Los factores de riesgo de mortalidad por CI son la afectación funcional del órgano trasplantado, la presencia de neutropenia (<500neutrófilos) y el uso de corticoides. En algunas series la edad superior a 60años y la aparición tardía de la CI (después de 30días del trasplante) son también factores que incrementan el riesgo de muerte. Como factor de protección se ha identificado en algún estudio la profilaxis con fluconazol en los 100días postrasplante30.
Factores de riesgoAunque la CI puede en ocasiones transmitirse a través del propio injerto o del líquido de perfusión del mismo, los factores de riesgo más importantes para padecer una CI en el paciente trasplantado dependerán del tipo de trasplante y de la manipulación quirúrgica a la que se le somete. Así, en pacientes con trasplante hepático, la colédoco-yeyunostomía se asocia a un mayor riesgo de infección que la anastomosis colédoco-colédoco. En el trasplante pancreático, el drenaje entérico se asocia a mayor riesgo que el drenaje a vía urinaria. Además, existen otros factores de riesgo comunes a todos los pacientes TOS, como son la insuficiencia renal aguda, la infección previa por citomegalovirus, el rechazo agudo del injerto, la reintervención quirúrgica y la colonización previa por Candida20,40. Otros factores de riesgo son la diabetes y la diálisis prolongada previa en el caso de trasplante pancreático y renal, respectivamente26,34.
La colonización por Candida es variable según el órgano trasplantado, pero puede alcanzar al 15-50% de los pacientes. La administración de dosis elevadas de prednisona (>10mg/día) y quizás de tacrolimus (>10mg/día) se consideran factores de riesgo de colonización por Candida3,13.
Manifestaciones clínicasLa infección candidiásica más frecuente en el paciente TOS es la mucositis oral. El tipo de CI más frecuente es la candidemia, asociada o no a clínica de candidiasis diseminada, con afectación focal (esofágica, ocular, cardiaca, renal, peritoneal o intraabdominal, osteoarticular o del sistema nervioso central). La candidemia aislada puede presentarse como un cuadro febril o como un síndrome séptico, indistinguible de una sepsis bacteriana grave.
Las infecciones de órgano más frecuentes son la peritonitis candidiásica en el trasplante de páncreas y hepático, y la colangitis y los abscesos de la encrucijada hepatobiliar en el trasplante hepático3,26,34,39.
Tratamiento de la candidiasis en el trasplante de órgano sólidoEl tratamiento de la infección por Candida en pacientes con TOS no difiere básicamente del recomendado en las guías terapéuticas en vigor para otros pacientes inmunodeprimidos1,9. Dado que no existen estudios aleatorizados dirigidos exclusivamente a pacientes con TOS, se extrapolan los resultados obtenidos en estudios heterogéneos en los que se incluye también a estos pacientes.
Debe recordarse que es necesario conocer la sensibilidad de las diferentes especies de Candida para elegir el tratamiento antifúngico definitivo, especialmente en un paciente inmunodeprimido como es el receptor de TOS. La anfotericinaB (AMB) liposomal es eficaz en general para todas las especies, salvo para Candida lusitaniae. Aunque los azoles (fluconazol, itraconazol, voriconazol y posaconazol) son en general activos frente a la mayoría de las especies de Candida, el voriconazol y el posaconazol presentan una mayor actividad, especialmente frente a Candida krusei o C.glabrata. Las equinocandinas (caspofungina, anidulafungina y micafungina) tienen una excelente actividad in vitro frente a Candida, incluidas C.glabrata y C.krusei; sin embargo, otras especies, como C.parapsilosis y Candida guilliermondii, son menos sensibles.
Existen algunas limitaciones específicas para el uso de ciertos antifúngicos en pacientes con TOS1,9. La AMB desoxicolato no debería utilizarse por su nefrotoxicidad, en especial en los pacientes que toman anticalcineurínicos como tratamiento inmunosupresor. Todos los azoles presentan interacción con los fármacos anticalcineurínicos debido a que su metabolismo depende del citocromo P450, por lo que es muy importante determinar los niveles plasmáticos tanto de los azoles como de los inmunosupresores. Las candinas (caspofungina, anidulafungina y micafungina) tienen en general pocos efectos secundarios y menos interacciones en pacientes con TOS que el resto de los antifúngicos.
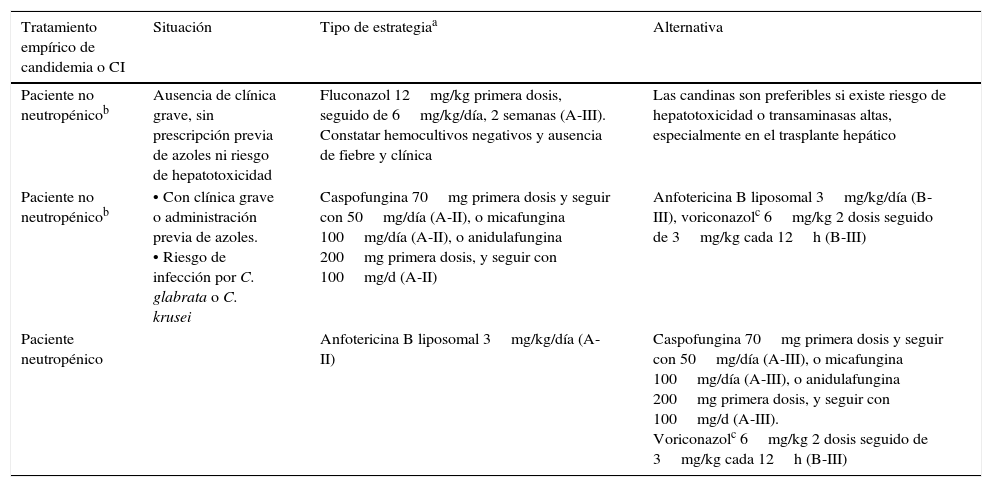
Tratamiento específicoEl tratamiento específico de una CI en un paciente TOS dependerá del tipo de infección y de la presencia o no de neutropenia. A continuación se refieren, con algunas modificaciones, las recomendaciones sobre el tratamiento de la CI de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC)1 (tabla 1):
- 1.
Tratamiento empírico de la candidemia
- 1.1.
En pacientes sin neutropenia, sin signos de gravedad clínica, en ausencia de daño hepático significativo y sin antecedentes de uso previo de azoles: fluconazol (12mg/kg la primera dosis, seguido de 6mg/kg/día) (A-III).
- 1.2.
En pacientes sin neutropenia, con profilaxis previa con azoles, con enfermedad moderada o grave y con riesgo de infección por C.glabrata o C.krusei, o si existe daño hepático significativo, administrar preferiblemente una candina (caspofungina 70mg/primera dosis, seguido de 50mg/día; micafungina 100mg/día [A-II], o anidulafungina 200mg/primera dosis, seguido de 100mg/día [A-II]). En caso de no poder administrar dichos fármacos, se recomienda la AMB liposomal (3-5mg/kg/día) (B-III) o el voriconazol (dosis 6mg/kg, dos dosis, seguido de 3mg/kg cada 12h) (B-III). El uso de azoles es problemático en estos pacientes por el riesgo de hepatotoxicidad y por la interacción con los fármacos anticalcineurínicos. Se recomienda determinar los niveles plasmáticos de voriconazol y de inmunosupresores.
- 1.3.
En pacientes neutropénicos, administrar AMB liposomal (A-II). Alternativamente puede administrarse una candina (caspofungina 70mg/primera dosis, seguido de 50mg/día [A-III]; micafungina 100mg/día [A-III], o anidulafungina 200mg/primera dosis, seguido de 100mg/día [A-III]), o voriconazol (dosis de 6mg/kg dos dosis, seguido de 3mg/kg cada 12h) (B-III). El uso de azoles es problemático en estos pacientes por el riesgo de hepatotoxicidad y por la interacción con los fármacos inmunosupresores. Las candinas (caspofungina, micafungina y anidulafungina) tienen en general pocos efectos secundarios y menos interacciones en pacientes con TOS que el resto de los antifúngicos.
- 1.1.
Recomendaciones de tratamiento antifúngico frente a Candida en pacientes trasplantados de órgano sólido
| Tratamiento empírico de candidemia o CI | Situación | Tipo de estrategiaa | Alternativa |
|---|---|---|---|
| Paciente no neutropénicob | Ausencia de clínica grave, sin prescripción previa de azoles ni riesgo de hepatotoxicidad | Fluconazol 12mg/kg primera dosis, seguido de 6mg/kg/día, 2 semanas (A-III). Constatar hemocultivos negativos y ausencia de fiebre y clínica | Las candinas son preferibles si existe riesgo de hepatotoxicidad o transaminasas altas, especialmente en el trasplante hepático |
| Paciente no neutropénicob | • Con clínica grave o administración previa de azoles. • Riesgo de infección por C. glabrata o C. krusei | Caspofungina 70mg primera dosis y seguir con 50mg/día (A-II), o micafungina 100mg/día (A-II), o anidulafungina 200mg primera dosis, y seguir con 100mg/d (A-II) | Anfotericina B liposomal 3mg/kg/día (B-III), voriconazolc 6mg/kg 2 dosis seguido de 3mg/kg cada 12h (B-III) |
| Paciente neutropénico | Anfotericina B liposomal 3mg/kg/día (A-II) | Caspofungina 70mg primera dosis y seguir con 50mg/día (A-III), o micafungina 100mg/día (A-III), o anidulafungina 200mg primera dosis, y seguir con 100mg/d (A-III). Voriconazolc 6mg/kg 2 dosis seguido de 3mg/kg cada 12h (B-III) |
CI: candidiasis invasora.
Una vez identificada la especie de Candida es importante la realización de un antifungigrama. A pesar de que C.parapsilosis muestra mayor grado de resistencia a las candinas que el resto de especies del género, se ha observado recientemente que el uso de candinas tiene la misma eficacia que el fluconazol14. En caso de aislarse C.glabrata es preferible administrar una equinocandina (BIII). El fluconazol sigue siendo el fármaco de elección si la especie de Candida es plenamente sensible y el paciente tiene una situación hemodinámica estable y no requiere ningún sistema de hemofiltración, ya que en este caso las dosis de fluconazol necesarias serían muy elevadas y existiría un grave riesgo de toxicidad hepática y de interferencia con otros fármacos, especialmente con inmunosupresores.
La duración del tratamiento para una candidemia que curse sin complicaciones metastásicas es de dos semanas una vez que el paciente esté estable y los hemocultivos se hayan negativizado (AIII). Debe retirarse siempre el catéter venoso (AII), aunque el aislamiento en punta de catéter en pacientes sin fungemia no implica necesariamente la necesidad de administrar antifúngicos38.
- 2.
Tratamiento empírico de CI (con afectación de órgano):
- 2.1.
Sin neutropenia: mismas indicaciones que las del apartado 1.1 y 1.2.
- 2.2.
Con neutropenia: mismas indicaciones que las referidas en el apartado 1.3.
- 2.3.
La duración del tratamiento no está definida pero se aconseja mantenerlo hasta que desaparezcan los síntomas y los cultivos o pruebas de laboratorio y las técnicas de imagen sean negativas.
- 2.1.
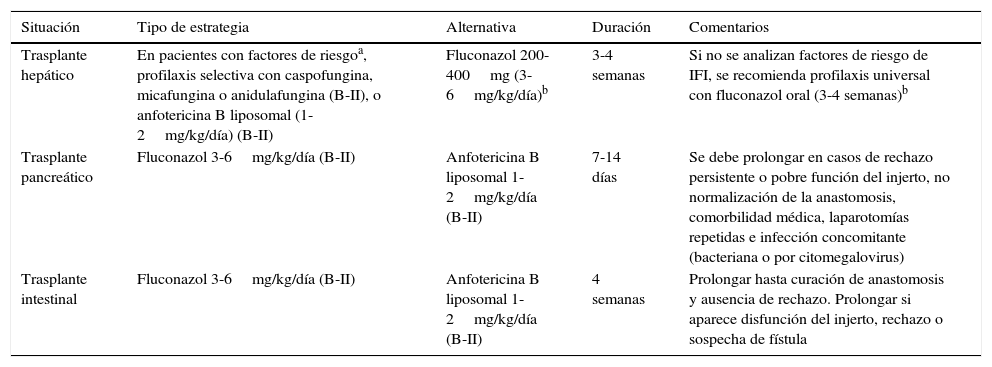
Puede resultar controvertido recomendar una determinada pauta de profilaxis antifúngica frente a Candida en los pacientes con TOS, fundamentalmente porque existen pocos estudios aleatorizados y porque la instauración universal de azoles puede seleccionar aislamientos de Candida con menor sensibilidad a estos antifúngicos. El resumen de las pautas seguidas más habitualmente se muestra en la tabla 2.
Resumen de la profilaxis antifúngica frente a Candida en pacientes con trasplante de órgano sólido
| Situación | Tipo de estrategia | Alternativa | Duración | Comentarios |
|---|---|---|---|---|
| Trasplante hepático | En pacientes con factores de riesgoa, profilaxis selectiva con caspofungina, micafungina o anidulafungina (B-II), o anfotericina B liposomal (1-2mg/kg/día) (B-II) | Fluconazol 200-400mg (3-6mg/kg/día)b | 3-4 semanas | Si no se analizan factores de riesgo de IFI, se recomienda profilaxis universal con fluconazol oral (3-4 semanas)b |
| Trasplante pancreático | Fluconazol 3-6mg/kg/día (B-II) | Anfotericina B liposomal 1-2mg/kg/día (B-II) | 7-14 días | Se debe prolongar en casos de rechazo persistente o pobre función del injerto, no normalización de la anastomosis, comorbilidad médica, laparotomías repetidas e infección concomitante (bacteriana o por citomegalovirus) |
| Trasplante intestinal | Fluconazol 3-6mg/kg/día (B-II) | Anfotericina B liposomal 1-2mg/kg/día (B-II) | 4 semanas | Prolongar hasta curación de anastomosis y ausencia de rechazo. Prolongar si aparece disfunción del injerto, rechazo o sospecha de fístula |
Se considera paciente de riesgo aquel que tiene un criterio mayor o 2 menores: Criterios mayores: a) diálisis; b) retrasplante; c) hepatitis fulminante. Criterios menores: a) aclaramiento de creatinina <50ml/min; b) transfusión intraoperatoria de >40unidades de hemoderivados; d) coledocoyeyunostomía en Y de Roux; e) cultivos de vigilancia peritrasplante positivos para Candida (esputo, faringe, recto, drenajes, orina…); f) reintervención.
En general se cree que no debe utilizarse profilaxis en el trasplante renal ni en el cardiaco. Por el contrario, es recomendable que los pacientes con trasplante pancreático, pulmonar e intestinal reciban profilaxis antifúngica al menos durante los primeros 7-14días postrasplante. En el trasplante hepático la profilaxis universal con fluconazol reduce significativamente la colonización y la infección fúngica superficial, pero no modifica la mortalidad global, ni el uso de antifúngicos empíricos33. No se recomienda el uso de profilaxis antifúngica universal frente a Candida en el trasplante hepático, pero sí es recomendable su uso en los pacientes con ciertos factores de riesgo38.
Para la profilaxis selectiva se ha utilizado sobre todo AMB liposomal, pero supone un elevado riesgo de nefrotoxicidad para el paciente trasplantado. La caspofungina ha demostrado su eficacia en el trasplante hepático en pacientes con riesgo elevado de IFI (B-II)16. Recientemente se han publicado dos estudios prospectivos que demuestran la eficacia de la profilaxis con micafungina y anidulafungina en pacientes trasplantados hepáticos con elevado riesgo de padecer IFI.
CriptococosisLa criptococosis es la tercera infección fúngica en frecuencia (8%) en los pacientes TOS, bastante por detrás de la candidiasis (53%) y la aspergilosis (19%)7,32. Sin embargo, por su gravedad —y, en ocasiones, difícil diagnóstico y tratamiento— debe ser bien conocida por los médicos encargados del cuidado de estos pacientes.
Cryptococcus es una levadura encapsulada que se encuentra en la naturaleza; se ha aislado de las deyecciones de paloma y otras aves, que la portan en el tracto gastrointestinal, y en los alrededores de ciertas especies arbóreas (Eucalyptus camaldulensis). Las especies más importantes por la infección en el ser humano son Cryptococcus neoformans var. neoformans o var. grubii, y Cryptococcus gattii, que se subdividen a su vez en varios genotipos (VNI, VII, VNB, VNIV y VGI-IV). La especie que con mayor frecuencia afecta a los receptores TOS en nuestro medio es C.neoformans var. grubii (70-80%). Recientemente se ha descrito un brote infeccioso por cepas hipervirulentas de C.gattii en Vancouver, la Columbia Británica y el noroeste de Estados Unidos. De los casos diagnosticados en Oregón, 11 de un total de 62 eran receptores de un TOS y presentaron más enfermedad diseminada y peor pronóstico que otras poblaciones15.
Incidencia y patogeniaEn general, la criptococosis no suele afectar a más del 3% de los pacientes TOS (0,3-5,3%)32,51, y como hemos mencionado previamente, la incidencia de estas micosis entre todas las padecidas por este grupo está por debajo del 10%. Así como la incidencia de la candidiasis y la de la aspergilosis se han reducido en los programas de TOS, la incidencia de la criptococosis no ha variado46. En una serie reciente que recogía los casos de IFI en pacientes TOS detectados en el periodo 2001-2006 en 23 centros norteamericanos de la red Transplant-Associated Infection Surveillance Network (TRANSNET), la criptococosis representaba el 8% de los 1.208 casos de IFI diagnosticados en 1.063 pacientes32.
La infección criptocócica suele adquirirse por vía respiratoria y probablemente se mantiene latente en el organismo aunque no sea detectable por los métodos habituales. La fungemia y la infección del sistema nervioso central (SNC) se producen tras la diseminación linfática o hematógena desde focos pulmonares subclínicos.
La criptococosis suele ser una IFI de aparición tardía (16-21meses), aunque aproximadamente un 5% de los casos aparecen en el primer mes postrasplante. Estos casos muy precoces posiblemente derivan del donante o de infecciones no diagnosticadas en el receptor y suelen tener localizaciones atípicas cercanas al órgano trasplantado8. Las criptococosis tardías pueden representar o bien reactivaciones, o bien infecciones de novo.
Factores de riesgo para la criptococosis en el paciente trasplantadoNo se conocen bien los factores de riesgo de la criptococosis en el paciente trasplantado. Algunos autores han observado mayor incidencia en pacientes que han precisado al menos dos dosis de ATG o alemtuzumab o cuyas pautas de inmunosupresión no incluyen inhibidores de la calcineurina48.
El tipo de inmunosupresores puede también influir en la presentación clínica. Así, en una serie multicéntrica, los pacientes con inhibidores de la calcineurina tuvieron mejor pronóstico, menos criptococosis diseminada y más afectación pulmonar23,41. Esto puede deberse, al menos en parte, a que algunos fármacos inmunosupresores, como la rapamicina, poseen actividad in vitro frente a Cryptococcus21 y a que los inhibidores de la calcineurina actúan sinérgicamente con la AMB y el fluconazol, lo que reduce hasta cuatro veces la concentración mínima inhibitoria (CMI) in vitro23.
Manifestaciones clínicasLa criptococosis suele presentarse en el paciente TOS con afectación del SNC o como enfermedad diseminada (53-72%)22. Otras manifestaciones clínicas menos frecuentes son la afectación pulmonar (25-54%), la cutánea, la ósea y la prostática. Es posible detectar fungemia en el 30-40% de los pacientes.
La afectación del SNC, generalmente en forma de meningitis subagudas o crónicas, con o sin criptococomas, ha de excluirse en todos los pacientes con criptococosis, ya que influirá en la elección del antifúngico y en el pronóstico, así como en la necesidad de excluir y tratar la hipertensión intracraneal. Los factores que se han asociado de manera independiente a la criptococosis del SNC en la población trasplantada son la alteración del nivel de consciencia, un título de antígeno criptocócico en suero ≥1:64, la infección tardía (>24meses después del trasplante) y la presencia de fungemia31. En una serie multicéntrica, el 95% de los pacientes TOS con criptococosis y alteración del nivel de consciencia presentaban afectación del SNC, aunque el 48% de los que tenían un nivel de consciencia normal también tenían afectación del SNC. Un cuarto de los pacientes tienen afectación parenquimatosa en los estudios de neuroimagen, lo que se asocia a una mayor mortalidad (50%)45.
Aproximadamente la mitad de los pacientes TOS con criptococosis tienen afectación pulmonar, y en el 63% de ellos el pulmón es el único órgano afectado. Las manifestaciones clínicas son muy variadas y oscilan desde el paciente asintomático hasta el paciente con síndrome de distress respiratorio del adulto. En general se produce por reactivación de infecciones previas latentes, aunque se han descrito casos de infección aguda por inhalación. La presentación más frecuente fue la existencia de nódulos pulmonares, y el antígeno criptocócico resultó positivo en más del 80% de los casos42. Es necesario tener en cuenta estos datos al evaluar a estos pacientes con lesiones pulmonares y recordar que la utilidad de la detección del antígeno criptocócico en suero es menor en pacientes con criptococosis pulmonar25,42.
La mortalidad de la criptococosis en el TOS es del 15-20%, y es mayor en los casos con afectación del SNC (30-50%)11,42,45. En el paciente inmunodeprimido puede producirse una diseminación desde el foco pulmonar y tener una elevada mortalidad42,43.
DiagnósticoEsta infección es relativamente fácil de diagnosticar siempre que se sospeche. Cryptococcus puede verse y aislarse prácticamente de cualquier muestra clínica y la serología es muy útil, lo que facilita el diagnóstico precoz. La levadura puede visualizarse en examen en fresco de la muestra mediante el uso de una gota de tinta china frente a la que contrasta la cápsula sin teñir que rodea a la levadura. Otras tinciones son también la de Gram, la de mucicarmín o la de Fontana-Masson en tejidos y otras muestras.
Cryptococcus crece bien en los medios de cultivo habituales y en medios sin clorhexidina. Prácticamente cualquier muestra es aceptable para cultivo; las más frecuentes son la sangre, el líquido cefalorraquídeo, las muestras respiratorias, la orina posmasaje prostático y las biopsias cutáneas o de cualquier otro tejido. Los hemocultivos suelen ser positivos en aproximadamente un tercio de los pacientes45.
Cryptococcus es normalmente sensible in vitro a la AMB, los azoles y la 5-fluorocitosina (5FC), y resistente a las equinocandinas. Se han descrito algunas cepas con valores de CMI elevados a los azoles, fundamentalmente en pacientes VIH positivos, aunque la correlación entre los estudios de sensibilidad in vitro a los antifúngicos y la respuesta clínica es controvertida2,6,49. Los resultados pueden diferir en función de los criterios (CLSI o EUCAST), el método empleado (microdilución en caldo o difusión en disco, E-test) y si el hongo ha sido subcultivado previamente o no10. En el brote de C.gattii mencionado previamente, los títulos de antígeno criptocócico en líquido cefalorraquídeo (LCR) fueron bajos en los receptores de TOS, y la CMI media al fluconazol fue de 12mg/l (2-32mg/l)15. Algunos autores han relacionado la aparición de recidivas con la elevación de la CMI frente al fluconazol6, aunque en nuestro medio este hecho es infrecuente19.
La serología (detección de antígeno criptocócico) es muy útil y puede realizarse en suero, LCR, orina, etc. Los títulos de antígeno criptocócico pueden utilizarse para valorar la respuesta al tratamiento. Los títulos elevados obligan a descartar una criptococosis diseminada42, aunque no se ha hallado correlación entre el pronóstico y el título inicial en el paciente TOS con criptococosis meníngea45. En estos pacientes es preciso realizar punciones lumbares hasta que se obtenga un cultivo negativo, no se detecte el antígeno criptocócico y se normalice la presión intracraneal.
Recientemente se ha diseñado un sencillo test lateral flow, en el que tras la introducción de una tira directamente en la muestra se obtiene un diagnóstico rápido sin necesidad de pretratamiento ni conservación en nevera de la muestra35. Esta técnica permite el diagnóstico incluso con una gota de sangre obtenida a pie de cama tras pinchar un dedo50. Es importante recordar que el beta-D-glucano no es útil para el diagnóstico de la criptococosis.
Tratamiento de la criptococosis en el paciente con trasplante de órgano sólidoEl tratamiento de la criptococosis depende en gran medida de la extensión y de la gravedad de la enfermedad, sobre todo de si existe o no afectación del SNC46.
Tratamiento de las formas graves: criptococosis con afectación del sistema nervioso central o las formas diseminadasEstas formas graves de criptococosis precisan de un tratamiento inicial o de inducción, uno de consolidación y uno de mantenimiento4. El tratamiento de inducción consiste en la administración durante dos semanas de una combinación de fármacos rápidamente fungicidas que incluyan la AMB12. Esta fase se continúa con 8 semanas de consolidación, generalmente con fluconazol, y finalmente de 6-12meses de mantenimiento4.
Existen múltiples estudios que han demostrado la superioridad de administrar un tratamiento combinado durante la inducción. El más sólido consiste en un ensayo clínico que incluyó 299 pacientes y que comparó la AMB sola (1mg/kg/día durante 4 semanas) frente a la AMB combinada con la 5FC (100mg/kg/día durante dos semanas) o con el fluconazol (400mg/12h durante dos semanas). La combinación con la 5FC fue la más rápidamente fungicida y la que se asoció a menor mortalidad12. Sin embargo, este estudio se realizó en pacientes infectados por el VIH reclutados en Vietnam y no incluyó pacientes trasplantados. Es importante recordar que la 5FC puede asociarse a toxicidad medular, por lo que esta ha de vigilarse y, si es posible, se deben monitorizar las concentraciones, con un rango recomendado de 30-80mg/l.
En el TOS suele preferirse el uso de las formulaciones lipídicas de AMB para reducir la nefrotoxicidad, ya que aproximadamente un tercio de los pacientes trasplantados ya tienen insuficiencia renal en el momento del diagnóstico y prácticamente todos reciben fármacos nefrotóxicos. Las recomendaciones elaboradas por la IDSA y la ATS incluyen formulaciones lipídicas de AMB (AMB liposomal [3-4mg/kg/día] o AMB complejo lipídico [5mg/kg/día]). Se recomienda también asociarlas a 5FC (100mg/kg/día dividida en cuatro tomas) durante la inducción, especialmente en los pacientes trasplantados que sufren criptococosis del SNC, infección diseminada o afectación pulmonar grave36,43,46.
La eficacia de las formulaciones lipídicas viene avalada por un estudio que incluía 75 pacientes TOS con criptococosis del SNC en el que estas se asociaron a una menor mortalidad a los 90 días en comparación a los pacientes tratados con AMB desoxicolato (10% frente al 40%; p=0,034)48. En dicho estudio se utilizó 5FC en el 63% de los pacientes tratados con AMB lipídicas frente al 40% de los pacientes con AMB convencional. Los factores asociados independientes de la mortalidad fueron la presencia de fungemia y la insuficiencia renal basal, mientras que el uso de formulaciones lipídicas resultó ser un factor protector (OR: 0,11; IC95: 0,02-0,57; p=0,008). La explicación a este hallazgo no está clara, aunque se baraja que la acción proinflamatoria de la AMB desoxicolato, que no es compartida por las formas lipídicas, puede tener efectos deletéreos en la población de TOS46.
La fase de inducción tiene una duración de dos semanas si se utiliza la AMB con la 5FC (B-II). Si no es posible incluir la 5FC, la inducción debe prolongarse hasta las 4-6 semanas (B-III)36. Es preferible utilizar la AMB liposomal, sobre todo si hay altas cargas fúngicas y en las recaídas (B-III).
Es muy importante tomar muestras para cultivo antes de suspender la AMB y comprobar que los cultivos se hayan negativizado. Se define como «persistencia» la positividad de los cultivos tras cuatro semanas de tratamiento antifúngico con un fármaco eficaz y a dosis adecuadas36. La recaída, sin embargo, consiste en la aparición de nuevos cultivos positivos, tras haberse negativizado (criterio microbiológico), y la recrudescencia de signos y síntomas después de haber obtenido una mejoría o normalización (criterio clínico). La variación de los títulos de antígeno criptocócico, tinciones positivas con tinta china y las alteraciones bioquímicas o celulares no son suficientes para definir una recaída. La mayoría de las recaídas son debidas a un tratamiento primario inadecuado (dosis o duración) o al fallo en el cumplimiento de las dosis de fluconazol en la fase de consolidación o tratamiento (tabla 3).
Recomendaciones de tratamiento antifúngico frente a Cryptococcus en pacientes trasplantados de órgano sólido
| Tipo de infección | Evidencia | ||
|---|---|---|---|
| Infecciones del SNC, infección grave o infección diseminada (afectación de más de una localización no contigua) | Inducción | 2 semanas de AMB-L (3-4mg/kg/día) o ABCL (5mg/kg/día) más 5FC (100mg/kg/día) dividido en 4 tomas Si no puede administrarse 5FC, prolongar a 4-6 semanas la AMB | B-I B-II |
| Evaluación respuesta | Es necesario comprobar la negativización de los cultivos en muestras sucesivas. Ante la persistencia de positividad se recomienda: - Revisar la sensibilidad de los aislamientos - Prolongar la inducción (4-10 semanas) y/o elevar las dosis de AMB-L hasta 6mg/kg/día y/o administrar tratamiento combinado si no se había hecho (bien con 5FC o bien con fluconazol 12mg/kg/día) - Algunos autores han usado interferón-gamma recombinante a dosis de 100 μg/m2 para adultos >50kg, 3 veces a la semana, durante 10 semanas, manteniendo el tratamiento antifúngico concomitante | B-I B-III | |
| Consolidación | 2 meses de fluconazol 400-800mg/día | B-III | |
| Mantenimiento | 6-12 meses de fluconazol 200- 400mg/día | B-III | |
| Infección leve-moderada, sin afectación del SNC y no diseminada | 6-12 meses de fluconazol 400mg/día | ||
| Hipertensión intracraneal (presión de apertura LCR ≥ 25cmH2O) | Punciones lumbares repetidas para reducir la presión de apertura al menos el 50% Si persiste elevada a pesar de punciones diarias, se debe valorar drenaje lumbar, ventriculostomía o derivación ventriculoperitoneal | B-II B-III | |
| Síndrome de reconstitución inmune (SRI) | En casos de complicaciones graves asociadas con el SRI, como el incremento de la presión intracraneal o SDRA, se pueden usar corticoides (0,5-1mg/kg/día), con descenso progresivo. No es preciso cambiar el tratamiento antifúngico | B-III | |
| Recaída | Realizar prueba de sensibilidad antifúngica del aislamiento e investigar focos no tratados suficientemente. Reinstaurar fase de inducción de tratamiento primario por un tiempo más prolongado (4-10 semanas). Para la consolidación de rescate puede utilizarse (tras estudio de sensibilidad) fluconazol 800-1.200mg/día (10 semanas), voriconazol 200-400mg/día (10 semanas), posaconazol 200mg/8h (10 semanas) | B-III |
ABCL: anfotericina B complejo lipídico; AMB-L: anfotericina B liposomal; SDRA: síndrome de distress respiratorio del adulto.
En estos casos pueden adoptarse diversas estrategias que se muestran en la tabla 3. Entre ellas está la prolongación de la fase de inducción, la elevación de la dosis de AMB, el uso de tratamiento combinado (bien con 5FC o con dosis altas de fluconazol, si antes no se había realizado), e incluso la inmunoterapia con interferón gamma. Aunque no existe evidencia irrefutable de la correlación clínico-microbiológica, es también muy conveniente conocer la CMI de las cepas aisladas. El aumento en 3 o más diluciones debe hacer sospechar la aparición de resistencia, siempre que se haya utilizado la misma técnica de laboratorio. La detección aislada de una CMI frente al fluconazol de ≥16mg/l o una CMI frente a la 5FC ≥32mg/l deben evaluarse cuidadosamente dada la disparidad de resultados si se utiliza E-test, EUCAST o CLSI. En el caso de fracaso terapéutico y sospecha de resistencia debe consultarse siempre a un experto, que valorará la posibilidad de usar fármacos alternativos. El uso de AMB intratecal no se recomienda en este momento.
En el tratamiento de consolidación y de mantenimiento el fluconazol continúa siendo el fármaco de elección dada su buena farmacocinética y difusión al LCR. Para la fase de mantenimiento se aconseja utilizar fluconazol (400-800mg/día) oral durante 8 semanas (B-II)36,37, y para la de mantenimiento continuar a dosis de 200-400mg/día durante 6-12 meses más (B-II). Es importante recordar que es preciso ajustar la dosis en pacientes con insuficiencia renal, que el fármaco es dializable y que puede producir interacciones medicamentosas. La experiencia con el voriconazol y con otros azoles es mucho menor y en general no se ha observado beneficio sobre el tratamiento con fluconazol17,27,29. En caso de utilizarse, se recomienda consultar con un experto.
Tratamiento de formas localizadas moderadas o leves y sin afectación del sistema nervioso centralSiempre es necesario descartar afectación del SNC mediante una punción lumbar, ya que este hallazgo puede modificar la elección del fármaco recomendado en la fase de inducción (B-II). En el paciente TOS con criptococosis pulmonar la positividad del antígeno criptocócico en suero se correlaciona con mayor frecuencia de infección concomitante del SNC42.
Una vez excluida la diseminación y la afectación del SNC, en pacientes con síntomas de gravedad leve-moderada se recomienda la administración de fluconazol 400mg/día (6mg/kg/día) durante 6-12meses.
Complicaciones durante el tratamientoHipertensión intracraneal. La presencia de hipertensión intracraneal (presión de apertura LCR ≥25cmH2O) debe comprobarse y monitorizarse siempre en estos pacientes, ya que se asocia a un aumento significativo de la morbilidad (ceguera permanente) y de la mortalidad, especialmente en la fase inicial de la infección. De forma tardía puede desarrollarse hidrocefalia5,36.
Se considera que la hipertensión se produce por la presencia de una elevada carga fúngica en el LCR que llega a interrumpir físicamente la reabsorción del líquido. La presión elevada al inicio del tratamiento debe tratarse muy activamente mediante descompresión con punciones lumbares repetidas, con catéter de drenaje lumbar transitorio, ventriculostomía o derivación ventriculoperitoneal5,18,24. La utilización de manitol, acetazolamida o corticoides no ha demostrado utilidad para disminuir la presión intracraneal.
Síndrome de reconstitución inmune. Para definir el síndrome de reconstitución inmune (SRI) en el TOS se utilizan los mismos criterios que en la población VIH:
- 1.
Reaparición o empeoramiento de las manifestaciones clínicas después de una respuesta inicial favorable al tratamiento, o aparición de nuevas manifestaciones a pesar de estar recibiendo el tratamiento adecuado.
- 2.
Aparición de síntomas que no pueden explicarse por la adquisición de una nueva infección, por el curso clínico normal o por efectos adversos del tratamiento.
La incidencia del SRI en el TOS oscila entre el 4,8 y el 14%44,47,50,51. El momento de su aparición (mediana) es de 5,5 semanas desde el inicio del tratamiento antifúngico44. Este síndrome se ha relacionado con un aumento parcial de la inmunidad celular específica y la inducción de citoquinas inflamatorias, que se asocian a una reacción inflamatoria exagerada36. Recientemente se han identificado dos factores de riesgo independientes para desarrollar SRI: la afectación del SNC (AOR, 6,23; p=0,03) y la interrupción de los anticalcineurínicos (AOR, 5,11; p=0,02). La incidencia de SRI fue del 2,6% (1/13) en pacientes sin ninguno de estos factores, del 18,8% (6/32) si estaba presente un factor y del 50% (6/12) con ambos. Entre los pacientes con enfermedad del SNC, el SRI era más frecuente si había alteraciones morfológicas en las pruebas de imagen, con independencia de los títulos de antígeno criptocócico47. El rechazo del injerto fue más frecuente en los pacientes con SRI (15,4% frente al 2,6%; p=0,07).
Las recomendaciones para su manejo se muestran en la tabla 3. Un estudio que analizaba el efecto del SRI en el injerto renal de los pacientes con criptococosis sugería que la supervivencia del injerto podría verse afectada por la disfunción crónica de este en pacientes que desarrollaron SRI durante el tratamiento de la criptococosis44.
RecaídaLa recaída se define como la obtención de cultivos positivos tras cultivos negativos previos. En ese caso es imprescindible realizar una prueba de sensibilidad antifúngica del aislamiento, como comentamos previamente, y excluir focos ocultos que expliquen la recidiva (próstata, endocarditis, infección endovascular, infección ósea, etc.). Se recomienda reiniciar el tratamiento antifúngico con la fase de inducción de tratamiento primario prolongada a 4-10 semanas (B-III). En la fase de consolidación de rescate se puede utilizar fluconazol a dosis altas (800-1.200mg/día), voriconazol (200-400mg/día) e incluso posaconazol durante 10 semanas (B-III).