Recientemente se ha observado un incremento de las fungemias causadas por especies diferentes de Candida albicans y una disminución de la sensibilidad de los microorganismos responsables al fluconazol.
ObjetivosEvaluar la epidemiología y la sensibilidad al fluconazol de los casos de fungemia en España en 2009, comparando los resultados con los obtenidos entre los años 1997-1999 (Pemán J, et al. Eur J Clin Microbiol Infect Dis. 2005).
MétodosEstudio prospectivo multicéntrico con 44 centros participantes realizado desde enero de 2009 a febrero de 2010. Los aislamientos fúngicos procedentes de hemocultivo fueron recogidos en cada centro, donde se realizó el estudio de sensibilidad antifúngica mediante microdilución colorimétrica (Sensititre Yeast One).
ResultadosDesde enero de 2009 a febrero de 2010 se recogieron 1.377 aislamientos en hemocultivos, correspondientes a 1.357 episodios de fungemia. Las fungemias se observaron principalmente en mayores de 64 años (46,7%) y el 8,6% en menores de 1 año. C. albicans (44,7%), Candida parapsilosis (29,1%), Candida glabrata (11,5%), Candida tropicalis (8,2%) y Candida krusei (1,9%) fueron las especies más frecuentes, pero su distribución no fue geográficamente homogénea. En los últimos 10 años la incidencia de C. albicans ha aumentado significativamente en Cataluña (39,1 vs. 54,7%, P=0,03) y reducido en la Comunidad Valenciana (49,1 vs. 34,6%, P=0,01). C. parapsilosis ha disminuido en Cataluña (29 vs. 12,4%, P=0,002) y Extremadura (58,3 vs. 20%, P=0,01). La sensibilidad a fluconazol fue similar en toda España pero en los aislamientos de C. albicans la resistencia fue diez veces superior en mayores de 64 años. Sin embargo, la tasa de resistencia (CMI > 32 mg/L) global ha disminuido con respecto a la obtenida hace 10 años (3,7 vs. 2,5% actual), sobre todo en C. albicans (3 vs. 1,6%).
ConclusionesEn los últimos 10 años la distribución de las especies causantes de fungemia en España y la sensibilidad al fluconazol no han variado significativamente, aunque se observa una menor tasa de resistencia. La distribución de las especies varía según la unidad de hospitalización, hospital y Comunidad Autónoma.
Recent epidemiological surveillance studies have reported an increase in fungaemia caused by non-Candida albicans species, as well as a decrease in fluconazole susceptibility.
ObjectivesTo evaluate changes in the epidemiology of fungaemia in Spain comparing data from a new surveillance epidemiological study conducted in 2009 with a previous study carried out from 1997 to 1999 (Pemán J, et al. Eur J Clin Microbiol Infect Dis. 2005).
MethodsFrom January 2009 to February 2010, 44 Spanish hospitals participated in a prospective multicentre fungaemia surveillance study to ascertain whether there have been changes in the epidemiology and fluconazole susceptibility. Susceptibility was determined by the colorimetric method Sensititre Yeast One. Demographic and clinical data and the first isolate of each episode were gathered.
ResultsA total of 1,377 isolates from 1,357 fungaemia episodes were collected, 46.7% from patients older than 64years and 8.6% from children less than 1 year old. C. albicans (44.7%), Candida parapsilosis (29.1%), Candida glabrata (11.5%), Candida tropicalis (8.2%), and Candida krusei (1.9%) were the most frequent species isolated. Distribution varied with the geographical area. C. albicans incidence has increased significantly in the last 10years in Cataluña (39.1 vs. 54.7%, P=0.03) and decreased in the Valencian Community (49.1 vs. 34.6%, P=0.002) and Extremadura (58.3 vs. 20%, P=0.01). Susceptibility to fluconazole was similar for all geographical areas, although resistance in C. albicans was ten times greater for patients aged more than 64years. The overall rate of fluconazole resistance (MIC > 32 mg/L) has decreased with respect to that obtained 10years ago (3.7 vs. 2.5%) mainly in C. albicans (3 vs. 1.6%).
ConclusionsIn the last ten years, species distribution and fluconazole susceptibility have not significantly changed, although a lower rate of fluconazole resistance has been observed. Species distribution varies with hospital, hospitalization Unit and geographical area.
La presencia de levaduras y algunos hongos filamentosos (Fusarium spp. y Scedosporium spp., entre otros) en sangre (fungemia) se asocia a una alta morbimortalidad15,18. Pero las tasas de letalidad disminuyen si se instaura precozmente el tratamiento antifúngico apropiado5,9. Además, las guías para el tratamiento de las infecciones fúngicas diseminadas recomiendan que el tratamiento inicial de las mismas debe establecerse en función de la identificación del agente causal y la epidemiología local, incluyendo los patrones de sensibilidad habituales para una determinada área geográfica6,8.
Aunque la variabilidad geográfica de la resistencia a fluconazol entre las especies causales de fungemia es conocida en otras latitudes2,7,14,17,19, poco se conoce en nuestro país de la repercusión que ha tenido en la sensibilidad al fluconazol (en la práctica diaria de nuestros hospitales) la incorporación de los nuevos triazoles voriconazol y posaconazol. Además, en la mayoría de los estudios epidemiológicos se ha observado una elevada tasa de fungemia en pacientes mayores de 65 años10,20, por lo que este grupo de pacientes merece una consideración individualizada, tanto de las características de las mismas como de la posible disminución de la sensibilidad al fluconazol producida por el probable contacto previo con azoles a lo largo de su vida.
El estudio multicéntrico FUNGEMYCA se realizó durante el año 2009 en España con el objetivo de conocer la situación real de las fungemias en nuestro país y la sensibilidad de los patógenos aislados al fluconazol y otros fármacos antifúngicos. En el presente trabajo presentamos los principales datos epidemiólogicos observados en el estudio y los comparamos con los obtenidos en un estudio multicéntrico previo realizado 10 años antes en España11, analizando las diferencias entre ambos y la repercusión de los antifúngicos introducidos en la última década en la epidemiología de las fungemias en nuestro país.
Material y métodosOrganismos y centros participantesEntre enero de 2009 y febrero de 2010 se incluyeron de forma prospectiva un total de 1.357 episodios de fungemia de 44 centros hospitalarios distribuidos por toda la geografía española. Se definió como episodio de fungemia el aislamiento en el hemocultivo de un hongo levaduriforme o filamentoso acompañado de síntomas y signos compatibles con infección fúngica diseminada. Por cada episodio de fungemia solo se recogió y almacenó el primer aislamiento identificado. Todo episodio de fungemia que ocurrió pasados 30 días después del aislamiento inicial en un mismo paciente fue considerado como nuevo episodio. En cada episodio de fungemia se recogieron datos demográficos, clínicos y microbiológicos mediante un cuestionario diseñado al efecto en el que se incluían 25 variables.
En el estudio participaron centros hospitalarios de 15 comunidades autónomas españolas: Andalucía (7 centros, 261 aislamientos), Aragón (2 centros, 40 aislamientos), Asturias (1 centro, 15 aislamientos), Baleares (1 centro, 44 aislamientos), Canarias (2 centros, 52 aislamientos), Castilla-La Mancha (1 centro, 20 aislamientos), Castilla-León (5 centros, 76 aislamientos), Cataluña (4 centros, 161 aislamientos), Comunidad Valenciana (6 centros, 191 aislamientos), Extremadura (1 centro, 30 aislamientos), Galicia (3 centros, 104 aislamientos), Murcia (1 centro, 36 aislamientos), Madrid (6 centros, 296 aislamientos), Navarra (1 centro, 16 aislamientos) y País Vasco (2 centros, 36 aislamientos).
Los microorganismos aislados en los hemocultivos fueron identificados en cada centro participante siguiendo la metodología habitual en cada laboratorio y almacenados en agua destilada estéril para ulteriores estudios y/o reconfirmación de resultados.
Estudio de sensibilidad antifúngicaLa sensibilidad de todos los aislamientos al fluconazol fue realizada en cada centro participante mediante la técnica de microdilución colorimétrica Sensititre YeatOne® SYO-09 (TREK Diagnostic Systems, West Sussex, UK) de acuerdo con las indicaciones del fabricante. Como cepas de control de calidad fueron utilizadas C. krusei ATCC 6258 y C. parapsilosis ATCC 22019.
Análisis estadísticoLos datos del estudio fueron analizados mediante el paquete estadístico SPSS 10.0.7 (SPSS, Inc., Chicago, EE.UU.). Las variables categóricas se analizaron mediante la prueba de Chi-cuadrado y valores de P < 0,05 fueron considerados significativos.
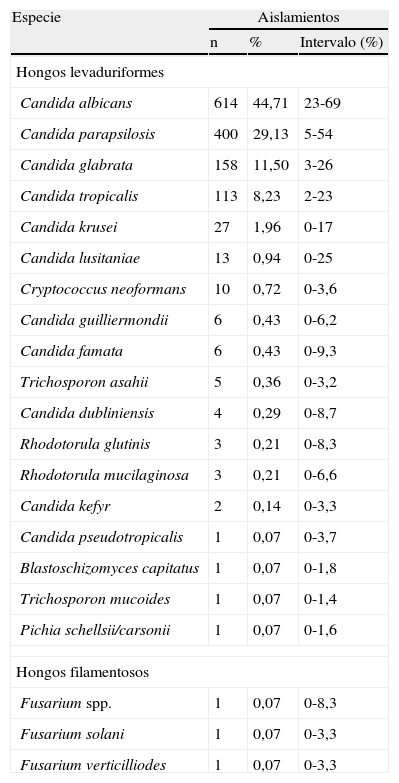
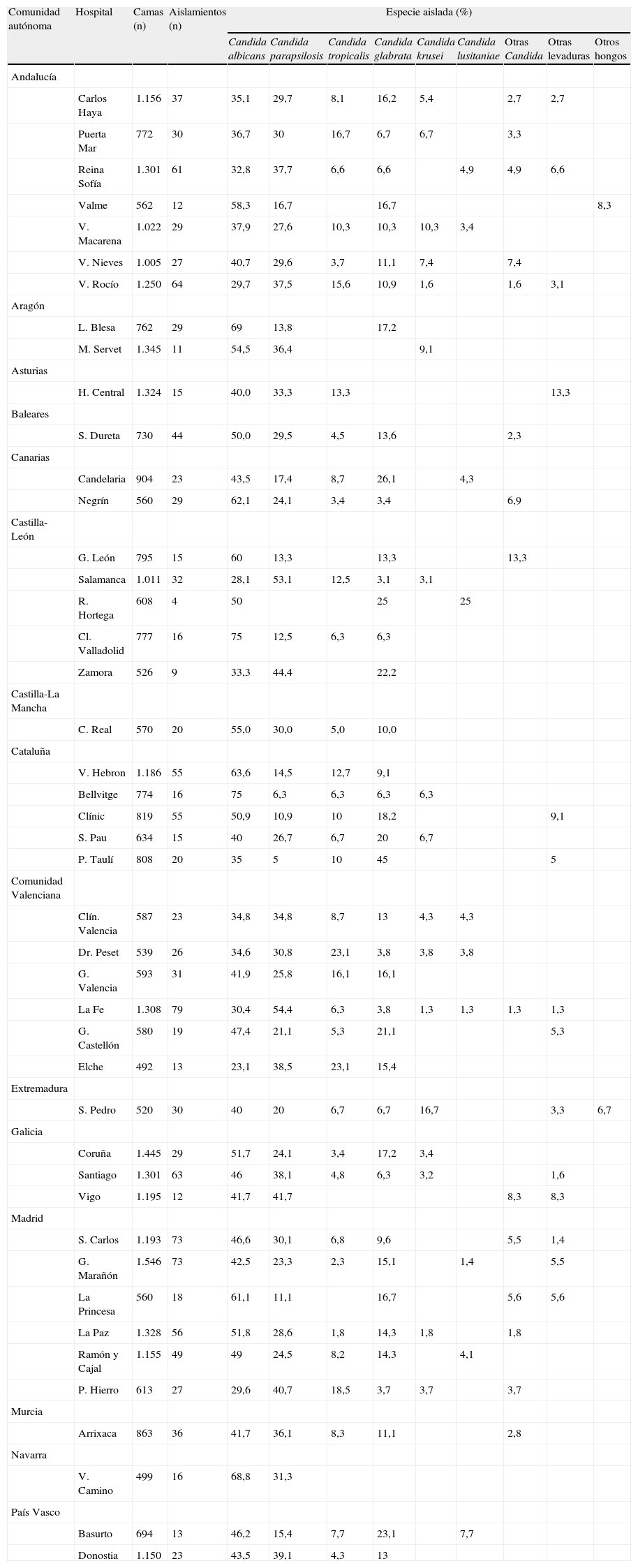
ResultadosDurante los trece meses del estudio se estudiaron 1.377 aislamientos fúngicos de hemocultivos correspondientes a 1.357 episodios de fungemia. Entre los agentes causales de fungemia, C. albicans fue la especie más frecuentemente aislada (44,7%), seguida de C. parapsilosis (29,1%), C. glabrata (11,5%), C. tropicalis (8,2%) y C. krusei (1,9%); en 65 episodios se aislaron otras especies minoritarias (tabla 1). El número de aislamientos y la distribución de las principales especies en cada centro hospitalario participante se detalla en la tabla 2; La Fe (79), San Carlos (73) y Gregorio Marañón (73) fueron los centros que más aislamientos aportaron al estudio.
Especies aisladas en el estudio
| Especie | Aislamientos | ||
| n | % | Intervalo (%) | |
| Hongos levaduriformes | |||
| Candida albicans | 614 | 44,71 | 23-69 |
| Candida parapsilosis | 400 | 29,13 | 5-54 |
| Candida glabrata | 158 | 11,50 | 3-26 |
| Candida tropicalis | 113 | 8,23 | 2-23 |
| Candida krusei | 27 | 1,96 | 0-17 |
| Candida lusitaniae | 13 | 0,94 | 0-25 |
| Cryptococcus neoformans | 10 | 0,72 | 0-3,6 |
| Candida guilliermondii | 6 | 0,43 | 0-6,2 |
| Candida famata | 6 | 0,43 | 0-9,3 |
| Trichosporon asahii | 5 | 0,36 | 0-3,2 |
| Candida dubliniensis | 4 | 0,29 | 0-8,7 |
| Rhodotorula glutinis | 3 | 0,21 | 0-8,3 |
| Rhodotorula mucilaginosa | 3 | 0,21 | 0-6,6 |
| Candida kefyr | 2 | 0,14 | 0-3,3 |
| Candida pseudotropicalis | 1 | 0,07 | 0-3,7 |
| Blastoschizomyces capitatus | 1 | 0,07 | 0-1,8 |
| Trichosporon mucoides | 1 | 0,07 | 0-1,4 |
| Pichia schellsii/carsonii | 1 | 0,07 | 0-1,6 |
| Hongos filamentosos | |||
| Fusarium spp. | 1 | 0,07 | 0-8,3 |
| Fusarium solani | 1 | 0,07 | 0-3,3 |
| Fusarium verticilliodes | 1 | 0,07 | 0-3,3 |
Distribución de las especies aisladas en cada centro hospitalario
| Comunidad autónoma | Hospital | Camas (n) | Aislamientos (n) | Especie aislada (%) | ||||||||
| Candida albicans | Candida parapsilosis | Candida tropicalis | Candida glabrata | Candida krusei | Candida lusitaniae | Otras Candida | Otras levaduras | Otros hongos | ||||
| Andalucía | ||||||||||||
| Carlos Haya | 1.156 | 37 | 35,1 | 29,7 | 8,1 | 16,2 | 5,4 | 2,7 | 2,7 | |||
| Puerta Mar | 772 | 30 | 36,7 | 30 | 16,7 | 6,7 | 6,7 | 3,3 | ||||
| Reina Sofía | 1.301 | 61 | 32,8 | 37,7 | 6,6 | 6,6 | 4,9 | 4,9 | 6,6 | |||
| Valme | 562 | 12 | 58,3 | 16,7 | 16,7 | 8,3 | ||||||
| V. Macarena | 1.022 | 29 | 37,9 | 27,6 | 10,3 | 10,3 | 10,3 | 3,4 | ||||
| V. Nieves | 1.005 | 27 | 40,7 | 29,6 | 3,7 | 11,1 | 7,4 | 7,4 | ||||
| V. Rocío | 1.250 | 64 | 29,7 | 37,5 | 15,6 | 10,9 | 1,6 | 1,6 | 3,1 | |||
| Aragón | ||||||||||||
| L. Blesa | 762 | 29 | 69 | 13,8 | 17,2 | |||||||
| M. Servet | 1.345 | 11 | 54,5 | 36,4 | 9,1 | |||||||
| Asturias | ||||||||||||
| H. Central | 1.324 | 15 | 40,0 | 33,3 | 13,3 | 13,3 | ||||||
| Baleares | ||||||||||||
| S. Dureta | 730 | 44 | 50,0 | 29,5 | 4,5 | 13,6 | 2,3 | |||||
| Canarias | ||||||||||||
| Candelaria | 904 | 23 | 43,5 | 17,4 | 8,7 | 26,1 | 4,3 | |||||
| Negrín | 560 | 29 | 62,1 | 24,1 | 3,4 | 3,4 | 6,9 | |||||
| Castilla-León | ||||||||||||
| G. León | 795 | 15 | 60 | 13,3 | 13,3 | 13,3 | ||||||
| Salamanca | 1.011 | 32 | 28,1 | 53,1 | 12,5 | 3,1 | 3,1 | |||||
| R. Hortega | 608 | 4 | 50 | 25 | 25 | |||||||
| Cl. Valladolid | 777 | 16 | 75 | 12,5 | 6,3 | 6,3 | ||||||
| Zamora | 526 | 9 | 33,3 | 44,4 | 22,2 | |||||||
| Castilla-La Mancha | ||||||||||||
| C. Real | 570 | 20 | 55,0 | 30,0 | 5,0 | 10,0 | ||||||
| Cataluña | ||||||||||||
| V. Hebron | 1.186 | 55 | 63,6 | 14,5 | 12,7 | 9,1 | ||||||
| Bellvitge | 774 | 16 | 75 | 6,3 | 6,3 | 6,3 | 6,3 | |||||
| Clínic | 819 | 55 | 50,9 | 10,9 | 10 | 18,2 | 9,1 | |||||
| S. Pau | 634 | 15 | 40 | 26,7 | 6,7 | 20 | 6,7 | |||||
| P. Taulí | 808 | 20 | 35 | 5 | 10 | 45 | 5 | |||||
| Comunidad Valenciana | ||||||||||||
| Clín. Valencia | 587 | 23 | 34,8 | 34,8 | 8,7 | 13 | 4,3 | 4,3 | ||||
| Dr. Peset | 539 | 26 | 34,6 | 30,8 | 23,1 | 3,8 | 3,8 | 3,8 | ||||
| G. Valencia | 593 | 31 | 41,9 | 25,8 | 16,1 | 16,1 | ||||||
| La Fe | 1.308 | 79 | 30,4 | 54,4 | 6,3 | 3,8 | 1,3 | 1,3 | 1,3 | 1,3 | ||
| G. Castellón | 580 | 19 | 47,4 | 21,1 | 5,3 | 21,1 | 5,3 | |||||
| Elche | 492 | 13 | 23,1 | 38,5 | 23,1 | 15,4 | ||||||
| Extremadura | ||||||||||||
| S. Pedro | 520 | 30 | 40 | 20 | 6,7 | 6,7 | 16,7 | 3,3 | 6,7 | |||
| Galicia | ||||||||||||
| Coruña | 1.445 | 29 | 51,7 | 24,1 | 3,4 | 17,2 | 3,4 | |||||
| Santiago | 1.301 | 63 | 46 | 38,1 | 4,8 | 6,3 | 3,2 | 1,6 | ||||
| Vigo | 1.195 | 12 | 41,7 | 41,7 | 8,3 | 8,3 | ||||||
| Madrid | ||||||||||||
| S. Carlos | 1.193 | 73 | 46,6 | 30,1 | 6,8 | 9,6 | 5,5 | 1,4 | ||||
| G. Marañón | 1.546 | 73 | 42,5 | 23,3 | 2,3 | 15,1 | 1,4 | 5,5 | ||||
| La Princesa | 560 | 18 | 61,1 | 11,1 | 16,7 | 5,6 | 5,6 | |||||
| La Paz | 1.328 | 56 | 51,8 | 28,6 | 1,8 | 14,3 | 1,8 | 1,8 | ||||
| Ramón y Cajal | 1.155 | 49 | 49 | 24,5 | 8,2 | 14,3 | 4,1 | |||||
| P. Hierro | 613 | 27 | 29,6 | 40,7 | 18,5 | 3,7 | 3,7 | 3,7 | ||||
| Murcia | ||||||||||||
| Arrixaca | 863 | 36 | 41,7 | 36,1 | 8,3 | 11,1 | 2,8 | |||||
| Navarra | ||||||||||||
| V. Camino | 499 | 16 | 68,8 | 31,3 | ||||||||
| País Vasco | ||||||||||||
| Basurto | 694 | 13 | 46,2 | 15,4 | 7,7 | 23,1 | 7,7 | |||||
| Donostia | 1.150 | 23 | 43,5 | 39,1 | 4,3 | 13 | ||||||
En 20 episodios se aisló más de una especie fúngica simultáneamente y fueron considerados como episodios de fungemia mixtos. El 50% de las fungemias mixtas se observaron en unidades de cuidados intensivos (UCI), siendo la asociación C. albicans + C. glabrata y C. albicans + C. parapsilosis las combinaciones más frecuentemente observadas (6 episodios cada una).
En nuestro estudio, las fungemias se observaron principalmente en varones (59,3%) y en pacientes mayores de 65 años (46,7%); la mediana de edad fue 62 años, y el valor modal en los pacientes adultos fue 78 años. El 14,7% de los episodios se observaron en niños (≤ 15 años), y el 8,6% en menores de un año. El 30% de los episodios de fungemia se observaron en pacientes ingresados en UCI, el 18% en unidades quirúrgicas y el 14% en unidades médicas. Un 7% de los episodios se observaron en pacientes hematológicos y un 6% en oncológicos.
Un total de 918 pacientes (66,6%) con fungemia eran portadores de catéter venoso central (CVC); la cirugía en el mes previo a la fungemia estaba presente en el 40,1% de los episodios y la neutropenia en el 9,1%. El 6% de los pacientes eran receptores de trasplante de progenitores hematopoyéticos (TPH), el 2,4% eran receptores de un trasplante de órgano sólido (TOS), el 4,3% eran quemados y sólo el 2,8% eran pacientes HIV+. Además, entre los niños con fungemia, el 29,4% eran prematuros.
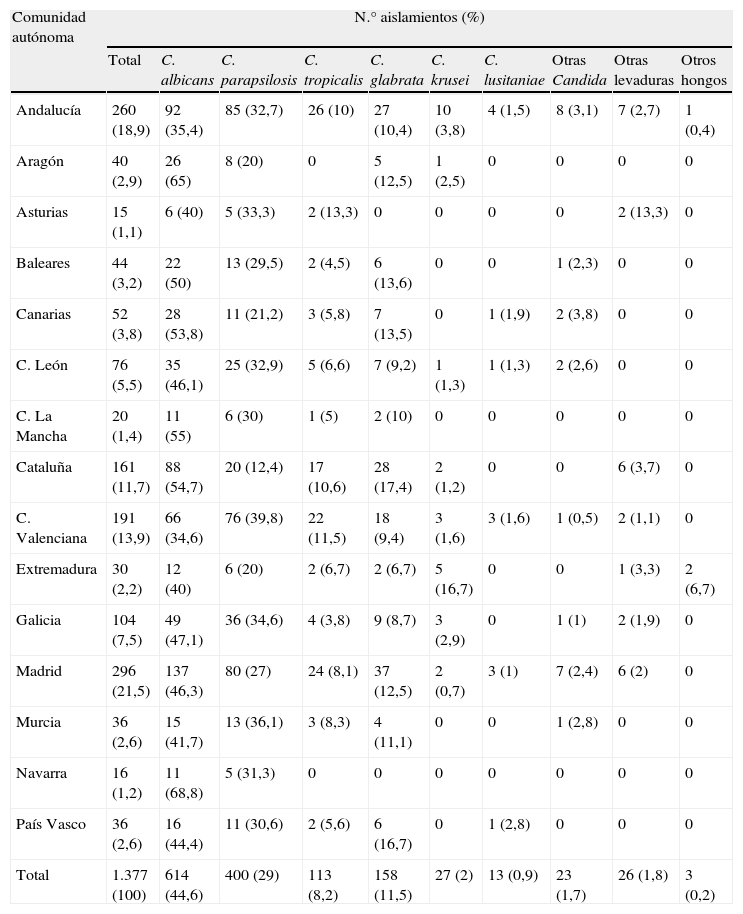
La distribución de las especies aisladas no fue homogénea en todo el país (tabla 3). Navarra (69%) y Aragón (65%) fueron las comunidades autónomas donde C. albicans se aisló con una frecuencia muy superior a la media nacional (44,7%); por el contrario, la Comunidad Valenciana y Andalucía fueron las comunidades donde la tasa de aislamientos de esta especie fue la más baja (35%). Por su parte, C. parapsilosis se aisló de manera más notable en la Comunidad Valenciana (40%) y Murcia (36%) y de forma muy inferior a la media nacional (29%) en Cataluña (12%). Sin embargo, Cataluña y el País Vasco fueron las comunidades con mayor porcentaje de aislamientos de C. glabrata (17%), especie que no fue aislada en Asturias ni en Navarra. C. tropicalis se aisló con más frecuencia en Asturias (13%) y en la Comunidad Valenciana (12%) y no se registró ningún aislamiento en Aragón ni en Navarra. Extremadura fue la comunidad con más aislamientos de C. krusei (17%), tasa muy superior a la media nacional (2%).
Distribución de las especies aisladas por Comunidad Autónoma
| Comunidad autónoma | N.° aislamientos (%) | |||||||||
| Total | C. albicans | C. parapsilosis | C. tropicalis | C. glabrata | C. krusei | C. lusitaniae | Otras Candida | Otras levaduras | Otros hongos | |
| Andalucía | 260 (18,9) | 92 (35,4) | 85 (32,7) | 26 (10) | 27 (10,4) | 10 (3,8) | 4 (1,5) | 8 (3,1) | 7 (2,7) | 1 (0,4) |
| Aragón | 40 (2,9) | 26 (65) | 8 (20) | 0 | 5 (12,5) | 1 (2,5) | 0 | 0 | 0 | 0 |
| Asturias | 15 (1,1) | 6 (40) | 5 (33,3) | 2 (13,3) | 0 | 0 | 0 | 0 | 2 (13,3) | 0 |
| Baleares | 44 (3,2) | 22 (50) | 13 (29,5) | 2 (4,5) | 6 (13,6) | 0 | 0 | 1 (2,3) | 0 | 0 |
| Canarias | 52 (3,8) | 28 (53,8) | 11 (21,2) | 3 (5,8) | 7 (13,5) | 0 | 1 (1,9) | 2 (3,8) | 0 | 0 |
| C. León | 76 (5,5) | 35 (46,1) | 25 (32,9) | 5 (6,6) | 7 (9,2) | 1 (1,3) | 1 (1,3) | 2 (2,6) | 0 | 0 |
| C. La Mancha | 20 (1,4) | 11 (55) | 6 (30) | 1 (5) | 2 (10) | 0 | 0 | 0 | 0 | 0 |
| Cataluña | 161 (11,7) | 88 (54,7) | 20 (12,4) | 17 (10,6) | 28 (17,4) | 2 (1,2) | 0 | 0 | 6 (3,7) | 0 |
| C. Valenciana | 191 (13,9) | 66 (34,6) | 76 (39,8) | 22 (11,5) | 18 (9,4) | 3 (1,6) | 3 (1,6) | 1 (0,5) | 2 (1,1) | 0 |
| Extremadura | 30 (2,2) | 12 (40) | 6 (20) | 2 (6,7) | 2 (6,7) | 5 (16,7) | 0 | 0 | 1 (3,3) | 2 (6,7) |
| Galicia | 104 (7,5) | 49 (47,1) | 36 (34,6) | 4 (3,8) | 9 (8,7) | 3 (2,9) | 0 | 1 (1) | 2 (1,9) | 0 |
| Madrid | 296 (21,5) | 137 (46,3) | 80 (27) | 24 (8,1) | 37 (12,5) | 2 (0,7) | 3 (1) | 7 (2,4) | 6 (2) | 0 |
| Murcia | 36 (2,6) | 15 (41,7) | 13 (36,1) | 3 (8,3) | 4 (11,1) | 0 | 0 | 1 (2,8) | 0 | 0 |
| Navarra | 16 (1,2) | 11 (68,8) | 5 (31,3) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| País Vasco | 36 (2,6) | 16 (44,4) | 11 (30,6) | 2 (5,6) | 6 (16,7) | 0 | 1 (2,8) | 0 | 0 | 0 |
| Total | 1.377 (100) | 614 (44,6) | 400 (29) | 113 (8,2) | 158 (11,5) | 27 (2) | 13 (0,9) | 23 (1,7) | 26 (1,8) | 3 (0,2) |
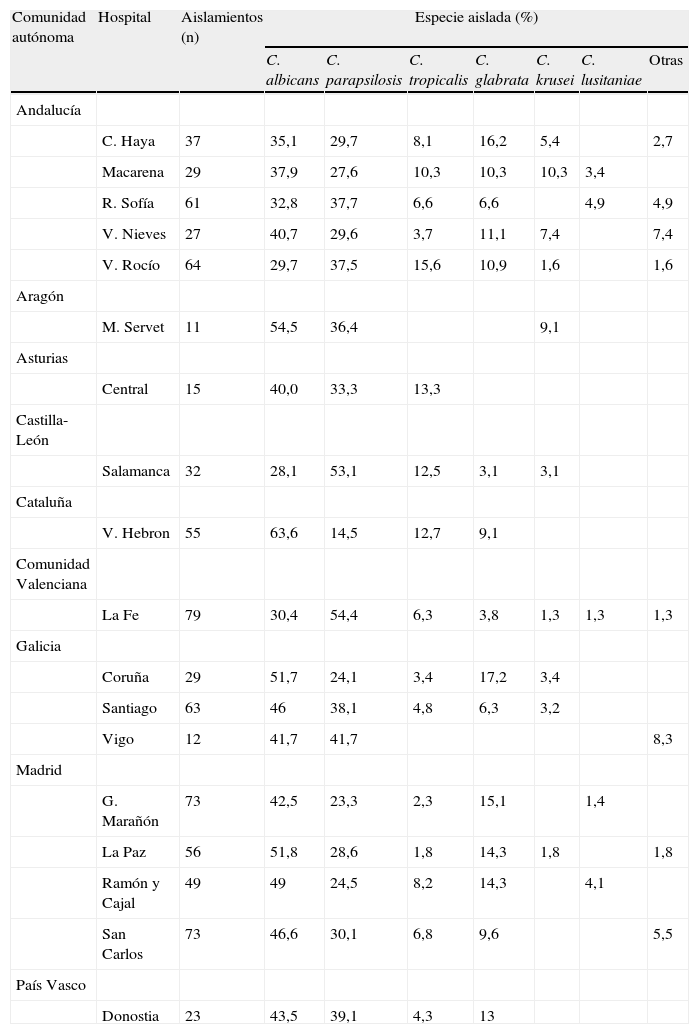
La distribución de los aislamientos en los diferentes centros hospitalarios participantes tampoco fue homogénea. En la tabla 4 se resume la distribución de especies aisladas en los grandes hospitales (más de 1.000 camas). Vall d’Hebron (64%) y Miguel Servet (54,5%) fueron los hospitales donde C. albicans se aisló más frecuentemente; por su parte, las tasas más bajas de aislamiento de esta especie las registraron Virgen del Rocío (30%) y Clínico de Salamanca (28%). C. parapsilosis se aisló de forma predominante en La Fe (54%) y Clínico de Salamanca (53%) y de forma minoritaria en Gregorio Marañón (23%) y Vall d’Hebron (14%). Los hospitales con mayor porcentaje de aislamientos de C. glabrata fueron Gregorio Marañón y La Paz (11 y 8%, respectivamente), en Miguel Servet no se registró ningún aislamiento de esta especie. Entre las especies minoritarias, Virgen del Rocío (10%) y Gregorio Marañón (9%) fueron los hospitales con mayores tasas de aislamiento de C. tropicalis y Virgen de la Macarena (3%) de C. krusei; C. tropicalis no se aisló en Xeral Cíes y Miguel Servet, y tampoco se registró ningún aislamiento de C. krusei en Gregorio Marañón, Vall d’Hebron, Ramón y Cajal, San Carlos y Reina Sofía.
Distribución de las especies aisladas en los centros hospitalarios con más de 1.000 camas
| Comunidad autónoma | Hospital | Aislamientos (n) | Especie aislada (%) | ||||||
| C. albicans | C. parapsilosis | C. tropicalis | C. glabrata | C. krusei | C. lusitaniae | Otras | |||
| Andalucía | |||||||||
| C. Haya | 37 | 35,1 | 29,7 | 8,1 | 16,2 | 5,4 | 2,7 | ||
| Macarena | 29 | 37,9 | 27,6 | 10,3 | 10,3 | 10,3 | 3,4 | ||
| R. Sofía | 61 | 32,8 | 37,7 | 6,6 | 6,6 | 4,9 | 4,9 | ||
| V. Nieves | 27 | 40,7 | 29,6 | 3,7 | 11,1 | 7,4 | 7,4 | ||
| V. Rocío | 64 | 29,7 | 37,5 | 15,6 | 10,9 | 1,6 | 1,6 | ||
| Aragón | |||||||||
| M. Servet | 11 | 54,5 | 36,4 | 9,1 | |||||
| Asturias | |||||||||
| Central | 15 | 40,0 | 33,3 | 13,3 | |||||
| Castilla-León | |||||||||
| Salamanca | 32 | 28,1 | 53,1 | 12,5 | 3,1 | 3,1 | |||
| Cataluña | |||||||||
| V. Hebron | 55 | 63,6 | 14,5 | 12,7 | 9,1 | ||||
| Comunidad Valenciana | |||||||||
| La Fe | 79 | 30,4 | 54,4 | 6,3 | 3,8 | 1,3 | 1,3 | 1,3 | |
| Galicia | |||||||||
| Coruña | 29 | 51,7 | 24,1 | 3,4 | 17,2 | 3,4 | |||
| Santiago | 63 | 46 | 38,1 | 4,8 | 6,3 | 3,2 | |||
| Vigo | 12 | 41,7 | 41,7 | 8,3 | |||||
| Madrid | |||||||||
| G. Marañón | 73 | 42,5 | 23,3 | 2,3 | 15,1 | 1,4 | |||
| La Paz | 56 | 51,8 | 28,6 | 1,8 | 14,3 | 1,8 | 1,8 | ||
| Ramón y Cajal | 49 | 49 | 24,5 | 8,2 | 14,3 | 4,1 | |||
| San Carlos | 73 | 46,6 | 30,1 | 6,8 | 9,6 | 5,5 | |||
| País Vasco | |||||||||
| Donostia | 23 | 43,5 | 39,1 | 4,3 | 13 | ||||
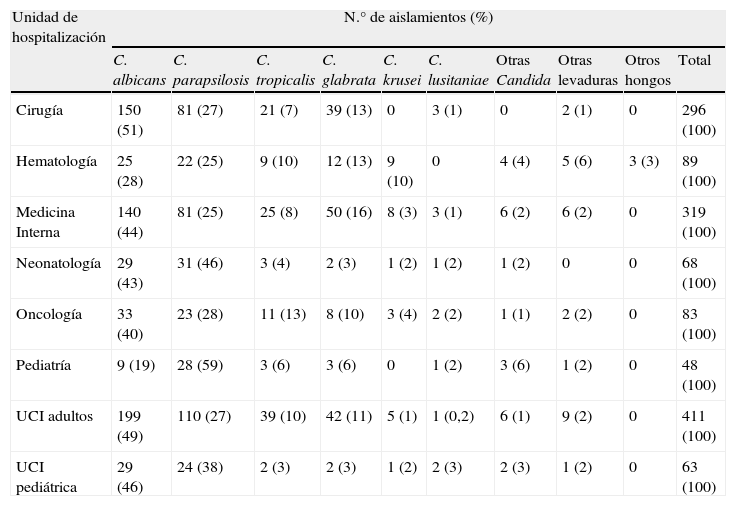
La distribución de las especies aisladas fue similar en las diferentes unidades de hospitalización (tabla 5). C. albicans fue la especie aislada mayoritariamente en todas las unidades excepto Neonatología y Pediatría General; en estas unidades C. parapsilosis se aisló con mayor frecuencia que C. albicans (46 vs. 43% y 59 vs. 19%, respectivamente).
Distribución de especies por unidad de hospitalización
| Unidad de hospitalización | N.° de aislamientos (%) | |||||||||
| C. albicans | C. parapsilosis | C. tropicalis | C. glabrata | C. krusei | C. lusitaniae | Otras Candida | Otras levaduras | Otros hongos | Total | |
| Cirugía | 150 (51) | 81 (27) | 21 (7) | 39 (13) | 0 | 3 (1) | 0 | 2 (1) | 0 | 296 (100) |
| Hematología | 25 (28) | 22 (25) | 9 (10) | 12 (13) | 9 (10) | 0 | 4 (4) | 5 (6) | 3 (3) | 89 (100) |
| Medicina Interna | 140 (44) | 81 (25) | 25 (8) | 50 (16) | 8 (3) | 3 (1) | 6 (2) | 6 (2) | 0 | 319 (100) |
| Neonatología | 29 (43) | 31 (46) | 3 (4) | 2 (3) | 1 (2) | 1 (2) | 1 (2) | 0 | 0 | 68 (100) |
| Oncología | 33 (40) | 23 (28) | 11 (13) | 8 (10) | 3 (4) | 2 (2) | 1 (1) | 2 (2) | 0 | 83 (100) |
| Pediatría | 9 (19) | 28 (59) | 3 (6) | 3 (6) | 0 | 1 (2) | 3 (6) | 1 (2) | 0 | 48 (100) |
| UCI adultos | 199 (49) | 110 (27) | 39 (10) | 42 (11) | 5 (1) | 1 (0,2) | 6 (1) | 9 (2) | 0 | 411 (100) |
| UCI pediátrica | 29 (46) | 24 (38) | 2 (3) | 2 (3) | 1 (2) | 2 (3) | 2 (3) | 1 (2) | 0 | 63 (100) |
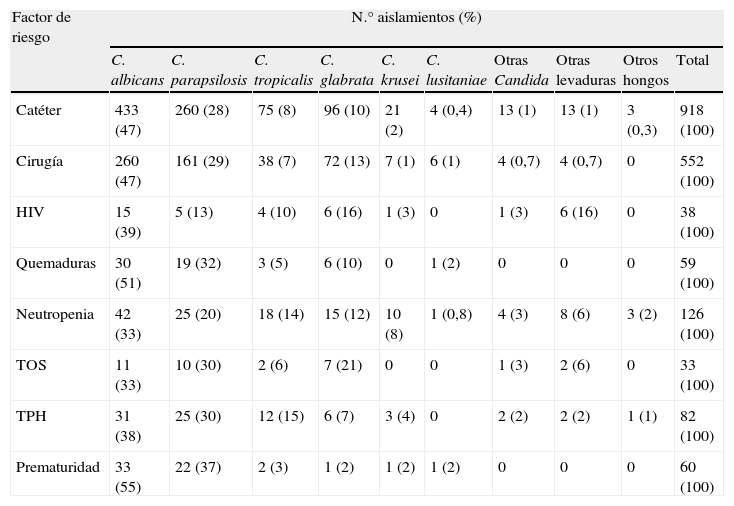
Cuando se clasificaron las fungemias teniendo en cuenta los factores de riesgo de los pacientes, también se observó que C. albicans era la especie predominante en los hemocultivos y C. parapsilosis la segunda en frecuencia a excepción de los pacientes HIV+ en los cuales C. glabrata se aisló con mayor frecuencia que C. parapsilosis (16 vs. 13%, respectivamente). En la tabla 6 se detalla la distribución de las especies aisladas dependiendo del factor de riesgo asociado a cada episodio.
Distribución de las especies aisladas según el factor de riesgo
| Factor de riesgo | N.° aislamientos (%) | |||||||||
| C. albicans | C. parapsilosis | C. tropicalis | C. glabrata | C. krusei | C. lusitaniae | Otras Candida | Otras levaduras | Otros hongos | Total | |
| Catéter | 433 (47) | 260 (28) | 75 (8) | 96 (10) | 21 (2) | 4 (0,4) | 13 (1) | 13 (1) | 3 (0,3) | 918 (100) |
| Cirugía | 260 (47) | 161 (29) | 38 (7) | 72 (13) | 7 (1) | 6 (1) | 4 (0,7) | 4 (0,7) | 0 | 552 (100) |
| HIV | 15 (39) | 5 (13) | 4 (10) | 6 (16) | 1 (3) | 0 | 1 (3) | 6 (16) | 0 | 38 (100) |
| Quemaduras | 30 (51) | 19 (32) | 3 (5) | 6 (10) | 0 | 1 (2) | 0 | 0 | 0 | 59 (100) |
| Neutropenia | 42 (33) | 25 (20) | 18 (14) | 15 (12) | 10 (8) | 1 (0,8) | 4 (3) | 8 (6) | 3 (2) | 126 (100) |
| TOS | 11 (33) | 10 (30) | 2 (6) | 7 (21) | 0 | 0 | 1 (3) | 2 (6) | 0 | 33 (100) |
| TPH | 31 (38) | 25 (30) | 12 (15) | 6 (7) | 3 (4) | 0 | 2 (2) | 2 (2) | 1 (1) | 82 (100) |
| Prematuridad | 33 (55) | 22 (37) | 2 (3) | 1 (2) | 1 (2) | 1 (2) | 0 | 0 | 0 | 60 (100) |
HIV: virus de la inmunodeficiencia humana; TOS: trasplante de órgano sólido; TPH: trasplante de progenitores hematopoyéticos.
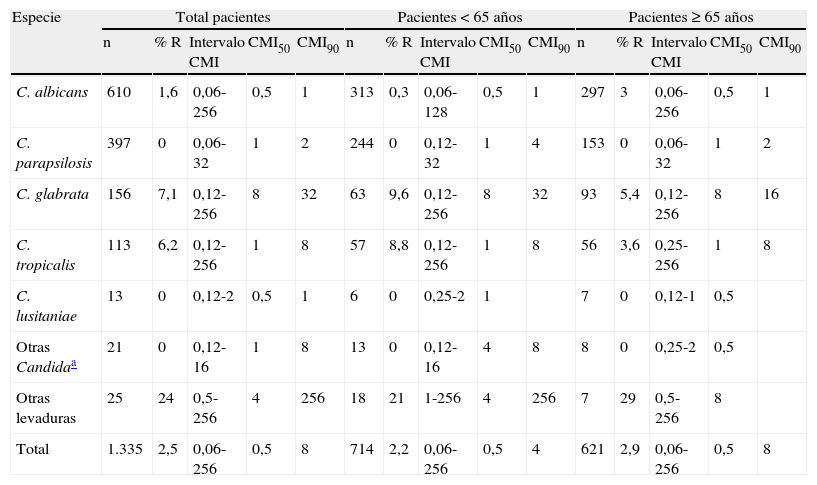
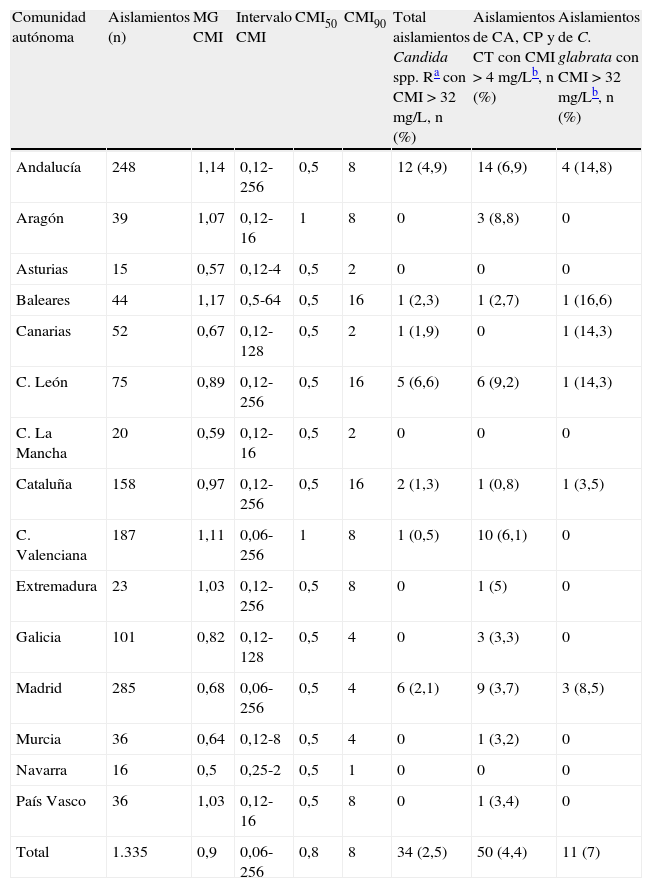
El estudio de sensibilidad in vitro a fluconazol se realizó en 1.335 aislamientos. En la tabla 7 se indica el porcentaje de aislamientos resistentes, el intervalo de la CMI, la CMI50 y la CMI90 de fluconazol sobre las principales especies aisladas en el estudio. Además de los datos globales, los resultados también se agrupan en función de la edad de los pacientes (menores o mayores de 65 años). Globalmente, la CMI50 osciló entre 0,5 y 1 mg/L en todas las especies de Candida excepto C. glabrata (8 mg/L). Cuando estos parámetros de sensibilidad se analizaron en función de la edad de los pacientes, no se observaron diferencias entre mayores y menores de 65 años. Analizados en su totalidad, el 2,5% de los aislamientos fueron resistentes a fluconazol (CMI≥64 mg/L), siendo muy similares las tasas de resistencia global entre los menores y mayores de 65 años (2,2 vs. 2,9%, respectivamente). Sin embargo, el porcentaje de C. albicans resistente a fluconazol fue diez veces superior en los pacientes mayores de 65 años, en comparación con los menores de esa edad. Entre las levaduras no pertenecientes al género Candida, solo las especies de Rhodotorula fueron resistentes a fluconazol (CMI≥64 mg/L). Al analizar la sensibilidad a fluconazol de todas las especies en conjunto según la comunidad autónoma (tabla 8), se apreció una homogeneidad casi total. La CMI50 de fluconazol fue 0,5 mg/L en todas las comunidades autónomas excepto en Aragón y la Comunidad Valenciana (1 mg/L). Sin embargo, la CMI90 más elevada (16 mg/L) fue observada en Baleares, Castilla-León y Cataluña. Según el punto de corte clínico del CLSI, la tasa global de aislamientos resistentes a fluconazol en España fue del 2,5%; en cada comunidad autónoma la tasa de resistencia osciló entre 0-6,6% (tabla 8). Sin embargo, aplicando los nuevos puntos de corte para fluconazol propuestos por Pfaller et al12, que consideran como resistentes los aislamientos de C. albicans, C. parapsilosis y C. tropicalis inhibidos con > 4 mg/L, la tasa de resistencia nacional a fluconazol de estas tres especies fue del 4,4% y la de C. glabrata, 7% (CMI > 32 mg/L). Castilla-León fue la comunidad autónoma con mayor tasa de resistencia de C. albicans, C. parapsilosis y C. tropicalis (9,2%), y Baleares donde se observó una mayor resistencia de C. glabrata (16,6%).
Sensibilidad a fluconazol (mg/L) de todos los aislamientos, detallada por especies
| Especie | Total pacientes | Pacientes < 65 años | Pacientes ≥ 65 años | ||||||||||||
| n | % R | Intervalo CMI | CMI50 | CMI90 | n | % R | Intervalo CMI | CMI50 | CMI90 | n | % R | Intervalo CMI | CMI50 | CMI90 | |
| C. albicans | 610 | 1,6 | 0,06-256 | 0,5 | 1 | 313 | 0,3 | 0,06-128 | 0,5 | 1 | 297 | 3 | 0,06-256 | 0,5 | 1 |
| C. parapsilosis | 397 | 0 | 0,06-32 | 1 | 2 | 244 | 0 | 0,12-32 | 1 | 4 | 153 | 0 | 0,06-32 | 1 | 2 |
| C. glabrata | 156 | 7,1 | 0,12-256 | 8 | 32 | 63 | 9,6 | 0,12-256 | 8 | 32 | 93 | 5,4 | 0,12-256 | 8 | 16 |
| C. tropicalis | 113 | 6,2 | 0,12-256 | 1 | 8 | 57 | 8,8 | 0,12-256 | 1 | 8 | 56 | 3,6 | 0,25-256 | 1 | 8 |
| C. lusitaniae | 13 | 0 | 0,12-2 | 0,5 | 1 | 6 | 0 | 0,25-2 | 1 | 7 | 0 | 0,12-1 | 0,5 | ||
| Otras Candidaa | 21 | 0 | 0,12-16 | 1 | 8 | 13 | 0 | 0,12-16 | 4 | 8 | 8 | 0 | 0,25-2 | 0,5 | |
| Otras levaduras | 25 | 24 | 0,5-256 | 4 | 256 | 18 | 21 | 1-256 | 4 | 256 | 7 | 29 | 0,5-256 | 8 | |
| Total | 1.335 | 2,5 | 0,06-256 | 0,5 | 8 | 714 | 2,2 | 0,06-256 | 0,5 | 4 | 621 | 2,9 | 0,06-256 | 0,5 | 8 |
Sensibilidad a fluconazol (mg/L) detallada por comunidad autónoma
| Comunidad autónoma | Aislamientos (n) | MG CMI | Intervalo CMI | CMI50 | CMI90 | Total aislamientos Candida spp. Ra con CMI > 32 mg/L, n (%) | Aislamientos de CA, CP y CT con CMI > 4 mg/Lb, n (%) | Aislamientos de C. glabrata con CMI > 32 mg/Lb, n (%) |
| Andalucía | 248 | 1,14 | 0,12-256 | 0,5 | 8 | 12 (4,9) | 14 (6,9) | 4 (14,8) |
| Aragón | 39 | 1,07 | 0,12-16 | 1 | 8 | 0 | 3 (8,8) | 0 |
| Asturias | 15 | 0,57 | 0,12-4 | 0,5 | 2 | 0 | 0 | 0 |
| Baleares | 44 | 1,17 | 0,5-64 | 0,5 | 16 | 1 (2,3) | 1 (2,7) | 1 (16,6) |
| Canarias | 52 | 0,67 | 0,12-128 | 0,5 | 2 | 1 (1,9) | 0 | 1 (14,3) |
| C. León | 75 | 0,89 | 0,12-256 | 0,5 | 16 | 5 (6,6) | 6 (9,2) | 1 (14,3) |
| C. La Mancha | 20 | 0,59 | 0,12-16 | 0,5 | 2 | 0 | 0 | 0 |
| Cataluña | 158 | 0,97 | 0,12-256 | 0,5 | 16 | 2 (1,3) | 1 (0,8) | 1 (3,5) |
| C. Valenciana | 187 | 1,11 | 0,06-256 | 1 | 8 | 1 (0,5) | 10 (6,1) | 0 |
| Extremadura | 23 | 1,03 | 0,12-256 | 0,5 | 8 | 0 | 1 (5) | 0 |
| Galicia | 101 | 0,82 | 0,12-128 | 0,5 | 4 | 0 | 3 (3,3) | 0 |
| Madrid | 285 | 0,68 | 0,06-256 | 0,5 | 4 | 6 (2,1) | 9 (3,7) | 3 (8,5) |
| Murcia | 36 | 0,64 | 0,12-8 | 0,5 | 4 | 0 | 1 (3,2) | 0 |
| Navarra | 16 | 0,5 | 0,25-2 | 0,5 | 1 | 0 | 0 | 0 |
| País Vasco | 36 | 1,03 | 0,12-16 | 0,5 | 8 | 0 | 1 (3,4) | 0 |
| Total | 1.335 | 0,9 | 0,06-256 | 0,8 | 8 | 34 (2,5) | 50 (4,4) | 11 (7) |
CA: C. albicans; CP: C. parapsilosis; CT: C. tropicalis; MG: media geométrica; R: resistente.
En el presente trabajo se analizan 1.357 episodios de fungemia procedentes de 44 centros hospitalarios españoles participantes en el estudio FUNGEMYCA. Los episodios fueron incluidos de forma prospectiva durante 13 meses consecutivos (enero de 2009-febrero de 2010) constituyendo el mayor estudio sobre epidemiología de fungemia realizado en nuestro país hasta la fecha. Otros estudios multicéntricos y prospectivos españoles incluyen también series elevadas de episodios1,3,10, pero ninguno de ellos ha reunido un número tan grande de centros participantes ni de episodios analizados.
En nuestro estudio, casi la mitad de las fungemias (46,7%) se observan en pacientes mayores de 65 años y aproximadamente un tercio (30%) en pacientes ingresados en UCI. La hegemonía de la UCI como unidad de hospitalización donde se diagnostican más episodios de fungemia en nuestro país se mantiene constante a lo largo del tiempo. Ya hace diez años, la tasa de candidemia en UCI españolas era del 29%11, porcentaje similar al encontrado en el estudio de Barcelona en 2005 (33%)1 y al nacional recientemente publicado (25,6%)3. Sin embargo, entre los factores de riesgo comúnmente asociados a fungemia, la tasa de pacientes con CVC en el momento del diagnóstico ha disminuido en los últimos años. Hace diez años esa tasa era del 82%11, en 2005 fue del 89%1 y en el último estudio publicado del 66,8%3, coincidiendo plenamente con la tasa observada en nuestro estudio (66,6%).
C. albicans es la especie más frecuentemente aislada en nuestro país como causa de fungemia (44,7%), seguida de C. parapsilosis (29%), C. glabrata (11,5%), C. tropicalis (8,25), C. krusei (2%) y de otras especies (4,6%) (tabla 1). Esta distribución de especies es similar a la publicada recientemente por Cisterna et al en nuestro país3, aunque los porcentajes de aislamiento de las principales especies varían ligeramente. En un total de 20 episodios de nuestro estudio (1,5%) se aísla simultáneamente más de una especie fúngica (tabla 2); la mitad de estos episodios mixtos se observan en UCI. Esta tasa de episodios mixtos es muy similar a la observada hace diez años por nosotros (1,03%)11 y hace siete años en Barcelona (2%)1.
La distribución de las especies aisladas no es homogénea en todo el país (tabla 3). C. albicans es la especie aislada mayoritariamente en todas las comunidades autónomas (con un intervalo de incidencia del 34,6 al 68,8%) excepto en la Comunidad Valenciana, donde C. parapsilosis es la especie más frecuente (39,8%). C. parapsilosis es la segunda especie aislada en todas las comunidades autónomas, excepto en Cataluña (12,4%), donde es la tercera después de C. glabrata (17,4%). Por su parte, C. glabrata es la tercera especie en frecuencia en todas las comunidades autónomas, excepto en Asturias y Navarra (donde no se registra ningún aislamiento), la Comunidad Valenciana (9,4%), donde ocupa el cuarto lugar, detrás de C. tropicalis (11,5%), y Cataluña, donde ocupa el segundo lugar detrás de C. albicans. Entre las comunidades autónomas que aportaron más de cien aislamientos al estudio (Galicia, Cataluña, Madrid, Comunidad Valenciana y Andalucía) se observan interesantes diferencias en la distribución de las especies aisladas. Entre ellas, Cataluña es la Comunidad Autónoma con menor incidencia de C. parapsilosis, diferencia que es estadísticamente significativa (P < 0,05) cuando se compara con las otras cuatro. Además, la tasa de C. glabrata también es significativamente superior (P < 0,05) en Cataluña a la observada en Andalucía, Galicia y la Comunidad Valenciana. Por su parte, la incidencia de C. albicans en Galicia, Madrid y Cataluña es muy superior (P < 0,05) a la de Andalucía y la Comunidad Valenciana. A su vez, la tasa de incidencia de C. parapsilosis en la Comunidad Valenciana es la mayor de todas las comunidades autónomas (39,8%); además, esta tasa es significativamente superior (P < 0,05) a la observada en Cataluña y Madrid. Según los datos obtenidos en el estudio, Galicia y Madrid presentan una distribución de las especies aisladas muy similar (sin diferencias significativas en ninguna de las especies aisladas), al igual que Andalucía y la Comunidad Valenciana, donde tampoco se observan diferencias significativas entre ambas.
Al analizar la distribución de las especies en los diferentes centros participantes también se aprecian ciertas peculiaridades. En los grandes hospitales (> 1.000 camas), C albicans es la especie más frecuentemente aislada como causa de fungemia en todos los centros excepto en cuatro hospitales, donde C. parapsilosis es la especie predominante: Reina Sofía (32,8 vs. 37,7%), Virgen del Rocío (29,7 vs. 37,5%), Clínico de Salamanca (28,1 vs. 53,1%) y La Fe (30,4 vs. 54,4%). Además, C. glabrata es la tercera especie aislada en todos los grandes centros excepto en Miguel Servet y Central de Asturias (donde no se aísla esta especie), y Virgen del Rocío, Clínico de Salamanca y Vall d’Hebron, en donde es la cuarta especie aislada después de C. tropicalis (tabla 4).
Dentro de los hospitales, la distribución de las especies aisladas tampoco es homogénea. Aunque C. albicans, C. parapsilosis y C. glabrata son las tres especies mayoritarias, y en ese orden, en casi todas las unidades de hospitalización, en Neonatología y Pediatría General C. parapsilosis es la especie predominante, seguida de C. albicans y C. tropicalis. Además, en Oncología, C. tropicalis también ocupa el tercer lugar en frecuencia por delante de C. glabrata (tabla 5).
Cuando se analiza la distribución de las especies en función del factor de riesgo asociado a la fungemia, C. albicans es la especie más frecuentemente asociada a todos ellos seguida de C. parapsilosis y C. glabrata, excepto en los pacientes HIV, donde C. glabrata es la segunda causa de fungemia, y los pacientes con neutropenia o receptores de TPH, en los cuales C. tropicalis es la tercera causa de fungemia por delante de C. glabrata (tabla 6).
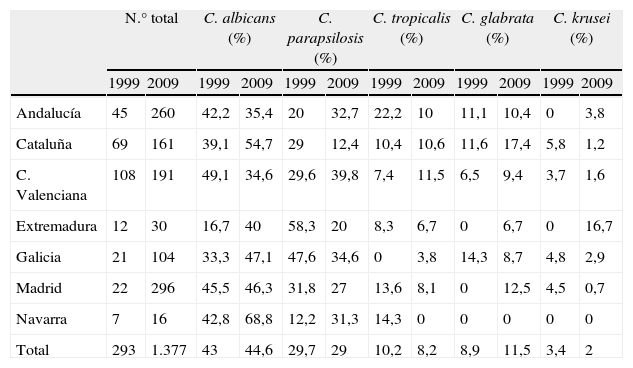
En el estudio multicéntrico sobre la epidemiología de las candidemias en España realizado por nuestro grupo hace 10 años, participaron 19 hospitales de 9 comunidades autónomas y se incluyeron 293 aislamientos de levaduras procedentes de hemocultivo11. Al comparar los resultados obtenidos en ambos estudios (1999 vs. 2009) se observa cómo, globalmente, el porcentaje de incidencia de las principales especies causantes de fungemia en nuestro país apenas ha variado. C. albicans fue y sigue siendo la especie predominante (43 vs. 44,6%), seguida de C. parapsilosis (29,7 vs. 29%); sin embargo, el porcentaje de aislamientos de C. glabrata ha aumentado ligeramente (8,9 vs. 11,5%) y los de C. tropicalis (10,2 vs. 8,2%) y C. krusei (3,4 vs. 2%) han descendido (tabla 9). Al analizar los resultados en función de cada comunidad autónoma sí se aprecian mayores diferencias en ambos periodos. La incidencia de C. albicans ha aumentado en todas las comunidades autónomas incluidas en ambos estudios excepto en Andalucía y la Comunidad Valenciana. Pero el incremento de C. albicans en estos 10 años solo ha sido estadísticamente significativo en Cataluña (39,1 vs. 54,7%, P=0,03), al igual que la disminución de esta especie en la Comunidad Valenciana (49,1 vs. 34,6%, P=0,01). Por su parte, C. parapsilosis ha disminuido de forma significativa su incidencia en Cataluña (29 vs. 12,4%, P=0,002) y Extremadura (58,3 vs. 20%, P=0,01). En Andalucía (20 vs. 32,7%), la Comunidad Valenciana (29,6 vs. 39.8%) y Navarra (12,2 vs. 31.3%) se observa un incremento, no significativo, de la incidencia de C. parapsilosis. El resto de las principales especies varía muy poco sus tasas de incidencia en los dos estudios, con la excepción de C. tropicalis en Andalucía (22,2 vs. 10%, P=0,01) y C. krusei en Cataluña (5,8 vs. 1,2%, P=0,04).
Distribución de las principales especies aisladas en cada comunidad autónoma en los años 1997-1999 y 2009
| N.° total | C. albicans (%) | C. parapsilosis (%) | C. tropicalis (%) | C. glabrata (%) | C. krusei (%) | |||||||
| 1999 | 2009 | 1999 | 2009 | 1999 | 2009 | 1999 | 2009 | 1999 | 2009 | 1999 | 2009 | |
| Andalucía | 45 | 260 | 42,2 | 35,4 | 20 | 32,7 | 22,2 | 10 | 11,1 | 10,4 | 0 | 3,8 |
| Cataluña | 69 | 161 | 39,1 | 54,7 | 29 | 12,4 | 10,4 | 10,6 | 11,6 | 17,4 | 5,8 | 1,2 |
| C. Valenciana | 108 | 191 | 49,1 | 34,6 | 29,6 | 39,8 | 7,4 | 11,5 | 6,5 | 9,4 | 3,7 | 1,6 |
| Extremadura | 12 | 30 | 16,7 | 40 | 58,3 | 20 | 8,3 | 6,7 | 0 | 6,7 | 0 | 16,7 |
| Galicia | 21 | 104 | 33,3 | 47,1 | 47,6 | 34,6 | 0 | 3,8 | 14,3 | 8,7 | 4,8 | 2,9 |
| Madrid | 22 | 296 | 45,5 | 46,3 | 31,8 | 27 | 13,6 | 8,1 | 0 | 12,5 | 4,5 | 0,7 |
| Navarra | 7 | 16 | 42,8 | 68,8 | 12,2 | 31,3 | 14,3 | 0 | 0 | 0 | 0 | 0 |
| Total | 293 | 1.377 | 43 | 44,6 | 29,7 | 29 | 10,2 | 8,2 | 8,9 | 11,5 | 3,4 | 2 |
La sensibilidad a fluconazol se ha estudiado en 1.335 de los aislamientos, observándose una tasa global de resistencia muy baja (2,5%). Por especies, C. glabrata presenta la tasa más elevada de resistencia (7,1%), seguida de C. tropicalis (6,2%) y C. albicans (1,6%). No se ha observado ningún aislamiento resistente de C. parapsilosis, C. lusitaniae, C. dubliniensis, C. guilliermondii, C. kefyr o C. pseudotropicalis. Al analizar la actividad in vitro de fluconazol en función de la edad de los pacientes, los aislamientos de C. albicans en mayores de 65 años son 10 veces más resistentes a fluconazol que en los menores de esa edad. Sin embargo, en los pacientes menores de 65 años se observa una mayor tasa de resistencia a fluconazol en los aislamientos de C. glabrata (9,6 vs. 5,4%) y C. tropicalis (8,8 vs. 3,6%). En el resto de especies, las tasas de resistencia son similares en ambos grupos de edad. Pfaller et al en el estudio SENTRY13 también observan un mayor porcentaje de aislamientos resistentes a fluconazol en el grupo de 29 a 59 años, edad en la que se enmarcan la mayoría de los aislamientos resistentes a fluconazol de nuestro estudio. Otros autores en estudios epidemiológicos similares obtienen porcentajes de resistencia parecidos: Rodríguez et al16, utilizando el método EUCAST, obtienen una tasa de resistencia total para las cuatro especies (C. albicans, C. parapsilosis, C. tropicalis y C. glabrata) en los aislamientos del área metropolitana de Barcelona del 5,7 vs. el 4,7% obtenido en nuestro estudio cuando aplicamos el mismo punto de corte (> 4 mg/L). Cisterna et al3, utilizando el método M27-A3, alcanzan un 5,2% de aislamientos con sensibilidad disminuida a fluconazol (CMI > 8 mg/L) para estas cuatro especies vs. al 6,2% obtenido en el presente estudio. La tasa de resistencia a fluconazol (CMI≥64 mg/L) ha disminuido ligeramente con respecto a la tasa global de resistencia obtenida en nuestro anterior estudio epidemiológico hace 10 años, pasando del 3,7 al 2,5% actual, aunque el método utilizado en el anterior estudio fue el M27-A y lectura a las 24 h de incubación10. Si se compara por especies, la mayor disminución en la tasa de resistencias se ha observado en los aislamientos de C. albicans (3 vs. 1,6%); en las otras especies esta disminución no es tan marcada: C. parapsilosis (3 vs. 2,3%), C. tropicalis (6,6 vs. 6,2%) y C. glabrata (8 vs. 7,1%). Estos datos confirman la posición actual del fluconazol en las últimas recomendaciones terapéuticas publicadas donde se aconseja su uso como fármaco de primera elección en candidemias de pacientes no neutropénicos hemodinámicamente estables y sin tratamiento previo con azoles, o, como alternativa a las candinas, en el tratamiento empírico de pacientes neutropénicos sin prescripción previa de azoles6,8.
Este es el primer estudio español, de ámbito nacional, donde se presenta información sobre la distribución de las especies y su sensibilidad a fluconazol en cada comunidad autónoma participante, comparando los resultados obtenidos entre las distintas comunidades autónomas. Es llamativa la variabilidad geográfica entre autonomías en la distribución de las especies, variabilidad que se observa también entre algunos centros dentro de la misma comunidad autónoma. Sin embargo, la tasa de resistencia a fluconazol se mantiene muy baja y uniforme en todas las comunidades autónomas sin apreciarse incrementos de la misma en los últimos 10 años, periodo en el que se han incorporado nuevos e importantes fármacos al arsenal terapéutico antifúngico, corroborando las recomendaciones recientemente publicadas en las guías terapéuticas para tratamiento empírico de las candidemias con fluconazol.
A la vista de estos resultados, donde la distribución de las especies aisladas varía en función de la comunidad autónoma, hospital e, incluso, unidad de hospitalización, es necesario remarcar la importancia de la realización de este tipo de estudios para realmente conocer la realidad epidemiológica propia de cada centro y unidad, muy distinta a la de otros países o latitudes geográficas y también, en ocasiones, a la macrorrealidad del país o de la propia comunidad autónoma.
Conflicto de interesesEl presente estudio forma parte del Proyecto FUNGEMYCA, financiado por Astellas Pharma, S.A.
Jesús Guinea (Hospital Universitario Gregorio Marañón, Madrid); Paloma Merino (Hospital Clínico San Carlos, Madrid); Maite Ruiz Pérez de Pipaon (Hospital Universitario Virgen del Rocío, Sevilla); Luisa Pérez del Molino (Complejo Hospitalario, Santiago de Compostela); María José Linares (Hospital Universitario Reina Sofía, Córdoba); Francesc Marco Reverté (Hospital Clínic, Barcelona); Julio García (Hospital Universitario La Paz, Madrid); Eva María Roselló Mayans (Hospital Universitario Vall d’Hebron, Barcelona); Rafael Cantón (Hospital Universitario Ramón y Cajal, Madrid); Nuria Borrell Solé (Hospital Universitario Son Dureta, Palma de Mallorca); Aurelio Porras (Hospital Universitario Carlos Haya, Málaga); J. Ruiz Gómez y Genoveva Yagüe (Hospital Universitario Virgen de la Arrixaca, Murcia); Inmaculada García García (Hospital Clínico, Salamanca); Remedios Guna Serrano (Hospital General, Valencia); Carmen Pazos Pacheco (Hospital San Pedro de Alcántara, Cáceres).
Además de los autores del presente manuscrito, en el Proyecto FUNGEMYCA también participan los autores que se relacionan en el anexo.