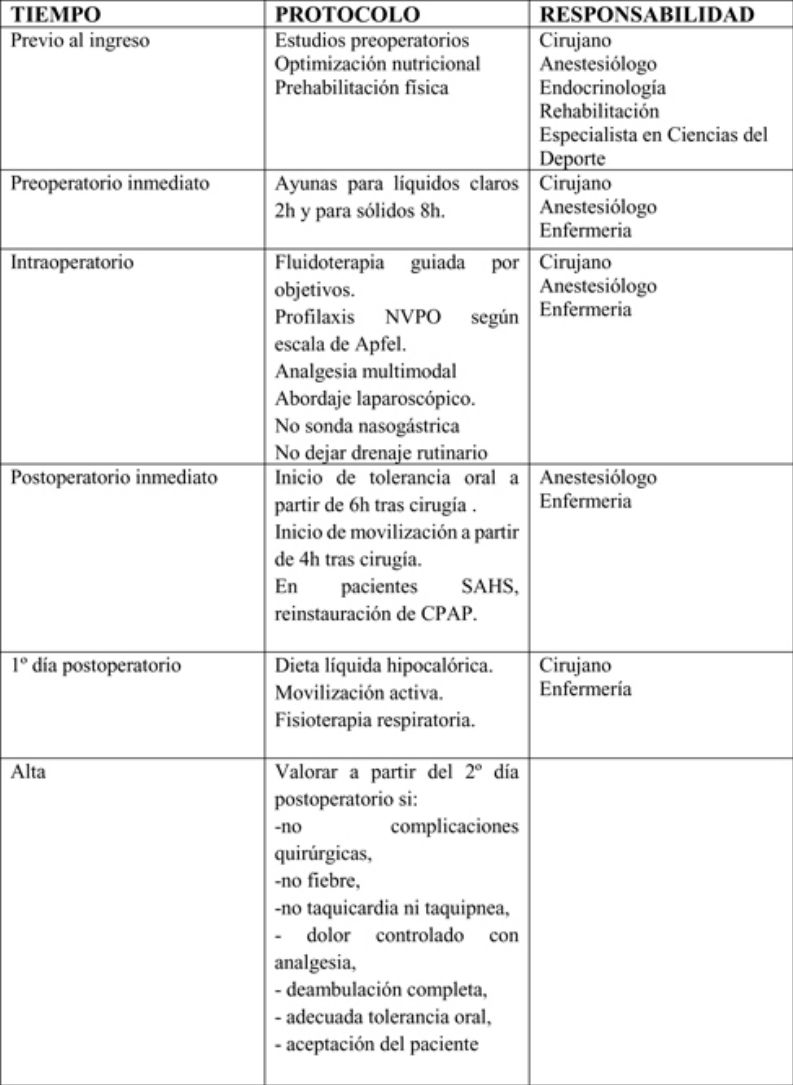
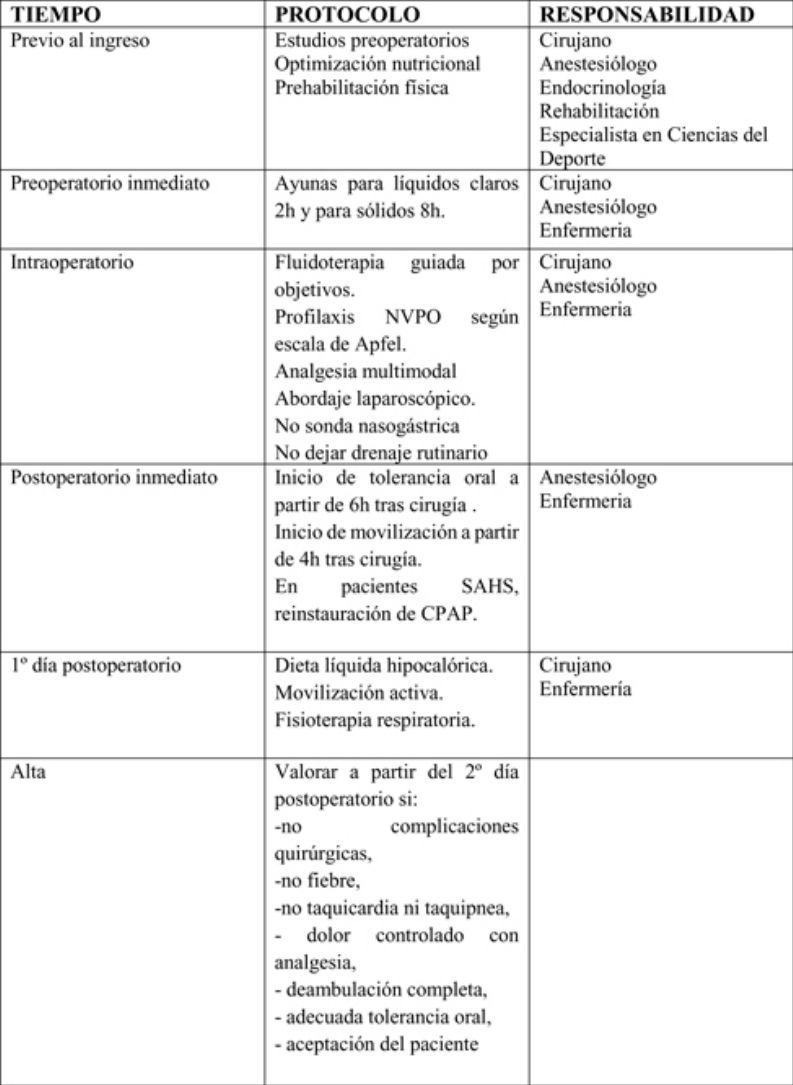
Los protocolos de rehabilitación multimodal o recuperación intensificada (PRI) son programas de cuidado del paciente basados en la evidencia científica y orientados a mejorar su recuperación postoperatoria. Abarcan todos los aspectos implicados en el cuidado del paciente y requieren un manejo multidisciplinar, en el que intervienen varios especialistas. La aplicación de estos protocolos se está extendiendo ampliamente por diferentes tipos de cirugías abdominales y extraabdominales, incluyendo la cirugía bariátrica.
Facultativos de diferentes especialidades, con experiencia en el tratamiento de pacientes obesos mórbidos, han formado parte del grupo de trabajo que desarrolló este protocolo. Para evaluar la evidencia científica actualizada, se realizó una búsqueda bibliográfica sobre PRI en cirugía bariátrica en diferentes bases de datos, estableciendo los niveles de calidad de evidencia y el grado de recomendación según la metodología GRADE. Se agruparon las actuaciones incluidas en la matriz temporal en 3 etapas: preoperatorio, perioperatorio y postoperatorio.
Enhanced recovery after surgery (ERAS) protocols are care programs based on scientific evidence and focused on postoperative recovery. They encompass all aspects of patient care and require multidisciplinary management, with the participation of diverse specialists. The implementation of these protocols is being extended to several abdominal and extra-abdominal surgeries, including bariatric approaches.
Diverse specialists with wide experience in the management of morbidly obese patients have taken part in the working group that developed this protocol. A bibliographic search about ERAS in bariatric surgery in several databases was performed to evaluate the current scientific evidence, establishing evidence levels and recommendations according to the GRADE methodology. The items included in this protocol are separated into preoperative, perioperative and postoperative guidelines.
Los protocolos de rehabilitación multimodal o recuperación intensificada (PRI), conocidos fuera de nuestro país como Enhanced Recovery After Surgery (ERAS), son programas de cuidado del paciente, basados en la evidencia científica y orientados a mejorar su recuperación postoperatoria. Abarcan todos los aspectos implicados en el cuidado del paciente, que requieren un manejo multidisciplinar, en el que intervienen varios especialistas. Esto ha demostrado claros beneficios en la recuperación postoperatoria, en términos de reducción de morbimortalidad, de estancia hospitalaria y gasto sanitario1,2. La protocolización de los cuidados perioperatorios también ha permitido «estandarizar» los procesos y mejorar la información aportada a pacientes y familiares. Esto último permite que el paciente también sea parte activa de su propia recuperación3.
Kehlet y Wilmore fueron los primeros en aplicar una serie de medidas de este tipo tras cirugía colorrectal dentro de un programa que llamaron «fast-track»1. Ante los excelentes resultados obtenidos en este tipo de cirugía, parece lógico extender su aplicación a otras cirugías abdominales o extraabdominales (traumatología, cirugía torácica, etc.)4-6.
En 2007, se creó en nuestro país el Grupo Español de Rehabilitación Multimodal (GERM), desarrollando inicialmente protocolos en cirugía colorrectal, cuya aplicación demostró claras ventajas frente a los estándares de cuidado clásico7-9. En 2014, se crearon grupos de trabajo para desarrollar protocolos aplicables a otras cirugías abdominales (cirugía gástrica10, esofágica11, hepática y bariátrica12,13). Con base en estos protocolos, y en colaboración con el Ministerio de Sanidad Asuntos Sociales e Igualdad, se publicó en el año 2015 la «Vía clínica de Recuperación Intensificada en Cirugía Abdominal (RICA)»14. A partir del protocolo en cirugía bariátrica se desarrolló también la «Vía clínica de cirugía bariátrica» en 2017, avalada por la Sociedad Española de Cirugía de la Obesidad (SECO), la sección de Obesidad Mórbida de la Asociación Española de Cirujanos y el GERM15.
En este documento presentamos la matriz temporal de PRI para gastrectomía vertical y bypass gástrico en Y de Roux como procedimientos bariátricos. Esta matriz temporal se realizó de forma consensuada entre todos los miembros del Grupo de trabajo para cirugía bariátrica del GERM, y está basada en una revisión exhaustiva de la evidencia disponible en la literatura, con aportaciones de la experiencia del grupo multidisciplinar de expertos que conforman el grupo de trabajo.
MétodosFacultativos de diferentes especialidades, incluyendo cirujanos, anestesiólogos, endocrinólogos, enfermeras y graduados en ciencias del deporte, con experiencia en el tratamiento de pacientes obesos mórbidos, han formado parte del grupo de trabajo que desarrolló este protocolo, creando una primera matriz temporal en una reunión de consenso llevada a cabo en Zaragoza en marzo del 2016. Posteriormente, esta matriz fue reevaluada y actualizada durante una reunión de trabajo durante el II Congreso del GERM, celebrado en Salamanca en abril del 2018.
Para evaluar la evidencia científica actualizada, se realizó una búsqueda bibliográfica sobre rehabilitación multimodal en cirugía bariátrica en las bases de datos Biblioteca Cochrane Plus (Cochrane Library), Medline, EMBASE y Scopus, desde 1995 hasta 2018, estableciendo los niveles de calidad de evidencia y el grado de recomendación según la metodología GRADE (tablas 1 y 2)16.
Escala GRADE. Significado de los niveles de evidencia
| Niveles de calidad | Definición |
|---|---|
| Alto | Alta confianza en la coincidencia entre el efecto real y el estimado |
| Moderado | Moderada confianza en la estimación del efecto. Hay posibilidad de que el efecto real esté alejado del efecto estimado |
| Bajo | Confianza limitada en la estimación del efecto. El efecto real puede estar lejos del estimado |
| Muy bajo | Poca confianza en el efecto estimado. El efecto verdadero muy probablemente sea diferente del estimado |
Clasificación del nivel de evidencia según el sistema GRADE
| Tipo de estudio | Nivel de calidad a priori | Desciende si | Sube si | Nivel de calidad a posteriori |
|---|---|---|---|---|
| Estudios aleatorizados | Alta | Riesgo de sesgo:– 1: importante– 2: muy importanteInconsistencia:– 1: importante– 2: muy importante | Efecto:+1: grande+2: muy grandeDosis-respuesta:+1: gradiente evidente | AltaModerada |
| Estudios observacionales | Baja | No evidencia directa:– 1: importante– 2: muy importanteImprecisión:– 1: importante– 2: muy importanteSesgo de publicación:– 1: probable– 2: muy probable | Todos los factores de confusión:+1: reducirían el efecto observado+1: sugerirían un efecto espurio si no hay efecto observado | BajaMuy baja |
Se agruparon las actuaciones incluidas en la matriz temporal en 3 etapas: preoperatorio, perioperatorio y postoperatorio.
ResultadosIndicaciones y contraindicacionesSerán candidatos para la aplicación de las medidas recomendadas aquellos pacientes que vayan a ser tratados mediante una gastrectomía vertical o un bypass gástrico en Y de Roux, cumpliendo las indicaciones generales de estos procedimientos: índice de masa corporal (IMC)> 40 kg/m2 o IMC> 35 kg/m2 asociado a comorbilidades derivadas de la obesidad.
Además, deberán cumplirse los siguientes criterios:
- –
Edad superior a 18 años.
- –
Estado cognitivo adecuado.
- –
ASA I, II y III.
Se excluirá para la aplicación de este protocolo a los pacientes tratados mediante otros procedimientos bariátricos, así como a los pacientes tratados mediante estas técnicas como procedimientos de revisión de otras técnicas bariátricas previas.
Periodo preoperatorioEn este periodo deben participar cirujanos, anestesiólogos, endocrinólogos, rehabilitadores y especialistas en ciencias del deporte. En este periodo cabe destacar las siguientes medidas:
- •
Información detallada oral y escrita de todo el proceso: esto permite reducir la ansiedad del paciente, favorece la tolerancia a alimentación por vía oral y movilización precoz, y mejora el control del dolor. (Recomendación fuerte. Nivel de evidencia moderado)17.
- •
Realización de estudios preoperatorios:
- ∘
Evaluación cardiológica si> 3 factores de riesgo cardiovascular: según la American Heart Association, todo paciente candidato a cirugía bariátrica debe tener una parte de la historia clínica y exploración enfocada a descubrir enfermedad cardiaca. No obstante, el examen físico suele infraestimar la disfunción cardiaca del obeso. (Recomendación fuerte. Nivel de evidencia: alto).
- ∘
Como pruebas asociadas, a todos los pacientes se les debe realizar electrocardiograma de 12 derivaciones y radiografía de tórax. Y se deben estudiar los factores de riesgo para enfermedad coronaria, que incluyen: cirugía mayor abdominal, antecedentes de enfermedad coronaria, insuficiencia cardiaca o accidentes cerebrovasculares, tratamiento con insulina y creatinina sérica preoperatoria> 2,0mg/dl, si hay 3 o más factores de riesgo, debe realizarse un test de esfuerzo, ecocardiograma, ecocardiograma de esfuerzo, ecocardiograma transesofágico con dobutamina o ventriculografía isotópica. (Recomendación fuerte. Nivel de evidencia alto)18.
- ∘
Screening del síndrome de apnea-hipopnea del sueño (SAHS): la prevalencia de SAHS entre pacientes con indicación de cirugía bariátrica es del 76-96%, pero solo el 15-20% están diagnosticados. En caso de diagnóstico de SAHS y que esté indicada la instauración de CPAP, es imprescindible su uso al menos durante 4-6 semanas, porque reduce la incidencia de complicaciones cardiopulmonares. La polisomnografía no debe realizarse indiscriminadamente. Existen diferentes cuestionarios para la valoración de SAHS. El test STOP-BANG es el que presenta la mayor sensibilidad (100%) y valor predictivo negativo (100%) para un índice de apnea-hipopnea> 30. Se recomienda la realización de screening de SAHS con el test STOP-BANG. Una puntuación igual o superior a 3 es indicación de polisomnografía. (Recomendación fuerte. Nivel de evidencia alto)19-21.
- ∘
Espirometría: se recomienda la realización de espirometría solo si existen factores de riesgo pulmonares identificados con otros estudios o al realizar la historia clínica. (Recomendación fuerte. Nivel de evidencia alto)22.
- ∘
Estudios de laboratorio: no hay evidencia del beneficio de hacer determinación de vitaminas y minerales en el preoperatorio. (Recomendación débil. Nivel de evidencia bajo23).
- ∘
En todos los pacientes obesos debe obtenerse un perfil lipídico. (Recomendación fuerte. Nivel de evidencia alto)23.
- ∘
Se recomienda evaluar la función renal en todos los pacientes, especialmente si son diabéticos e hipertensos. (Recomendación fuerte. Nivel de evidencia alto)24.
- ∘
En el paciente diabético se recomienda determinación de hemoglobina glucosilada (HbA1c), que permite valorar el control glucémico a medio plazo (3 meses). Antes de la cirugía, se recomienda una glucemia basal ≤ 110mg/dl, una glucemia posprandrial ≤ 140mg/dl y HbA1c 6,5-7%, aunque en pacientes con dificultad para alcanzar un buen control, se acepta HbA1c 7-8%. (Recomendación débil. Nivel de evidencia bajo)23.
- ∘
Endoscopia digestiva alta o estudio esófago-gastroduodenal: es frecuente que los pacientes obesos mórbidos presenten gastritis o reflujo gastroesofágico, que no siempre es sintomático y que puede afectar a la evolución tras la intervención. En los pacientes sintomáticos se debe realizar endoscopia digestiva alta previa a la cirugía. (Recomendación fuerte. Nivel de evidencia alto)25,26.
- ∘
La European Association for Endoscopic Surgery aconseja la evaluación de tracto digestivo alto por endoscopia o tránsito esófago-gastro-duodenal a todos los pacientes. (Recomendación débil. Nivel de evidencia bajo)27.
- ∘
Screening de Helicobacter pylori(H. pylori) y erradicación preoperatoria (si hay exclusión gástrica): la American Society for Gastrointestinal Endoscopy (ASGE) recomienda realizar test de H. pylori en todos los pacientes y erradicación en los casos positivos, en aquellos pacientes en los que la cirugía va a incluir una exclusión gástrica. (Recomendación débil. Nivel de evidencia bajo)28.
- •
Optimización nutricional:
- ∘
Pérdida de peso antes de la cirugía: la pérdida de peso previa a la intervención ha demostrado beneficios (disminución del volumen hepático, mejor control de glucemia, reducción de grasa visceral, reducción del riesgo de conversión, favorece la adherencia del paciente al tratamiento postoperatorio) y es recomendable ayudar al paciente a que consiga una pérdida del 5-10% de su peso antes de la cirugía. Las mejores estrategias para conseguir esta pérdida de peso son dietas bajas en calorías (800-1.500kcal/día) entre 6 y 12 semanas antes de la intervención o dietas muy bajas en calorías (600kcal/día) entre 2-6 semanas. Suelen utilizarse preparados comerciales que sustituyen una comida, siendo los que producen resultados más reproducibles. (Recomendación débil. Nivel de evidencia bajo)29,30.
- ∘
Valorar métodos coadyuvantes: puede utilizarse el balón intragástrico durante 6-12 meses antes de la intervención o tratamiento farmacológico con sibutramina durante 6 meses. Estos métodos como coadyuvantes de dietas muy bajas en calorías pueden producir mejores resultados de pérdida de peso y de volumen visceral. (Recomendación débil. Nivel de evidencia bajo)29,30.
- •
Fisioterapia respiratoria: el entrenamiento preoperatorio de la musculatura inspiratoria, en los pacientes tratados mediante cirugía bariátrica, mejora la fuerza y resistencia de estos músculos con un incremento de la presión inspiratoria máxima que permite una recuperación precoz de la función pulmonar. La utilización de forma aislada del inspirómetro incentivador no es de utilidad para prevenir el deterioro de la función pulmonar tras la cirugía bariátrica. Se recomienda la realización de fisioterapia respiratoria preoperatoria y postoperatoria. (Recomendación fuerte. Nivel de evidencia moderado)31.
- •
Prehabilitación física
Los pacientes con obesidad mórbida habitualmente muestran un estilo de vida sedentario y bajos niveles de condición física. Una baja capacidad cardiorrespiratoria se asocia a un mayor número de complicaciones postoperatorias (pulmonares, tromboembólicas, etc.) y a una mayor estancia hospitalaria.
Junto a esto, las dietas preoperatorias, además de provocar disminuciones de la masa grasa, van a generar disminuciones de la masa magra, lo que puede evitarse mediante entrenamiento de fuerza.
Siempre que la capacidad funcional del paciente lo permita, es recomendable instaurar un programa de ejercicio, centrado en mejorar la condición física (especialmente la capacidad cardiorrespiratoria), maximizar la pérdida de masa grasa y reducir la pérdida de masa magra. Es aconsejable implantar un programa de ejercicio 3-6 meses previos a la cirugía, que combine entrenamiento cardiorrespiratorio y de fuerza. Debe iniciarse con una frecuencia de 2 días a la semana e ir progresando hasta los 4 días semanales. Iniciar a intensidades moderadas, tanto el entrenamiento cardiorrespiratorio (40-50% consumo de oxígeno pico) como el de fuerza (∼50% de una repetición máxima), e ir progresando a intensidades más elevadas (en función de la tolerancia del paciente). En pacientes a los que no pueda aplicarse un entrenamiento más estricto, debe aconsejárseles que aumenten el número de pasos diarios: empezar con 5.000 pasos/día y progresar hasta 10.000 pasos/día. (Recomendación fuerte. Nivel de evidencia bajo)32-34.
Periodo perioperatorioEn este periodo deben participar cirujanos, anestesiólogos y enfermería. Aquí cabe destacar las siguientes medidas:
- •
Tromboprofilaxis: los pacientes tratados mediante cirugía bariátrica tienen un riesgo alto de sufrir eventos tromboembólicos venosos en el postoperatorio, siendo la embolia pulmonar una de las principales causas de mortalidad. La profilaxis tromboembólica se recomienda de forma rutinaria en todos los pacientes, asociando movilización precoz, la utilización de dispositivos de compresión neumática intermitente y la profilaxis farmacológica con heparinas de bajo peso molecular. La compresión neumática intermitente se debe iniciar en el quirófano y mantener hasta la deambulación completa del paciente. (Recomendación fuerte. Nivel de evidencia moderado)35.
- •
Se debe considerar la profilaxis antitrombótica farmacológica, siguiendo los protocolos de tromboprofilaxis de cada centro (Recomendación fuerte. Nivel de evidencia moderado)35.
- •
Ayunas: los ayunos generan una respuesta catabólica caracterizada por deshidratación, resistencia a la insulina, hiperglucemia postoperatoria y una respuesta inmunológica deprimida. Se aconseja que el período de ayuno para líquidos claros (agua, zumos sin pulpa, bebidas carbohidratadas, té claro y café) sea de 2 h y para sólidos de 8 h. (Recomendación fuerte. Nivel de evidencia moderado)14,36.
- •
Antibioterapia: se recomienda la administración de profilaxis antibiótica sistémica dentro de los 120 min previos a la inducción anestésica. Los fármacos recomendados de primera elección son cefalosporinas de segunda generación y en caso de alergia a betalactámicos se recomienda emplear fluoroquinolonas o la asociación de vancomicina y gentamicina, o clindamicina y aztreonam. Las dosis administradas deben ser ajustadas al peso del paciente37. (Recomendación fuerte. Nivel de evidencia alto).
- •
Monitorización invasiva: la monitorización invasiva no está indicada de forma rutinaria, siendo útil en pacientes seleccionados la canalización arterial invasiva (en pacientes con alteraciones cardiorrespiratorias graves y que puedan presentar problemas en el postoperatorio). (Recomendación fuerte. Nivel de evidencia bajo)14,38.
- •
Catéter venoso central no indicado de rutina: el uso de catéter venoso central debe limitarse a pacientes con enfermedades respiratorias en los que se prevea que puedan necesitar administración de vasopresores o inotrópicos en perfusión continua. (Recomendación fuerte. Nivel de evidencia bajo)14.
- •
Sondaje vesical no indicado de rutina: la colocación de sondaje vesical debe limitarse a pacientes en los que se prevea una cirugía prolongada o bien en pacientes de alto riesgo de presentar complicaciones cardiorrespiratorias o renales durante el periodo intra o postoperatorio. Si se realiza sondaje, se recomienda retirarlo a las 24 h de la intervención, si las circunstancias del paciente lo permiten. (Recomendación fuerte. Nivel de evidencia bajo)14.
- •
Anestesia libre de opiáceos: los opiáceos tienen numerosos efectos adversos, algunos de ellos responsables de la aparición de complicaciones postoperatorias (aumento de náuseas y vómitos, complicaciones respiratorias e hiperalgesia inducida por opiáceos). Los pacientes con SAHS tienen incluso mayor riesgo, por la depresión respiratoria causada por estos fármacos. La anestesia libre de opiáceos mejora la recuperación postoperatoria y reduce el grado de inmunosupresión, además de asociarse a menores requerimientos de opiáceos en el postoperatorio.
Dentro de las indicaciones de la anestesia libre de opiáceos se incluyen la adicción o la intolerancia a narcóticos, pacientes con hiperalgesia, inmunodeprimidos, con SAHS u otras enfermedades pulmonares, y antecedentes de náuseas o vómitos postoperatorios. Se consideran contraindicaciones relativas las alteraciones del sistema nervioso autónomo y pacientes en tratamiento con betabloqueantes o con bloqueos cardiacos. Los fármacos más empleados en la anestesia libre de opiáceos son dexmedetomidina, lidocaína, ketamina, magnesio, clonidina y ketorolaco. (Recomendación fuerte. Nivel de evidencia moderado)39.
- •
Fluidoterapia guiada por objetivos: el objetivo de la fluidoterapia es el mantenimiento de un volumen circulatorio adecuado, evitando en lo posible la sobrecarga. La utilización de fluidoterapia guiada por objetivos ha demostrado reducir la morbimortalidad y la estancia hospitalaria. Se recomienda la monitorización del volumen sistólico o de la variación de volumen sistólico mediante dispositivos validados, para guiar la administración intraoperatoria de fluidos. Se prefiere la monitorización con doppler esofágico o métodos basados en análisis de contorno de pulso. (Recomendación fuerte. Nivel de evidencia alto)14.
- •
En caso de no disponer de estos dispositivos, se recomienda fluidoterapia restrictiva basada en el peso ideal. La mayoría de estudios que aplican la fluidoterapia guiada por objetivos en cirugía bariátrica limitan la infusión de fluidos a una tasa de 600-800ml/h. (Recomendación fuerte. Nivel de evidencia moderado)40,41.
- •
Profilaxis de náuseas y vómitos postoperatorios (NVPO) según escala de Apfel modificada: las náuseas y los vómitos postoperatorios son la primera causa de retraso en la tolerancia a alimentación por vía oral tras cirugía y de alta hospitalaria. Debe estratificarse el riesgo de la aparición de NVPO según la escala de Apfel (tabla 3). (Recomendación fuerte. Nivel de evidencia alto)42.
Tabla 3.Escala de Apfel para estratificación del riesgo de náuseas o vómitos postoperatorios
Factores de riesgo Puntuación Riesgo Mujer 1 Basal 10% No fumador 1 1 punto: 20% Historia previa de náuseas o vómitos postoperatorios o cinetosis 1 2 puntos: 40%3 puntos: 60% Uso de opioides postoperatorios 1 4 punto: 80% Riesgo bajo (0-1 punto, 10-20%); moderado (2 puntos, 40%); alto (3-4 puntos, 60-80%).
Se deben realizar medidas generales de disminución del riesgo de NVPO en los pacientes de moderado-alto riesgo: evitar los anestésicos halogenados, utilización de propofol para la inducción y el mantenimiento, evitar la utilización de protóxido, minimizar el uso de opioides perioperatorios (Recomendación fuerte. Nivel de evidencia alto)43-45.
En función de la puntuación obtenida en la escala de Apfel, los fármacos administrados son dexametasona, ondansetrón y droperidol de forma individual, en doble o triple terapia. (Recomendación fuerte. Nivel de evidencia alto)46.
- •
Analgesia multimodal: existe evidencia científica acerca de la superioridad, tanto en la calidad analgésica, como en la menor tasa de complicaciones postoperatorias, de la analgesia epidural utilizada en cirugía abdominal abierta. Se debe realizar anestesia combinada con analgesia epidural a todos los pacientes tratados mediante cirugía abdominal abierta. (Recomendación fuerte. Nivel de evidencia alto)47.
En cirugía laparoscópica, no existen diferencias significativas en cuanto a complicaciones postoperatorias, reducción de la estancia hospitalaria ni recuperación de la función intestinal precoz. Pese al mejor perfil analgésico, dado el riesgo-beneficio de la técnica, no está recomendada la analgesia epidural como método analgésico de rutina en cirugía laparoscópica. (Recomendación fuerte. Nivel de evidencia alto)48.
El bloqueo del plano transverso del abdomen (TAP) proporciona analgesia para piel, músculos y peritoneo parietal de T7 a L1. El uso de la técnica ecoguiada reduce las complicaciones y la tasa de fallos. No obstante, la anatomía distorsionada del obeso mórbido complica la técnica, aun con la ecografía. El TAP guiado por laparoscopia es una alternativa para la realización eficaz de la técnica. En ningún caso esta práctica supera la eficacia analgésica de la epidural. Aquellos pacientes en los que esté contraindicada la realización de analgesia epidural, podrían beneficiarse de la realización de TAP bilateral como parte de la analgesia multimodal (Recomendación débil. Nivel de evidencia bajo)49-51.
No hay evidencia suficiente que demuestre que la infiltración con anestésico local de las heridas de los trocares mejore el dolor postoperatorio, por lo que no puede recomendarse su utilización rutinaria. (Recomendación débil. Nivel de evidencia bajo)52,53.
- •
No sonda nasogástrica (solo intraoperatoria para vaciar estómago): el uso de sonda nasogástrica no debe ser rutinario, ya que no ha demostrado que prevenga complicaciones y sí que aumenta la estancia hospitalaria (Recomendación fuerte. Nivel de evidencia moderado)54,55.
- •
Drenaje: si se dejan, deben ser cerrados, unidireccionales y conectados a vacío. Recientes estudios muestran que el uso de drenaje no previene fugas ni sangrados, ni facilita su diagnóstico precoz. No se recomienda su uso de forma rutinaria. (Recomendación fuerte. Nivel de evidencia moderado)56.
En este periodo deben participar cirujanos, anestesiólogos y enfermería. Aquí cabe destacar las siguientes medidas:
- •
Inicio de tolerancia oral precoz: la tolerancia oral inicial tras cirugía bariátrica tiene como objetivos principales minimizar los posibles efectos secundarios precoces tras la cirugía (náuseas, vómitos, diarreas, dolor abdominal, etc.). Se recomienda iniciar la tolerancia oral a líquidos en las primeras 6 h postoperatorias. (Recomendación fuerte. Nivel de evidencia alto)23,57.
- •
Se recomienda que la dieta postoperatoria durante las primeras 2semanas se realice con una dieta líquida (preferentemente comercial) que aporte una cuantía de proteínas> 60g/día. (Recomendación fuerte. Nivel de evidencia moderado)58,59.
- •
Movilización precoz tras cirugía: la movilización precoz postoperatoria disminuye el riesgo de complicaciones tales como, tromboembolia pulmonar, úlceras por presión y neumonía, y, por lo tanto, reduce de la estancia hospitalaria. El inicio de la movilización se indicará a partir de las 4 h de la finalización de la cirugía. Se incidirá en la práctica de ejercicios activos de las extremidades inferiores y de derivación circulatoria en sedestación. (Recomendación fuerte. Nivel de evidencia alto)60,61.
- •
En pacientes con SAHS, reinstauración precoz de la CPAP: la CPAP postoperatoria mejora la gasometría arterial y reduce la necesidad de intubación, no incrementando el riesgo de fístula postoperatoria. En los pacientes con SAHS, cuando esté indicado, se recomienda la reinstauración de los dispositivos de CPAP en el postoperatorio de forma precoz (Recomendación débil. Nivel de evidencia bajo)62,63.
- •
Pruebas complementarias: no existe consenso sobre la necesidad de realizar de forma rutinaria estudios de imagen tras cirugía bariátrica. Los estudios radiológicos con contraste oral para descartar fugas anastomóticas tienen una baja sensibilidad. Se recomienda reservar los estudios de imagen para la sospecha clínica de fuga anastomótica y deberían realizarse mediante tomografía computarizada con contraste por vía oral asociado o no a estudios endoscópicos. (Recomendación débil. Nivel de evidencia moderado)64.
Los criterios de alta hospitalaria serán: ausencia de complicaciones quirúrgicas, fiebre, taquicardia o taquipnea, dolor controlado con analgesia, deambulación completa, adecuada tolerancia oral, aceptación por parte del paciente y comprensión de la información dada, posibilidad de seguimiento al alta y disponibilidad de apoyo domiciliario y coordinación con Atención Primaria. (Recomendación fuerte. Nivel de evidencia fuerte)65. El PRI en cirugía bariátrica incluye la información a los pacientes sobre los principales signos de alarma de posibles complicaciones (fiebre, taquicardia, aumento del dolor abdominal, dificultad respiratoria, vómitos o hemorragia digestiva), ante los que deben ponerse en contacto inmediatamente con su médico de Atención Primaria o acudir a Urgencias de su hospital de referencia.
Tras el alta hospitalariaEl control postoperatorio debe estar guiado por cirujanos, endocrinólogos, enfermería y especialistas en ciencias del deporte:
- •
Tromboprofilaxis: la tromboprofilaxis farmacológica debe prolongarse como mínimo 7-10 días tras el alta y valorar extenderla a 4 semanas en pacientes de alto riesgo. (Recomendación débil. Nivel de evidencia bajo)35,66.
- •
Programa de ejercicio postoperatorio: al año de la cirugía, se producen disminuciones de un 8-11% de la densidad mineral ósea de la cadera, lo que aumenta el riesgo de presentar fracturas. Del mismo modo, se producen reducciones de la masa magra (∼10kg al año de la cirugía). Esto va a disminuir la tasa metabólica basal, lo que va a predisponer al organismo a un aumento de peso.
Los principales objetivos del entrenamiento en esta fase serán reducir la pérdida de masa magra y de densidad mineral ósea, así como mejorar la capacidad funcional del paciente. Al mes de la cirugía, se recomienda aplicar un programa de entrenamiento cardiorrespiratorio y de fuerza. El programa debe iniciarse a intensidades moderadas y progresar en función de la evolución del paciente, a intensidades más elevadas, sobre todo en el entrenamiento de fuerza. Iniciar con 2 días a la semana y progresar al menos a 4 días semanales. (Recomendación fuerte. Nivel de evidencia bajo)31-33.
Aunque estas recomendaciones fueron enfocadas inicialmente hacia los pacientes tratados mediante gastrectomía vertical y bypass gástrico en Y de Roux, en la última reunión del grupo de trabajo en cirugía bariátrica del GERM, se planteó la posibilidad de evaluar la aplicación de este PRI a pacientes tratados mediante otros procedimientos bariátricos, tales como el bypass gástrico de una anastomosis u otros procedimientos malabsortivos. Aunque teóricamente la gran mayoría de estas medidas serían aplicables a todos los procedimientos bariátricos, no hay suficiente evidencia en la literatura que respalde el uso de PRI en estas técnicas.
La implantación de estas medidas debe adecuarse a la organización de cada centro, aunque es recomendable la aplicación en conjunto de la mayor parte de ellas. Es necesario el trabajo multidisciplinar de diversos especialistas para obtener una secuencia de cuidados bien estructurada, lo que permitirá que todas las partes del proceso se sucedan de manera más rápida y efectiva. Uno de los propósitos del GERM es evaluar periódicamente los resultados de la aplicación de los protocolos y actualizarlos acorde con las nuevas evidencias científicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Eva Alarcón, Ricardo Belda, Manuel Ferrer, Antonio Morandeira, José Luis Muñoz, Pablo Royo, Elisabeth Redondo, Manuel Duran, Alejandro Garcia, Carlos Ferrigni, Camilo Castellón, Irene Portero, Carmen Vallejo, Damian Garcia-Olmo, Miguel Angel Bielsa, Jose Miguel Candeal, Maria Jose Palacios, Ana Navarro, Azucena Gonzalo, Diana Berrio, Maria Diez, Nuria Esteve, Elena Miranda, Lorea Zubiaga, Antonio Arroyo, Carolina Llavero, Juan Carlos Ruiz de Adana, Javier Martin Ramiro, José María Calvo, Salud García, Fátima Sabench.