La testosterona es una hormona intracrina que se sintetiza desde el colesterol, usando una cascada de enzimas, configurando una vía «frontdoor» para su producción, que es la más conocida. Sin embargo existen al menos 2 vías alternas adrenales de producción consideradas también «frontdoor» y otras 2 vías traseras o «backdoor» que apenas ahora empiezan a ser reconocidas con importancia clínica. En la génesis y tratamiento del cáncer de próstata es fundamental la presencia de testosterona y sus derivados en lo que se conoce como la «hipótesis de los andrógenos». Adicionalmente son muy importantes las cantidades remanentes de andrógenos y si el organismo tiene unas rutas alternas para producir el más potente de los andrógenos, es decir, la dihidrotestosterona (DHT), por lo que conocer las vías traseras de su síntesis (backdoor pathway) y controlarlas, tiene una importancia fundamental en el tratamiento del cáncer de próstata resistente a la castración. La ultracastración (también llamada hipercastración) no es la última frontera en el tratamiento de la enfermedad hormono resistente, puesto que otras alternativas relacionadas con el receptor androgénico, como su modificación o destrucción, están en ciernes.
Testosterone is an intracrine hormone that is synthesized from cholesterol, using a cascade of enzymes that is best known of «frontdoor» pathway for production. However, there are at least two alternative adrenal ways for testosterone synthesis also considered «frontdoor» and two «backdoor» pathways that just now are beginning to be recognized with clinical significance. In prostate cancer the presence of testosterone and its by-products is essential, in what is known as the «androgen's hypothesis». Additionally in prostate cancer the remaining amounts of androgens are very important, as well as knowing if the body has some alternate routes to produce the most important androgens, i.e. dihydrotestosterone (DHT). Knowing the «backdoor pathway» and controlling it is fundamental in the current management of prostate cancer. The so-called ultra-castration (or hypercastration) is not the final frontier in the treatment of hormone resistant disease; alternatives related to the androgen receptor as its modification or destruction are in experimentation.
El tema de la testosterona, y en especial su déficit, ha sido parte integral de la medicina sexual en los últimos 120 años, y a pesar de las intensas pasiones que suscita su discusión, lo que con frecuencia limita el análisis racional del tema, no cesan de producirse cambios, incluso en los paradigmas. Ya la doctrina Morgentaler modificó para siempre la ecuación testosterona/próstata vigente desde la década de los cuarenta. No en vano, el cáncer de próstata es durante todas sus etapas una afinada máquina de matar que funciona más efectivamente en presencia de andrógenos; como el objetivo terapéutico paliativo es el bloqueo de dichos andrógenos, llega un momento de la enfermedad en que las vías alternas de la síntesis de testosterona, llamadas traseras (o backdoor pathway), implican para su control, revisar el modelo tradicional de la síntesis desde colesterol, y en especial las maneras de realizar una cesación efectiva de toda producción, en aquellos pacientes que por su enfermedad de base, mejor ejemplificadas por el cáncer de próstata hormonorresistente, requieren de un bloqueo del máximo grado, incluso con «cero» tolerancia a los andrógenos1-4.
Síntesis de la testosteronaLa testosterona es una hormona esteroidea cuya acción es clásicamente intracrina; es decir, que su real efecto es dentro de la célula, una vez alcanza el receptor androgénico (AR) en el citoplasma de la célula blanco, actuando sobre el núcleo que genera un ARN mensajero, que es copia parcial del ADN nuclear, que permite sintetizar proteínas —lo que se ha llamado acción anabólica—, las que a su vez actúan para ejercer una función en un sitio determinado o ayudar a crear una estructura. Esta acción usa el clásico «ciclo celular», clave de la vida, que cumple con un esquema circular denominado «G-S-M» («Growth, Synthetic and Mitosis»), un proceso unidireccional que permite la replicación de cada célula del genoma humano en 2 células hijas para la transmisión del ADN5-7.
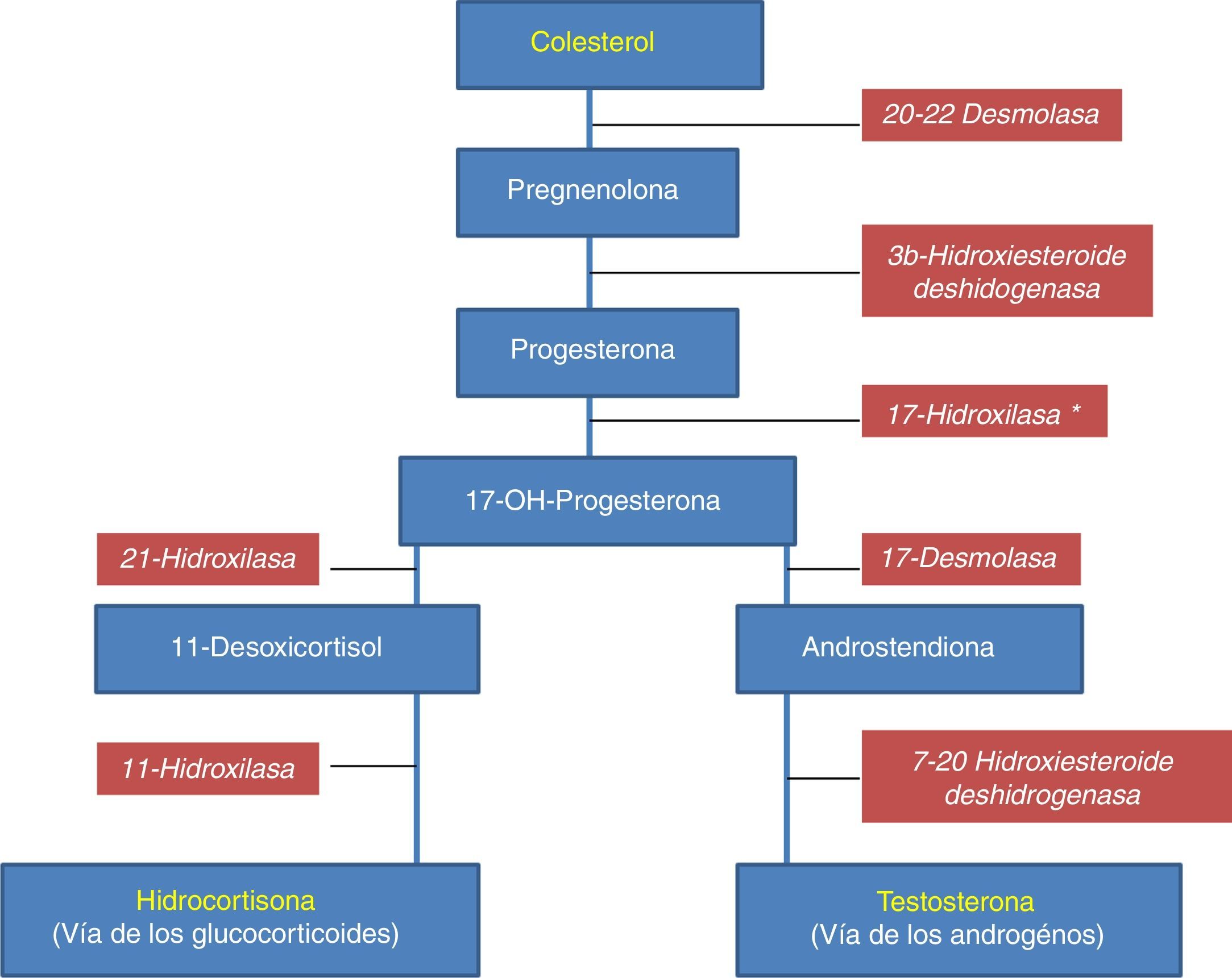
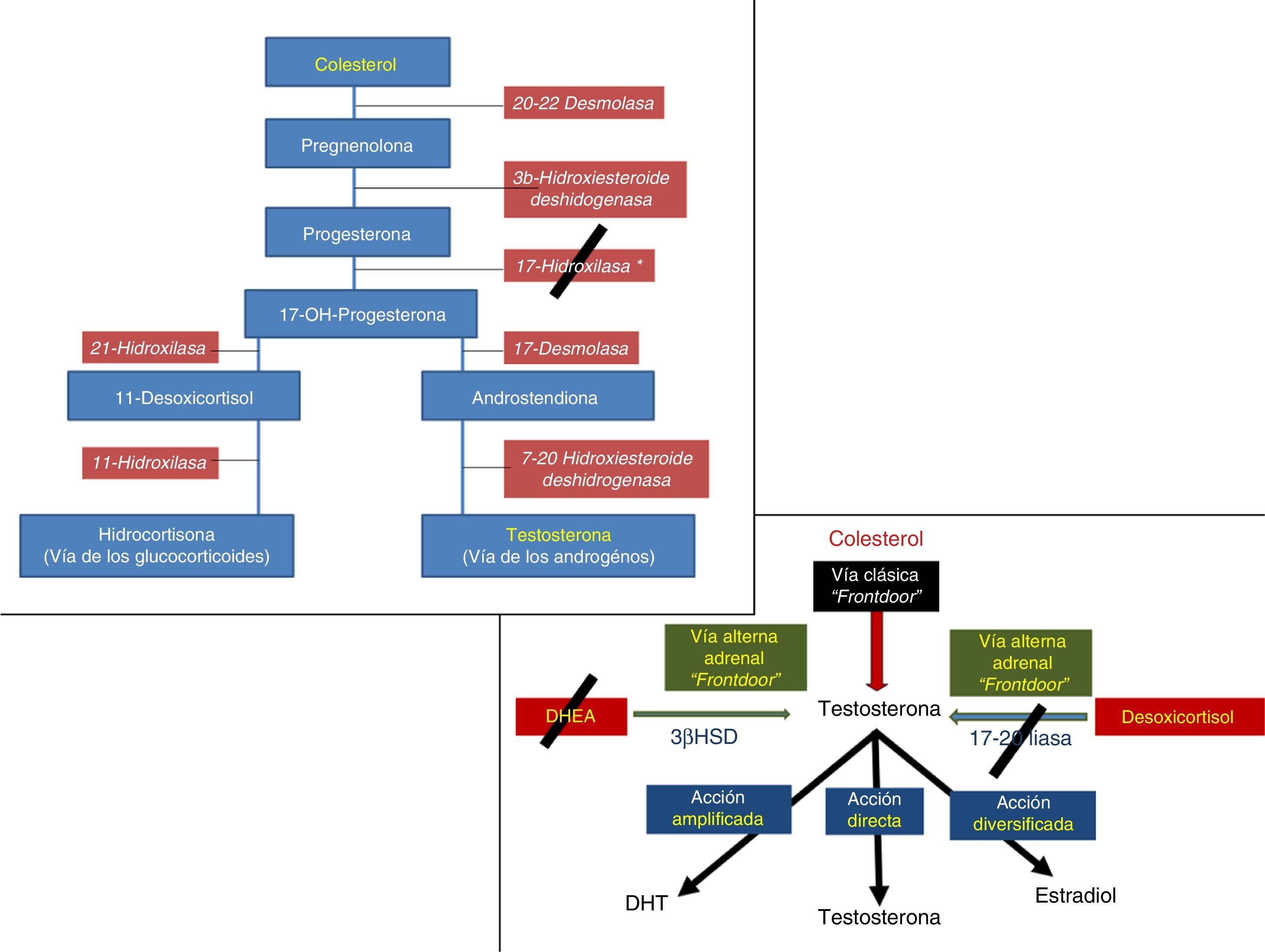
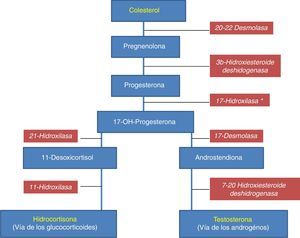
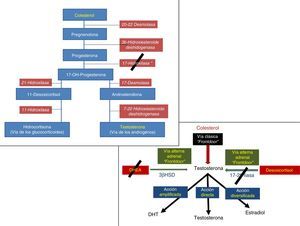
El origen de la síntesis androgénica se remonta hasta el colesterol, que en su vía clásica, luego de 5 pasos, con sus respectivas enzimas, da origen a la testosterona, usando la llamada «vía de los andrógenos», que se alterna en delicado balance con la «vía de los glucocorticoides», que da origen a la hidrocortisona endógena. La testosterona es el mayor andrógeno circulante, secretado principalmente por las células de Leydig del testículo a partir de una molécula de colesterol. La secreción diaria de testosterona testicular es de aproximadamente 10mg, a los que se deben agregar alrededor de 500μg aportados por las glándulas suprarrenales y de la conversión periférica de androstenodiona. La acción inicial y más significativa es la movilización de los ésteres de colesterol, de 27 átomos de carbono, desde las vacuolas grasas a las mitocondrias, su hidroxilación y la posterior conversión en pregnenolona, de 21 átomos de carbono. Este proceso inicial lo logra un complejo enzimático, el citocromo CYP450. Los pasos metabólicos son iniciados por la hormona luteinizante (LH) y en menor medida por otros inductores expresados por las células de Sertoli y el intersticio testicular, como otras hormonas, neurotransmisores y factores de crecimiento (FC), en especial la interleucina-1 (IL-1), que ha demostrado la capacidad de estimular la secreción. Sin embargo, producir las sustancias por esta vía tradicional, o «frontdoor pathway», implica un gran gasto de insumos para el organismo (ver fig. 1, síntesis de testosterona)8-11.
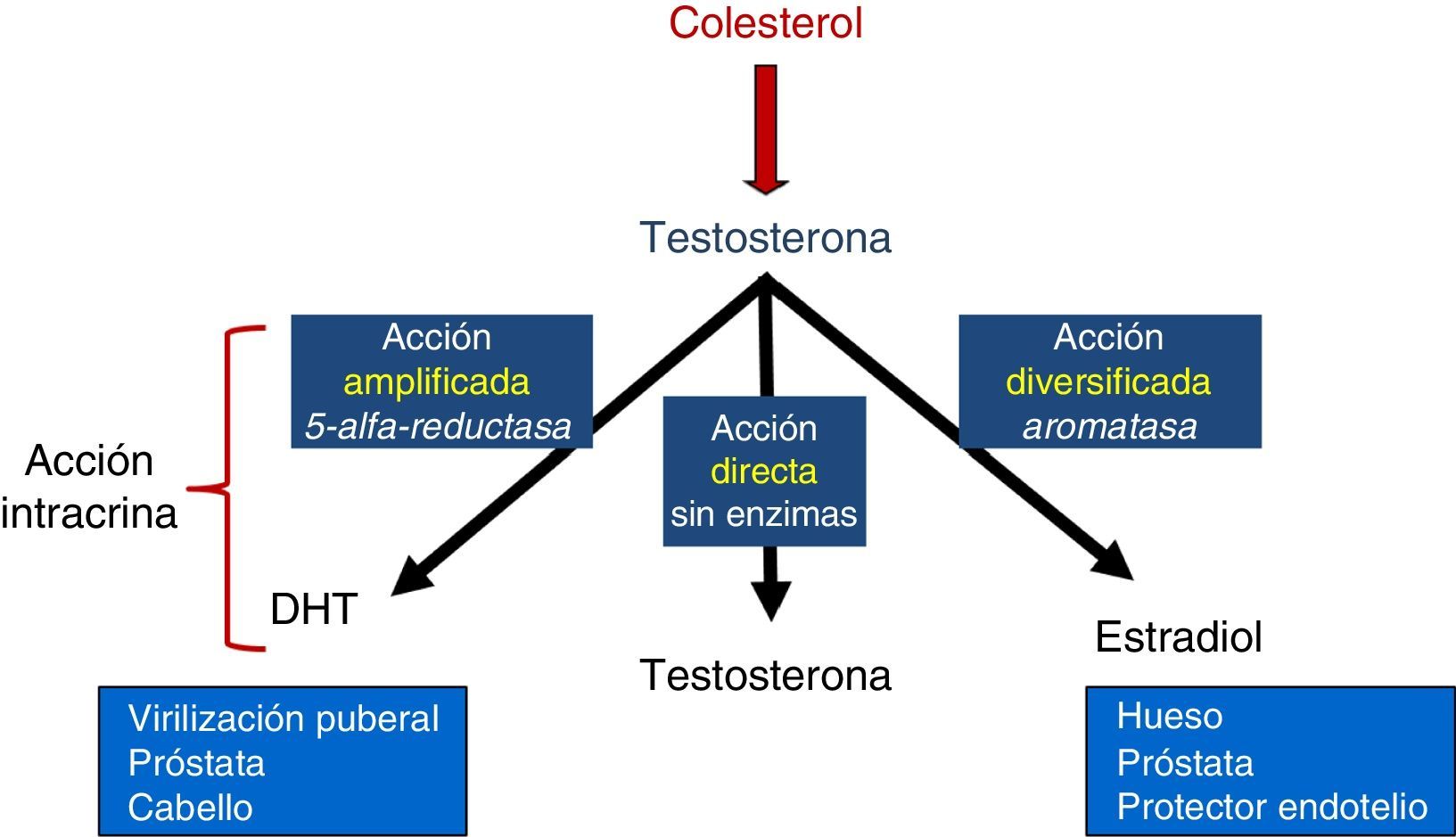
El AR, que está situado en el cromosomaX, interactúa con andrógenos y otras sustancias, lo que en inglés se conoce como ligand. El AR es una puerta inteligente que mantiene una prioridad gradativa a las sustancias que interactúan con él; la puerta de primera clase es para la dihidrotestosterona (DHT); es puerta de segunda clase para la testosterona pura (T), androstenodiona, dihidroepidandrosterona (DHEA) y DHEA-S, y es puerta de tercera clase es para los estrógenos y la progesterona. De esta manera se está garantizado que siempre la testosterona, y sobre todo la DHT, tengan la prioridad de adherencia y función12.
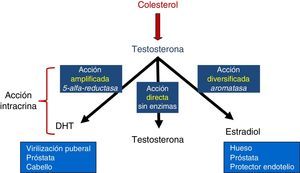
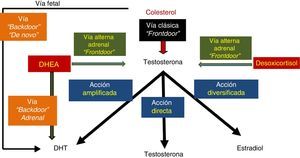
La testosterona (T), como tal, tiene en realidad 3 rutas posibles de acción sobre el AR: una vía amplificada que necesita de la enzima 5 reductasa (5α-R) para convertirse en DHT, que es la vía preferida del receptor; una vía directa como testosterona (T), segunda en preferencia, y una vía diversificada, en que existe aromatización a estrógenos para convertirse en la fuente principal de estrógenos masculinos (E), que es la tercera preferencia. Por supuesto, esta jerarquización tiene importancia para la fisiopatología y el tratamiento del cáncer de próstata (fig. 2).
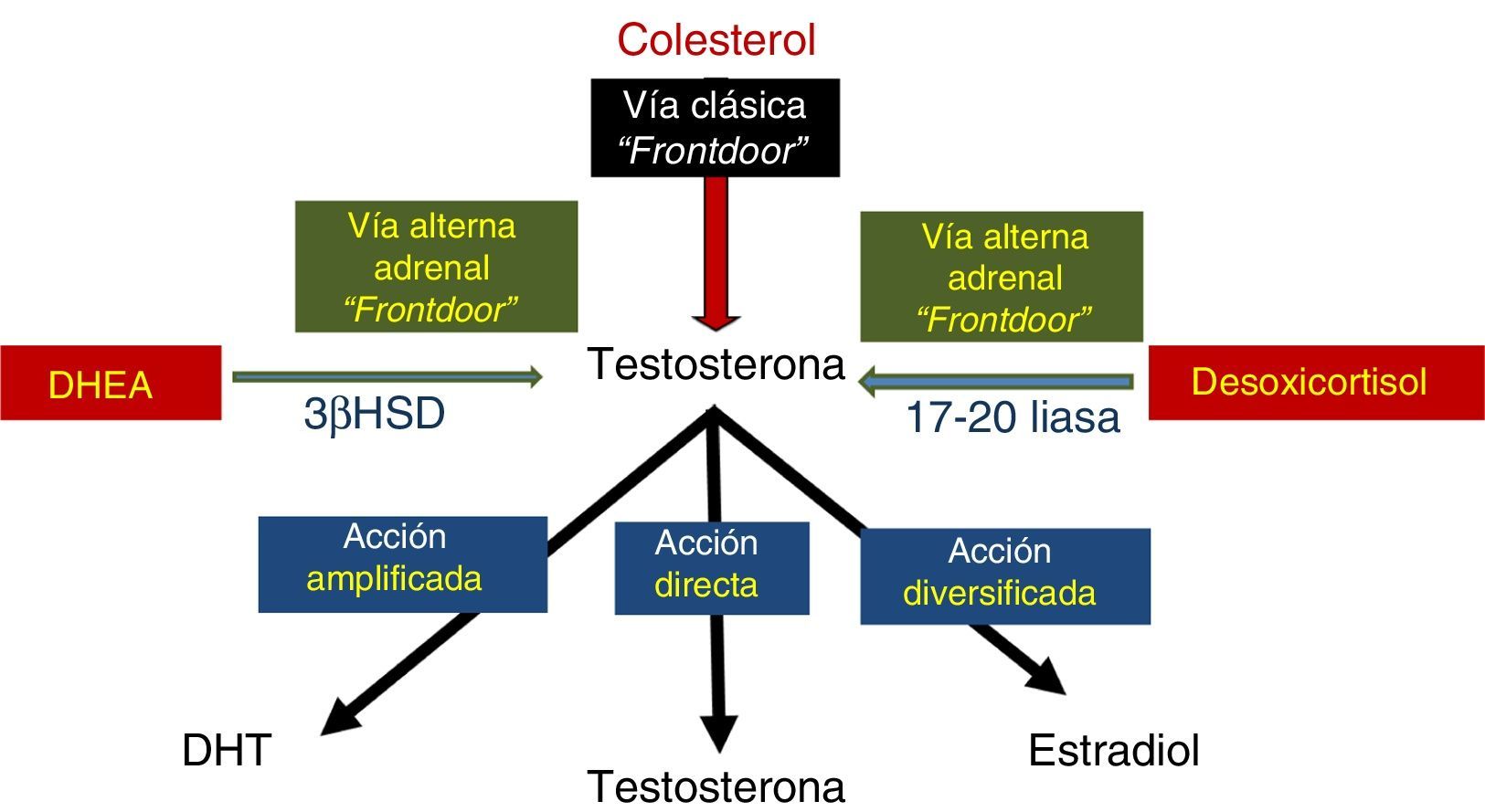
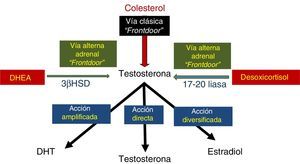
Sin embargo, existen otras 2 vías alternas, de origen adrenal, para generar testosterona (T) que se consideran también «frontdoor»: una es producirla desde la DHEA mediante la enzima 3β-hidroxiesteroide deshidrogenasa, y la otra es producirla desde el desoxicortisol mediante la enzima 17-20 liasa. Ambas producen testosterona, aunque en menor cantidad que la vía clásica desde el colesterol (fig. 3)13.
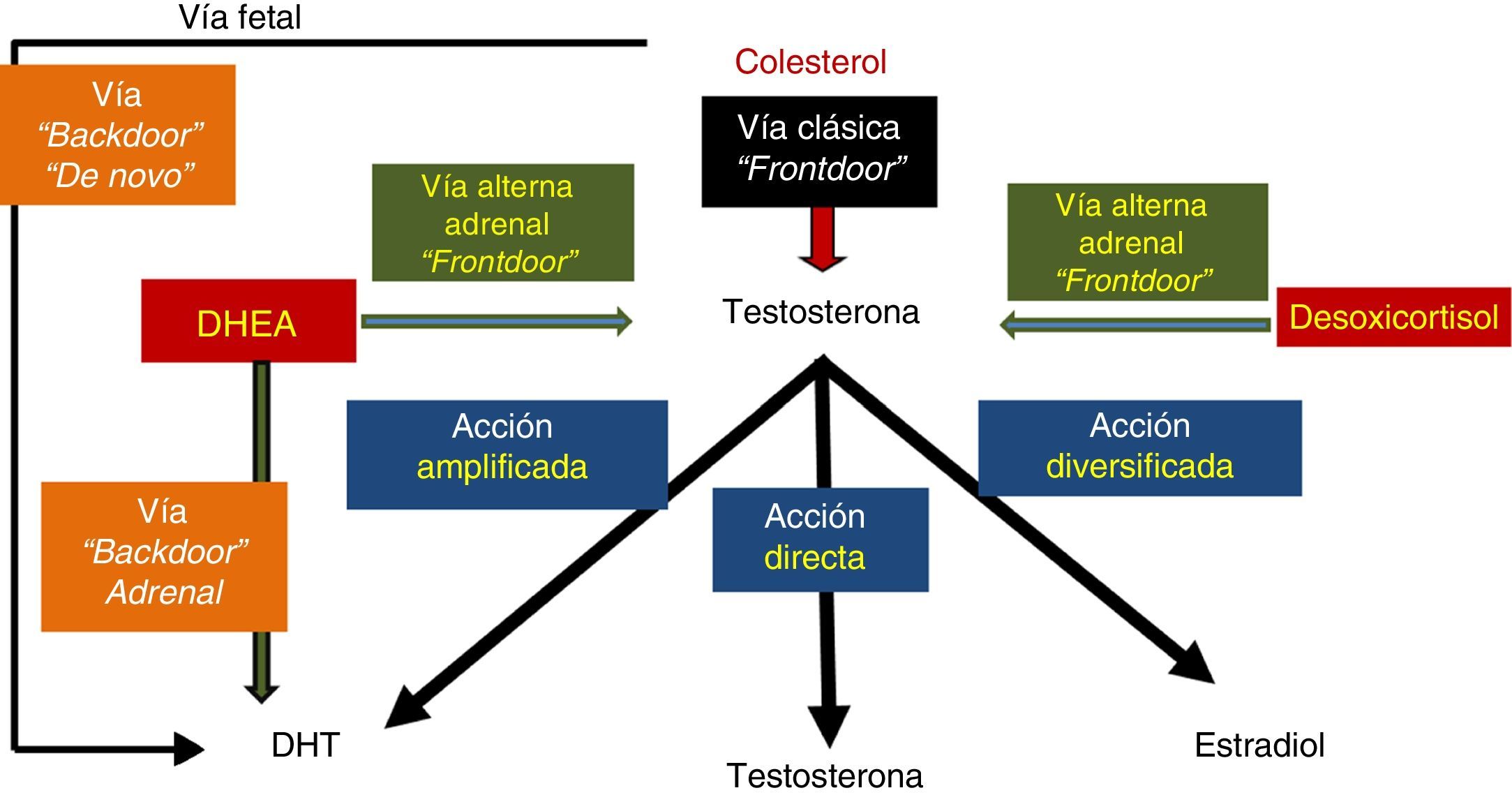
Pero adicionalmente existen otras 2 vías traseras para producir el poderoso andrógeno DHT: una vía directa desde el colesterol, y que es de origen fetal (que puede ser reactivada de novo en algún momento de la vida), y otra vía adrenal para producir DHT desde DHEA. Ambas se consideran «backdoor pathways» (fig. 4)14,15.
Testosterona, receptor androgénico y cáncer de próstataEl receptor androgénico (AR) del paciente con cáncer de próstata responde a la castración con alteraciones moleculares y bioquímicas que causan hipersensibilidad a bajos niveles de estas sustancias o por síntesis nueva de DHT desde andrógenos más débiles como la DHEA y/o desde colesterol, consideradas ambas vías traseras o «backdoor pathway». En el tratamiento actual del cáncer de próstata ha tomado gran importancia el control de estas fuentes de testosterona, aun de las cantidades despreciables que se producen por backdoor pathway16.
En condiciones normales la función del epitelio glandular prostático es secretar PSA (una proteína fundamental para la reproducción de la especie) y factores de crecimiento (FC), pero cuando se produce la transformación maligna se genera una vía aberrante de producción de los mismos FC, de predominio autocrino y siempre a favor del tumor, con tal número de divisiones que tenderá a la inmortalidad.
En realidad la próstata con adenocarcinoma o próstata autocrina es una fábrica siniestra. Cuando ocurre la transformación cancerosa, los mecanismos paracrinos de acción en el receptor androgénico son reemplazados por mecanismos autocrinos emergentes y las células cancerosas son cada vez menos dependientes de los factores celulares estromales. El tumor tendrá a su disposición DHT, que aunque deseable por ser la primera opción del receptor, no es indispensable, porque cada vez será capaz de retroalimentarse en forma autocrina con FC sintetizados para favorecerlo y de otras sustancias como andrógenos suprarrenales, estrógenos y progesterona, que antes eran de menos preferidos que la DHT. Las señales aberrantes crean mutaciones de los FC llevando a pérdida de la función, apagando las señales que inhibirían el cáncer o activando permanentemente las señales que lo favorecen. Son 2 acciones sinérgicas: mutación de la arquitectura y mutación de la función. Esta funcionalidad pro-tumor sigue requiriendo activar el AR, usando desde la sustancia más activa, la DHT, pero logrando activarlo con cualquier molécula que case en el receptor mutado, incluso con antiandrógenos17-22.
Los mecanismos moleculares que contribuyen a la perpetuación de la enfermedad resistente a la castración no dependen solo de conseguir hormonas, sino de cambiar el AR, y son los siguientes:
- 1.
Vía hipersensitiva del AR (hipersensitive pathway). Existe una amplificación genética del AR que se vuelve hipersensible a pequeñas concentraciones de andrógenos por las mutaciones.
- 2.
Vía trasera (backdoor pathway). Consiste en la síntesis intracrina de novo de andrógenos tipo DHT que estimulan muy bien el AR y que es el tema básico de este artículo (ver fig. 4).
- 3.
Vía promiscua (promiscuos pathway). Otras hormonas o sustancias similares estimulan el AR mutado: Estrógenos, progesterona o incluso antiandrógenos como la flutamida o la bicalutamida en el llamado «whitdrawal syndrome».
- 4.
Vía ilegal (outlaw pathway). Moléculas no esteroideas como: FC proliferativo, FC relacionado con la insulina (IGF-1) y la interleucina-6 (IL-6), FC epidérmico; las citoquinas inflamatorias estimulan también el AR.
- 5.
Stem cells. Crecimiento externo de subpoblaciones de células preexistentes andrógeno-independientes derivadas de stem cells totipotenciales.
- 6.
Splice variants. Variantes cortas desde el AR con menos secuencia de proteínas. Se hace un corte y empalme de una proteína precursora que conlleva la eliminación de una secuencia de aminoácidos para originar una nueva proteína madura23,24.
Como son varios los mecanismos que convergen en mantener la señal en el AR en el ambiente de castración, todos son potenciales blancos para una intervención terapéutica. Igualmente han aparecido unos nuevos paradigmas de tratamiento del cáncer de próstata recurrente a la castración que pueden resumirse de la siguiente manera:
El principal mecanismo es prevenir síntesis de andrógenos tisulares es la inhibición de la síntesis de andrógenos de novo usando medicamentos como la abiraterona. Este medicamento produce bloqueo en 2 niveles diferentes: bloqueando la vía de la testosterona al inhibir la enzima 17-hidroxilasa y bloqueando el paso de DHEA a testosterona bloqueando la 3-B hidroxiesteroide deshidrogenasa; debe notarse que por ser el primer bloqueo antes de la 17-OH-progesterona, también se bloquea la vía de los glucocorticoides y el medicamento se debe suministrar con esteroides simultáneos. Al menos en teoría, también sirven los inhibidores de la 5-alfa reductasa para bloquear enzimas involucradas en la síntesis y el metabolismo de los andrógenos (fig. 5)25-29.
Otras alternativas de tratamiento en cáncer de próstata hormonorresistente podrían ser las siguientes:
- 1.
Destruir directamente la vasculatura prostática, lo que impide cualquier función hormonal por falta de sustrato.
- 2.
Prevenir la activación del AR «ligand-independiente» usando inhibidores de señales no nucleares del AR.
- 3.
Aumentar la degradación de los andrógenos tisulares.
- 4.
Inactivar o destruir AR, lo que impide cualquier función hormonal, aun las provenientes de mutación. Se puede hacerse de 3 maneras:
- a.
Bloqueando la síntesis del AR. Esto implica hacer blanco en oligonucleótidos «antimensajeros» (antisense) que bloquean la expresión de genes por el ARN o influir en la «maduración» del AR usando inhibidores de la histona de acetilasa (HDAC). Por ejemplo, vorinostat, panobinostat, romidepsin30.
- b.
Haciendo blanco en las chaperonas del AR para desestabilizar e incrementar las ratas de degradación del AR usando inhibidores contra proteínas como la Hsp90 (17-allylaminogeldanamicina) o Hsp27 (OGX-427 o Apatorsen).
- c.
Usar antagonistas potentes de segunda generación AR que bloqueen el dominio de unión «ligand-binding domain» del AR y prevengan la dimerización y translocación nuclear (por ejemplo, antagonistas de pequeñas moléculas como el MDV3100, llamado enzalutamida)31,32.
- -
La DHT es el andrógeno principal en cáncer de próstata.
- -
Cuando el AR muta, funciona con cualquier cosa.
- -
La ultracastración es uno de los objetivos de tratamiento en enfermedad resistente a la castración.
- -
La combinación abiraterona + prednisona es adecuada para ultracastración. Sin embargo, no existe bloqueo de las 2 vías consideradas «backdoor pathway».
- -
Llegarán más medicamentos o mecanismos que cubran el espectro faltante.
Los autores declaran no tener ningún conflicto de intereses.