Los angiomiolipomas (AML) renales, responsables del 1-3% de todos los tumores renales, son neoplasias benignas de origen mesenquimal compuestas por cantidades variables de tejido adiposo maduro, músculo liso y vasos sanguíneos dismórficos, que hacen parte del grupo de neoplasias de células epitelioides perivasculares (PEComas). Por lo general son asintomáticos, pero el incremento en el uso del ultrasonido, la tomografía computarizada y la resonancia magnética ha aumentado el diagnóstico y, por consiguiente, la incidencia de estas lesiones. Aunque las lesiones con contenido graso de origen renal corresponden en su gran mayoría a AML, es importante hacer diagnóstico diferencial con carcinoma de células renales y liposarcoma retroperitoneal, por lo que es de gran importancia reconocer las características en imágenes típicas y las posibles variantes. Las nuevas modalidades en biología molecular han permitido describir variantes histológicas como el AML epitelioide, que requiere un manejo distinto por su potencial de malignización. Los avances en el tratamiento endovascular han permitido establecer los criterios de riesgo para hemorragia y otras complicaciones.
Renal angiomyolipoma (AML), responsible for 1-3% of all renal neoplasms, are benign tumours of mesenchymal origin composed of varying amounts of mature adipose tissue, smooth muscle, and dysmorphic blood vessels, which form part of the group of perivascular epithelioid cell neoplasms. They are usually asymptomatic, but the increase in the use of ultrasound, computed tomography and magnetic resonance imaging has increased their diagnosis and therefore their incidence. Although renal lesions with fat content mostly correspond to AML, it is important to make differential diagnosis with renal cell carcinoma (RCC) and retroperitoneal liposarcoma; thus it is very important to recognise their typical imaging findings and the possible variants. New modalities in molecular biology have enable histological variants to be described, like epithelioid AML, which requires different management due to its malignancy potential. Advances in endovascular treatment have established risk criteria for bleeding and other complications.
El presente artículo tiene como objetivo realizar una revisión actualizada sobre los angiomiolipomas, haciendo énfasis en sus características en imágenes y el manejo intervencionista. Se realizó una búsqueda de literatura detallada según términos «MeSH» en las bases de datos médicas disponibles con filtros específicos, de estudios realizados entre los años 2002 y 2015, que fueron analizados y seleccionados para hacer la revisión. Se utilizaron casos representativos de nuestra institución.
IntroducciónLos angiomiolipomas (AML) renales son neoplasias benignas de origen mesenquimal compuestas por cantidades variables de tejido adiposo maduro, músculo liso y vasos sanguíneos dismórficos, que representan el 1 al 3% de todos los tumores renales1. Su incidencia en la población general es de aproximadamente el 0,3 al 3%, y como la gran mayoría de ellos suelen ser asintomáticos, se identifican principalmente en autopsias. Antiguamente eran clasificados como hamartomas, pero actualmente hacen parte del grupo de neoplasias de células epitelioides perivasculares, las cuales se caracterizan por proliferación monoclonal de este tipo de células alrededor de vasos sanguíneos. Existen 2 subtipos histológicos, uno clásico —también llamado trifásico— y otro epitelioide, los cuales pueden tener diferentes comportamientos en las modalidades de imágenes diagnósticas. En 2004, la Organización Mundial de la Salud clasificó además los AML de tipo epitelioide como neoplasias potencialmente malignas2-4.
Estos tumores son más frecuentes en mujeres que en hombres. Del 50 al 70% son de presentación esporádica, con una incidencia del 0,1 al 0,2%, y del 30 al 50% restante se asocian a síndromes genéticos, como el complejo de esclerosis tuberosa (CET) y la linfangioleiomiomatosis pulmonar esporádica. El 80% de pacientes con CET presentan AML renales en algún momento de su vida5,6 y su etiología aún no es conocida. Se han descrito 2 tipos: el tipo 1 (CET1), asociado a alteración en el cromosoma 9q34, y el tipo 2 (CET2), asociado a alteración en el cromosoma 16q13.3. En los AML epitelioides (AMLE), que pueden tener transformación maligna, se ha descrito además mutación de gen p537-9.
Los AML de tipo esporádico usualmente son lesiones focales únicas, se presentan alrededor de la cuarta a sexta décadas de la vida y predominan en mujeres con una relación de 4:19; la mayoría son asintomáticos, aunque se pueden presentar como masas palpables asociadas a dolor en flancos y hematuria. Los AML que se asocian a CET tienden a ser lesiones múltiples, siendo más comunes también en mujeres pero manifestándose en edades más tempranas (tercera a cuarta décadas de la vida). En algunos estudios se ha demostrado mayor tendencia de estos últimos a presentar complicaciones como rotura y hemorragia10.
Los AMLE, que representan alrededor del 8% de los AML renales, se asocian con mayor frecuencia a CET4. Se caracterizan por tener un comportamiento mucho más agresivo, siendo masas grandes, necróticas e infiltrativas. Aproximadamente un tercio demuestran invasión local y metástasis a distancia al momento del diagnóstico y han sido recientemente clasificados como neoplasias potencialmente malignas11,12.
PatologíaLos AML clásicos (AMLC) se caracterizan por ser masas bien circunscritas y encapsuladas con proporciones variables de los 3 componentes (grasa, músculo liso y vasos sanguíneos). Los vasos sanguíneos son numerosos y no tienen membrana elástica interna, y el patrón de músculo liso es desorganizado. La cantidad de grasa puede ser variable, existiendo un subtipo de AML con bajo contenido graso, definido como contenido graso menor al 25% por campo de poder, que puede presentar características similares al carcinoma de células renales (CCR)11,13. Las calcificaciones son poco frecuentes. En el análisis inmunohistoquímico demuestran expresión de marcadores de melanocitos como el HMB-45, melan-A y marcadores de músculo liso como actina, desmina y calponina1,14.
Los AMLE tienen poco contenido graso, no tienen vasos sanguíneos y demuestran contenido de células ovales y poligonales (células epitelioides) con pleomorfismo nuclear; el grado de atipia es variable y no todos los casos que la presentan son malignos. El análisis inmunohistoquímico es similar al del subtipo clásico15,16.
Presentación clínicaLa mayoría de los AML renales son asintomáticos y su diagnóstico es incidental. Lesiones con diámetro mayor de 4cm tienen mayor riesgo de ser sintomáticas y de presentar complicaciones. La triada clásica descrita, que se puede presentar hasta en un 40% de los casos, consiste en dolor abdominal agudo, masa palpable y hematuria8.
Sin embargo, por lo general la presentación es variable, con síntomas desde dolor abdominal (40%), masa palpable (11%) y/o rotura con hemorragia retroperitoneal (síndrome de Wunderlich). En los casos más severos, hasta en un 20%, la hemorragia puede conllevar a shock hipovolémico3,8.
Diagnóstico por imágenesCualquier lesión renal con grasa macroscópica demostrada en ultrasonido (US), tomografía computarizada (TC) o resonancia magnética (RM) debe hacer sospechar el diagnóstico de AML. Aunque el diagnóstico radiológico usualmente es acertado y se cuenta con múltiples modalidades diagnósticas complementarias para la confirmación, en algunos casos se debe recurrir a la realización de biopsia para estudio histopatológico. Los AMLC tienen una presentación típica en cada una de las modalidades diagnósticas; sin embargo, en las variantes con bajo contenido graso1 y epitelioide, que tienen una presentación muy similar, los hallazgos pueden ser indistinguibles a los de CCR, por lo que la evaluación debe ser minuciosa17.
El tamaño y la formación de aneurismas se relaciona directamente con el riesgo de rotura de los AML, por lo que su identificación y descripción son de gran importancia. A medida que el tumor crece la vascularización es mayor y aumenta el riesgo de formación de aneurismas; aneurismas mayores a 5mm tienen mayor riesgo de rotura y otras complicaciones18.
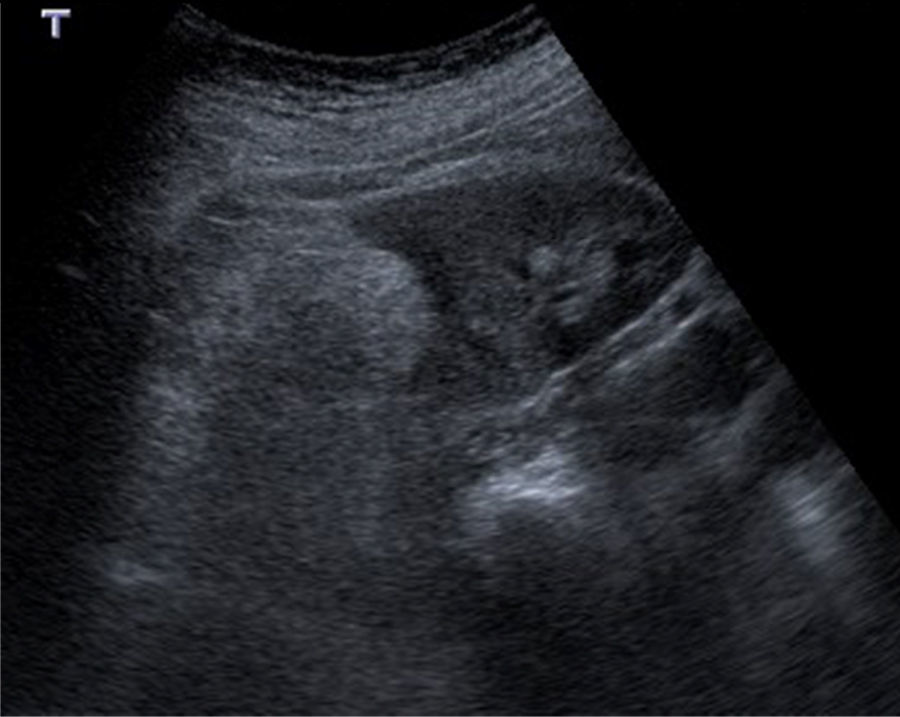
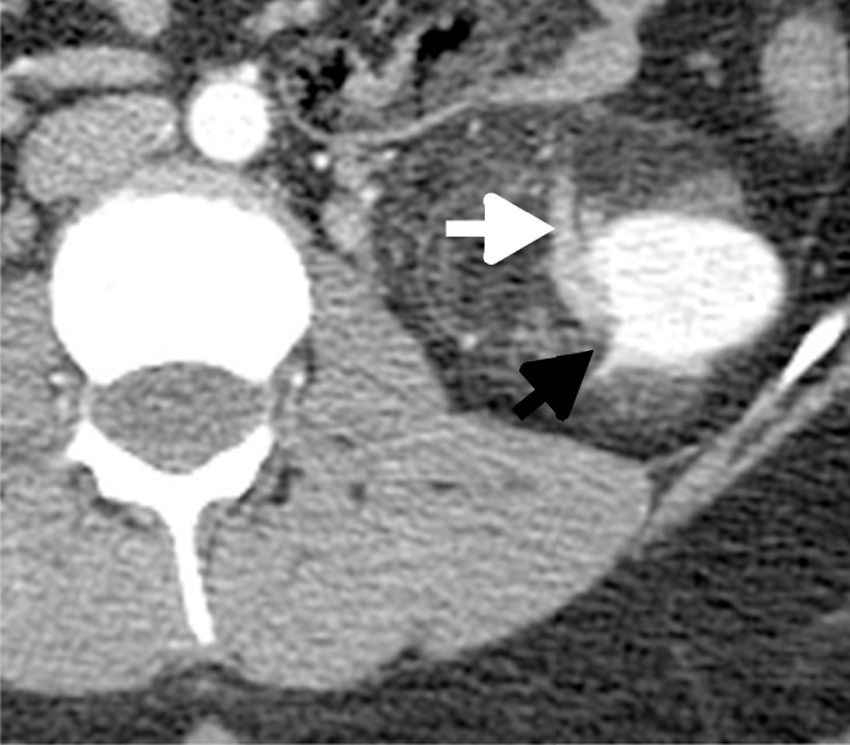
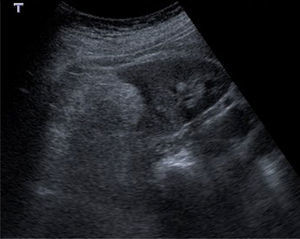
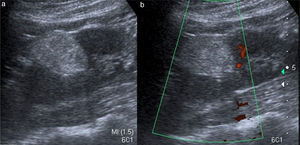
UltrasonidoLa apariencia típica de los AMLC en US es de masas focales ecogénicas con sombra acústica posterior. El contenido graso y vascular es responsable del aspecto ecogénico, mientras que la sombra acústica posterior se presenta por la interfase entre los múltiples tejidos que contiene (fig. 1). Las variedades con bajo contenido graso y epitelioide, que representan la minoría, suelen presentarse como masas isoecoicas con respecto al parénquima renal y representan un dilema diagnóstico por su similitud con el CCR, pudiéndose confundir hasta en un 12% de los casos12. Aunque su diferenciación mediante US es difícil y poco precisa, en algunos estudios se ha sugerido que la presencia de un anillo ecogénico periférico y/o la presencia de lesiones hipoecoicas intralesionales son hallazgos sugestivos de CCR12,19.
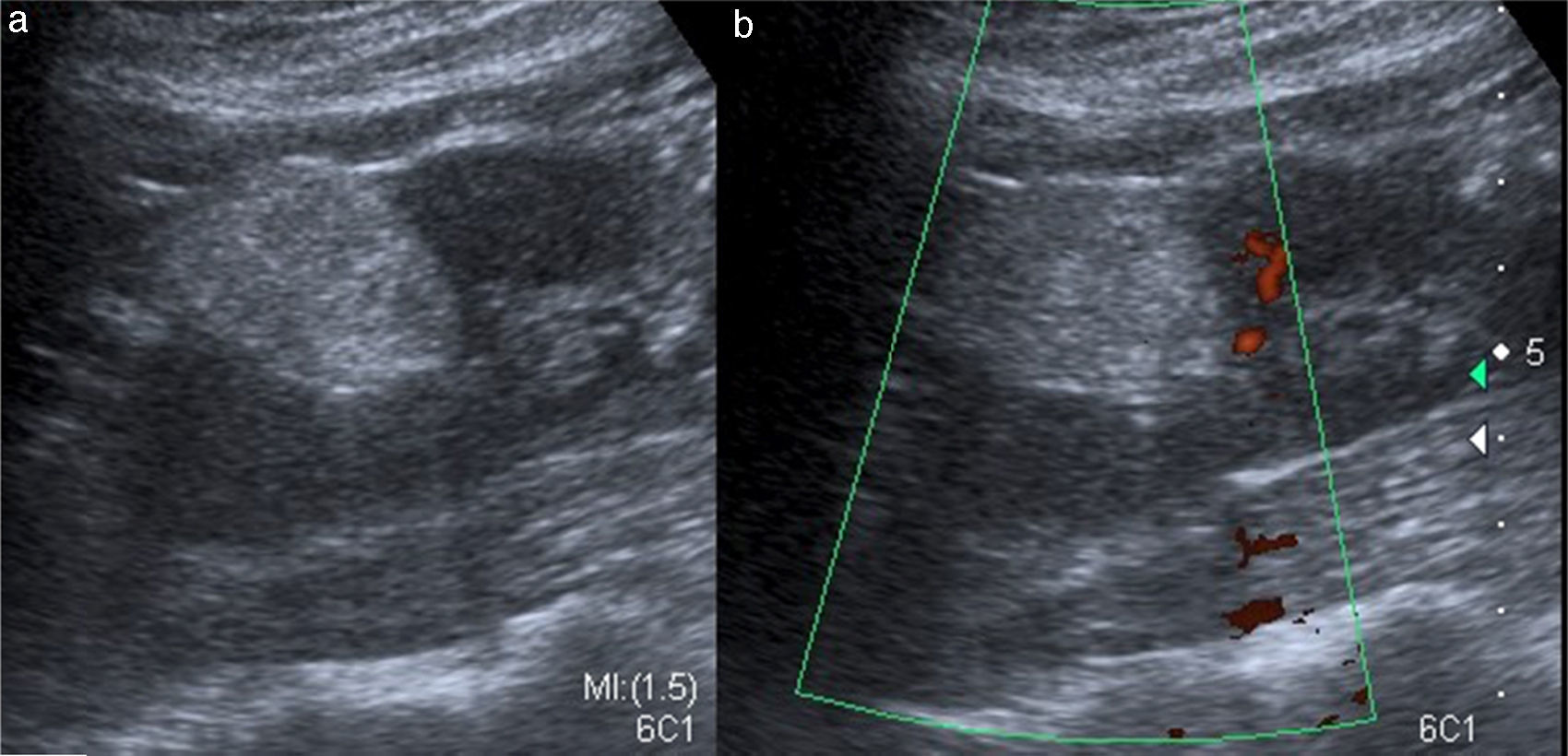
A la valoración con Doppler color y Doppler de poder puede haber ausencia de flujo intratumoral o presencia de flujo central persistente que no se extiende a la periferia, a diferencia de los CCR, en los que sí hay flujo periférico. Adicionalmente el Doppler ha sido considerado una herramienta útil para el diagnóstico de aneurismas intralesionales19 (fig. 2).
En el contexto de hemorragia aguda, el US se utiliza como modalidad preliminar y el diagnóstico puede ser sospechado si se identifica una masa ecogénica con una colección hipoecogénica adyacente.
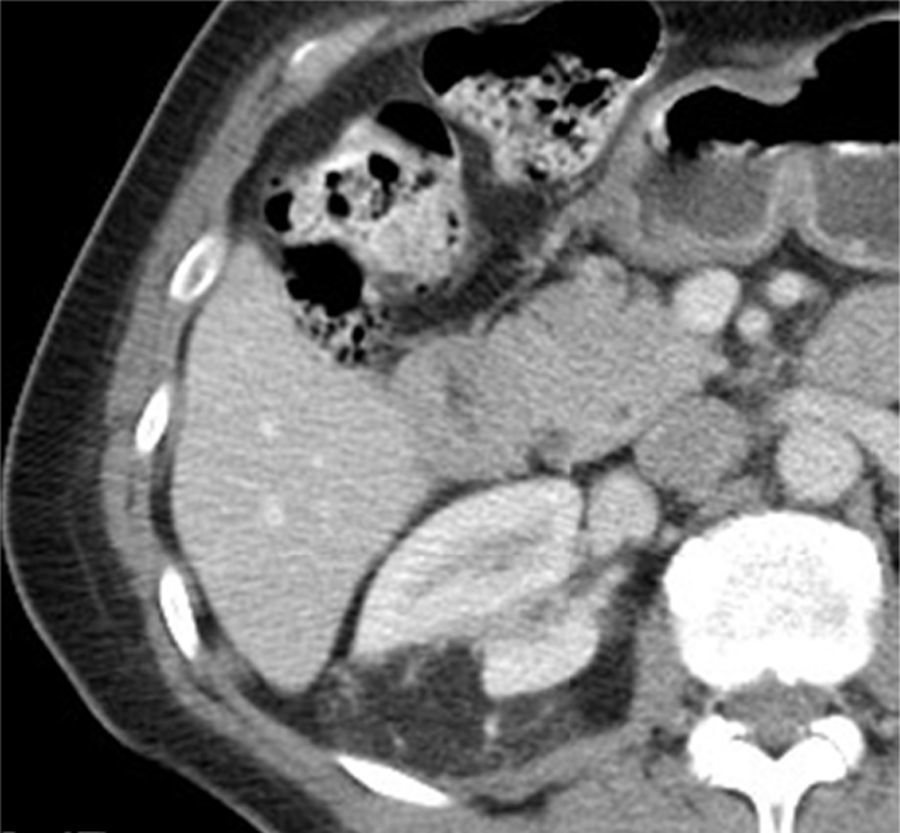
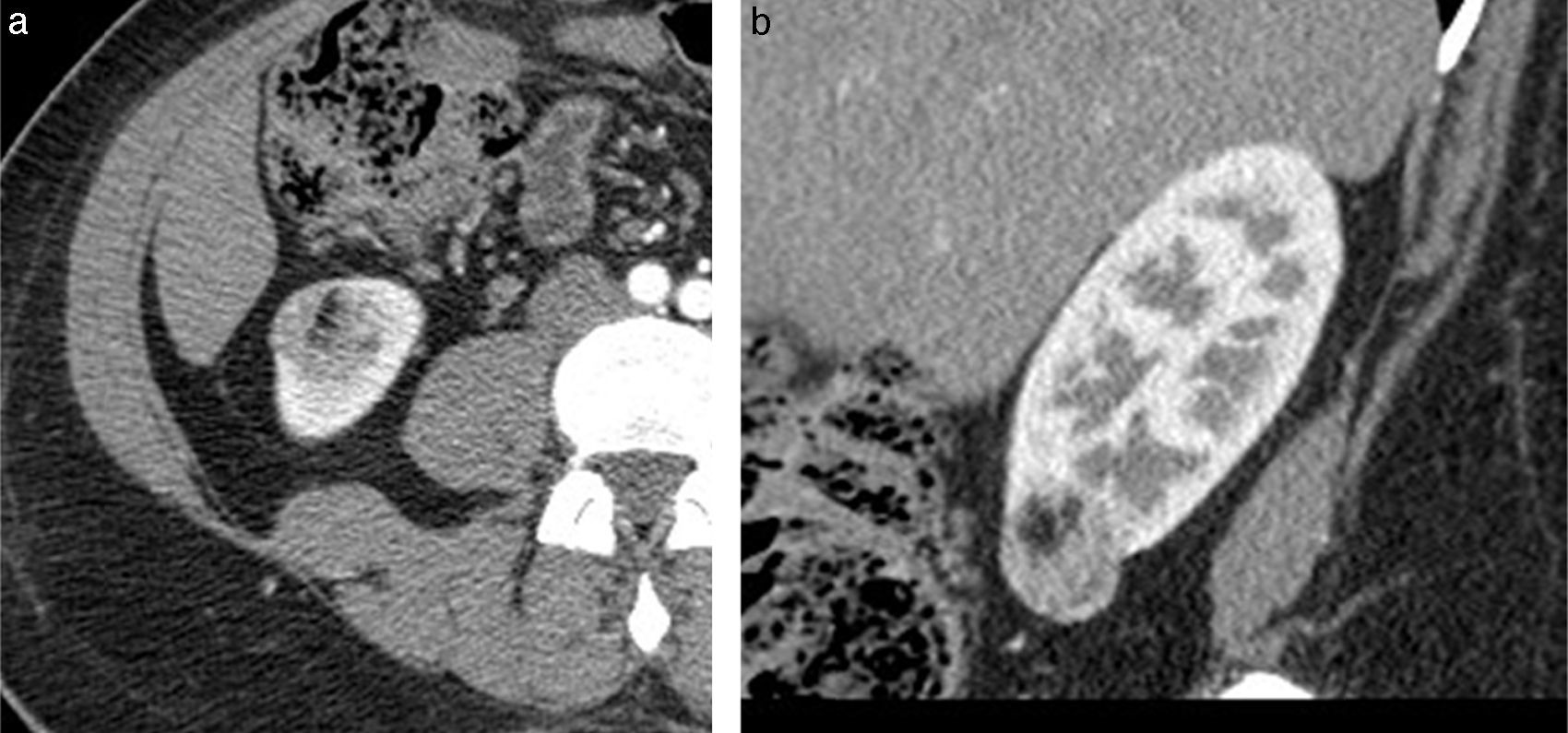
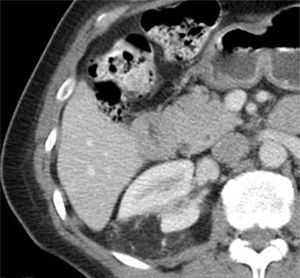
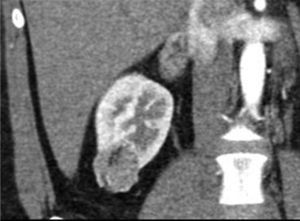
Tomografía computarizadaLa TC es la modalidad diagnóstica más ampliamente utilizada para el estudio de las masas renales. La apariencia de los AMLC en tomografía simple es la de una masa bien definida, con densidad homogénea o heterogénea predominantemente grasa, esto definido como una densidad entre −15 y −30UH; sin embargo, algunos estudios consideran como un valor diagnóstico cualquier densidad por debajo de −10UH, especialmente si se determina con análisis de píxeles en una zona de interés determinada (ROI)20,21 (figs. 3 y 4). En la gran mayoría de casos, la demostración de zonas con atenuación grasa confirma el diagnóstico y no se requieren estudios adicionales. Técnicas como la tomografía con análisis de píxeles —que permite la cuantificación de la heterogeneidad de una masa en una región de interés (ROI) con base en la distribución de píxeles y escala de grises— y los histogramas podrían emplearse para confirmar el contenido graso de la lesión22,23.
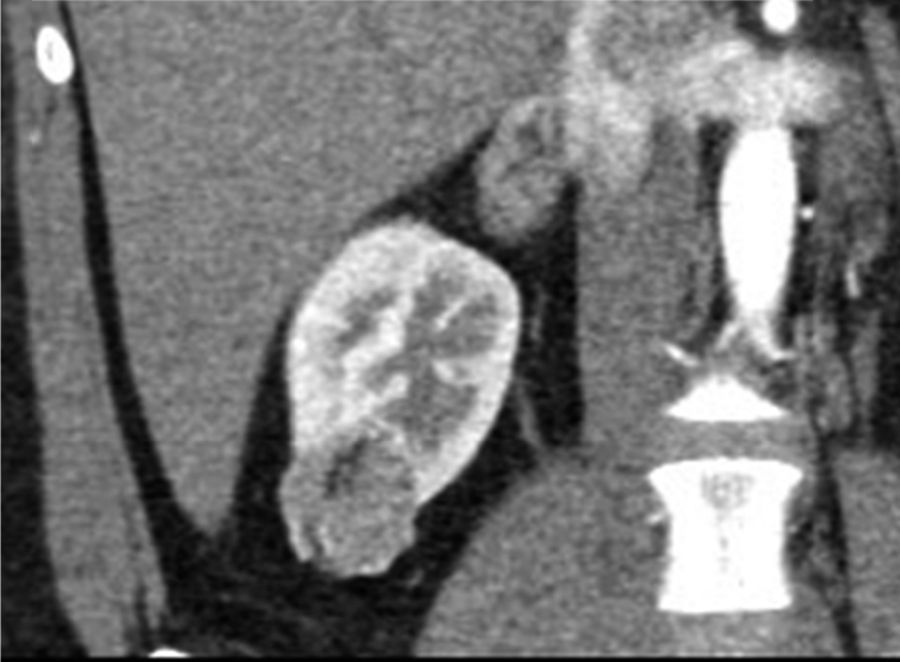
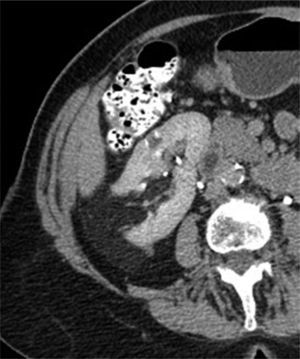
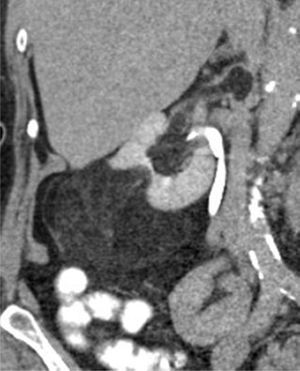
Los AML con bajo contenido graso, que representan aproximadamente el 5% de los AMLC24, suelen ser masas bien circunscritas de tamaños variables, isodensas con respecto al parénquima renal (30-40UH) y sin áreas claramente demostrables de densidad grasa, por lo que se pueden confundir con CCR (fig. 5).
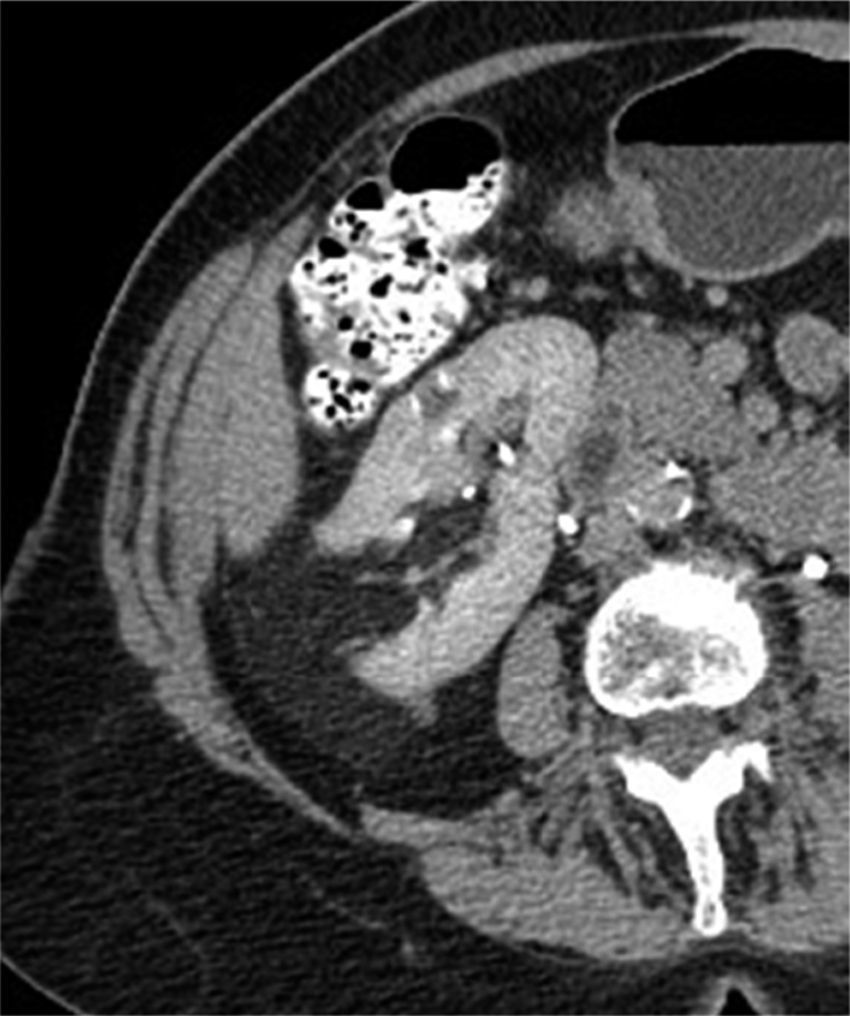
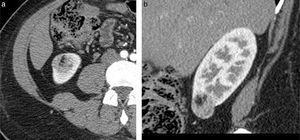
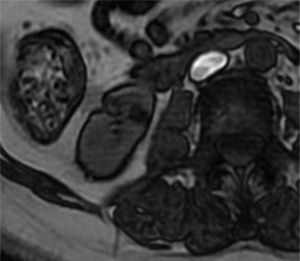
Los AMLE por lo general son hiperdensos con respecto al parénquima renal (40-90UH), tienen mayor tamaño, áreas de necrosis central y componente infiltrativo por su naturaleza agresiva; sin embargo, sus características en imágenes son muy variables y no existe un patrón definido, pudiendo encontrar lesiones sólidas homogéneas o heterogéneas y lesiones quísticas complejas25-28 (fig. 6).
En los casos de AML con bajo contenido graso y epitelioides es difícil la diferenciación con CCR, en los cuales la presencia de grasa es muy poco frecuente y se asocia principalmente a respuesta local por necrosis. En la mayoría de los casos se requiere biopsia para confirmar el diagnóstico; sin embargo, la TC con contraste bifásico (fases corticomedular y excretora) puede ser de gran ayuda. En algunos estudios se ha descrito que los AML con bajo contenido graso son de mayor atenuación que los CCR en las imágenes simples y presentan realce homogéneo en la fase corticomedular que persiste en la fase excretora, siendo el signo más característico de estos, a diferencia de los CCR, en los que el realce suele ser periférico y no persistente, con un VPP de 91% y un VPN del 87%29. Otros estudios han descrito que la presencia de vasos intratumorales, que se puede demostrar por altos valores de atenuación en las imágenes simples y realce durante la fase excretora temprana, sugieren el diagnóstico de CCR30.
En un contexto agudo de hemorragia renal espontánea, la tomografía es la modalidad de mayor utilidad. El principal hallazgo es una colección adyacente a una masa renal con características de AML, que no realza con el medio de contraste. La hemorragia puede extenderse al espacio perirrenal haciendo el tumor indistinguible, e incluso puede llegar al seno renal, simulando una masa en esta localización. La evaluación debe ser cuidadosa para identificar aneurismas intralesionales como causa del sangrado, que son más fáciles de visualizar utilizando técnicas de angiografía por tomografía12.
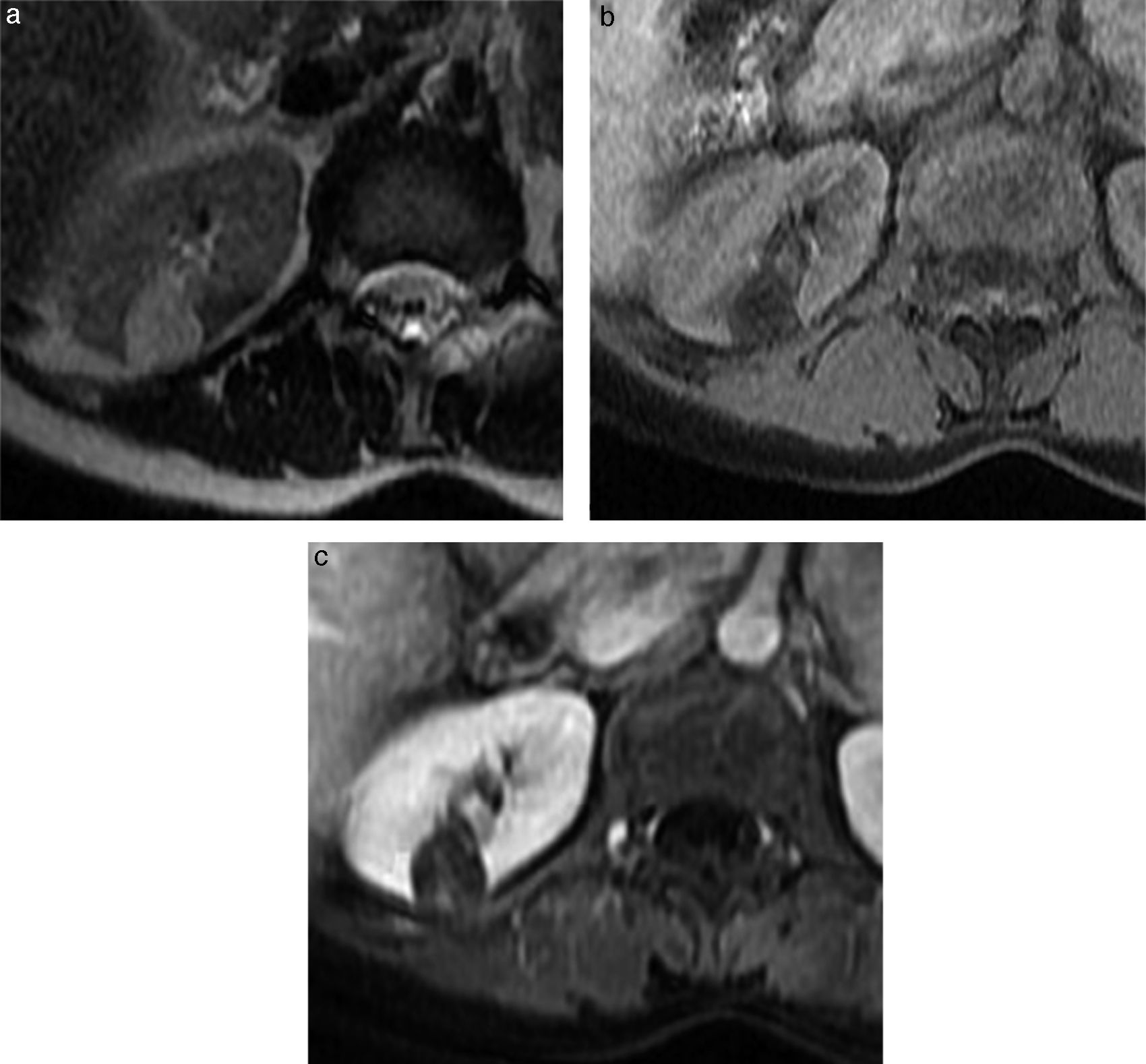
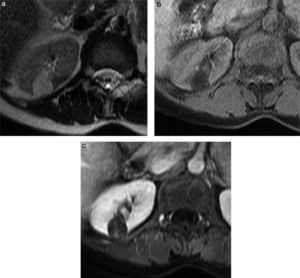
Resonancia magnéticaComo se ha mencionado, el diagnóstico de AML es altamente probable cuando se detecta grasa dentro de la lesión en cualquiera de las modalidades diagnósticas. En RM las lesiones con contenido graso presentan alta intensidad de señal en secuencias eco de espín con información T1 y T2 y son hipointensas en secuencias con saturación grasa, similar a la grasa subcutánea31-34 (fig. 7).
Cortes axiales de RM. a) Imagen con información T2 en la que se identifica una lesión focal renal con intensidad de señal predominantemente hiperintensa. b) Imagen con información T1 con saturación grasa; la misma lesión pierde señal, lo que confirma el contenido graso. c) Imagen con información T1 con saturación grasa luego de contraste endovenoso en fase nefrográfica, demostrando contenido graso y leve realce interno.
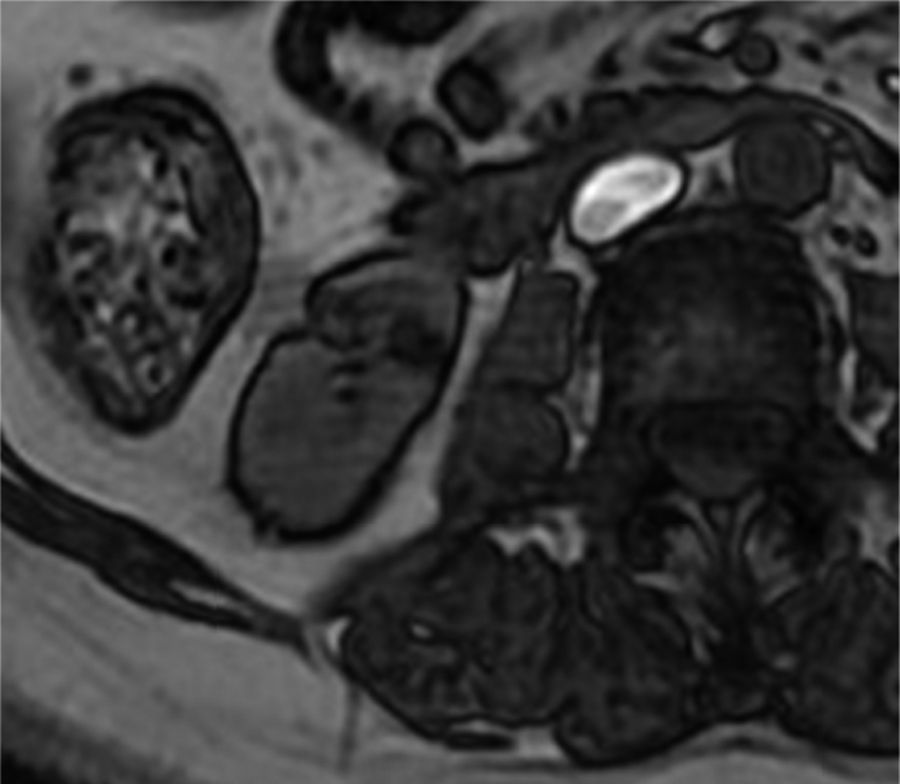
Cuando el AML es rico en grasa intracitoplasmática se presenta una caída de la intensidad de señal en las secuencias eco de gradiente en fase opuesta con respecto a las imágenes en secuencias en fase (fig. 8).
Sin embargo, en el 5 al 15% de los casos no se logra detectar grasa porque la lesión tiene bajo contenido graso y predomina el contenido de células de músculo liso, o por hemorragia intratumoral, que no permite detectar la intensidad de señal de la grasa. En estos casos es importante descartar CCR o AMLE4,29.
Aunque la confirmación de la presencia de grasa es altamente sugestiva, detectar pérdida de la intensidad de señal en secuencias con saturación grasa y en fase opuesta no establece el diagnóstico definitivo de AML, ya que algunos CCR también pueden contener grasa.
La baja intensidad de señal en secuencias con información T2 en relación con el parénquima renal y el pequeño tamaño de la lesión focal renal sugieren el diagnóstico de AML con bajo contenido graso, con una precisión del 98%35,36.
Las imágenes de difusión en resonancia magnética pueden ser una herramienta adicional para diferenciar AML con bajo contenido graso de CCR. Esta diferenciación es importante, ya que el AML con bajo contenido graso requiere observación, mientras que el CCR requiere resección quirúrgica33. Los AML con bajo contenido graso tienen señal homogénea en difusión y los CCR tienen señal heterogénea.
En cualquiera de las secuencias empleadas, la presencia de necrosis intratumoral y el gran tamaño de la lesión aumentan la posibilidad de que se trate de CCR subtipo células claras36.
El AML exofítico en algunos casos tiene una apariencia por imagen similar al liposarcoma retroperitoneal bien diferenciado. Es importante diferenciar estas 2 entidades, ya que el liposarcoma requiere resección quirúrgica, mientras que el AML requiere seguimiento por imágenes y, eventualmente, embolización o cirugía.
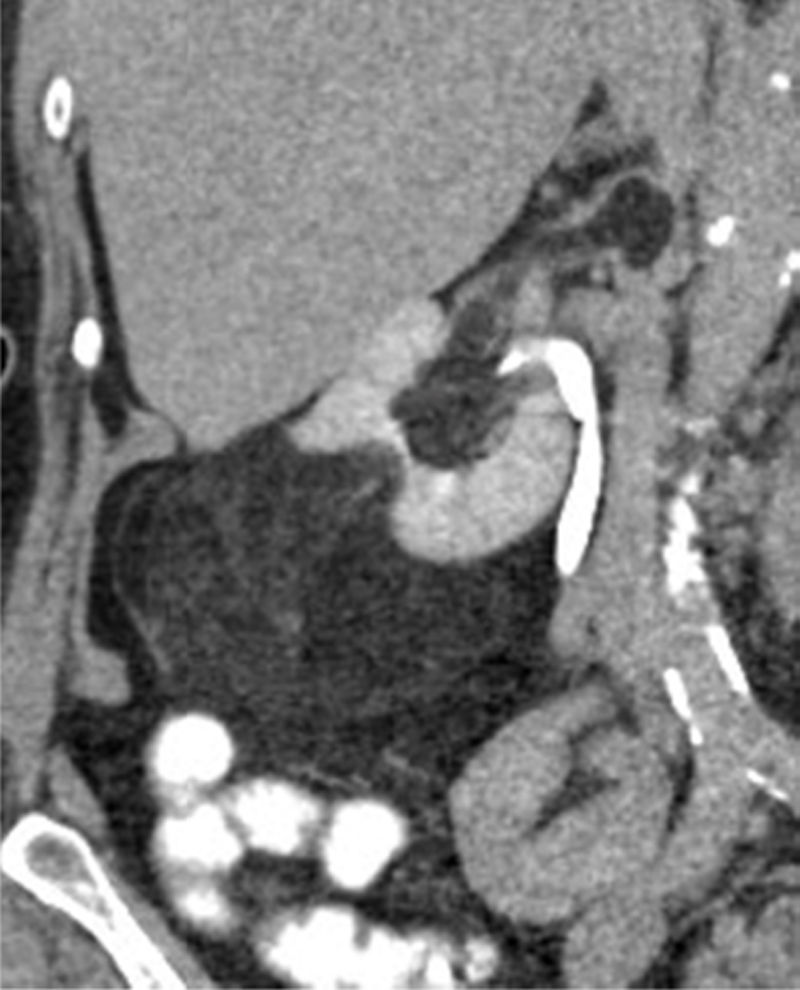
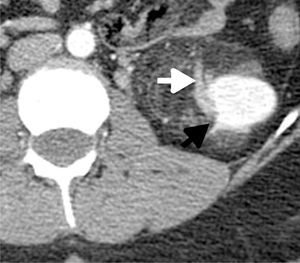
Se ha encontrado que la detección de un origen renal de la lesión, demostrado por defecto del parénquima renal, apoya el diagnóstico de AML, ya que el liposarcoma retroperitoneal bien diferenciado no invade el parénquima renal y su cápsula permanece integra. Otro hallazgo por imagen que indica la presencia de AML es la presencia de vasos dilatados dentro del tumor, mientras que el liposarcoma retroperitoneal es avascular o tiene vasos intratumorales no dilatados37 (fig. 9).
La presencia de otras lesiones grasas en el riñón contralateral o ipsolateral es un fuerte indicador de que el tumor es un AML.
Manejo intervencionistaEl tratamiento de los AML resulta controversial, dado que algunos autores consideran que las lesiones asintomáticas, independientemente de su tamaño, no requieren tratamiento, mientras que otros consideran que toda lesión mayor de 4cm requiere tratamiento10. Entre mayor sea el tamaño de la lesión, mayor es el riesgo de formación de aneurismas y, por consiguiente, de rotura. Aneurismas mayores a 5mm predisponen a rotura, y esto prácticamente obliga a realizar un tratamiento intervencionista, ya que el sangrado puede poner en riesgo la vida del paciente18. Las opciones de tratamiento son la embolización selectiva y la nefrectomía total o parcial (tumorectomía)38.
Embolización selectivaLa embolización arterial transcatéter es una opción terapéutica cada vez más utilizada cuyo objetivo es ocluir permanentemente el componente angiogénico del tumor y permitir la preservación de la mayor cantidad posible de parénquima renal funcional39. Los espirales, el gelfoam y el alcohol absoluto o mezclas de alcohol absoluto y polivinil alchohol (PVA) son otros agentes embolizantes que también han dado buenos resultados, ya que consiguen la oclusión definitiva de los vasos de la lesión con reducción del componente angiogénico.
La embolización supraselectiva de los AML es un método seguro y efectivo para controlar el sangrado agudo, disminuye el tamaño de la lesión y, en consecuencia, el riesgo de hemorragía, preservando la función renal40,41.
Se recomienda la embolización profiláctica en AML mayores de 4cm y AML con aneurismas mayores a 5mm, ya que tienen mayor riesgo de sangrado, con una sensibilidad del 100 y del 100%, respectivamente, y una especificidad del 38 y del 86%, respectivamente42. Otras indicaciones son AML múltiples, lesiones asociadas a CET, lesiones en pacientes con insuficiencia renal preexistente (para preservar la función renal) y lesiones en pacientes con alto riesgo quirúrgico10,39.
La embolización transcatéter es mínimamente invasiva, no necesita anestesia general, preserva la función renal con mayor eficacia, es más económica, se puede realizar varias veces y requiere menor tiempo de recuperación y hospitalización. Como se mencionó anteriormente, este procedimiento disminuye el tamaño de la lesión, previene el sangrado y preserva la función renal.
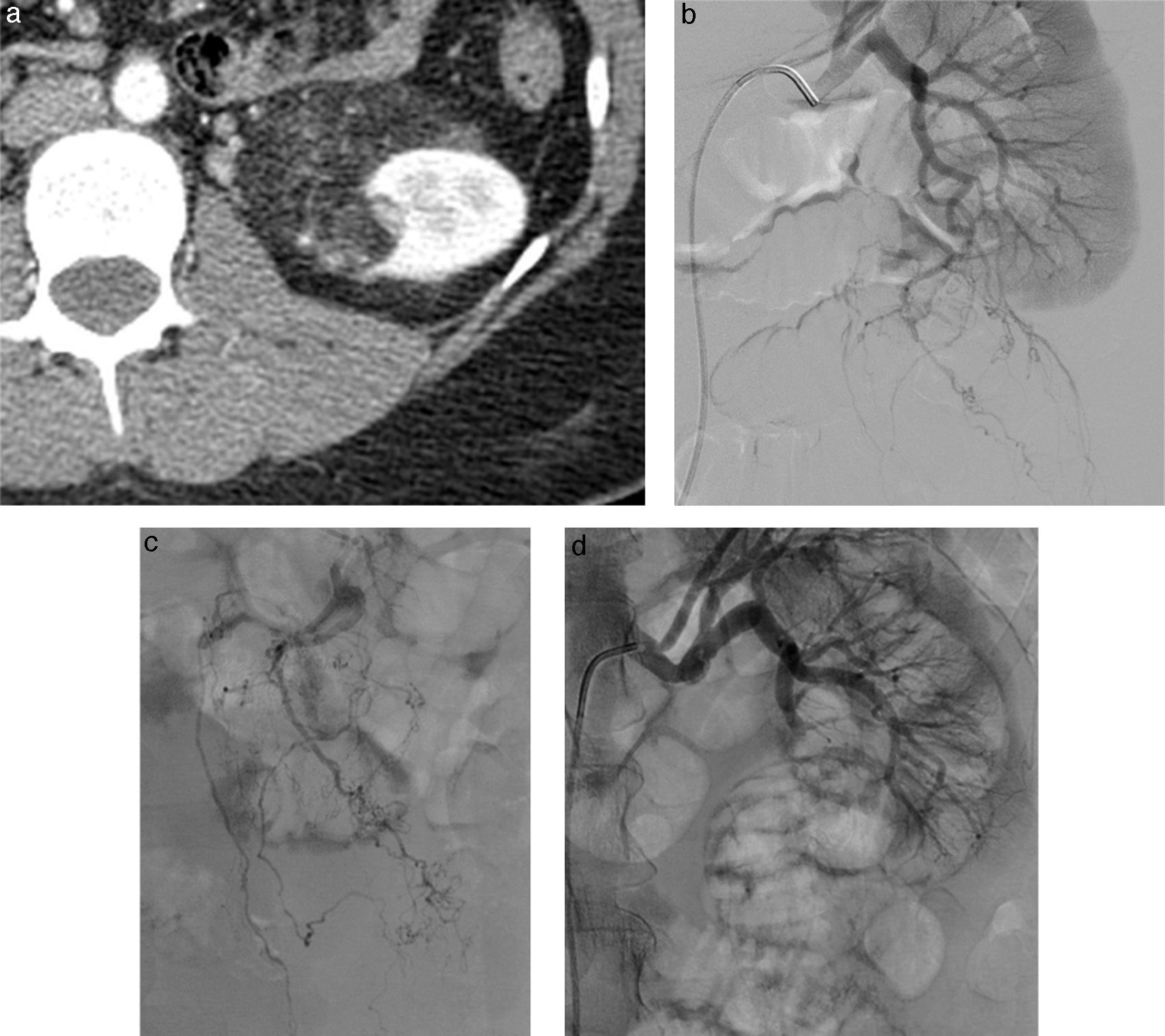
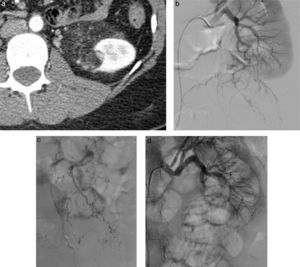
El tratamiento intervencionista consiste en embolización transarterial selectiva con partículas de polivinil alcohol (PVA) de 250 a 350μ o coils, lo cual produce infarto y necrosis del tumor, con resultados muy buenos a largo plazo (fig. 10).
(a) Corte axial de TC con medio de contraste, en la que se demuestra masa con contenido graso en el polo inferior del riñón izquierdo, que correspondía a AML. (b) Imagen de angiografía por sustracción digital selectiva de la arteria renal izquierda; se detectan las ramas que irrigan la lesión (c), en el momento de la embolización con micropartículas de PVA (d), adecuada embolización supraselectiva de la lesión.
La arteriografía es un procedimiento utilizado como método diagnóstico y terapéutico para las complicaciones de estos tumores, ya que se pueden encontrar vasos tortuosos y aneurismas o seudoaneurismas de las arterias intrarrenales. Si la oclusión es incompleta existe alto riesgo de recurrencia de sangrado. Los AML gigantes tienen mayor riesgo de recurrencia. No siempre se logra la ablación completa de los AML tratados mediante embolización transarterial, pero el riesgo de sangrado disminuye al excluir los vasos que irrigan el tumor, aunque el tamaño de la lesión en sí no disminuya de manera significativa32.
La embolización selectiva, conocida desde hace más de 20años, es cada vez más utilizada como manejo definitivo, logrando reducción significativa en el tamaño del AML, con mínimas complicaciones que llegan al 10%, siendo el absceso renal la más frecuente. Se ha descrito resangrado luego de una primera intervención hasta en el 20% de los pacientes8. Se han mostrado resultados favorables cuando se lleva a cabo previo a la realización de nefrectomía total, al disminuir el riesgo de sangrado intraoperatorio y, de forma secundaria, las posibles complicaciones intra y postoperatorias.
La relativa ausencia de episodios de sangrado, el mantenimiento de los valores séricos normales de creatinina, junto con la desaparición del componente vascular en los seguimientos, se encuentran entre las herramientas más confiables para evaluar la eficacia del método39.
NefrectomíaEn un paciente con rotura del AML que se presenta con shock hipovolémico, la opción quirúrgica es la nefrectomía radical, generalmente debido a la imposibilidad de diferenciar parénquima renal normal de la lesión hemorrágica. La nefrectomía parcial o total debe reservarse para aquellos casos en los que la embolización no consigue detener el sangrado38.
ComplicacionesLas principales complicaciones de los AML renales incluyen falla renal y hemorragia en grados variables. Aproximadamente el 25% se manifiestan con rotura espontánea y sangrado importante, lo que es más frecuente en tumores mayores de 4cm y en los que tienen aneurismas intralesionales mayores de 5mm. Adicionalmente pueden infiltrar la vena renal o la vena cava inferior, lo cual no necesariamente implica su transformación maligna1,5 (fig. 11).
ConclusionesLos AML representan el 1-3% de todos los tumores renales. Aunque estas neoplasias mesenquimales son por lo general benignas, existe una variante histológica, el AMLE, que se debe reconocer por su potencial de malignización.
El incremento en el uso de diferentes modalidades de imágenes ha aumentado el diagnóstico de estas lesiones, y es de gran importancia reconocer sus características típicas y atípicas, teniendo en cuenta siempre entre los diagnósticos diferenciales el CCR y el liposarcoma retroperitoneal.
Aunque su tratamiento resulta controversial, se recomienda que toda lesión mayor de 4cm sea tratada; el manejo intervencionista con embolización selectiva o nefrectomía (parcial o total) representa una excelente opción para estos pacientes.
Conflicto de interesesLos autores declaran que no existen conflictos de intereses para la publicación de este artículo.
Es importante recordar que la expresión «mínimo contenido graso» ha sido utilizada por los radiólogos en términos meramente descriptivos para hacer referencia a AML con poca grasa macroscópica identificable, como se hace en el presente artículo. No se trata de un diagnóstico definitivo, ya que este solo se hace mediante histología40.