Las hipospadias resultan de un arresto en el desarrollo normal de la uretra, creando un meato ectópico proximal en la cara ventral del pene. Estudios moleculares y un mejor conocimiento de la embriogénesis del tubérculo genital demuestran una compleja interacción de genes, hormonas y el ambiente con el desarrollo de hipospadias. Es posible que esta entidad sea la expresión fenotípica común de varias enfermedades diferentes. Recientemente se describió un nuevo gen candidato en el desarrollo de hipospadias llamado MAMLD1, involucrado en la producción normal de testosterona durante la embriogénesis.
Hypospadias is the result of an abnormal development of the urethra causing an ectopic and more proximal placement of the meatus in the ventral side of the penis. Recent molecular studies, and a better understanding of the normal development of the genital tubercle, have demonstrated a complex interaction between genes, hormones and the environment with the development of hypospadias. It is possible that hypospadias is the phenotypic expression of different diseases. Recently a new candidate gene for hypospadias has been discovered, called MAMLD1, which is involved in the normal production of testosterone during foetal development.
Las hipospadias son una enfermedad caracterizada por la presencia del orificio uretral en una región ectópica a lo largo de la cara ventral del pene. En su mayoría son casos esporádicos y aislados. Se ha descrito recientemente que la incidencia viene en aumento. La causa específica se desconoce, pero se propone un efecto ambiental al respecto. En Colombia hemos descrito en nuestro grupo que la incidencia de hipospadias aisladas se encuentra entre 1,4 y 1,7 por cada 1.000 nacidos vivos1,2.
Recientemente grandes esfuerzos se han dedicado al estudio molecular de la embriología del tubérculo genital (TG) y los diferentes genes implicados en su desarrollo. El 64% de los casos de hipospadias proximales no tienen un diagnóstico molecular. Es claro el papel que ejerce la testosterona en este proceso, pero mutaciones en genes como el receptor de andrógenos (RA) y el gen que codifica para la 5-a-reductasa han sido descritos en una minoría de los casos de hipospadias. Por esto es posible que haya más de un gen asociado en el desarrollo de hipospadias. Recientemente se describió un nuevo gen candidato asociado con el desarrollo de hipospadias, llamado MAMLD1.
A continuación realizamos una revisión sistemática de la literatura sobre este nuevo gen descrito y su efecto en los procesos fisiológicos y fisiopatológicos del desarrollo del TG.
EmbriologíaEl desarrollo de los genitales externos es un proceso complejo en el que participa una cascada de eventos moleculares que interactúan entre sí, incluyendo procesos de expresión genética, actividad enzimática, diferenciación celular y vías de señalización hormonal3,4. Se ha identificado que el desarrollo genital se divide en 2 fases: una temprana, independiente del estímulo hormonal, y otra posterior, dependiente del influjo hormonal5. En la fase inicial de la hormono-independiente, que ocurre entre la semana 5 a la semana 8 de gestación, el crecimiento del TG depende de las familias de genes Shh, HOX, FGF, BMP. y Wnt/beta catenina. En la fase tardía hormono-dependiente, que va de la semana 8 a la 20, los andrógenos resultan muy importantes y participan acá los genes RA, 5aR tipo 2. 17aHSDH tipo 3, FKBP52, MAMLD1, ATF3, Dhh, HOX.
Los primeros estudios y descripciones de la embriología uretral fueron descritos por Glenister en 1954, donde se mencionó por primera vez el concepto de placa uretral6,7.
Es importante tener presente que la mayoría de procesos ocurren de forma simultánea y con interacción entre cada proceso. Por ejemplo, durante la semana 5 de gestación se inicia la formación de la membrana cloacal y los pasos iniciales en la formación gonadal8.
El primer paso fundamental es la determinación del sexo del feto, el cual ocurre en el momento de la fecundación. Cuando se determina el sexo genéticamente, el siguiente paso es la expresión del gen SRY, el cual va a estimular la diferenciación de las células primitivas en células de Sertoli ubicadas en los cordones sexuales primitivos. En caso que no haya la expresión normal del SRY, entonces estas células van a continuar su proceso y se van a convertir en las células foliculares del ovario. Cuando ya las células de Sertoli inician su actividad y expresión genética, la producción de sustancia inhibitoria mülleriana va a ser fundamental en el desarrollo de los caracteres masculinos, haciendo que los conductos paramesonéfricos (de Müller) involucionen. Esto ocurre alrededor de la semana 7 a 10. Los remanentes de esta involución van a ser los apéndices testiculares y el utrículo prostático.
Entre la semana 9 a 10 aparecen las células de Leydig. No están claros su origen y el estímulo molecular que genera su diferenciación. Sin embargo, una vez maduras, las células de Leydig inician la producción de testosterona alrededor de la semana 8 a 12, proceso vital para continuar con el proceso de masculinización de los genitales. Normalmente el estímulo androgénico en el desarrollo de los genitales externos ocurre en fases tardías de la embriogénesis9.
Inicialmente, en la porción más caudal del feto se forma la membrana cloacal, compuesta solo por ectodermo y endodermo, que va desde el ombligo hasta lo que en un futuro será el periné. En estos primeros pasos se ve una migración del mesodermo hacia la membrana cloacal. Estas células mesodérmicas van a dar origen a los músculos del periné, la sínfisis del pubis y la pared anterior de la vejiga. Cuando se completa la migración del mesodermo se inicia la formación de los genitales, lo cual ocurre para el final de la semana 4.
Los pliegues cloacales se forman durante la quinta semana de gestación; estos son iguales en ambos sexos y se forman a los lados de la membrana cloacal. Al final de la semana 5 se fusionan en la región anterior y medial para formar el TG ubicado por delante del seno urogenital. Este proceso se completa para el final de la semana 6. Este TG se compone de una placa lateral de mesodermo y una superficie de ectodermo con una placa uretral de endodermo. Al igual que en procesos de formación de extremidades, la orientación y el crecimiento de proximal a distal es muy importante en el desarrollo del futuro pene. La porción más distal es conocida como epitelio uretral distal (EUD). A este nivel se dará la expresión principalmente de genes Shh, FGF y BMP.
Fase independiente de hormonasEn la fase inicial independiente de estímulo hormonal, la orientación del crecimiento está dada principalmente por la expresión del gen Fgf8, que se expresa en el EUD que va a determinar como un centro regulador el crecimiento longitudinal del futuro pene10. Sin embargo, no es completamente claro el mecanismo específico de acción del Fgf8, ya que la inactivación del mismo no inhibe completamente el desarrollo del TG. Otros genes similares involucrados en esta fase del desarrollo descritos son Fgf10 y su receptor Fgfr211. Dentro de las muchas funciones descritas, el Fgf8 estimula la expresión de otros genes, como Bmp4, Bmp7 Wnt7 y Msx112,13. La expresión de esta cascada de genes es muy importante en las interacciones mesenquimoepiteliales. En esta fase inicial del desarrollo del TG, independiente del estímulo androgénico, es muy importante la expresión del Sonic hedgehog (Shh), descrito como uno de los genes iniciales en el desarrollo y crecimiento del TG, al igual que el gen Gli2. En estudios de ratones knockout para Shh se ha descrito la agenesia peneana. Lo mismo ha sido descrito ante la no expresión del Wnt5a14,15. Resultados similares han sido descritos en ratones knockout para Gli2; aunque en estos sí hubo la formación de un falo, sin embargo no hubo la formación de una estructura uretral en estos animales16. El Shh ha demostrado su participación en la determinación y orientación del desarrollo genital. Se ha descrito que el Shh estimula la expresión de otros genes, como Fgf8, Bmp7, Ptch1, Fgf10, Bmp2, Bmp4, Hoxa13, Wnt5a y Msx1.
Al suprimir la expresión de Shh se ha visto una reducción en el desarrollo genital con detención celular en G1 e inclusive una persistencia cloacal17. La expresión de Shh se ha sugerido en 2 fases principales: una inicial del desarrollo del TG y el cierre cloacal, y una segunda fase más tardía durante el cierre de la uretra17,18. En fases posteriores, cuando ya se ha visto un desarrollo distal del TG, las expresiones de Hoxa-13 y de Bmp7 van a ser importantes para la formación de los futuros cuerpos cavernosos19. El Bmp7, descrito en múltiples órganos —extremidades, ojos, riñón—, también tiene su participación en el desarrollo del TG y aparentemente su expresión permite el desarrollo y la adecuada interacción del epitelio con el mesénquima20. Esta interacción está en parte regulada por la expresión de la familia de genes FGF y BMP. Por primera vez durante el proceso de formación del TG aparece la expresión de los genes HOX (Hoxa13 y Hoxd13) que van a estar presentes en las fases de interacción mesenquimoepiteliales regulando la expresión de otros genes, como Bmp7 y Fgf8. Otro gen regulador del Fgf8 es el Wnt5a, cuya función adicional durante el proceso de interacción mesenquimoepitelial es la de mantener la homeóstasis y el adecuado funcionamiento de la uretra21. Aunque poco frecuente, los casos descritos con mutaciones a este nivel desarrollan hipospadias proximales severas. Los genes HOX también van a resultar importantes en la fase hormono-dependiente. En ratones knockout para genes HOX, la formación resulta anormal, con la presencia de una cloaca persistente en los animales experimentales19. A nivel de las vasculogénesis del TG, se ha visto que también regula la expresión de los genes EphA6 y EphA722.
De forma simultánea con el proceso anterior, durante la quinta semana se forman, a partir del seno urogenital, los pliegues urogenitales que se fusionarán en la porción medial generando el surco urogenital. Los bordes de este surco se llamarán pliegues uretrales, y van a estar formados al final de la sexta semana. Luego se forman a cada lado de los pliegues y del TG los pliegues labioescrotales. Durante este segundo mes de gestación es muy importante la influencia hormonal de la testosterona producida en las células de Leydig fetales que se inicia con la diferenciación testicular en la semana 8.
A medida que el TG va elongándose, en su porción ventral se forma el surco uretral que de la misma forma va creciendo hacia distal. En la porción distal se encuentra el EUD, posteriormente llamado placa uretral, que más adelante se canalizará y se extenderá hasta la punta del glande para dar origen a la uretra distal. Se ha visto una mayor expresión de Shh en esta placa. En la porción más proximal del surco uretral se inicia la formación de unos pliegues que van a fusionarse ventralmente en un punto específico llamado en inglés «midline sean»23. La fusión en la región ventral y medial continúa de proximal a distal tubularizando la uretra. Todo este proceso se inicia en la semana 11 y finaliza alrededor de las semanas 15 a 16. Previamente se creía que la fosa navicular se formaba por una invaginación de distal a proximal del ectodermo hasta la laguna magna o fosa de Guerin. Actualmente se ha identificado que el urotelio endodérmico tiene la capacidad de diferenciarse en tejido escamoso y, por lo tanto, toda la uretra se origina del seno endodérmico.
El prepucio se forma por un cierre ventral de los pliegues uretrales ectodérmicos que cubrirán el endodermo (uretra). Genes como el Fgf1 y su receptor Fgfr2IIIb han sido descritos en la fase del desarrollo del prepucio. Recientemente se identificó, en ratas expuestas a flutamida con hipospadias proximales, una baja expresión en la epidermis prepucial del gen que codifica para la proteína inducida por la prolactina (PIP)24. Una falla en el cierre de los pliegues uretrales va a dar origen a las hipospadias. La placa uretral que no se desarrolló adecuadamente ha demostrado tener islotes de tejido esponjoso muy bien vascularizados y sin tejido cicatricial. El desarrollo neurovascular es normal, incluyendo las fibras productores de óxido nítrico.
Fase hormono-dependienteLa masculinización de los genitales se inicia alrededor de la semana 10-14 de gestación por el estímulo hormonal de los andrógenos. Sin embargo, fases anteriores pueden verse influenciadas por los andrógenos antes de notar la masculinización de los genitales25. Inicialmente el estímulo hormonal va a ser por parte de la placenta. In utero, la gonadotropina coriónica humana (hCG), a partir de la semana 9 de gestación con un pico entre la 11 y 18 semanas, va a ser el principal estimulador hormonal de la masculinización del TG. Posteriormente, una vez se han diferenciado y formado las células de Leydig, estas van a iniciar la producción de testosterona. Dicho proceso se inicia alrededor de la 9.a semana. Posteriormente va a ser transformada en DHT, su forma más potente gracias a la 5-α-reductasa. La DHT va a ser más importante que la testosterona en el desarrollo de los genitales externos. El lugar donde se expresan los primeros receptores androgénicos es en el mesénquima ventral prostático derivado del seno urogenital. Posteriormente se verá un aumento en la actividad y expresión de los receptores en los demás órganos genitales26. Se ha visto que los andrógenos tienen influencia en la expresión de genes como Cyp1b1, Fkbp51, Fgf10, su receptor Fgfr2 y MafB, que participan en el desarrollo del TG27.
Dentro de los primeros signos de virilización genital está un aumento en la distancia entre el ano y los genitales masculinos. Posteriormente le sigue la elongación del falo con la formación de la uretra peneana y prepucio. Este último se inicia a partir de la décima semana. Para las semanas 15 a 16, el proceso de la formación de los genitales externos está completo en la mayoría de los fetos.
Gen MAMLD1Inicialmente fue conocido como chromosome X open reading frame 6 (CXorf6) o F1828. El MAMLD1 es un gen inicialmente descrito por Laporte en 1997 en pacientes con genitales ambiguos durante el estudio de la miotrofia miotubular ligada alX29. Recientemente Fukami et al. han venido trabajando en la asociación con hipospadias, ya que se documentó que los casos con microdeleciones del MTM1 y que se extienden hacia el locus del MAMLD1 no solo presentan las alteraciones musculares sino también alteraciones en el desarrollo de los genitales, específicamente hipospadias28,30. Sus siglas corresponden, en inglés, a mastermind like domain containing protein 1.
Otras alteraciones diferentes a las hipospadias que se han descrito con su mutación son la presencia de micropene, escroto bífido, hipoplasia escrotal y criptorquidia. La información obtenida hasta el momento no asocia la mutación del gen con la severidad de las hipospadias, pues se ha descrito en diferentes grados de severidad de hipospadias. Otros tejidos diferentes al parénquima testicular donde se ha identificado la expresión del MAMLD1 son el músculo esquelético, el cerebro, la placenta y el corazón, en donde no se le conoce una función específica29. La baja expresión a nivel placentario podría explicar la asociación entre bajo peso al nacer e hipospadias, ya que una disfunción placentaria podría estar presente.
Se ubica en el brazo largo del cromosomaX en la banda28 (Xq28). Se compone de 100kb con un total de 7 exones, de los cuales 2 son no codificantes. Presenta una zona de lectura abierta (open reading frame) en 3-6. Codifica para 2 proteínas de 701 y 660 aminoácidos gracias al splicing con y sin el exón4. La variante que es positiva para el splicing del exón4 se expresa más que la que es negativa31. Gracias a los estudios de Tsai et al. se identificó que el exón3 codifica el 80% de la información para la producción de la proteína32,33. Hasta el momento la mayoría de mutaciones están presentes en el exón3. Una característica importante es la de codificar para un dominio rico en prolinas, lo cual lo hace característico de una proteína de unión al ADN. Estructuralmente la proteína codificada por el MAMLD1 es muy parecida a la MAML2, con una secuencia de aminoácidos rica en prolina, glutamina y serina llamada dominio mastermind-like. La MAML2 se caracteriza por ejercer una función importante en la diferenciación celular en muchos tejidos mediante la inducción o inhibición de diferentes genes gracias a la formación intracelular de un complejo proteico. Esto mismo no ocurre completamente con el MAMLD1, ya que no requiere del completo para ejercer su función activadora directa sobre el ADN. Se ha visto entonces que la función del MAMLD1 es la de transactivar el promotor hairy/enhancer of split (HES3) mediante la interacción adicional del STAT3 y aumentar la expresión del gen CYP17A1, con lo cual se logra tener una producción adecuada de testosterona en las células de Leydig durante la embriogénesis32. Estudios in vitro han demostrado que la disminución de la expresión del gen a un 25 a 30% genera niveles de testosterona que se reducen a un 50 a 60% de lo normal pero nunca llegan a ser indetectables34. La prueba de estimulación con hCG no se ve alterada ante la deleción del MAMLD1.
Es llamativo que los pacientes con mutaciones ene gen tienen niveles normales de testosterona al momento de ser evaluados, y quizá la justificación para esta asociación sea el momento crucial de la expresión de este gen durante la organogénesis. Estudios en animales demostraron su expresión en las células de Leydig y de Sertoli durante los periodos principales en los que ocurre la organogénesis genital (E12,5 a E14), y luego de este tiempo la expresión disminuye significativamente a niveles subfisiológicos. Durante la embriogénesis también se ha visto que se coexpresa con el factor esteroidogénico (SF1) previamente descrito en el desarrollo gonadal35. Este SF1 tiene un sitio de unión upstream en el intrón2 en la región codificante que ejerce así la activación del MAMLD136.
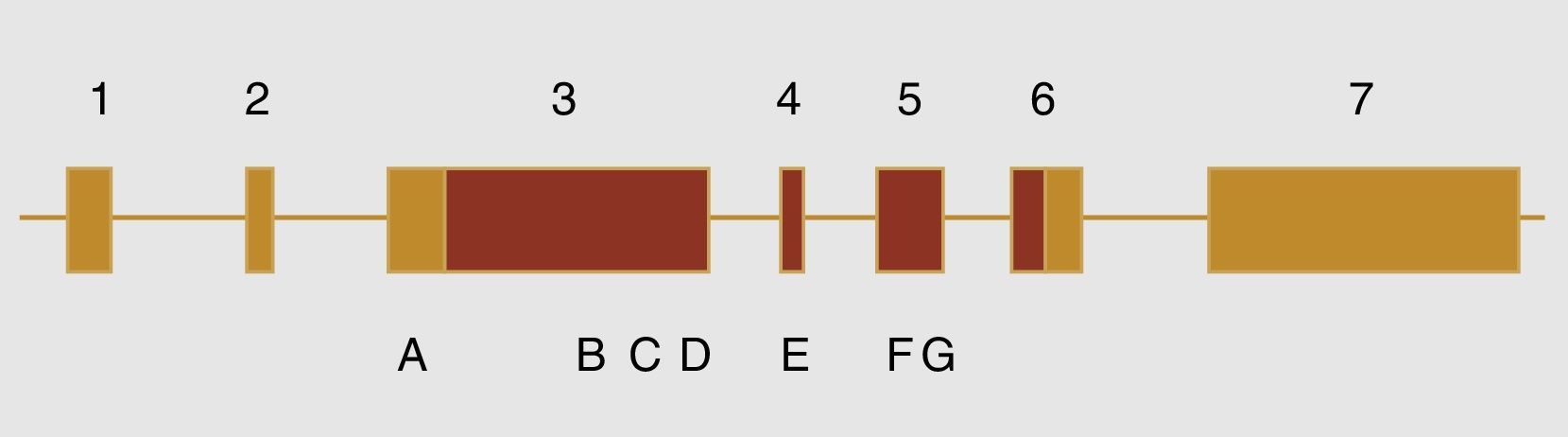
Dentro de las variantes descritas asociadas con el desarrollo de hipospadias en este gen están las siguientes (fig. 1): 370G-T (E124X), p.589C-T (Q197X), 1957C-T (R653X), 1295T>C (V432A), 325deG, p.Q529K, p.D686D, c.2065+8ª>t y la p.531ins3Q (CAG10>CAG13)36,37, la inserción de 9 nucleótidos, lo cual genera la presencia de 3 glutaminas adicionales. Previamente un tipo similar de inserciones fue descrito en el receptor de andrógenos; sin embargo, no está claro que este fenómeno se asocie directamente con el desarrollo de hipospadias36. Esto es raro en las malformaciones del tracto genitourinario, aunque se ha visto en diferentes grados de hipospadias que una mutación en el exón3 con un codón de parada a su inicio se asocia con hipospadias proximales.
Esquema del gen MAMLD1. Los números corresponden a los diferentes exones que componen el gen. En color amarillo las zonas no codificantes y en terracota las regiones codificantes. Las letras corresponden a: A c.865C>T (p.P286S), B c.1295T>C (p.V432A), C c.1585C>A (p.Q529K), D c.1591ins(CAG)3 (p.531ins3Q), E c.1766A>G (p.N589S), F c.2058C>T (p.D686D) y E c.2065+8ª>t.
Una variante recientemente descrita en un caso de hipospadias, sin lograrla describir en otros miembros de la familia con el mismo fenotipo, es la p.P286S. Adicionalmente la variante p.P589S, recientemente descrita también en un caso de hipospadias, fue identificada en una baja proporción en pacientes sanos28,36. Por lo tanto, este haplotipo, descrito como S-S, tiene una alta asociación con hipospadias, sin poder ser conclusiva su relación estadísticamente.
DiscusiónRecientemente la gran cantidad de información molecular ha permitido conocer con mayor detalle la fisiopatología de las hipospadias. Aún se desconocen los mecanismos exactos, pero resulta clara la interacción entre el genotipo y el medio ambiente en el desarrollo de esta entidad.
Teniendo presente las 2 fases en el desarrollo del TG y los múltiples genes involucrados en este proceso, resulta posible proponer que las hipospadias son la expresión fenotípica de diferentes enfermedades.
Aunque aún faltan más detalles por conocer, se podría explicar la cascada de eventos moleculares con la acción de diferentes genes en orden cronológico y correlacionar esto con la severidad de las hipospadias, de tal forma que alteraciones en fases más tempranas se correlacionen con casos más severos. Hasta el momento se puede considerar por la embriogénesis que los diferentes genes implicados en la fase hormono-independiente pertenecen a un grupo diferente al de los genes hormono-dependientes, y por ende podrían dividirse en 2 grupos, dando origen a varias enfermedades diferentes.
El gen MAMLD1 es un ejemplo de la correlación fenotipo-genotipo de la expresión en un tiempo específico durante la embriogénesis y la importancia de la cantidad de expresión expresada en cantidad de producción de testosterona como mecanismo del desarrollo anormal de la uretra. Quizá esta dependencia cuantitativa de expresión explique la razón por la cual individuos con la mutación presenten diferentes grados de hipospadias.
La utilidad de estudios a futuro nos permitirá conocer con más detalle este grupo de enfermedades expresadas como hipospadias.
Nivel de evidenciaNivel de evidencia III.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.