El sarcoma pleomórfico indiferenciado (SPI) de alto grado en la mama es una entidad extremadamente rara en la población pediátrica, representando menos del 1% de los tumores malignos mamarios y un desafío respecto a su diagnóstico y tratamiento, por la falta de guías específicas. Se describe el caso de una paciente de 12 años, sin antecedentes de importancia, quien consultó a un hospital de cuarto nivel por una masa mamaria de crecimiento rápido, dolorosa y con cambios cutáneos. Los estudios imagenológicos mostraron una masa compleja BIRADS 4C, sin metástasis aparente. El caso fue evaluado por una junta multidisciplinaria, que indicó manejo quirúrgico primario. El reporte de patología posoperatorio reportó un SPI. Se indicó adyuvancia con radioterapia de intensidad modulada (IMRT) y quimioterapia con ifosfamida y doxorrubicina, según el protocolo para sarcomas no rabdomiosarcomas pediátricos. La paciente mostró una evolución posoperatoria favorable, con cicatrización completa de los injertos y sin signos de recaída hasta la fecha. Este caso resalta la importancia de un manejo quirúrgico agresivo y la personalización del tratamiento adyuvante en sarcomas mamarios pediátricos, destacando la necesidad de estudios adicionales que permitan establecer guías de manejo específicas y optimizar los resultados en esta población.
High-grade undifferentiated pleomorphic sarcoma (UPS) of the breast is an extremely rare entity in children, representing less than 1% of malignant breast tumors. It poses a challenge in diagnosis and treatment due to the lack of specific guidelines. We describe the case of a 12-year-old patient with no significant medical history who presented to a tertiary care hospital with a rapidly growing, painful breast mass with cutaneous changes. Imaging studies showed a complex BIRADS 4C mass with no sign of metastasis. The case was submitted to a multidisciplinary board, which indicated primary surgical management. The postoperative pathology report indicated UPS. Adjuvant intensity-modulated radiation therapy (IMRT) and chemotherapy with ifosfamide and doxorubicin were indicated according to the protocol for pediatric non-rhabdomyosarcoma. The patient showed a favorable postoperative outcome, with complete graft healing and no signs of relapse to date. This case highlights the importance of aggressive surgical management and personalized adjuvant treatment in pediatric breast sarcomas, emphasizing the need for additional studies to establish specific management guidelines and optimize outcomes in this population.
Las masas mamarias en niños y adolescentes son infrecuentes, con una incidencia del 3,2%, de los cuales solo un 0,02% son malignas, y de estas, la mitad son sarcomas1. Los sarcomas son un grupo heterogéneo de tumores malignos no epiteliales formados de tejido mesenquimal, que se subdividen en osteosarcomas y sarcomas de tejidos blandos (STB)2. Dentro de los STB hay varios subtipos histológicos, como el angiosarcoma, fibrosarcoma, sarcoma de células claras y el sarcoma pleomórfico indiferenciado (SPI), que representa el 15% de los tumores de este grupo2,3.
El SPI era conocido como histiocitoma fibroso maligno; sin embargo, la Organización Mundial de la Salud estableció que este término hacía referencia a un patrón morfológico más que a una entidad clinicopatológica4.
Se presenta el caso de una niña de 12 años con un SPI de alto grado, diagnosticado tras una mastectomía radical (MR). Este caso resalta la importancia de un manejo quirúrgico agresivo y la personalización del tratamiento adyuvante en sarcomas mamarios (SM) pediátricos, destacando la necesidad de estudios adicionales que permitan establecer guías de manejo específicas y optimizar los resultados en esta población. La rareza de este tipo de tumor impide realizar estudios prospectivos por lo que reportar estos casos contribuye al entendimiento de la enfermedad.
Caso clínicoUna paciente de 12 años consultó a un hospital de cuarto nivel por un cuadro de 10 meses de evolución, consistente en una masa mamaria derecha asociada a mastalgia y crecimiento progresivo. Negó antecedentes de cáncer de mama o radiación en el tórax. En el examen físico, se encontró una masa de 15 x 15 cm que reemplazaba la glándula mamaria, asociada a cambio de coloración en la piel. No se palparon adenopatías axilares (fig. 1).
En la ecografía de mama, se mostró una masa mamaria derecha, heterogénea, con diámetro 128 x 84 x 147 mm y adenopatías axilares. La tomografía axial computarizada (TAC) de tórax reportó contacto entre la masa y el músculo pectoral mayor, sin plano de clivaje definido y adenopatías axilares bilaterales, con engrosamiento cortical mayor en la región axilar derecha. No se evidenció metástasis en la TAC de abdomen ni en la gammagrafía ósea. El estudio histológico de la biopsia tru-cut reportó un tumor maligno de alto grado, con proliferación fusocelular y mixoide, y extensa necrosis, sin diferenciación glandular escamosa. Adicionalmente, se realizó una biopsia tru-cut de ganglio derecho axilar, la cual fue negativa.
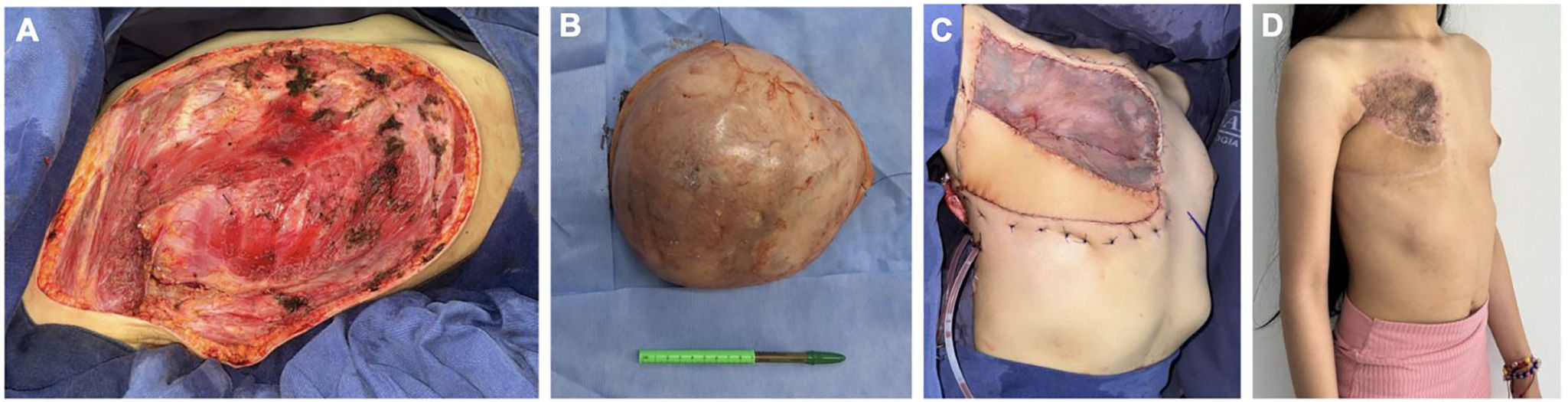
Se presentó en la junta multidisciplinaria, y se consideró el tratamiento primario quirúrgico, dada la dificultad para establecer el diagnóstico histopatológico. Se realizó MR derecha con márgenes oncológicos de 1 cm (fig. 2A), más la reconstrucción por el servicio de cirugía plástica con colgajo musculocutáneo de dorsal ancho e injertos de piel parcial (fig. 2C). Se optó por vaciamiento ganglionar, por la documentación intraquirúrgica de compromiso macroscópico ganglionar.
En el reporte posoperatorio de patología se describió una lesión de 20 cm, con compromiso hasta la dermis, extensa necrosis, bordes libres de tumor y ganglios axilares 0/18 positivos para malignidad. Asimismo, consideraron que a pesar de un FISH negativo para ss-18 y 20, marcadores de inmunohistoquímica que mostraron reactividad difusa para TLE-1, FLY-1 y Bcl-2; reactividad parcial para CK, AE1/AE3, P63, c-Myc, Cyclin-D1, MyoD1 y ERG1; el WT1 difuso pero citoplasmático, CD34 y GATA3 dudoso focal y negatividad para EMA, desmina, CD99, SATB2, miogenina, calretinina, CD117, MUC4 y PAX8; sin pérdida de INI-1; se trató de un SPI de alto grado, estadio IIIB.
Recibió manejo adyuvante con radioterapia IMRT con dosis de 55,8 Gy en 31 fracciones de 1,8 Gy. Hematooncología pediátrica indicó terapia adyuvante con ifosfamida y doxorrubicina, según protocolo para sarcomas no rabdomiosarcoma (rama C del protocolo COG ARST 0332)5.
Actualmente, completó tratamiento sistémico sin recaída local y control imagenológico sin metástasis (fig. 2D).
DiscusiónLos SM son tumores malignos infrecuentes que representan menos del 1% de todos los tipos de cáncer de mama6. Usualmente, aparecen entre la quinta y sexta décadas de la vida y comprometen con mayor frecuencia a las extremidades2,6. Respecto a su distribución general, representan el 1,5% de las neoplasias en adultos y el 7,4% en niños, aunque el número absoluto es menor en comparación con la población adulta7. Los sarcomas son un grupo heterogéneo de tumores de origen mesenquimal extraesqueléticos que se clasifican según el tejido al que se asemejan histológicamente7. El SPI se caracteriza por tener mal pronóstico, tiene una sobrevida a 5 años del 60%, una recurrencia local del 44%, y el 42% hacen metástasis a distancia2.
Dada la agresividad de estos tumores, se debe realizar un diagnóstico oportuno orientado por su presentación clínica. Los SPI se han descrito como una masa grande, de aspecto fungoide, hemorrágica que crece en meses hasta comprometer la mama, generando hinchazón, piel adelgazada, violácea y eritematosa, que puede necrosar el pezón y puede asociarse a fiebre de origen desconocido o fiebre neoplásica8. El estudio de elección es la resonancia magnética, pero no suele ser la primera herramienta diagnóstica. En la ecografía asemejan lesiones ovaladas con realce acústico posterior 4,9. No hay ningún patrón clínico o imagenológico patognomónico para identificar este tumor 4.
El diagnóstico del SPI es todo un reto, ya que, al ser un tumor que no pertenece a ninguna línea de diferenciación específica, es una entidad de exclusión. Histológicamente, se pueden encontrar variaciones del tamaño nuclear, necrosis perilesional, hipercromasia y variedad celular dada por células fusiformes similares a fibroblastos, células gigantes multinucleadas y células espumosas2,4. Adicionalmente, las pruebas de inmunohistoquímica sirven para descartar tumores no mesenquimales malignos y para diferenciar los sarcomas primarios del seno4. Con este objetivo, se evalúan marcadores como la desmina, vimentina, antígeno del músculo liso, CK, el antígeno común de los leucocitos, CD34, HMB-45, SMA, EMA y la proteína S-1004. El carcinoma metaplásico (sarcomatoide) expresa positividad de CK. El tumor Phyllodes maligno es un tumor bifásico, con sobrecrecimiento estromal respecto al componente epitelial, pleomorfismo celular con elementos sarcomatosos, y se puede diferenciar del SPI mediante un muestreo para identificar los componentes epiteliales4. Los miofibrosarcomas son tumores malignos de miofibroblastos, la mayoría son inmunorreactivos para la AME y la expresión de CK, EMA, CD34, desmina o proteína S-100 se observa esporádicamente4.
Un estudio de Ferrari et al. analizó una cohorte de 48.012 pacientes con STB para evaluar su comportamiento en diferentes grupos etarios, concluyó que no hay diferencias epidemiológicas significativas por las que los pacientes con STB deban ser tratados de manera diferente según su edad7.
La resección quirúrgica, por cuadrantectomía o mastectomía, es la primera opción de tratamiento2. Un estudio retrospectivo realizado por Toesca et al., que incluyó a 37 pacientes con SM primario y secundario, analizó factores pronósticos, desenlaces y opciones de reconstrucción. Los resultados mostraron que aquellos que recibieron una cirugía conservadora de mama o a una mastectomía más reconstrucción, no mostraron peor pronóstico respecto a las pacientes que recibieron una mastectomía10. De igual manera, no hubo asociación entre la reconstrucción y la presentación de complicaciones, por lo que se recomienda realizarla inmediatamente cuando sea posible10.
Los tratamientos adyuvantes no se indican de rutina, sino en casos seleccionados6. El protocolo COG ARST 0332 para sarcomas no rabdomiosarcoma pediátricos dictamina que tumores de bajo grado con resección R1 o R0; o tumores de alto grado, menores de 5 cm con resección R0 se benefician de manejo quirúrgico sin adyuvancia. La combinación de cirugía más radioterapia adyuvante para disminuir el riesgo de recaída local está indicada en tumores de alto grado, de cualquier tamaño con resecciones R1 o tumores mayores de 5 cm. Para tumores de alto grado y tumores mayores de 5 cm, se puede considerar quimioterapia adyuvante con ifosfamida y doxorrubicina. En pacientes con enfermedad localmente avanzada o irresecable al momento del diagnóstico, se recomienda quimioterapia neoadyuvante, seguido de cirugía y radioterapia11,12.
ConclusiónSe implementó un enfoque quirúrgico agresivo con MR para asegurar una resección R0. Se logró una reconstrucción inmediata con colgajo musculocutáneo de dorsal ancho, con recuperación estética y funcional, sin comprometer los resultados oncológicos. Por las características del tumor y la edad de la paciente, se prefirió administrar manejo adyuvante, según el protocolo COG ARST 0332 para sarcomas no rabdomiosarcoma pediátricos, para mejorar el control local de la enfermedad y disminuir el riesgo de recaída local. No se administró manejo neoadyuvante porque para el diagnóstico definitivo se tuvo que realizar la cirugía primero.
Este caso subraya la importancia de adaptar los protocolos de adultos a pacientes pediátricos, mediante un equipo interdisciplinario. Es fundamental fortalecer la evidencia de estos tumores mediante la publicación continua de casos y el desarrollo de estudios prospectivos, que contribuyan a establecer guías de manejo para la población pediátrica.
Responsabilidades éticasLos autores declaran que se obtuvo aprobación del comité de ética del Hospital Universitario San Ignacio.
Consentimiento informadoLos autores declaran que se obtuvo el consentimiento informado de la paciente y su acudiente para la publicación de este trabajo.
FinanciaciónLos autores declaran que este trabajo no cuenta con patrocinio externo. Fue financiado con los fondos propios de los investigadores.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.