El objetivo es describir la validez diagnóstica y la seguridad de los métodos empleados en nuestro entorno para obviar el vaciamiento axilar en el tratamiento quirúrgico primario de mama en estadio inicial tras determinación de macrometástasis en el ganglio centinela.
MétodosEstudio observacional retrospectivo multicéntrico aprobado por el Comité de Ética. Determinación de sensibilidad, especificidad, valor predictivo positivo y negativo de los métodos: OSNA (punto de corte a 15.000 copias de ARN), score Tenon 5 (punto de corte en 5), perfil de alto riesgo (si no cumple T1G2RH+ HER–), criterios ACOSOG Z-11 y resultado de ganglio secundario.
Se incluyó a pacientes con cáncer de mama dirigidas a tratamiento quirúrgico primario; tamaño T1-T2 y axila clínica y radiológicamente negativa; con resultado de ganglio centinela positivo para macrometástasis.
ResultadosSe incluyó a 279 pacientes con macrometástasis en el ganglio centinela, de los cuales resultaron 69 (24,4%) linfadenectomías positivas. Los resultados de sensibilidad, especificidad, valor predictivo positivo y negativo fueron: OSNA (100%, 17%, 32%, 100%); Tenon 5 (91%, 34%, 31%, 92%); alto riesgo (82%, 32%, 28%, 85%), ACOSOG Z-11 (30%, 97%, 75%, 84%); ganglio secundario (86%, 76%, 55%, 94%).
ConclusionesEl método más seguro, score Tenon 5, solo evitaría un tercio de linfadenectomías negativas. Un perfil de riesgo no ofrecería suficiente seguridad. La propuesta del grupo ACOSOG Z-11 sería el método menos seguro. La cuantificación de la macrometástasis por método OSNA no conseguiría validez diagnóstica. El análisis del ganglio secundario, siendo el método menos aplicado, sería el más válido, con mejor sensibilidad y especificidad conjunta. En nuestra valoración, ninguno de los métodos estudiados resultaría suficientemente riguroso pues no obtendrían resultados óptimos para permitir obviar la linfadenectomía.
The aim of this study was to describe the diagnostic validity and safety of the most commonly used methods to avoid axillary lymph node dissection (ALND) in the primary surgical treatment of initial-stage breast cancer after determination of sentinel node macrometastases.
MethodsThis multicenter, retrospective observational study was approved by the ethics committee and assessed the sensitivity, specificity, positive and negative predictive value of the following methods: OSNA (cut-off point of 15,000 RNA copies), Tenon 5 score (cut-off point 5), HIGH risk profile (RH+ HER-), ACOSOG Z-11 criteria and second-tier sentinel node outcome.
We included patients with breast cancer undergoing primary surgical treatment, with T1-T2 tumours, clinically and radiologically negative axillae, and sentinel node macrometastases.
ResultsWe included 279 patients, of whom 69 (24.4%) had a positive ALND. The results of sensitivity, specificity, positive predictive value and negative predictive value were as follows: OSNA (100%, 17%, 32%, 100%); Tenon 5 (91%, 34%, 31%, 92%); HIGH (82%, 32%, 28%, 85%), ACOSOG Z-11 (30%, 97%, 75%, 84%); SECOND (86%, 76%, 59%, 94%).
ConclusionsThe most accurate method, the Tenon score, would only avoid one-third of negative lymphadenectomies. Relying on a risk profile would not provide enough safety. The proposal of the ACOSOG Z-11 group was the least safe method. Quantification of macrometastases by OSNA would not be a valid diagnostic method. Second-tier sentinel node analysis, the least applied method, seems the most accurate, with the best sensitivity and specificity.In our analysis, none of the methods would be sufficiently rigorous to safely allow avoidance of ALND.
En los últimos años, el enfoque general del tratamiento del cáncer de mama (CM) ha evolucionado gracias al mejor conocimiento de la biología del cáncer, los avances en las técnicas diagnósticas y la mayor eficacia de los tratamientos sistémicos y de la radioterapia1.
La biopsia de ganglio centinela (BGC) es en la actualidad el mejor método para estadificar la axila. Sin embargo, persiste la cuestión de si la linfadenectomía es necesaria en todas las pacientes con GC positivo, dado que hasta un 70% de los vaciamientos serán negativos. La posibilidad de un vaciamiento axilar (VAX) negativo parece depender de varios factores. Entre ellos, el tipo y el tamaño tumoral, el tamaño de la metástasis en el GC, la invasión extracapsular del ganglio y el número de GC positivos2-5. Sin embargo, ninguno de ellos permite predecir con total seguridad qué paciente podría obviar la cirugía axilar.
Además, desde el trabajo publicado en 2010 (ACOSOG Z0011) por Giuliano et al.6 se ha observado un cambio de paradigma al cuestionarse el impacto terapéutico del VAX en pacientes con CM en estadio inicial (T1-2N0). Sin embargo, no todos los equipos multidisciplinares han dejado de realizar el VAX siguiendo los mismos criterios de este estudio. Los diferentes centros de nuestro entorno han solucionado de manera variable esta cuestión, bien basándose en guías clínicas, o bien en la literatura o en la propia casuística7,8. Incluso, quizás por falta de seguridad ante las nuevas recomendaciones, algunos profesionales han decidido no cambiar el protocolo empleado en las últimas décadas (realizar VAX ante un GC con macrometástasis). En consecuencia, una misma paciente puede recibir diferentes opciones de tratamiento sobre la axila dependiendo de dónde sea asistida, incluso en centros de similares características y de la misma ciudad.
Con el fin de estudiar la validez y la seguridad de los diferentes métodos empleados, es decir, su «rigor», nos propusimos valorar la capacidad de predecir enfermedad ganglionar residual en el VAX de los diferentes algoritmos que se están empleando en la actualidad, recuperando los casos de GC positivo para macrometástasis con VAX de los últimos años. De este modo, se podría inferir cuántos VAX evitaríamos y cuántas axilas positivas quedarían sin tratar quirúrgicamente.
El objetivo principal del estudio fue determinar un método válido y seguro que permita obviar la linfadenectomía axilar en el tratamiento quirúrgico primario de CM en estadio inicial.
MétodosDiseñoEstudio observacional, retrospectivo y multicéntrico, coordinado desde el Hospital Germans Trias i Pujol (HUGTIP) y centralizado en el HUGTIP. El estudio contó con la aprobación del Comité de Ética de Investigación de este hospital. Este comité consideró no necesario el consentimiento individual de cada paciente al tratarse de un estudio observacional retrospectivo. La validación de los diferentes métodos de predicción se realizó mediante la determinación de sensibilidad (S), especificidad (E), valor predictivo positivo (VPP) y valor predictivo negativo (VPN).
ParticipantesSe incluyó a las pacientes intervenidas por CM durante los 3 años previos al cambio de paradigma en cada uno de los centros. Los criterios de inclusión fueron: tratamiento quirúrgico primario del CM, tumor T1-T2, axila clínica y radiológicamente negativa, GC positivo para macrometástasis y subsecuente VAX.
VariablesLas variables de estudio fueron: edad; tratamiento quirúrgico sobre la mama; tamaño radiológico (considerado por cada comité, sea ecográfico, mamográfico o por RM); tamaño patológico; tipo y grado histológico (bajo en los grados i y ii; alto en grado iii); estado de receptores hormonales (positivo si superior a 10%) y HER-2 (por inmunohistoquímica, positivo si 3+; por FISH/SISH, positivo si amplificado), índice de proliferación Ki-67 (positivo si superior a 20%); perfil biológico definido de la siguiente manera: luminal A (LA), receptor hormonal positivo, HER-2 negativo; luminal B (LB), receptor estrogénico positivo (REP), receptor progesterónico positivo (RPP)± 20%; HER2, receptores hormonales negativos y HER-2 positivo (HERP); triple negativo (TN), receptores negativos; número de GC biopsiados; número de GC positivos; invasión extracapsular en el GC; resultado OSNA (en casos estudiados por este método); detección y resultado de ganglio secundario (GS); número de ganglios no centinelas biopsiados en la técnica de BGC; número de ganglios totales en el VAX; número de ganglios positivos en el VAX; tamaño de las metástasis en el VAX.
Los métodos de predicción de afectación axilar residual en el VAX fueron:
- –
OSNA. En el caso de disponer de método OSNA y según la literatura9, un resultado de carga tumoral ganglionar total determinada por el método OSNA superior a 15.000 copias de ARNm de CK19 indicaría el VAX. Este método fue analizado en 32 pacientes.
- –
Score Tenon 5. Según descrito en la literatura10, un score mayor de 5 indicaría el VAX. Este score se obtiene de varias puntuaciones parciales: 2 puntos por macrometástasis; 0, 1,5 o 3 puntos según el tamaño del tumor (< 1cm; entre 1 y 2cm;> 2cm, respectivamente); 0, 1 o 2 puntos según una ratio entre los GC positivos respecto el total de GC biopsiados (< 0,5; entre 0,5 y 1; igual a 1; respectivamente). Este método fue analizado en los 279 pacientes que integran el estudio.
- –
GS. En el caso de obtener un GS definido como ganglio con actividad (cps) inferior al 25% de la observada en el GC, localizado en la misma vía de drenaje linfático del GC y en situación centrípeta en la red de drenaje linfático11. Su negatividad evitaría el VAX. Este método fue analizado en 28 pacientes.
- –
Perfil de alto riesgo. A partir de la literatura, y tras obtener los resultados de los diferentes métodos descritos2-5, describimos un perfil de bajo riesgo como tumor de tamaño T1, grado histológico i-i, estado de receptores hormonales positivo, receptor HER-2 negativo. Su complementario correspondería al perfil de alto riesgo. Este método fue analizado en 275 pacientes. Al añadir a este perfil el índice de proliferación Ki-67 elevado (> 20%), se propuso el método definido como AR-Ki. Este método fue analizado en 215 pacientes.
- –
Z-11. Tal como describe el grupo ACOSOG6. En el caso de cirugía conservadora y descartada la afectación extraganglionar de la grasa axilar, este método obviaría el VAX ante un hallazgo de 2 o menos GC positivos. Este método fue analizado en 160 pacientes. La principal limitación de este método al establecer como punto de corte 2 ganglios es que la experiencia de la mayoría de los grupos muestra que el promedio de GC extirpados es 2, lo que significa que muchas pacientes tienen solo un GC biopsiado. Por ello, adicionalmente, se propuso añadir como criterio de exclusión los casos en los que la BGC no hubiera obtenido como mínimo 3 GC. Se denominó este método Z-11 con 3 ganglios y fue analizado en 48 pacientes.
Se realizó un análisis descriptivo de todas las variables. Las variables cualitativas se describieron mediante tablas de frecuencias de las diferentes categorías. Las variables cuantitativas se describieron según su media, desviación estándar y rango. En el caso de comparación entre variables cualitativas, se utilizó el test de la chi al cuadrado. Para la comparación entre una variable cuantitativa y una cualitativa se utilizó el test de la t de Student. En caso de no cumplirse las condiciones de aplicación, se utilizaron pruebas no paramétricas.
Teniendo los resultados del VAX como estándar de oro, se calcularon para cada método la S, la E, el VPP, el VPN, la tasa de falsos negativos (FN), la tasa de falsos positivos y la exactitud. Para el análisis de cada método, se excluyeron los casos que no cumplían los criterios de análisis o de los que no se disponía la información.
Para las pruebas de hipótesis se utilizaron el concepto de bilateralidad, un nivel de significación de 0,05 y una potencia del 90%. Las variables de estudio fueron analizadas mediante el paquete estadístico SPSS v.17.
ResultadosUn total de 14 centros participaron en el estudio, con un reclutamiento de 294 pacientes, siendo excluidas 15 por no cumplir los criterios de selección, resultando 279 para el análisis.
La media de edad de las pacientes fue 57,3 años (DE: 12,1; rango 34-87). La cirugía de mama fue conservadora en 190 pacientes (84,2%) y mastectomía en 34 (15,8%) (se contabilizaron 55 pérdidas correspondientes a un mismo centro que no recogió esta variable). El tamaño medio radiológico del tumor fue de 2,04cm (DE: 0,80; rango 0-5,30) y el patológico de 2,12cm (DE: 0,93; rango 0,20-5,50). El tipo histológico correspondió en 240 casos (86,0%) carcinomas ductal infiltrante, en 26 (9,4%) carcinoma lobulillar infiltrante y en el resto, 4 (1,4%), considerados de alto grado (correspondían a los tipos carcinosarcoma, metaplásico o medular) y 9 (3,2%) considerados de bajo grado (apocrino, cribiforme, mucinoso o papilar). El grado histológico fue bajo (grados i y ii) en 211 (75,6%) y alto en 68 (24,4%). El estado de los receptores hormonales fue 88,0% REP; 77,5% RPP y 9,5% HERP (4 pérdidas); el índice de proliferación Ki-67 fue alto (superior al 20%) en el 67,1% (60 pérdidas). El perfil biológico establecido con los criterios descritos fue: 70,2% LA; 12,4% LB; 9,4% HER2 y 8,0% TN.
Se obtuvo una media de 1,8 GC por paciente (DE: 0,97; rango 1-7). Fueron positivos para macrometástasis 1,3 GC (DE: 0,60; rango 1-6) y se determinó afectación extracapsular en el 20,7% de los mismos (38 pérdidas).
Un total de 68 pacientes presentaron ganglios adicionales en el VAX (24,4%), con una media de 2,6 ganglios adicionales positivos (DE: 2,2; rango 1-9). De estas, 32 pacientes (47,1%) tenían un ganglio metastásico adicional; 11 (16,2%) tenían 2; 10 (14,7%) tenían 3; 4 (5,9%) tenían 4; 2 (2,8%) tenían 5; 3 (4,4%) tenían 6; 1 (1,5%) tuvo 7; 4 (5,9%) tenían 8 y 1 (1,5%) tuvo 9. La media de ganglios axilares extraídos en el VAX fue 14,8 (DE: 5,7; rango 1-42).
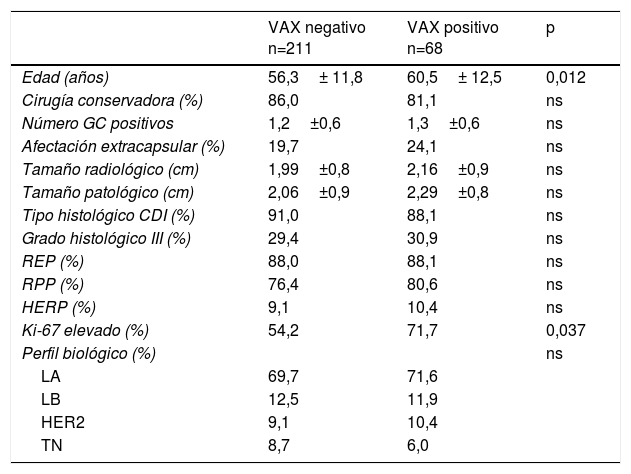
Las características de las pacientes, el tumor y la cirugía según el resultado del VAX se muestran en la tabla 1. Se observa una tendencia de las variables de riesgo en el grupo de VAX positivo, si bien sin llegar a la significación estadística, a excepción del índice de proliferación Ki-67. Al contrario, la edad de las pacientes resultó en una relación inversa a lo esperado.
Características de las pacientes, tumor y cirugía según el resultado del vaciamiento axilar (VAX)
| VAX negativo n=211 | VAX positivo n=68 | p | |
|---|---|---|---|
| Edad (años) | 56,3± 11,8 | 60,5± 12,5 | 0,012 |
| Cirugía conservadora (%) | 86,0 | 81,1 | ns |
| Número GC positivos | 1,2±0,6 | 1,3±0,6 | ns |
| Afectación extracapsular (%) | 19,7 | 24,1 | ns |
| Tamaño radiológico (cm) | 1,99±0,8 | 2,16±0,9 | ns |
| Tamaño patológico (cm) | 2,06±0,9 | 2,29±0,8 | ns |
| Tipo histológico CDI (%) | 91,0 | 88,1 | ns |
| Grado histológico III (%) | 29,4 | 30,9 | ns |
| REP (%) | 88,0 | 88,1 | ns |
| RPP (%) | 76,4 | 80,6 | ns |
| HERP (%) | 9,1 | 10,4 | ns |
| Ki-67 elevado (%) | 54,2 | 71,7 | 0,037 |
| Perfil biológico (%) | ns | ||
| LA | 69,7 | 71,6 | |
| LB | 12,5 | 11,9 | |
| HER2 | 9,1 | 10,4 | |
| TN | 8,7 | 6,0 |
CDI: carcinoma ductal infiltrante; GC: ganglio centinela; HER2: perfil HER2; HERP: HER-2 positivo; LA: luminal A; LB: luminal B; REP: receptor estrogénico positivo; RPP; receptor progesterónico positivo; TN: triple negativo.
En un total de 32 pacientes (11,5%), el análisis del GC se realizó mediante el método OSNA. El número medio de copias de ARNm CK19 fue de 498.113. No hubo diferencias significativas en el número de copias medio entre los casos con VAX positivo y los casos con VAX negativo (342.868 copias vs. 558.861; p= ns).
La puntuación media del score Tenon 5 fue de 5,47 (DE: 1,2; rango 2-7), por encima del punto de corte de discriminación. Se hallaron diferencias significativas entre los casos con VAX negativo (5,3) y los casos con VAX positivo (6,0) (p< 0,001).
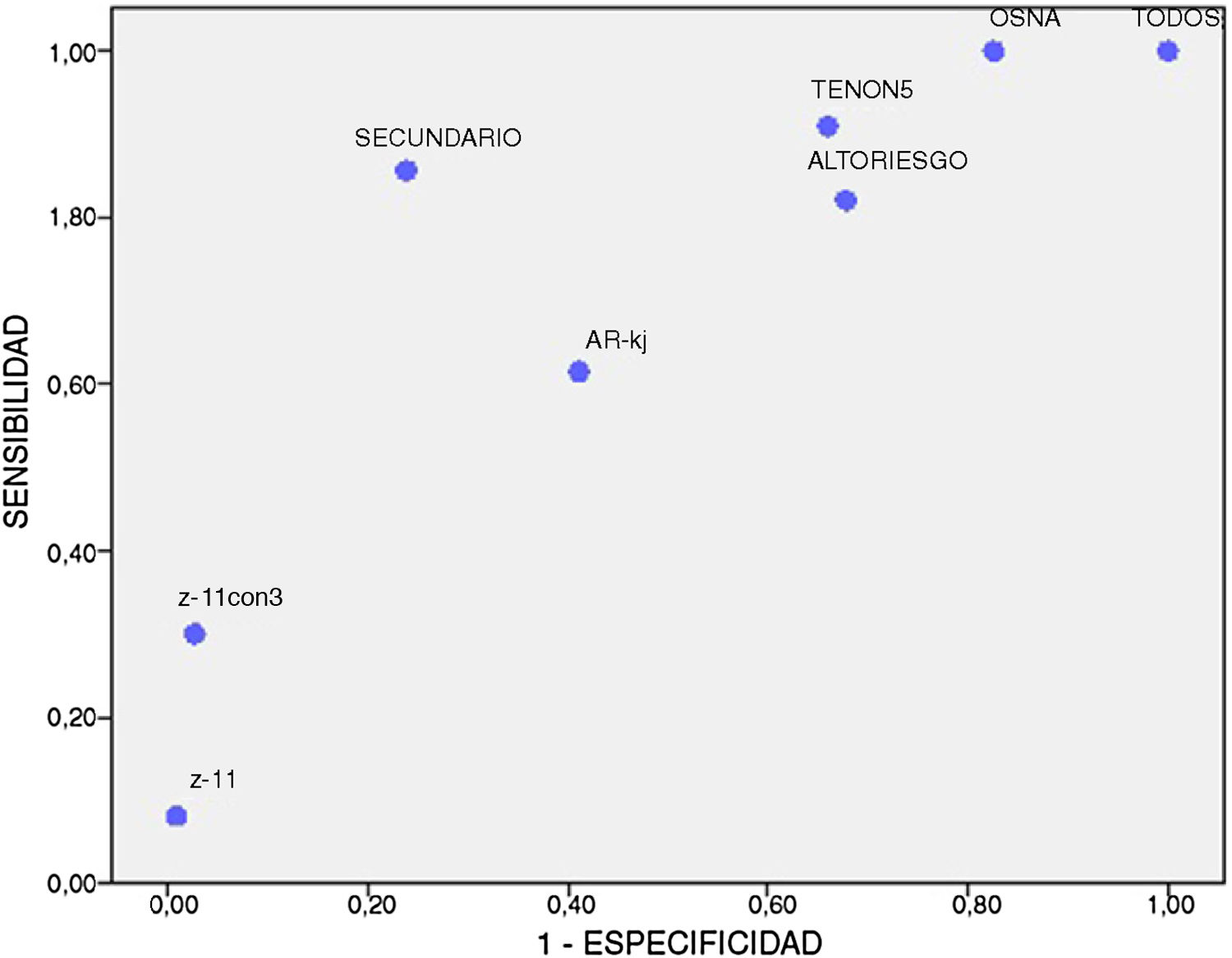
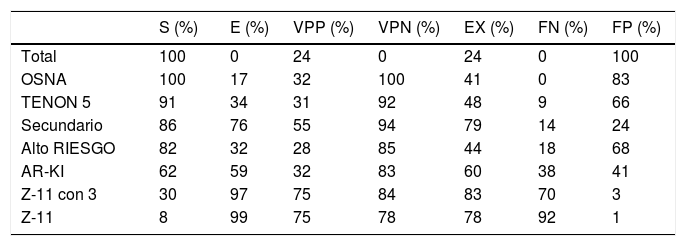
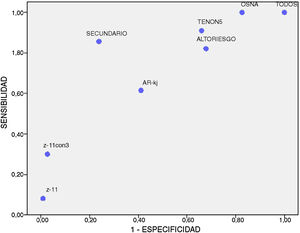
El rendimiento diagnóstico para cada uno de los métodos se describe en la tabla 2. La figura 1 muestra la relación inversa entre S y E para cada uno de ellos; ninguno alcanzó una S y E superiores al 90%. El mejor perfil lo obtuvieron la detección y el análisis del GS, aunque este método es de limitado uso entre los diferentes hospitales.
Resultados de sensibilidad (S), especificidad (E), valor predictivo positivo (VPP), valor predictivo negativo (VPN), exactitud (EX), tasa de falsos negativos (FN) y tasa de falsos positivos (FP) para el total de la muestra y para cada método
| S (%) | E (%) | VPP (%) | VPN (%) | EX (%) | FN (%) | FP (%) | |
|---|---|---|---|---|---|---|---|
| Total | 100 | 0 | 24 | 0 | 24 | 0 | 100 |
| OSNA | 100 | 17 | 32 | 100 | 41 | 0 | 83 |
| TENON 5 | 91 | 34 | 31 | 92 | 48 | 9 | 66 |
| Secundario | 86 | 76 | 55 | 94 | 79 | 14 | 24 |
| Alto RIESGO | 82 | 32 | 28 | 85 | 44 | 18 | 68 |
| AR-KI | 62 | 59 | 32 | 83 | 60 | 38 | 41 |
| Z-11 con 3 | 30 | 97 | 75 | 84 | 83 | 70 | 3 |
| Z-11 | 8 | 99 | 75 | 78 | 78 | 92 | 1 |
Una medida «rigurosa» es la que se hace con gran exactitud (mide lo que queremos medir) y precisión (es fiable), y de ambas deriva su seguridad. En el ámbito diagnóstico, ese rigor se traduce en su validez y se define mediante los índices S, E, VPP y VPN.
Este estudio compara diferentes métodos empleados en distintos hospitales para evitar un VAX en pacientes con macrometástasis del GC.
Respecto al método OSNA, se observó que el punto de corte de 15.000 copias de ARNm CK19 determinaba una inadecuada capacidad para discriminar los VAX negativos (con número de copias muy elevado e incluso más alto que en los VAX positivos), al mostrar una E del 17%. Este método no habría evitado el VAX negativo, al contrario de lo publicado en el trabajo de Peg et al.9. Cabe comentar que la representatividad de la muestra de análisis, siendo pequeña, probablemente no haya podido reproducir los resultados obtenidos por el autor.
Con el método Tenon 5 se consiguió una tasa de FN inferior al 10%. Sin embargo, solo evitaría un tercio de los VAX negativos, con una E del 34%. Se trataría de un método con más asequible al basarse en el tamaño del tumor y el resultado de la cirugía axilar. El trabajo de Barco et al.10 consigue una mejor E de 59,3% que relacionamos con la inclusión de pacientes con resultado de micrometástasis en el GC: siendo una población que presenta menos carga tumoral y mayor probabilidad de VAX negativos se espera obtener una E mejor.
Nuestros resultados habrían sido peores si hubiéramos empleado el score Tenon original con punto de corte en 3,5 descrito por sus autores12,13, de la misma manera que Rouzier et al. han comunicado en un trabajo más actual de 201714.
La formulación de un score de riesgo ha sido empleada por los diferentes centros, consistiendo en nomogramas de mayor complejidad15 o en índices más sencillos fundamentados en las variables pronósticas reconocidas16-18. En nuestro estudio utilizamos una valoración de riesgo similar al empleado por otros centros de nuestra área adaptado de las publicaciones2-5 y a los propios resultados. Se definió un perfil de alto riesgo basado en tamaño, el grado histológico y el receptor hormonal, es decir, parámetros de la tumoración conocidos antes de la BGC. Los resultados obtenidos no fueron aceptables, con E del 32% y tasa de FN elevada, del 18%.
Al añadir el índice de proliferación Ki-67 (única variable que resultó significativa en el análisis univariante), la E se incrementó, a expensas de bajar la S a niveles subóptimos del 62%.
La edad no fue una variable de discriminación útil al observarse significativamente diferente, pero en sentido contrario al esperado, asociado a la positividad en el VAX.
El reciente trabajo de Rouzier et al.14 utiliza conjuntamente el nomograma MSKCC y el score Tenon con punto de score 3,5. Los autores concluyen que el método no muestra suficiente seguridad para su aplicación pues no logra obtener buenos parámetros de E (16,2%), siendo una minoría de los pacientes los elegibles para obviar el VAX.
El método ACOSOG Z-11 aplicado a nuestra muestra obtendría una S de solo el 8% y conservaría el 92% de las axilas positivas. Ello es debido a que el número de GC biopsiados fue mayoritariamente inferior a 2 (media 1,8), por lo que independientemente de su resultado no se habría indicado el VAX. En este sentido, un subanálisis de los casos en los que como mínimo se obtuvieron 3 ganglios no conseguiría optimizar los resultados de S.
Los mejores resultados de S y E se obtuvieron con el análisis del GS (el 86 y el 76%, respectivamente), pero este método se vería limitado por su aplicabilidad, ya que, por un lado, su práctica es limitada entre los hospitales (únicamente 3 de los que participan en el estudio) y, por otro, la ratio de identificación de un GS es moderada.
Una segunda acepción de «riguroso» define que cumple o hace cumplir las normas establecidas o impuestas de forma excesivamente «severa».
Existen varios aspectos que permitirían transgredir la severidad. No la rigurosidad, como comentan Cabañas et al.19, que se desvincularía de «datos incongruentes, malinterpretados o sesgados». En principio, la enfermedad residual en la mayoría de las pacientes es baja, entre 1 y 2 ganglios metastásicos adicionales en el 63,2% en nuestro estudio. Se podría considerar que la extensión del campo radioterapéutico sobre la mama alcanzaría los primeros niveles donde se localizan. Así mismo, que el régimen quimioterapéutico va a ser el mismo independientemente del número de ganglios positivos y que sería razonablemente efectivo. Probablemente sea así en el conjunto de pacientes, tal como refleja el último estudio de seguimiento de ACOSOG Z-1120.
Sin embargo, la gran dificultad para asumir el cambio es que el grupo de pacientes incluidas en el estudio ACOSOG Z-11 presenta una alta heterogeneidad, de ninguno a 3ganglios infiltrados, con o sin afectación extracapsular, en tumores con una biología tumoral mayoritariamente poco adversa, baja representación de los carcinomas no ductales y con inclusión del 40% de los casos por micrometástasis. Esta variabilidad de pacientes no ha sido analizada y por ello, excluidos los casos de micrometástasis21,22, carecemos de un criterio que nos permita identificar qué pacientes con macrometástasis en el GC son de elevado riesgo para una recaída axilar.
La situación actual en los hospitales de nuestro entorno sigue siendo dispar. Cada centro se ha acogido, según su experiencia y el análisis crítico de la literatura, a un método adaptado y particular a su centro. Pocos han aceptado los criterios ACOSOG Z-11, mientras que la mayoría utiliza un nomograma, que incluye variables pronósticas de bajo riesgo o los resultados de la misma BGC.
Este estudio se ha llevado a cabo gracias a la participación de 14 centros que realizaron el esfuerzo de recoger las variables necesarias para el análisis. La incidencia de datos no recogidos o pérdidas no ha superado el 10%, a excepción de la técnica quirúrgica sobre la mama, el cual no fue considerado como factor discriminatorio por uno de los centros. Por otro lado, como estudio retrospectivo y multicéntrico, una limitación plausible pudiera ser el sesgo de medición de las variables, que incluso tras el esfuerzo de uniformización pueda verse sesgado por los criterios propios de cada comité. Finalmente, 3métodos se han estudiado con un cifra baja de casos (< 50): el método OSNA, la valoración del GS y el método ACOSOG cuando se fuerza a una exéresis de 3 o más ganglios, como consecuencia de la no aplicabilidad uniforme de los mismos en el total de los 14 centros. Ello probablemente condicione en un sentido o en otro los resultados obtenidos.
Como conclusión, los resultados de este estudio nos indican que los métodos de predicción de que disponemos pueden no ofrecer suficiente validez y seguridad para discriminar la presencia de enfermedad axilar tras GC positivo para macrometástasis, y que el campo de aplicación de alguno de ellos puede adolecer de carencias o dificultades que menoscaban su practicabilidad. Sin embargo, la incidencia de ganglios adicionales positivos en la axila no operada no es despreciable, por lo que cabrá decidir cuáles son los límites de nuestra confianza en los tratamientos oncológicos actuales.
AutoríaDiseño: MSS, XEM, MFL.
Datos: MLT, IAV, IAB, XMA, PPG, JGN, LCL, JJT, JGC, AGF, LSJ, CBB, CJM.
Análisis: MSS.
Redacción: MSS, SVS.
Revisión: IBN, SVS, IAV, MVT, XMA, AGF, LSJ, JGN, EJR, JAR.
Aprobación: MSS, XEM, MFL.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este estudio se ha llevado a cabo gracias a la participación de 14 centros que realizaron el esfuerzo de recoger las variables necesarias para el análisis. Nuestro agradecimiento a los colaboradores que, por normativa editorial, no son mencionados como autores: Miguel Luna Tomás (Ginecología, Hospital Universitario Germans Trias i Pujol de Badalona); Antonio García Fernández (Ginecología, Hospital Mutua de Terrassa); Inmaculada Alonso Vargas (Ginecología, Hospital Clínic de Barcelona); Laura Cusiné López (Ginecología, Consorci Sanitari de l’Anoia de Igualada); Iris Aran Ballesta (Ginecología, Parc Salut-Hospital del Mar), y Jordina Munrós Feliu (Ginecología, Hospital Clínic de Barcelona).
Parte de este estudio ha sido presentado en una Sesión de la Sección Colegial de Senología del Colegio Oficial de Médicos de Barcelona el 17 de octubre del 2016.