este estudio pretende determinar la correlación entre la carga tumoral total (TTL) analizada por One Step Nucleic Acid Amplification (OSNA) y los resultados obtenidos en nuestra práctica clínica, y si la TTL es una herramienta útil para la selección de pacientes que deben realizarse una linfadenectomía axilar.
Material y métodosel estudio tiene un diseño de cohorte retrospectivo, realizado en el Hospital Costa de Sol, sobre 92 pacientes con (GC+) analizados por OSNA, entre 2012 y 2017.
Resultadosel análisis de supervivencia libre de enfermedad se realizó clasificando a los pacientes en micrometastásicos, macrometastásicos con menos de 25.000 copias de ARNm-CK19/ul y macrometastásicos con más 25.000 copias de ARNm-CK19/ul, sin que se encontrara significación estadística entre los grupos (prueba de log-rank 0,266).
Discusiónla recomendación de la linfadenectomía axilar (ALND) en los casos de pacientes que reciben cirugía conservadora y con axilas clínicamente (o radiológicamente) negativas con alta carga tumoral determinada por OSNA no tiene relación con el control local de la enfermedad.
The aim of this study was to determine the correlation between total lymph load (TLL) analyzed by one step nucleic acid amplification (OSNA) and the results obtained in our clinical practice, and whether TTL is a useful tool for selecting patients who should undergo axillary lymph node dissection.
Material and methodsThe study has a retrospective cohort design, conducted at the Hospital Costa de Sol on 92 patients with (GC+) analyzed by OSNA, between 2012 and 2017.
ResultsDisease-free survival was analyzed classifying patients into micro-metastatic, macro-metastatic with less than 25,000 copies of mRNA-CK19/ul, and macro-metastatic with more than 25,000 copies of mRNA-CK19/ul, with no statistical significance found between groups (log-rank test 0.266266).
DiscussionThe recommendation of axillary lymph node dissection (ALND) in conservatively operated patients with clinically (or radiologically) negative axilla and high tumor load as determined by OSNA is not related to local disease control.
El estudio Z00111 ha demostrado (con más de 10 años de seguimiento y con aplicación clínica en todo el mundo) que luego de una biopsia de ganglio centinela (BSGC) existe un porcentaje del 27% de ganglios no centinelas metastásicos; sin embargo, el porcentaje de recidivas axilares es similar al de la linfadenectomía.
A pesar de ello, algunas guías clínicas han incluido en sus recomendaciones el uso del método One Step Nucleic Acid Amplification (OSNA) y la carga tumoral total (TTL) para seleccionar pacientes con cáncer de mama precoz e indicar la realización de una linfadenectomía axilar (ALND)2 en pacientes que recibieron cirugía conservadora por cáncer de mama. Por lo tanto, consideran la TTL, definida como el número de copias del ARNm CK19/ul, como el criterio decisivo para la indicación de linfadenectomía, independientemente del número de ganglios metastásicos.
Esto significa que en determinadas situaciones el método OSNA y la TTL prevalecen sobre los criterios de desescalada, indicando la realización de una ALND, aun en casos de pacientes que reciben cirugía conservadora y que cumplen criterios Z00111,3,4.
En la Unidad de Mama del Hospital Universitario Costa de Sol se utiliza el método OSNA para clasificar a las pacientes con biopsia de ganglio centinela SLNB en: ganglios linfáticos con células tumorales aisladas, micrometastásicas y macrometastásicas. Por otro lado, en los pacientes con cirugía conservadora y con ganglios afectos, para decidir la realización de una ALND, se siguieron las guías internacionales y los criterios de inclusión del estudio Z0011 y no la TTL.
Este estudio pretende determinar la correlación entre la TTL y los resultados clínicos obtenidos en nuestra práctica clínica, y si la TTL es una herramienta útil para la selección de pacientes que deben recibir una linfadenectomía axilar.
Material y métodosEl estudio tiene un diseño de cohorte retrospectivo, realizado en el Hospital Costa de Sol sobre 92 pacientes con ganglio centinela positivo (GC+) analizados por OSNA entre 2012 y 2017, lo que permite un seguimiento prolongado de aquellos que cumplían los criterios ACOSOG Z0011 (usando la clasificación de micro o macrometástasis según las copias de ARNm-CK19/ul) y que no recibieron una ALND independientemente de la TTL.
Los criterios de inclusión (ACOSOG Z0011) fueron: cirugía conservadora, T1-T2 (hasta 5 cm), N0 clínico, no más de 2 ganglios con macrometástasis en el resultado intraoperatorio, paciente que recibirá radioterapia complementaria sobre el volumen mamario, paciente sin linfadenectomía axilar, sin quimioterapia neoadyuvante y estudio intraoperatorio mediante el método OSNA.
Se tomaron los siguientes criterios de exclusión: paciente con linfadenectomía axilar, estudio intraoperatorio con un método distinto al OSNA y TTL inferior a 250 copias (células tumorales aisladas).
El examen intraoperatorio del ganglio centinela se realizó mediante el siguiente procedimiento: el ganglio linfático fue disecado del tejido adiposo y la grasa perinodal, se incluyó en parafina para su estudio histológico diferido. A continuación, se realizó una citología de impronta antes de que el GC fuera homogeneizado para su estudio mediante técnica molecular de análisis de amplificación de ARNm de la citoqueratina 19 (OSNA Sysmex).
El análisis descriptivo se realizó utilizando medidas de tendencia central y dispersión para las variables cuantitativas, y distribución de frecuencias para las variables cualitativas. Para evaluar las diferencias entre los grupos en cuanto a supervivencia libre de enfermedades (SLE), se dicotomizaron las copias de ARNm con un punto de corte de 25.000 copias de ARNm-CK19/ul. Para las variables cualitativas se utilizó la prueba de chi-cuadrado y para las cuantitativas la prueba t de Student. Los pacientes clasificados por tipo de metástasis y número de copias se evaluaron mediante el método de Kaplan–Meier, tomando como variable de ajuste los pacientes clasificados por tipo de metástasis y número de copias, evaluando las diferencias mediante la prueba log-rank. En los diferentes análisis, el nivel de significación estadística se estableció en p < 0,05. Se utilizó el software SPSS v28.
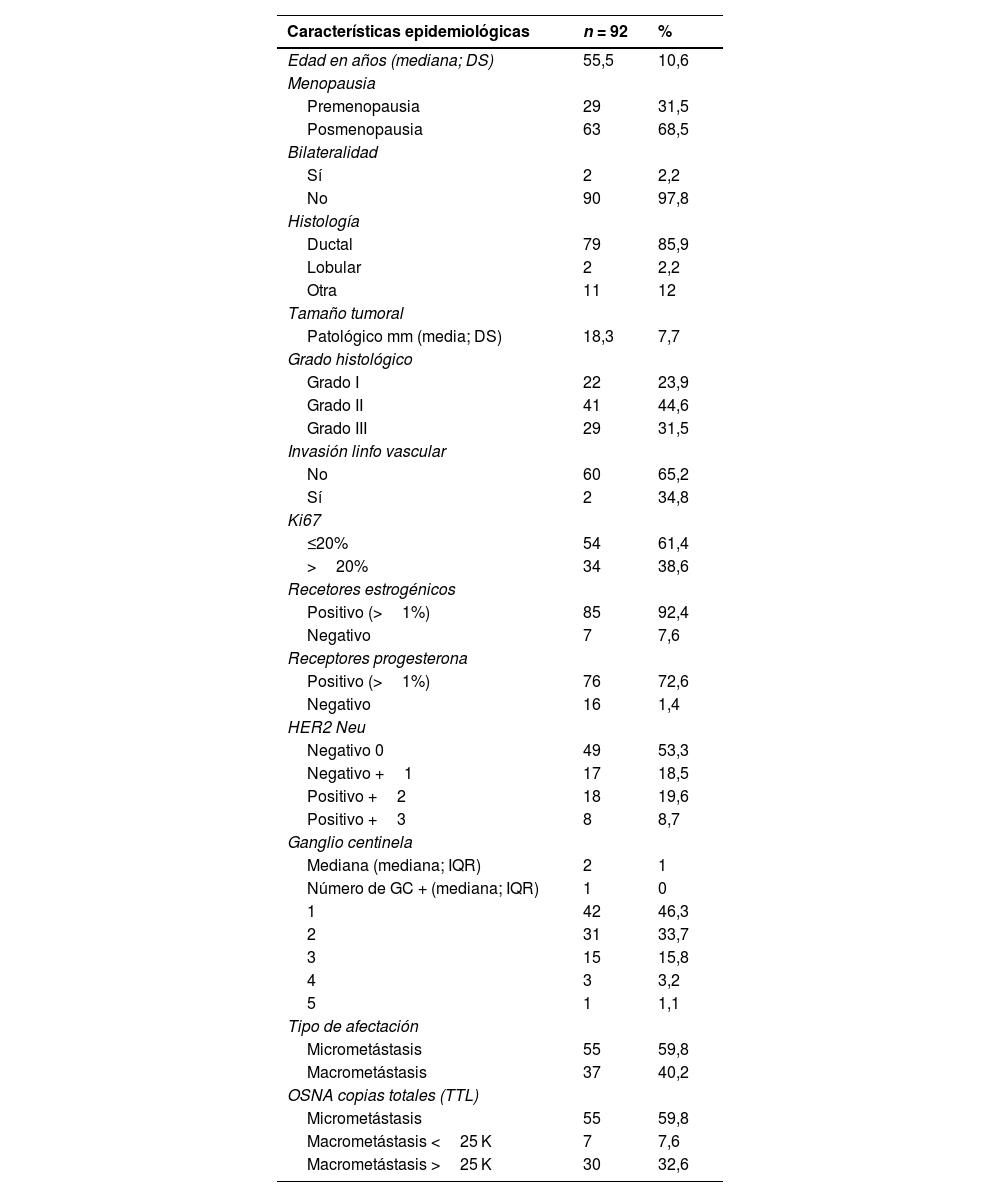
ResultadosLa mediana del número de ganglios centinela obtenidos por el procedimiento fue de 2 ganglios, con una mediana de número de ganglios positivos de 1 (límites 1–5) (tabla 1). Todos los pacientes cumplieron los criterios del estudio Z0011 (tabla 1).
Características epidemiológicas
| Características epidemiológicas | n = 92 | % |
|---|---|---|
| Edad en años (mediana; DS) | 55,5 | 10,6 |
| Menopausia | ||
| Premenopausia | 29 | 31,5 |
| Posmenopausia | 63 | 68,5 |
| Bilateralidad | ||
| Sí | 2 | 2,2 |
| No | 90 | 97,8 |
| Histología | ||
| Ductal | 79 | 85,9 |
| Lobular | 2 | 2,2 |
| Otra | 11 | 12 |
| Tamaño tumoral | ||
| Patológico mm (media; DS) | 18,3 | 7,7 |
| Grado histológico | ||
| Grado I | 22 | 23,9 |
| Grado II | 41 | 44,6 |
| Grado III | 29 | 31,5 |
| Invasión linfo vascular | ||
| No | 60 | 65,2 |
| Sí | 2 | 34,8 |
| Ki67 | ||
| ≤20% | 54 | 61,4 |
| >20% | 34 | 38,6 |
| Recetores estrogénicos | ||
| Positivo (>1%) | 85 | 92,4 |
| Negativo | 7 | 7,6 |
| Receptores progesterona | ||
| Positivo (>1%) | 76 | 72,6 |
| Negativo | 16 | 1,4 |
| HER2 Neu | ||
| Negativo 0 | 49 | 53,3 |
| Negativo +1 | 17 | 18,5 |
| Positivo +2 | 18 | 19,6 |
| Positivo +3 | 8 | 8,7 |
| Ganglio centinela | ||
| Mediana (mediana; IQR) | 2 | 1 |
| Número de GC + (mediana; IQR) | 1 | 0 |
| 1 | 42 | 46,3 |
| 2 | 31 | 33,7 |
| 3 | 15 | 15,8 |
| 4 | 3 | 3,2 |
| 5 | 1 | 1,1 |
| Tipo de afectación | ||
| Micrometástasis | 55 | 59,8 |
| Macrometástasis | 37 | 40,2 |
| OSNA copias totales (TTL) | ||
| Micrometástasis | 55 | 59,8 |
| Macrometástasis <25 K | 7 | 7,6 |
| Macrometástasis >25 K | 30 | 32,6 |
OSNA: One Step Nucleic Acid Amplification; TTL: carga tumoral total.
Cincuenta y cinco pacientes fueron clasificados mediante el método OSNA como micrometastásicos, mientras que 37 fueron clasificados como macrometastásicos. Utilizando la carga tumoral total como parámetro, 7 de los pacientes clasificados como macrometastásicos tenían menos de 25.000 copias de ARNm-CK19/ul y 30 de los pacientes presentaban más de 25.000 copias de ARNm-CK19/ul.
En el análisis univariante, tomando como variable de respuesta las copias de OSNA (<25.000/≥25.000), ni la edad (p = 0,739), el tamaño patológico del tumor (p = 0,236), el estado menopáusico (p = 0,983), el grado histológico (p = 0,933), Ki67 (p = 0,917), los receptores de estrógenos (p = 0,420), los receptores de progesterona (p = 0,314), el número de ganglios linfáticos afectados (p = 0,180) mostraron asociación estadística. Solo la presencia de invasión linfática vascular mostró asociación estadística (p = 0,05) con la progresión libre de enfermedad.
Para realizar el análisis de supervivencia libre de enfermedad, y usando siempre el método OSNA, los pacientes se clasificaron en micrometastásicos, macrometastásicos con menos 25.000 copias de ARNm-CK19/ul y macrometastásicos con más 25.000 copias de ARNm-CK19/ul, sin que se encontrara significación estadística en cuanto a SLE entre los grupos (prueba de log-rank 0,266) (fig. 1).
Durante el periodo de estudio, 6 pacientes tuvieron una recaída de la enfermedad (tabla 2). Solo uno de ellos ha presentado una recidiva axilar asociada a recidiva supraclavicular y laterocervical, pulmonar y mediastínica. Ha habido 2 recaídas sistémicas, una recaída mamaria y 3 recaídas locorregionales con enfermedad sistémica asociada.
Recaídas
| Paciente | Tipo de recurrencia | Tiempo hasta la recurrencia (meses) | Descripcióna | TTL |
|---|---|---|---|---|
| 1 | Locorregional y sistémica | 14 | pT2 pN1 LVSI+, Luminal B | 2.100 |
| 2 | Locorregional y sistémica | 111 | pT1 pN1 LVSI+ Luminal A | 1.400.000 |
| 3 | Locorregional y sistémica | 40 | pT2 pN1 Luminal B | 630.000 |
| 4 | Sistémica | 63 | pT2 pN1 Luminal B HER2+ | 15.900.000 |
| 5 | Sistémica | 22 | pT2 pN1 HER2 enrich LVSI+ | 1.720.000 |
| 6 | Mamaria | 50 | pT1b pN1 Luminal A | 1.300 |
Paciente 1: TTL 2.100 de ARNm-CK19/ul. Carcinoma ductal infiltrante (CDI) T 2,4 cm grado histológico (GH) II, presencia de carcinoma ductal in situ (CDIS), LVSI+, margen de tumorectomía a 0,3 mm de componente CDIS. RE+ RP negativos HER2 Neu 2 + SISH negativo, Ki67 70%. Quimioterapia (QT) adyuvante con adriamicina ciclofosfamida (AC) + docetaxel + tamoxifeno (TAM). Recaída mamaria, axilar supraclavicular y laterocervical, pulmonar y mediastínica.
Paciente 2: TTL 1.400.000 de ARNm-CK19/ul. CDI mixto T 1,8 cm, GH I, LVSI+, márgenes de tumorectomía libres, RE+, RP+, HER2 Neu negativo, Ki67 no disponible, Rxponder RS: 15, letrozol, recaída mamaria con letálides, axilar contralateral, pulmonar.
Paciente 3: TTL 630.000 de ARNm-CK19/ul. CDI, cT2 N1, RE+, RP+, HER2 Neu negativo, Ki67 24%, QT adyuvante con AC/docetaxel + TAM, recaída hepática, cutánea en coraza y pulmonar.
Paciente 4: TTL 15.900.000 de ARNm-CK19/ul. CDI T 2 cm, GH III RE+ RP+, HER2 Neu 3+, CDIS <25%, márgenes tumorales libres, QT adyuvante AC/docetaxel + herceptin, TAM + exemestano, recaída ósea, mediastínica y hepática.
Paciente 5: TTL 1.720.000 de ARNm-CK19/ul. CDI T 4,5 cm, receptores hormonales negativos, GH III, HER2 Neu 3+, LVSI+, QT AC/taxanos + herceptin + petuzumab, recaída sistema nervioso central.
Paciente 6: TTL 1.300 de ARNm-CK19/ul. CDI tubular, T 0,9 cm, RE +, RP+, HER2 Neu negativo, Ki67 6%, márgenes tumorales libres, letrozol, recidiva mamaria CDIS + microinvasión.
Por último, y para conocer el alcance de las posibles sobreindicaciones de un ALND, se calculó el número de pacientes que necesitarían ser tratadas bajo los criterios de TTL para producir daño, el cual fue de 2,3 (NNH [Hazard Ratio, Cox Regression]).
DiscusiónSe debe reevaluar la relevancia clínica que puede tener en la estadificación axilar la utilización de un método como el OSNA. Más aún si el método está destinado a ser utilizado para seleccionar pacientes que son candidatas a la disección axilar en la era pos-Z00115–10.
Peg et al.11 analizaron a 697 pacientes con ALND tras un GC+. A pesar de que el diámetro de los tumores incluidos era T1-T3, encontraron un porcentaje de ganglios no centinelas metastásicos similar al del estudio publicado por Giuliano et al. (29% Peg vs. 27,3% Giuliano)12. Este estudio se inició antes de la publicación de Z0011, con el objetivo de evitar linfadenectomías, y solo el 2,8% de los pacientes del grupo de alta carga no recibieron disección axilar. Evidentemente, la publicación del estudio Z00111,3 cambió el impacto real que podía tener la TTL. Por otro lado, publicaciones recientes advierten que la TTL medido por el método OSNA13 no debe utilizarse fuera de un ensayo clínico.
Ales Martínez et al. analizaron un total de 321 pacientes con BSGC evaluada por OSNA con un seguimiento medio de 56 meses. Setenta y un casos mostraron una TTL superior a 15.000 copias. Utilizando los criterios Z0011, obtuvieron resultados similares a los nuestros con una baja tasa de linfadenectomía axilar. En nuestro caso, solo la presencia de LVSI estuvo relacionada con SLE; si bien este último es un parámetro poco reproducible, debe ser incluido en los informes de anatomía patológica14.
También concluyen, al igual que nosotros, que si el manejo axilar se hubiera basado en los valores de TTL, habrían multiplicado el número de linfadenectomías axilares por un factor de 3,3 y que no existe relación entre la TTL medido por el método OSNA y los resultados clínicos locales y a distancia15.
En nuestro estudio, la posibilidad de realizar una linfadenectomía en exceso se calculó como NNH, con un resultado de 2,3.
Diferentes autores han propuesto puntos de corte para las copias de ARNm con el fin de decidir si, en presencia de un GC+, se debe realizar ALND16. Incluso el punto de corte propuesto ha sido modificado recientemente en los protocolos de algunas sociedades científicas2.
Aunque el análisis de TTL por OSNA ha mostrado en un metaanálisis publicado por Tiernan et al.13, una sensibilidad global de 0,87 y una especificidad de 0,98 al analizar el compromiso metastásico del GC, dada la baja prevalencia de macrometástasis, estos valores podían llevar a interpretaciones erróneas. Ciertamente, en el año de publicación de este trabajo y con los puntos de corte propuestos, se obtenían bajos valores predictivos positivos, lo que podía conducir a indicaciones de linfadenectomía en exceso. Aunque la intención del nuestro trabajo no es valorar los actuales puntos de corte utilizados para clasificar las metástasis axilares en células tumorales asiladas, micro o macrometástasis (por otra parte, ampliamente establecidos), sino la utilidad de la TTL para indicar una linfadenectomía en la era pos-Z0011.
Recientemente se han publicado los resultados del estudio SINODAR ONE17 y SENOMAC18. SINODAR ONE es un estudio aleatorizado, multicéntrico, prospectivo y de no inferioridad cuyo objetivo es evaluar la utilidad de la disección de ganglios linfáticos axilares en que recibieron cirugía conservadora de mama o mastectomía para el cáncer de mama T1–2 y que presentaban uno o 2 GC con macro metástasis. El examen histopatológico se realizó mediante el método estándar y la técnica OSNA. Usando el método OSNA, los ganglios fueron clasificados en micro o macrometastásicos, pero no se usó un punto de corte en base al número de copias para indicar o no la necesidad de una linfadenectomía. Sus resultados no respaldan el uso de la ALND de rutina en este tipo de pacientes. El estudio SENOMAC es un ensayo de no inferioridad en el que pacientes con ganglios clínicamente negativos con criterios de inclusión más amplios que el estudio Z0011 (T1–3, micrometástasis adicionales, extensión extracapsular), demostró una vez más que la omisión de la disección completa de los ganglios linfáticos axilares no fue inferior a una cirugía más extensa.
La recomendación de ALND en casos de axilas clínicamente (o radiológicamente) negativos con alta carga tumoral determinada por OSNA en pacientes que cumplen criterios Z011 no se apoya en los datos de grandes estudios aleatorizados en concordancia con los resultados de nuestro estudio, a pesar de ser un diseño de cohorte retrospectivo. En estos estudios19–25 y con un seguimiento medio de 8–10 años, la tasa de recurrencia axilar osciló entre el 1,5 y 3,8%, no siendo diferente de la tasa observada con la ALND. Este hecho, así como la igualdad entre la supervivencia libre de enfermedad y la supervivencia global, y el hecho de que la decisión de realizar un tratamiento adyuvante sistémico se base en las características biológicas del tumor, hacen que la tendencia actual sea reducir cada vez más la necesidad de la linfadenectomía axilar.
¿Cuáles son las implicaciones de no completar una linfadenectomía en presencia de GC+? No parece que los falsos negativos de la BSGC, ni el posible compromiso residual axilar comprometan el verdadero objetivo final, que es el control local de la enfermedad19,26,27.
Responsabilidades éticasEl estudio cuenta con la aprobación de Comité de Ética de la Investigación del Hospital Universitario Costa de Sol.
Consentimiento informadoLos autores declaran que cuentan con el consentimiento de los pacientes para su publicación.
FinanciaciónLos autores declaran que no han recibido financiación alguna.
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses.