El ejercicio físico en el paciente oncológico se debería considerar un tratamiento adyuvante por los beneficios que aporta. Sin embargo, su papel en el linfedema secundario al cáncer de mama no está claramente definido. El objetivo de la revisión es describir el efecto de los diferentes tipos de ejercicio en este tipo de pacientes. Se realizó una búsqueda bibliográfica en las bases de datos PubMed y PEDro. Se incluyeron ensayos clínicos controlados publicados entre 2017 y 2023, en inglés y español. La selección de artículos se realizó de manera independiente por 2 investigadores, utilizando la estrategia PICO. Se obtuvieron 43 artículos, de los que, tras revisión por los autores, se incluyeron 19, la mayoría centrados en el ejercicio de fuerza. El ejercicio físico de fuerza en mujeres con linfedema o con riesgo de desarrollarlo, incluso con altas cargas, ha demostrado ser seguro, incluido durante el tratamiento con taxanos. Además, tiene efecto beneficioso en la calidad de vida, los síntomas relacionados con el linfedema, funcionalidad de la extremidad, y la ganancia de fuerza, sin poder demostrar claramente su papel en la prevención o tratamiento del linfedema. Actualmente, no existen protocolos específicos sobre el ejercicio de fuerza. Otros tipos de ejercicios como el acuático, el pilates y el yoga también deben considerarse adecuados para esta población.
The role of exercise in breast cancer-related lymphedema (BCRL) is not clearly defined. The main target of this review is to describe the effects of the different types of exercises on this kind of patient. Bibliographic research was done through the databases of PubMed and PEDro. Controlled trials published between 2017 and 2023 in both Spanish and English, were included. Article selection was carried out separately by 2 researchers using the PICO strategy. Forty-three articles were selected and, after the authors´ review, 19 were included, the majority focused on strength exercises. Strength physical exercise in women with BCRL or at risk of developing it, proved to be safe, even with heavy loads and even during taxanes treatment. Furthermore, it has a beneficial effect on the patients quality of life, in lymphedema symptoms, extremities functionality, and strength gain, although it could not prove its positive role in the prevention or treatment of BCRL. There are no specific protocols for the strength exercise. Other types of exercises such as water sports, pilates, and yoga are considered adequate for these patients.
El cáncer de mama sigue siendo el más frecuente en mujeres de países desarrollados. En España, se estima una incidencia de 144 casos nuevos al año por cada 100.000 mujeres1. Los avances científicos han aumentado la supervivencia, a expensas de un mayor número de efectos secundarios al propio cáncer y a sus tratamientos, siendo el linfedema uno de los más comunes y temidos2.
El ejercicio físico es una intervención coste-efectiva con importantes beneficios en los pacientes oncológicos, incluido el cáncer de mama3. La guía de la American College of Sports Medicine (ACSM) y otras publicaciones, consideran el ejercicio como práctica segura durante y tras los tratamientos oncológicos (recomendación A), que previene y mitiga los efectos colaterales de los mismos, mejorando la función física, la movilidad del hombro y la fuerza, la ansiedad y depresión, la fatiga relacionada con el cáncer y la calidad de vida relacionada con la salud4–6.
En cuanto al linfedema secundario a cáncer de mama (LSCM), se recomienda que la educación sanitaria incluya el ejercicio con el objetivo de controlar el peso corporal para prevenir su aparición, sobre todo en las primeras fases tras el cáncer7,8. Sin embargo, la falta de protocolos sobre los programas de ejercicio para el LSCM, con frecuencia deriva en inseguridad del paciente9.
Esto se agrava con las recomendaciones de algunos profesionales de evitar actividades físicas vigorosas, repetitivas o de fuerza con el miembro superior, por la creencia de que sobrecargan e interrumpen el flujo linfático, por lo que solo permiten ejercicios libres de carga.
Los pioneros en desmitificar esta teoría fueron McKenzie, en 1998, con las carreras de remo «Dragon boat» y Harris y Niesen-Vertommen en el año 200010,11. En 2003 se publicaron los primeros resultados sobre la respuesta aguda y crónica del ejercicio en el LSCM, considerándolo una práctica segura, y desde entonces ha sido objeto de múltiples estudios5.
El objetivo principal de este trabajo fue revisar la literatura científica sobre el tipo y características del ejercicio físico recomendado a mujeres con LSCM o en riesgo de desarrollarlo. El objetivo secundario fue extraer de dicha revisión los beneficios del ejercicio en otras complicaciones que pueden acontecer tras la cirugía del cáncer de mama.
Material y métodosA través de 2 bases de datos electrónicas se realizó una estrategia de búsqueda de artículos de la siguiente manera:
- –
En PubMed: («Exercise»[Mesh]) OR «Physical Exertion»[Mesh] OR «Physical Fitness»[Mesh] OR «Sports»[Mesh] OR «Exercise Movement Techniques»[Mesh]) AND «Breast Neoplasms»[Mesh] AND «Lymphedema»[Mesh].
- –
En PEDro, una búsqueda avanzada con las palabras clave: «lymphedema and physical exercise», utilizando como operador booleano «AND».
Se aplicaron los filtros: estudios clínicos y estudios clínicos aleatorizados, tamaño muestral n > 15, idiomas español e inglés, de 2017 hasta diciembre de 2023. Para evitar la pérdida de estudios potencialmente elegibles, se realizó la revisión manual de las referencias bibliográficas de los estudios incluidos que cumplían los requisitos.
La selección de artículos relevantes se llevó a cabo de manera independiente por 2 investigadores, utilizando la estrategia PICO (tabla 1). La extracción de datos de cada uno de los estudios se realizó por los mismos revisores, de forma individual. Las discrepancias se resolvieron por consenso.
Criterios de inclusión y exclusión para la selección de artículos de la revisión según metodología PICO
| Criterios de inclusión | ||
|---|---|---|
| Acrónimo | Definición | |
| P | Pacientes | Con cáncer de mama con linfedema o riesgo de desarrollarlo |
| I | Intervención | Cualquier tipo de ejercicio físico |
| C | Comparación | Sin restricciones |
| O | Resultados | Sin restricciones |
| Diseño de estudios y características | Estudios clínicosEnsayos aleatorizados | |
| Idioma | Inglés o español | |
| Año de publicación | 2017 a diciembre de 2023 | |
| Criterios de exclusión | ||
| Revisiones, metaanálisis, guías, opiniones, libros, editoriales, cartas al directorEstudios en animales | ||
P: Población, I: Intervención, C: Comparación, O: Resultados (Outcomes).
La definición de ejercicio físico elegida para la revisión fue «actividad física planeada, estructurada y repetida que tiene como objetivo mejorar la condición física». Se excluyeron los artículos que incluían los ejercicios relacionados con la rehabilitación física poscirugía o tratamientos fisioterápicos, como el drenaje linfático.
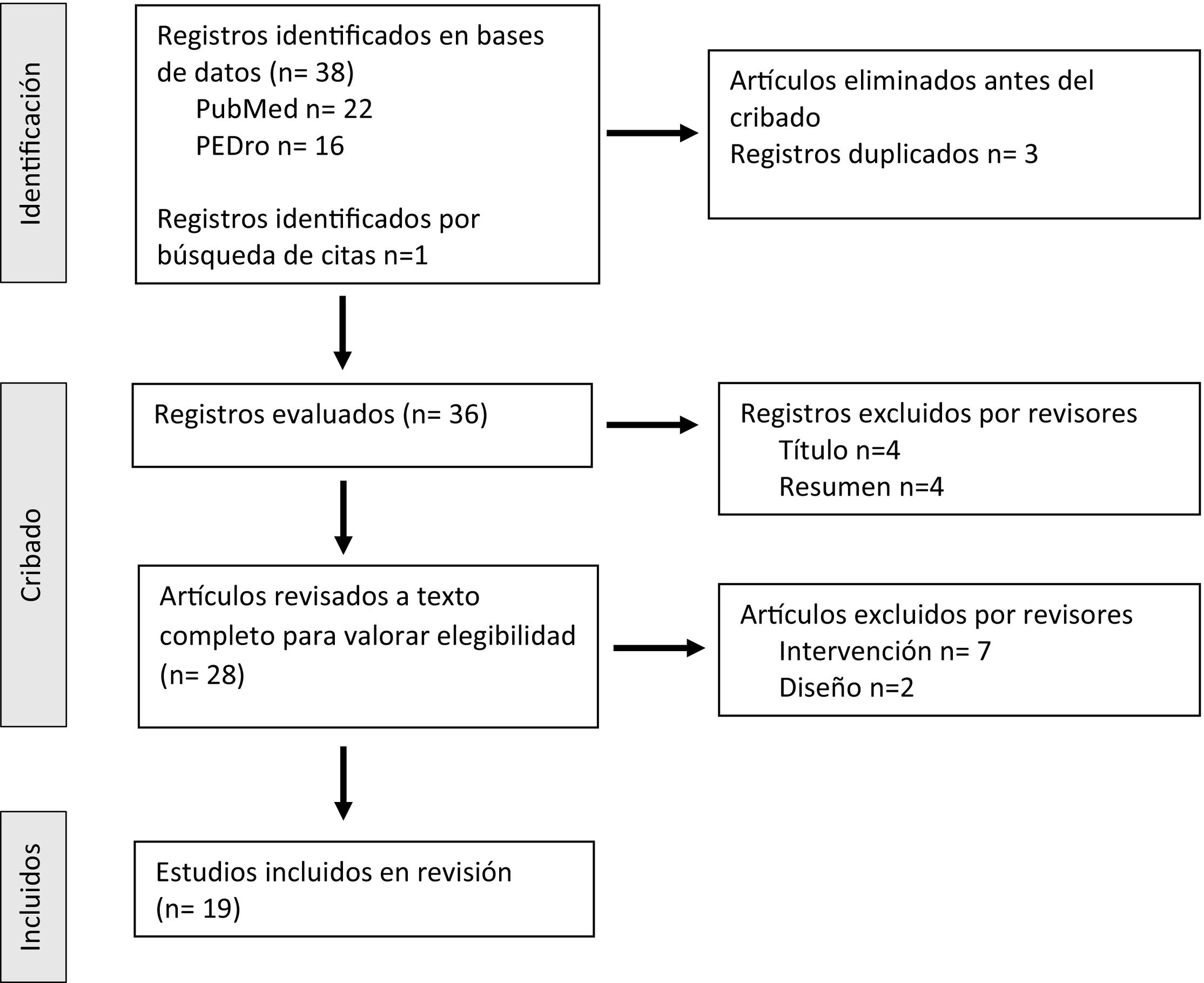
ResultadosDe la búsqueda en la base de datos de PubMed, se obtuvieron 24 estudios clínicos y se incluyeron 12. Se excluyeron 4 tras la lectura de los títulos y resúmenes, y 8 tras la lectura del texto completo: 6 por no hacer referencia específicamente a la intervención definida para este trabajo, y 2 por diseño, uno de los artículos tenía una muestra menor de 15 pacientes y otro era un protocolo de estudio sin resultados.
De la base de datos PEDro, se obtuvieron 16 artículos y se incluyeron 4. Tres de ellos se encontraban repetidos en PubMed, 5 fueron excluidos tras la lectura de los títulos y resúmenes, y 4 tras la lectura del artículo, por no corresponder a la población o intervención a estudio.
De la revisión manual de las referencias bibliográficas de los estudios incluidos, se seleccionaron 3 ensayos controlados que cumplían con los requisitos. En la figura 1 se muestra el diagrama de flujo de la selección de los artículos de acuerdo a las recomendaciones PRISMA. Finalmente, se seleccionaron 19 ensayos clínicos en la revisión (tablas 2 y 3), con un único estudio doble ciego.
Estudios sobre ejercicios de fuerza aislado o combinado con otros ejercicios (n = 11)
| Referencia | Diseño | Muestra | Ejercicio | Intervención | Variables | Duración | Resultados |
|---|---|---|---|---|---|---|---|
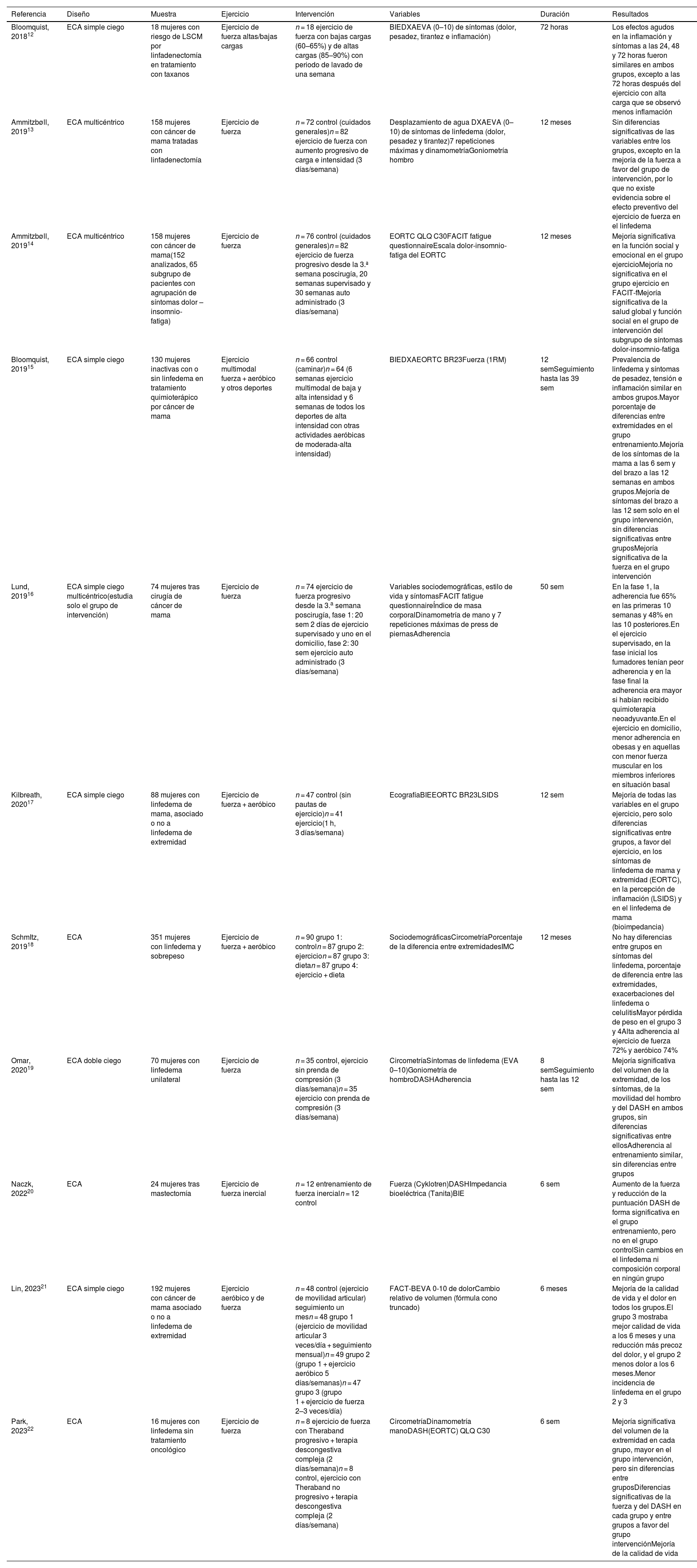
| Bloomquist, 201812 | ECA simple ciego | 18 mujeres con riesgo de LSCM por linfadenectomía en tratamiento con taxanos | Ejercicio de fuerza altas/bajas cargas | n = 18 ejercicio de fuerza con bajas cargas (60–65%) y de altas cargas (85–90%) con periodo de lavado de una semana | BIEDXAEVA (0–10) de síntomas (dolor, pesadez, tirantez e inflamación) | 72 horas | Los efectos agudos en la inflamación y síntomas a las 24, 48 y 72 horas fueron similares en ambos grupos, excepto a las 72 horas después del ejercicio con alta carga que se observó menos inflamación |
| Ammitzbøll, 201913 | ECA multicéntrico | 158 mujeres con cáncer de mama tratadas con linfadenectomía | Ejercicio de fuerza | n = 72 control (cuidados generales)n = 82 ejercicio de fuerza con aumento progresivo de carga e intensidad (3 días/semana) | Desplazamiento de agua DXAEVA (0–10) de síntomas de linfedema (dolor, pesadez y tirantez)7 repeticiones máximas y dinamometríaGoniometría hombro | 12 meses | Sin diferencias significativas de las variables entre los grupos, excepto en la mejoría de la fuerza a favor del grupo de intervención, por lo que no existe evidencia sobre el efecto preventivo del ejercicio de fuerza en el linfedema |
| Ammitzbøll, 201914 | ECA multicéntrico | 158 mujeres con cáncer de mama(152 analizados, 65 subgrupo de pacientes con agrupación de síntomas dolor – insomnio-fatiga) | Ejercicio de fuerza | n = 76 control (cuidados generales)n = 82 ejercicio de fuerza progresivo desde la 3.ª semana poscirugía, 20 semanas supervisado y 30 semanas auto administrado (3 días/semana) | EORTC QLQ C30FACIT fatigue questionnaireEscala dolor-insomnio-fatiga del EORTC | 12 meses | Mejoría significativa en la función social y emocional en el grupo ejercicioMejoría no significativa en el grupo ejercicio en FACIT-fMejoría significativa de la salud global y función social en el grupo de intervención del subgrupo de síntomas dolor-insomnio-fatiga |
| Bloomquist, 201915 | ECA simple ciego | 130 mujeres inactivas con o sin linfedema en tratamiento quimioterápico por cáncer de mama | Ejercicio multimodal fuerza + aeróbico y otros deportes | n = 66 control (caminar)n = 64 (6 semanas ejercicio multimodal de baja y alta intensidad y 6 semanas de todos los deportes de alta intensidad con otras actividades aeróbicas de moderada-alta intensidad) | BIEDXAEORTC BR23Fuerza (1RM) | 12 semSeguimiento hasta las 39 sem | Prevalencia de linfedema y síntomas de pesadez, tensión e inflamación similar en ambos grupos.Mayor porcentaje de diferencias entre extremidades en el grupo entrenamiento.Mejoría de los síntomas de la mama a las 6 sem y del brazo a las 12 semanas en ambos grupos.Mejoría de síntomas del brazo a las 12 sem solo en el grupo intervención, sin diferencias significativas entre gruposMejoría significativa de la fuerza en el grupo intervención |
| Lund, 201916 | ECA simple ciego multicéntrico(estudia solo el grupo de intervención) | 74 mujeres tras cirugía de cáncer de mama | Ejercicio de fuerza | n = 74 ejercicio de fuerza progresivo desde la 3.a semana poscirugía, fase 1: 20 sem 2 días de ejercicio supervisado y uno en el domicilio, fase 2: 30 sem ejercicio auto administrado (3 días/semana) | Variables sociodemográficas, estilo de vida y síntomasFACIT fatigue questionnaireÍndice de masa corporalDinamometría de mano y 7 repeticiones máximas de press de piernasAdherencia | 50 sem | En la fase 1, la adherencia fue 65% en las primeras 10 semanas y 48% en las 10 posteriores.En el ejercicio supervisado, en la fase inicial los fumadores tenían peor adherencia y en la fase final la adherencia era mayor si habían recibido quimioterapia neoadyuvante.En el ejercicio en domicilio, menor adherencia en obesas y en aquellas con menor fuerza muscular en los miembros inferiores en situación basal |
| Kilbreath, 202017 | ECA simple ciego | 88 mujeres con linfedema de mama, asociado o no a linfedema de extremidad | Ejercicio de fuerza + aeróbico | n = 47 control (sin pautas de ejercicio)n = 41 ejercicio(1 h, 3 días/semana) | EcografíaBIEEORTC BR23LSIDS | 12 sem | Mejoría de todas las variables en el grupo ejercicio, pero solo diferencias significativas entre grupos, a favor del ejercicio, en los síntomas de linfedema de mama y extremidad (EORTC), en la percepción de inflamación (LSIDS) y en el linfedema de mama (bioimpedancia) |
| SchmItz, 201918 | ECA | 351 mujeres con linfedema y sobrepeso | Ejercicio de fuerza + aeróbico | n = 90 grupo 1: controln = 87 grupo 2: ejercicion = 87 grupo 3: dietan = 87 grupo 4: ejercicio + dieta | SociodemográficasCircometríaPorcentaje de la diferencia entre extremidadesIMC | 12 meses | No hay diferencias entre grupos en síntomas del linfedema, porcentaje de diferencia entre las extremidades, exacerbaciones del linfedema o celulitisMayor pérdida de peso en el grupo 3 y 4Alta adherencia al ejercicio de fuerza 72% y aeróbico 74% |
| Omar, 202019 | ECA doble ciego | 70 mujeres con linfedema unilateral | Ejercicio de fuerza | n = 35 control, ejercicio sin prenda de compresión (3 días/semana)n = 35 ejercicio con prenda de compresión (3 días/semana) | CircometríaSíntomas de linfedema (EVA 0–10)Goniometría de hombroDASHAdherencia | 8 semSeguimiento hasta las 12 sem | Mejoría significativa del volumen de la extremidad, de los síntomas, de la movilidad del hombro y del DASH en ambos grupos, sin diferencias significativas entre ellosAdherencia al entrenamiento similar, sin diferencias entre grupos |
| Naczk, 202220 | ECA | 24 mujeres tras mastectomía | Ejercicio de fuerza inercial | n = 12 entrenamiento de fuerza inercialn = 12 control | Fuerza (Cyklotren)DASHImpedancia bioeléctrica (Tanita)BIE | 6 sem | Aumento de la fuerza y reducción de la puntuación DASH de forma significativa en el grupo entrenamiento, pero no en el grupo controlSin cambios en el linfedema ni composición corporal en ningún grupo |
| Lin, 202321 | ECA simple ciego | 192 mujeres con cáncer de mama asociado o no a linfedema de extremidad | Ejercicio aeróbico y de fuerza | n = 48 control (ejercicio de movilidad articular) seguimiento un mesn = 48 grupo 1 (ejercicio de movilidad articular 3 veces/día + seguimiento mensual)n = 49 grupo 2 (grupo 1 + ejercicio aeróbico 5 días/semanas)n = 47 grupo 3 (grupo 1 + ejercicio de fuerza 2–3 veces/día) | FACT-BEVA 0-10 de dolorCambio relativo de volumen (fórmula cono truncado) | 6 meses | Mejoría de la calidad de vida y el dolor en todos los grupos.El grupo 3 mostraba mejor calidad de vida a los 6 meses y una reducción más precoz del dolor, y el grupo 2 menos dolor a los 6 meses.Menor incidencia de linfedema en el grupo 2 y 3 |
| Park, 202322 | ECA | 16 mujeres con linfedema sin tratamiento oncológico | Ejercicio de fuerza | n = 8 ejercicio de fuerza con Theraband progresivo + terapia descongestiva compleja (2 días/semana)n = 8 control, ejercicio con Theraband no progresivo + terapia descongestiva compleja (2 días/semana) | CircometríaDinamometría manoDASH(EORTC) QLQ C30 | 6 sem | Mejoría significativa del volumen de la extremidad en cada grupo, mayor en el grupo intervención, pero sin diferencias entre gruposDiferencias significativas de la fuerza y del DASH en cada grupo y entre grupos a favor del grupo intervenciónMejoría de la calidad de vida |
BIE: bioimpedancia espectroscópica; DASH: Disability of the Arm, Shoulder and Hand; DXA: Dual-energy X-ray Absorptiometry; ECA: Estudio Clínico Aleatorizado; EORTC BR23: European Organization for Research and Treatment of Cancer Breast Cancer; EVA: Escala Visual Analógica; FACT-B: Functional Assessment of Cancer Therapy-Breast instrument; IMC: índice de masa corporal; LSIDS: Lymphoedema Symptom Intensity and Distress Survey; Sem: Semanas.
Estudios sobre otros tipos de ejercicios (n = 8)
| Referencia | Diseño | Muestra | Ejercicio | Intervención | Variables | Duración | Resultados |
|---|---|---|---|---|---|---|---|
| Ali, 202123 | ECA simple ciego | 50 mujeres con LSCM | Acuático con mancuernasvs. suelo | n = 25 resistidos aguan = 25 resistidos en suelo1 h 3 veces/semana | CircometríaBA hombroDolor EVA | 8 sem | Mejoría significativa todas las variables en ambos grupos.Diferencias significativas a favor de grupo ejercicio acuático |
| Deacon, 201924 | ECA simple ciego cruzado | 18 mujeres con LSCM | Acuático lento (Aichi) vs. velocidad normal | 1 sesión de 50 minutosPeriodo lavado 1 sem y cruce | VolumetríaBioimpedanciaSatisfacción | 2 sem | Reducción de volumen posintervención en grupo Aichi. No se mantiene a la horaSin diferencias entre grupos en composición corporalAlta satisfacción en ambos grupos |
| Odynets,201925 | ECA | 68 mujeres con LSCM | Pilates vs.Acuático | n = 34 ejercicio acuáticon = 34 pilates1 h 3 veces/semana | CircometríaFuerza con dinamómetroBA hombro | 12 sem | Ambos grupos mejoran la fuerza y BA con respecto a situación basalEjercicio acuático es superior al pilates en BA (p < 0,01)y en el tamaño de linfedema en mano y antebrazo (p < 0,05),Sin diferencias entre grupos en fuerza |
| Şener, 201726 | ECA | 60 mujeres con LSCM | Pilates | n = 30 pilatesn = 30 grupo control | Circometría, BAAnsiedad Social (SAA),Calidad de vida EORTC QLQ-BR23DASH | 8 sem | Mejora significativa en todas las variables respecto a grupo control |
| Odynets 201927 | ECA | 115 mujeres con LSCM | Ejercicio acuáticoPilatesYoga | n = 45 Ejercicio acuáticon = 40 Pilatesn = 30 Yoga1 h 3 veces/sem | Calidad de vida FACT B+4 | 12 meses | Mejora significativa de calidad de vida en todos los grupos |
| Pasyar,201928 | ECA simple ciego | 40 mujeres con LSCM | Yoga | n = 20 yogan = 20 control3 veces/sem | Calidad de vida EORTC QLQ-C30Volumen con circometría | 8 sem | Mejora de calidad de vidasin diferencias en el volumen |
| Bloomquist,202129 | ECA | 78 mujeres intervenidas de cáncer de mama | Fútbol | n = 46 fútboln = 22 control2 veces/semana | Calidad de vida EORTCQLQ-BR23DASHVolumen linfedema calculado por DXABioimpedancia | 12 meses | Sin diferencias significativas a los 12 mesesPráctica segura |
| Ochalek, 201830 | ECA | 45 mujeres con cáncer de mamaAleatorización precirugía | Ejercicios movilidad de hombro, F/E codo y puño | n = 23 manga compresión Cl1 circularn = 22 no compresión15 min/día | Actividad física IPAQCalidad de vida: EORTC QLQ-BR23 y QLQ-C30Volumen linfedema | 12 meses | Grupo compresión menos diferencia volumen brazosin diferencias en calidad de vida ni actividad física.Manga bien tolerada |
BA: Balance articular; DASH: Disability of the Arm, Shoulder, and Hand; DXA: dual-energy X-ray absorptiometry; ECA: Estudio Clínico Aleatorizado; EVA: Escala Visual Analógica; EORTC BR23: European Organization for Research and Treatment of Cancer Breast Cancer; F/E: Flexo extensión, FACT-B: Functional Assessment of Cancer Therapy-Breast instrument; IPAQ: International Physical Activity Questionnaire; SAA: Social Appearance Anxiety Scale; Sem: semanas.
El total de la muestra de los estudios incluidos en la revisión fue de 1.753 participantes. El tamaño de las muestras de los estudios varió entre 16 y 351 pacientes. Ninguno de los artículos incluía pacientes varones.
Los trabajos hacían referencia a diferentes tipos de ejercicio, como el aeróbico, de fuerza, yoga, pilates, acuáticos, estiramientos, ejercicios de miembro superior o actividad física general. El ejercicio de fuerza fue el principal objeto de estudio en 11 artículos, en 7 de ellos en exclusiva, y el resto, incluyendo otros tipos de ejercicio. Un trabajo se centró en el yoga como única intervención, otro en el fútbol y un tercero en el pilates.
Las variables para valorar el linfedema fueron: (a) el volumen (medido por circometría, por desplazamiento de agua, fórmula del cono truncado, por el líquido libre extracelular mediante ecografía, o parámetros de la composición corporal), (b) los síntomas de linfedema (dolor, pesadez, inflamación y tirantez) por la escala EVA (Escala Visual Analógica 0–10), por la Lymphoedema Symptom Intensity and Distress Survey (LSIDS) o subescalas de los cuestionarios de calidad de vida. También se valoró la movilidad del hombro por goniometría, la fuerza de la extremidad por dinamometría o test de repeticiones máximas, y la discapacidad del miembro superior con el cuestionario DASH (Disabilities of the Arm, Shoulder and Hand).
Los cuestionarios de calidad de vida más se utilizados fueron el European Organization for Research and Treatment of Cancer (EORTC) Breast Module -BR23- y QLQ C30.
DiscusiónLas pacientes intervenidas de cáncer de mama, con LSCM o con riesgo de desarrollarlo, deberían seguir las recomendaciones generales de actividad física destinadas a los pacientes oncológicos. En estas pacientes, se ha objetivado una disminución de la actividad y ejercicio físico, en parte debido a los tratamientos adyuvantes, ya que el descenso es mayor cuando precisan quimio y radioterapia, comparado con la cirugía sola o combinada con radioterapia15,31. Como consecuencia, puede aumentar el peso corporal, reducirse la fuerza y la función muscular15.
Componentes y tipos de ejercicioNo hay consenso sobre cuál es el mejor ejercicio, y es llamativa la escasa descripción de los componentes del entrenamiento (FITT: Frecuencia, Intensidad, Tiempo y Tipo)32,33. Por este motivo, se recomienda que sean pautados de forma individualizada por un profesional sanitario y supervisados, al menos en etapas tempranas, en personas no entrenadas o con sobrepeso/obesidad4,32,34–36. Se considera seguro comenzar al mes poscirugía (grado de recomendación A) para no interferir en la cicatrización34. La recomendación general es incluir 6-8 ejercicios implicando los grandes grupos musculares, 2–3 días/semana, a días alternos, para mantener la masa muscular y ósea al año poscirugía2,37,38.
El ejercicio supervisado frente al domiciliario aumenta la adherencia, sobre todo si las pacientes han recibido quimioterapia neoadyuvante, y en aquellas con obesidad o menor fuerza basal16,39.
Ejercicio aeróbico y de fuerzaEn la búsqueda no se encontró ningún artículo sobre el ejercicio aeróbico aislado. Dos de los trabajos estudian la combinación del aeróbico con el de fuerza, uno incluye un entrenamiento multimodal y otros deportes, y otro compara el entrenamiento aeróbico con el de fuerza12,17,18,21. El ejercicio aeróbico más frecuentemente analizado es caminar, seguido de bicicleta estática, remo y cinta de marcha15,17,21.
Bloomquist et al. realizan un entrenamiento multicomponente de alta intensidad, observando resultados equivalentes en la prevalencia de linfedema y en la mejoría de los síntomas (pesadez, tirantez y dolor), pero mayor adherencia y ganancia de fuerza, menor dolor y diferencia de volumen entre brazos, respecto a un grupo control15. Lin et al. observaron que la mejoría de la calidad de vida y la reducción del dolor es más precoz en el entrenamiento de fuerza, aunque la reducción del dolor a largo plazo (mayor que 6 meses) es mayor en el ejercicio aeróbico. Los grupos de ejercicio aeróbico o de fuerza muestran menor incidencia de linfedema respecto a grupos control, con mejores resultados en el grupo de fuerza21.
Aunque no se describe en la totalidad de los artículos qué grupos musculares se trabajan, principalmente incluyen musculatura del hombro; algunos también bíceps, tríceps, musculatura torácica y, con menos frecuencia, miembros inferiores12,15,17,19,20,22. Tres artículos trabajan la fuerza mediante cintas elásticas, 2 con mancuernas, otro solo con máquinas, 2 combinan alguna de estas modalidades y en el resto no está claramente definido14–19,21,22. De forma casi unánime se considera seguro, ya que no aumenta la incidencia o volumen de un linfedema, incluso durante el tratamiento con taxanos12,15,19,21.
Es más controvertido el papel del ejercicio de fuerza como tratamiento para el volumen del linfedema o su prevención. Park et al. observaron descenso del volumen del linfedema en los 2 grupos de ejercicio de fuerza con bandas elásticas asociados a terapia física descongestiva, con mayor reducción en el grupo de entrenamiento progresivo y supervisado respecto al grupo domiciliario y no progresivo22. Sin embargo, Naczk et al. no obtienen mejoría del linfedema establecido comparado con un grupo control20, por lo que parte del beneficio del estudio anterior podría atribuirse al tratamiento del linfedema con técnicas de fisioterapia. Ammitzbøll et al. no pudieron demostrar su efecto preventivo al año de la cirugía de mama13.
El ejercicio de fuerza tiene otros beneficios añadidos en estas pacientes. Se ha documentado una reducción de los síntomas en la extremidad o mama con linfedema, sobre todo del dolor, pesadez, inflamación y tirantez, medido por diferentes escalas, aunque en ocasiones sin diferencias significativas con respecto al grupo control13,17. Aumenta la fuerza y calidad de vida, sobre todo si es supervisado14,19,21,22. Tiene efectos positivos en la salud social y emocional comparado con un grupo control al año poscirugía, y en el subgrupo de mujeres con síntomas de dolor-sueño-fatiga, la mejoría del estado de salud global y función social es significativa14.
La mayoría de los estudios aplican cargas bajas o moderadas, aunque a intensidades altas también ha demostrado ser una práctica fiable y segura en mujeres con LSCM o con alto riesgo de desarrollarlo4,15,32,37,38,40,41. Bloomquist et al. comparan el entrenamiento de alta o baja intensidad en mujeres físicamente inactivas sin LSCM en tratamiento con taxanos, y los resultados a las 24-72 horas fueron similares en relación al líquido extracelular, volumen del brazo y los síntomas de linfedema. A las 72 horas la reducción del líquido extracelular fue mayor en el grupo de entrenamiento de alta intensidad12.
Existe poca literatura sobre el ejercicio excéntrico, pero, al igual que los concéntricos, son seguros y beneficiosos. Naczk et al. observaron que tras la mastectomía el entrenamiento de la musculatura de hombro es bien tolerado, no produce lesiones, mejora de forma significativa la fuerza de los miembros superiores y no produce cambios respecto al linfedema20.
Aunque la mayoría de los estudios no registran efectos adversos, se documentan algunos leves, como exacerbación del dolor en los hombros o las rodillas en mujeres en tratamiento con inhibidores de la aromatasa, u otras lesiones propias del ejercicio12,17,39.
Otros tipos de ejercicioEl ejercicio acuático añade el beneficio de las propiedades físicas de flotabilidad, presión hidrostática y viscosidad, que producen un efecto analgésico y disminuyen el estrés articular. Su efecto sobre el linfedema es beneficioso, mostrando reducciones de volumetría y circometría. Programas de al menos 8 semanas obtienen mejoras en el balance articular del hombro, la fuerza en el miembro superior, el dolor y la calidad de vida23–25,27. Se recomienda que la profundidad del agua llegue a la altura de la clavícula para optimizar el flujo linfático del miembro superior, aunque en 2 de los 4 estudios no se especifica25,27. Lo que no parece tener influencia es la velocidad a la que se realice el ejercicio, o si incluye o no respiraciones abdominodiafragmáticas, aunque las características del estudio son insuficientes para establecer conclusiones24.
La práctica de pilates mejora también la gravedad del linfedema, la discapacidad del miembro superior (escala DASH), la fuerza y la ansiedad. Comparando el ejercicio acuático versus pilates, el ejercicio en el agua se muestra superior en la mejora de la flexión y abducción del hombro (p < 0,1), pero no en la ganancia de fuerza. Odynets et al. obtienen mejoría del linfedema del miembro superior en las 3 mediciones de la extremidad (brazo, antebrazo y mano) para el grupo de ejercicio en el agua (p < 0,001), y solo a nivel proximal con el pilates, con diferencias significativas entre ambos grupos25. El pilates mejora las puntuaciones de calidad de vida FACT-B de forma significativa en otro ensayo clínico, aunque con beneficios menores con respecto al yoga y ejercicio acuático42. También mejora la circometría, el balance articular y la discapacidad de miembro superior, la calidad de vida y la ansiedad respecto a un grupo control26.
El yoga también es seguro y eficaz entre las mujeres con cáncer de mama, con o sin linfedema. Su interés se centra en la mejora de la calidad de vida, la función física, emocional y cognitiva, así como la disminución del dolor, la fatiga y el insomnio. En mujeres con linfedema, Pasyar et al. objetivan superioridad del yoga (4 u 8 semanas) respecto a un grupo control en los aspectos físicos, emocionales y cognitivos; sin embargo, no observaron diferencias significativas en el volumen del linfedema28.
La búsqueda incluye un estudio aleatorizado sobre el entrenamiento de fútbol en mujeres que han finalizado el tratamiento agudo del cáncer de mama, concluyendo que es seguro y fiable29. A pesar de los riesgos por ser un deporte de contacto, no se observa incremento en la prevalencia del linfedema ni de los síntomas en el brazo respecto al grupo control.
Uso de prendas de compresión en el ejercicioEl uso de la prenda de compresión durante la práctica del ejercicio físico en mujeres con linfedema o con riesgo de desarrollarlo tras un cáncer de mama es considerado una buena práctica por la guía de la APTA (grado de recomendación B).
Sin embargo, existen escasos trabajos que investiguen la función de la prenda durante el ejercicio; muchas veces no está reflejada esta información y, aunque parece que produce beneficios asociados, no se pueden extraer conclusiones definitivas19,30,35. En el estudio de Omar et al., el uso de la manga de compresión no parece influir en la adherencia al ejercicio de fuerza ni en los beneficios que este obtiene sobre el volumen del linfedema, sus síntomas, la movilidad del hombro y la puntuación del cuestionario DASH. Más del 90% de las pacientes tenían una alta adherencia a la manga, siendo pocas las que referían incomodidad o intolerancia19.
Ochalek et al. publican 3 trabajos utilizando la misma muestra30,43,44. No observan diferencias en la cantidad de actividad física (vigorosa, moderada o caminar) realizada por las pacientes con o sin manga de compresión circular tras un año de seguimiento. Concluyen que una manga de baja compresión (clase 1) es bien tolerada y no reduce la cantidad de actividad física ni la calidad de vida44. En el seguimiento a 2 años no obtienen menor incidencia de linfedema, pero sí de los síntomas asociados43.
Dolor y limitación de la movilidad del hombroEl dolor y la alteración de la movilidad del hombro tienen una prevalencia de más del 60% tras los tratamientos de cáncer de mama y puede perdurar en el tiempo45.
El ejercicio de fuerza de baja intensidad mejora la movilidad del hombro y la puntuación del DASH19. En el trabajo de Naczk mejoran, específicamente, los ítems de dificultad para dormir debido al dolor, la capacidad de llevar una maleta o bolsa de la compra, transportar un objeto pesado o lavarse la espalda20. El ejercicio en el agua también mejora la movilidad del hombro23–25.
En cuanto a los cordones axilares (síndrome de red axilar), que en ocasiones limitan la movilidad del hombro tras la cirugía, no se ha encontrado ningún artículo que haga referencia al efecto del ejercicio físico.
Hay varias limitaciones en este trabajo que influyen en la capacidad de generalizar los resultados. La principal es inherente al tipo de estudio, al tratarse de una revisión narrativa. Por otro lado, la mayoría de los trabajos tienen muestras menores de 100 pacientes y carecen de seguimiento a largo plazo. La falta de información sobre la definición, medición y estadio del linfedema de las pacientes que participan, y la heterogeneidad de los estudios en relación con los protocolos de ejercicio y los tratamientos oncológicos, obliga a interpretar con precaución los resultados publicados.
ConclusionesTras la revisión realizada, se puede concluir que el ejercicio físico supervisado, pautado de forma individualizada, es una práctica segura y beneficiosa en todas las fases de tratamiento del cáncer de mama. No hay razones para limitar la actividad física de las pacientes intervenidas de cáncer de mama, ya que no aumenta el riesgo de desarrollar ni empeorar el linfedema y mejora los síntomas asociados al mismo.
Hay que tener en cuenta que el ejercicio físico también mejora otros efectos adversos del tratamiento oncológico, como la calidad de vida, el dolor, la movilidad y la función del hombro. No hay resultados concluyentes sobre el uso o no de la prenda de compresión durante la práctica del ejercicio.
El ejercicio de fuerza es el más estudiado y se ha considerado seguro, pero hay otras modalidades a tener en cuenta que podrían adaptarse mejor a la condición física y preferencias de cada paciente y así aumentar la adherencia. En un futuro, creemos que sería interesante investigar el papel del ejercicio sobre otras opciones terapéuticas del linfedema como las técnicas de microcirugía.
Responsabilidades éticasEl trabajo es una revisión bibliográfica que no ha comportado experimentación en animales ni sujetos humanos por lo que no precisa consentimiento informado de pacientes ni aprobación específica por Comité Ético de Investigación Clínica. El trabajo respeta todos los derechos de privacidad de los sujetos humanos de acuerdo a la Declaración Helsinki.
FinanciaciónEl presente trabajo no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores confirman que no tienen conflictos de intereses.