Evaluar las mastectomías reductoras de riesgo realizadas y analizar las indicaciones y resultados según las características individuales, oncológicas y quirúrgicas de nuestras pacientes.
MétodosEstudio observacional retrospectivo de todas las mastectomías con reconstrucción inmediata en mamas sanas realizadas desde 2013 a 2019. Se dividieron las pacientes en tres grupos: I) riesgo genético de cáncer de mama, II) cáncer de mama diagnosticado y III) antecedente de cáncer de mama.
ResultadosSe realizaron 56 mastectomías reductoras de riesgo a 46 pacientes, 15% grupo I, 50% grupo II y 35% grupo III, pero tras estudios diferidos, 20 pacientes (43%) presentaban mutación genética. La media de edad en este subgrupo fue de 40 años y con predominio de tumores HER2+ (40% frente al 12%, p=0,164). En el grupo III observamos más complicaciones inmediatas (31%, p=0,014) y tardías (69%, p=0,027) relacionadas con la reconstrucción protésica, y más evidente en mamas que tuvieron enfermedad (73% frente al 39% sanas, p=0,002). Se encontró relación entre contractura capsular y la radioterapia postoperatoria (p=0,008) y entre necrosis y radioterapia preoperatoria (p=0,001). Se reintervino al 7% por complicaciones en mastectomías profilácticas. No hemos tenido recidivas locales.
ConclusionesConsideramos justificada la mastectomía reductora de riesgo realizada a mujeres jóvenes con mutación genética y a pacientes con cáncer precoz, HER2+ y riesgo familiar. En pacientes ya tratadas por cáncer, el riesgo de complicaciones supera el valor profiláctico de la técnica. La reconstrucción mamaria es la principal responsable de complicaciones postoperatorias y las pacientes deben ser plenamente conscientes de ello.
To evaluate the risk-reducing mastectomies performed and to analyse the indications and results according to the individual, oncological and surgical characteristics of our patients.
MethodsRetrospective observational study of all mastectomies with immediate reconstruction in healthy breasts performed from 2013 to 2019. The patients were divided into three groups: I) genetic risk of breast cancer, II) diagnosed breast cancer and III) history of cancer breast.
ResultsA total of 56 risk-reducing mastectomies were performed in 46 patients, 15% in group I, 50% in group II and 35% in group III. After deferred studies, 20 (43%) patients had a genetic mutation. This subgroup had an average age of 40 years and a predominance of HER2+ tumours (40% versus 12%, p=0.164). In group III, we observed more immediate (31%, p=0.014) and late (69%, p=0.027) complications related to prosthetic reconstruction, which were more evident in breasts with disease (73% versus 39% healthy, p=0.002). A relationship was found between capsular contracture and postoperative radiotherapy (p=0.008) and between necrosis and preoperative radiotherapy (p=0.001). Reoperation was required in 7% for complications of prophylactic mastectomies. There were no local relapses.
ConclusionsWe consider risk-reducing mastectomy to be justified in young women with a genetic mutation and in patients with early cancer, HER2+ and family risk. In patients already treated for cancer, the risk of complications exceeds the prophylactic value of the technique. Breast reconstruction is primarily responsible for postoperative complications and patients should be fully aware of this.
En una sociedad donde se sobrevalora la imagen corporal, donde se impone el tratamiento conservador del cáncer de mama con cifras globales de supervivencia satisfactorias, llama la atención el aumento constante de mastectomías solicitadas por mujeres sin enfermedad.
Hay tres situaciones fundamentales por las que una mujer solicita la resección de una mama sana: 1) alto riesgo de padecer cáncer de mama, especialmente en pacientes con test genético positivo o alta carga familiar; 2) padecer cáncer de mama, como parte del tratamiento en la mama contralateral; y 3) haber padecido cáncer de mama, para evitar repetir el proceso.
En pacientes con mutación BRCA el riesgo de cáncer de mama es del 45-80% a lo largo de la vida, y de hasta un 83% el de padecer cáncer de mama contralateral (CMC), riesgo que se incrementa un 3% anual1,2. La mastectomía bilateral reductora de riesgo (MBRR) en portadoras sanas ha demostrado una disminución en la incidencia de cáncer del 95-99% y un aumento de supervivencia a largo plazo en muchos de los estudios al respecto3, siendo aceptada por la mayoría de las guías clínicas como una opción válida para mujeres jóvenes en esta situación4,5.
En el cáncer esporádico, por el contrario, la mastectomía contralateral reductora de riesgo (MCRR) ha demostrado escaso valor, sin haberse observado beneficio en la supervivencia en revisiones sistemáticas3,6, o como mucho una discreta mejoría inferior al 1% a los 20 años de seguimiento7. El pronóstico depende fundamentalmente del tipo y estadio del tumor primario, más que el de una segunda neoplasia. Si consideramos además que los tratamientos complementarios como la hormonoterapia reducen la incidencia de CMC y que el diagnóstico precoz fruto del seguimiento de estas pacientes mejora el pronóstico de las recaídas, no parece aceptable revisando la literatura indicar MCRR como parte del tratamiento del cáncer de mama no hereditario6–8.
A pesar de la evidencia existe consenso en que la indicación de la mastectomía reductora de riesgo (MRR) debe ser individualizada en función de las características de cada paciente, sin olvidar que el CMC es el tumor más frecuente en supervivientes de cáncer de mama, supone el 30-50% de segundos cánceres y aunque el riesgo se incrementa solamente un 0,3-1% anual, llega a duplicar el de la población normal a los 10 años8. Parece coherente que una paciente que ha pasado por un proceso diagnóstico y terapéutico duro esté dispuesta a sacrificar su imagen corporal y asumir complicaciones quirúrgicas para evitar repetirlo.
El objetivo de este trabajo es comprobar cuántas de nuestras pacientes se beneficiaron realmente de la técnica según las evidencias, y evaluar los resultados según las diferentes indicaciones de la MRR.
Material y métodoSe realizó un estudio observacional retrospectivo recogiendo los datos individuales, oncológicos y quirúrgicos de todas las MRR (tanto MBRR como MCRR) con reconstrucción inmediata en mamas consideradas sanas. Se incluyeron todas las realizadas por el mismo equipo de la Unidad de Patología Mamaria de Cirugía General de forma consecutiva en los últimos 7 años (2013-2019). Se excluyeron las pacientes con mastectomías realizadas solo con intención terapéutica, las realizadas por complicaciones de patología benigna (diabetes, fístulas crónicas) y las que no iban acompañadas de reconstrucción inmediata.
En función de las indicaciones primarias, se dividió a las pacientes en tres grupos; grupo I: pacientes sanas con riesgo familiar o genético sometidas a MBRR; grupo II: pacientes con cáncer de mama unilateral (mama enferma) que se someten a MCRR (mama sana) en el mismo acto quirúrgico que la mastectomía terapéutica; y grupo III: pacientes con antecedentes de cáncer de mama ya tratado o lesiones histológicas de riesgo, que se someten de forma diferida a cirugía de la mama sana (MCRR) o también de la mama previamente enferma tratada con cirugía conservadora (MBRR).
Se consideraron primarias las indicaciones que condicionaron la mastectomía, pero se recogieron también las causas definitivas que justificaron esta cirugía tras resultados diferidos de pruebas genéticas o análisis histológico de la pieza.
Se recogieron las complicaciones quirúrgicas a corto plazo y las complicaciones oncológicas y secuelas estéticas a largo plazo, y se compararon entre los tres grupos. También se compararon las complicaciones quirúrgicas de las mastectomías terapéuticas con las de las mastectomías profilácticas en las mismas pacientes (en los grupos II y III).
Se consideraron complicaciones a corto plazo todos los eventos producidos en el plazo de un mes tras la cirugía que obligaron a revisión quirúrgica, tratamiento antibiótico o reingreso de la paciente. Las complicaciones a largo plazo, es decir, recogidas pasado un mes y durante el periodo de estudio, se centraron en la evolución oncológica y secuelas estéticas tardías de las mamas operadas.
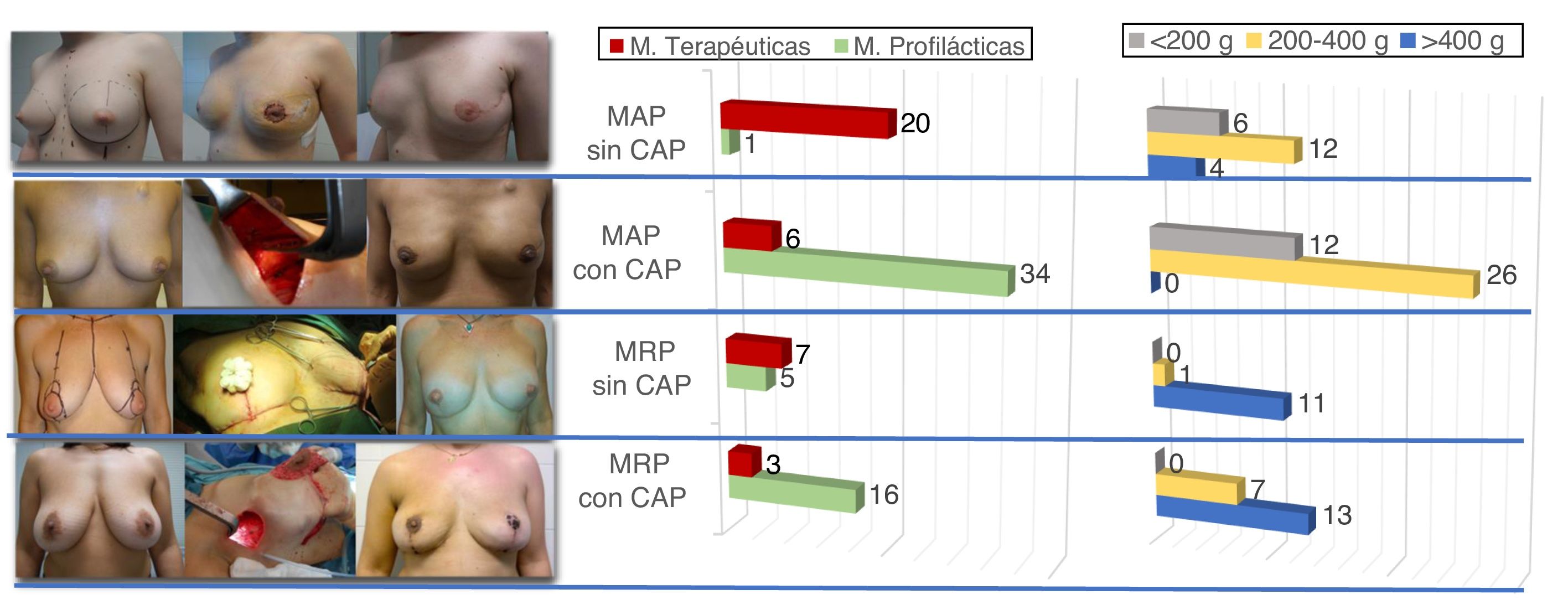
Técnicamente se realizaron tres tipos de mastectomías: mastectomía ahorradora de piel (MAP), mastectomías ahorradoras de piel y complejo aréola-pezón (MAPC), y mastectomías reductoras de piel (MRP) (técnica de Spira) con o sin conservación del CAP (complejo aréola-pezón) (fig. 1). Los criterios para la elección de la técnica se basaron en el volumen y conformación de las mamas, en el deseo de la paciente de aumentar o no su tamaño original, y en la técnica indicada en la mama contralateral enferma.
Las reconstrucciones inmediatas se llevaron a cabo con prótesis directas de gel de silicona, texturizadas o microtexturizadas de 4 compañías farmacéuticas diferentes, o con prótesis-expansor tipo Becker. Se colocaron retromusculares o premusculares con apoyo de la fascia superficialis o colgajo dérmico de la propia paciente (en la técnica de Spira) o bien con mallas biológicas o de polipropileno,
Análisis estadísticoSe realizó un análisis descriptivo de las variables a estudio. Las de tipo cualitativo se miden en frecuencias relativas y absolutas, y para hallar diferencias significativas entre los tres grupos se emplearon la Chi-cuadrado de Pearson. Para las variables cuantitativas se usó el test de Student. Un valor de p≤0,05 se consideró diferencia estadísticamente significativa. El análisis fue realizado con el programa estadístico SPSS® 22.0 para Windows.
ResultadosDesde enero de 2013 hasta diciembre de 2019, se operaron por cáncer de mama en nuestro Servicio un total de 1.190 pacientes. Se realizaron 56 MRR (10 MBRR y 36 MCRR) a 46 pacientes de entre 26 y 63 años (media 43,3). Esto supone el 31% de las 183 mastectomías con reconstrucción inmediata (RI) y el 13% del total de las 412 mastectomías realizadas en este periodo.
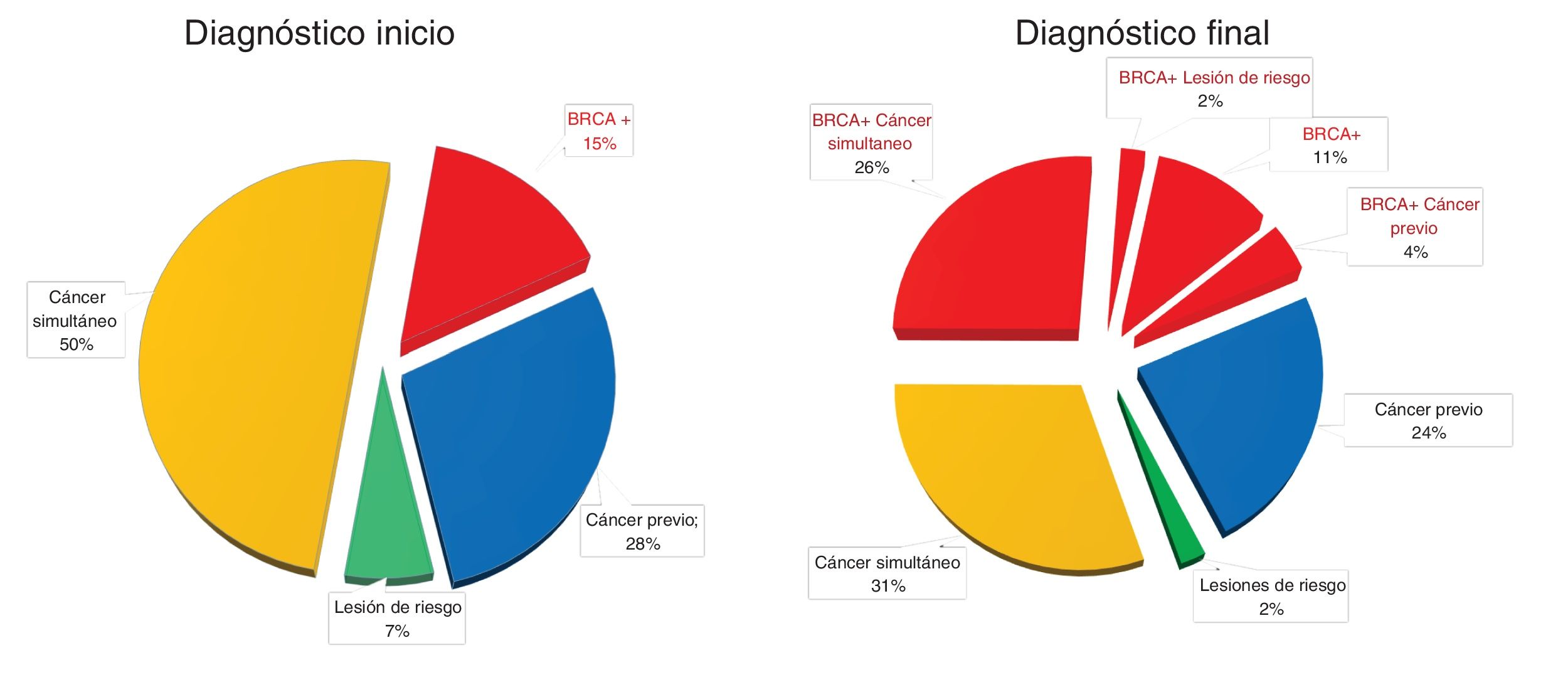
Se operaron 7 pacientes del grupo I (15%), 23 del grupo II (50%) y 16 del grupo III (35%). Sin embargo, las indicaciones por las que se formaron los grupos cambiaron tras el estudio patológico de la pieza y las pruebas genéticas practicadas a posteriori: a 2 pacientes del grupo I y a una del grupo III se diagnosticó un cáncer infiltrante en la pieza, mientras que 10 pacientes del grupo II y 3 del III demostraron mutación genética tras el tratamiento. A todas estas pacientes se les denomina para el estudio comparativo como grupo mixto. Las características clínicas, oncológicas y quirúrgicas de todas ellas se recogen en la tabla 1.
Características clínicas y patológicas de las pacientes con mastectomía reductora de riesgo
| Características clínico-patológicas | Grupo IRiesgo genético n=5 | Grupo IICáncer simultáneo n=14 | Grupo IIICáncer previo n=12 | MixtoCáncer+R. genéticon=15 | Total n=46 |
|---|---|---|---|---|---|
| Edad | 45,5 (37-61) | 44,8 (29-63) | 44 (30-60) | 40,5 (26-61) | 43,3 (26-63) |
| Antecedentes familiares | 5 (100%) | 8 (53%) | 4 (33%) | 7 (50%) | 24 (52%) |
| Tabaco | 0 (0%) | 1 (7%) | 5 (42%) | 1 (7%) | 7 (15%) |
| Comorbilidad | 0 (0%) | 0 (0%) | 1 (8%) | 1 (7%) | 2 (4%) |
| Peso mama | |||||
| <200g | 1 (20%) | 3 (21%) | 3 (25%) | 2 (13%) | 9 (20%) |
| 200-400g | 3 (60%) | 6 (43%) | 7 (58%) | 6 (40%) | 23 (50%) |
| >400g | 1 (20%) | 5 (36%) | 2 (17%) | 7 (47%) | 11 (30%) |
| IHQ | |||||
| In situ | 0 (0%) | 2 (17%) | 2 (13%) | 4 (10%) | |
| Luminal | 8 (57%) | 7 (58%) | 5 (33%) | 20 (49%) | |
| HER2+ | 2 (14%) | 1 (8%) | 6 (40%) | 9 (22%) | |
| TN | 4 (29%) | 1 (8%) | 2 (13%) | 7 (17%) | |
| TNM | |||||
| Estadio 0 | 0 (0%) | 1 (8%) | 2 (13%) | 3 (7%) | |
| Estadio I | 3 (21%) | 4 (33%) | 3 (20%) | 10 (24%) | |
| Estadio IIA | 9 (64%) | 5 (42%) | 7 (47%) | 21 (51%) | |
| Estadio IIB | 0 (0%) | 1 (8%) | 3 (20%) | 4 (10%) | |
| Estadio III | 2 (14%) | 0 (0%) | 0 (0%) | 2 (5%) | |
| QT | |||||
| QTNA | 8 (57%) | 1 (8%) | 7 (47%) | 16 (40%) | |
| QTA | 3 (21%) | 3 (25%) | 2 (13%) | 8 (20%) | |
| RT | |||||
| Precirugía | 1 (7%) | 3 (25%) | 1 (7%) | 5 (12%) | |
Las técnicas practicadas en las 56 mastectomías realizadas con intención profiláctica fueron: 1 MAP (en este caso con reconstrucción inmediata del CAP mediante autoinjerto), 34 MAPC, con incisiones por surco submamario relacionadas con peso estimado de mama inferior a 200g (32%) o periareolar extendido entre 200 y 400g (65%), y 21 MRP con patrón de reducción de Wise, en un 85% relacionadas con mamas de peso superior a 400g.
Las técnicas variaron en el caso de las mamas con cáncer: de las 36 mastectomías realizadas por este motivo en las pacientes del estudio, solo se conservaron 9 CAP frente a los 50 incluidos en las MRR (fig. 1), pero a cambio hubo mayor proporción de reconstrucción inmediata del CAP con autoinjerto o colgajo local (12 frente a 5 de las profilácticas). A todos se les realizó análisis intraoperatorio de tejido retroareolar.
A 42 pacientes (91%) se les reconstruyó de forma inmediata con prótesis directa, 37 sin utilización de mallas y 5 con malla (una premuscular); a 3 pacientes (7%) se les puso una prótesis/expansora tipo Becker y a una paciente ambas opciones. No se realizaron colgajos miocutáneos en las reconstrucciones inmediatas de mamas sanas (fig. 2).
Las complicaciones inmediatas y tardías y las diferencias entre los tres grupos se recogen en la tabla 2. Las diferencias entre las complicaciones registradas en las mastectomías realizadas con intención profiláctica en mama sana y las realizadas en mamas con cáncer o antecedente de cáncer de las pacientes estudiadas, así como la relación con la radioterapia recibida por estas últimas se recogen en la tabla 3. Se encontraron diferencias estadísticamente significativas por mayor índice de complicaciones inmediatas (hematoma) y complicaciones tardías (asimetrías) de las pacientes del grupo III. Así mismo, se encontró asociación estadística entre la contractura capsular a largo plazo y la radioterapia postoperatoria (p=0,008) y relación entre la necrosis del CAP y pérdida protésica con la radioterapia recibida antes de la cirugía (p=0,001).
Complicaciones de las mastectomías reductoras de riesgo según los grupos de pacientes
| Complicaciones | Grupo I n=7 | Grupo II n=23 | Grupo III n=16 | Total(pacientes)n=46 | p |
|---|---|---|---|---|---|
| Complicaciones inmediatas | |||||
| Hematoma | 0 (0%) | 0 (0%) | 3 (19%) | 3 (6,5%) | 0,049 |
| Seroma | 1 14%) | 0 (0%) | 0 (0%) | 1 (2%) | 0,152 |
| Isquemia | 0 (0%) | 4 (17%) | 0 (0%) | 4 (9%) | 0,146 |
| Necrosis | 0 (%) | 3(13%) | 0 (0%) | 3 (6,5%) | 0,201 |
| Infección | 0 (0%) | 0 (0%) | 2 (12,5%) | 2 (4%) | 0,141 |
| Complicaciones tardías | |||||
| Asimetría | 0 (0%) | 4 (9%) | 9 (20%) | 13 (28%) | 0,005 |
| Malposición | 0 (0%) | 1 (2%) | 1 (2%) | 2 (4%) | 0,796 |
| Dolor | 1 (2%) | 0 (0%) | 0 (0%) | 1 (2%) | 0,152 |
| Ripling | 1 (2%) | 1 (2%) | 1 (2%) | 3 6%) | 0,733 |
| Reintervención (recambio/complicaciones) | 1 (2%) | 6 (13%) | 2 (4%) | 8 (17%) | 0,039 |
| Oncológicas | |||||
| Recaída local | 0 (0%) | 0 (0% | 0 (0%) | 0 (%) | |
| Recaída a distancia | 0 (0%) | 1 (2%) | 1 (2%) | 2 4%) | 0,806 |
| Fallecimiento | 0 (0%) | 1 (2%) | 0 (0%) | 1 (2%) | 0,613 |
Grupo I: riesgo genético. Grupo II: cáncer de mama contralateral. Grupo III: antecedente de cáncer de mama o lesiones de riesgo.
En negrita, los valores estadísticamente significativos (p<0,05).
Complicaciones de mastectomías reductoras de riesgo y terapéuticas o tratadas. Relación con la radioterapia
| MRR (n=56) | M. Terapéuticas | Total | p | |||
|---|---|---|---|---|---|---|
| No RTP n=15 | RTP Pre- n=5 | RTP Post- n=19 | n=39 | |||
| Hematoma | 3 (5%) | 2 (5%) | 0 (0%) | 1 (2,5%) | 3 (8%) | 0,571 |
| Seroma | 2 (3,5%) | 1 (2,5%) | 0 (0%) | 1 (2,5%) | 2 (5%) | 0,853 |
| Isquemia | 4 (7%) | 1 (2,5%) | 0 (0%) | 0 (0%) | 1 (2,5%) | 0,463 |
| Necrosis | 3 (5%) | 0 (0%) | 1 (2,5%) | 0 (0%) | 1 (2,5%) | 0,028 |
| Infección | 2 (3,5%) | 0 (0%) | 1 (2,5%) | 1 (2,5%) | 2 (5%) | 0,201 |
| Celulitis | 0 (0%) | 1 (2,5%) | 0 (0%) | 0 (0%) | 1 (2,5%) | 0,463 |
| Malposición | 3 (5%) | 1 (2,5%) | 0 (0%) | 1 (2,5%) | 2 (5%) | 0,853 |
| Capsulitis | 0 (0%) | 1 (2,5%) | 3 (8%) | 10 (26%) | 14 (36%) | 0,008 |
| Dolor | 1 (2%) | 0 (0%) | 0 (0%) | 1 (2,5%) | 1 (2,5%) | 0,567 |
| Ripling | 4 (7%) | 1 (2,5% | 0 (0%) | 0 (0%) | 1 (2,5%) | 0,463 |
| Extrusión | 0 (0%) | 0 (0%) | 2 (5%) | 0 (0%) | 2 (5%) | 0,001 |
| Reoperaciones | 8 (14%) | 1 (2,5%) | 2 (5%) | 8 (20,5%) | 11 (28%) | 0,201 |
En negrita, los valores estadísticamente significativos (p<0,05).
Los factores que más influyen en el aumento progresivo de MRR realizadas son la sobrevaloración del riesgo del cáncer de mama y la generalización de las técnicas de reconstrucción mamaria inmediata8,9. También contribuye el deseo de evitar los controles para seguimiento de mamas complicadas, e incluso el deseo de simetrizar mama operada por cáncer9–11.
La MBRR solo ha demostrado ser efectiva en las pacientes con mutación BRCA 1/2, tanto para reducir la incidencia como la mortalidad por cáncer3 (grupo I). De hecho, la alta incidencia se pudo constatar al comprobar la presencia de cáncer no esperado en el 28,6% de las mamas operadas con estas características. Sin embargo, en nuestra experiencia es el grupo con menos casos, y al igual que sucede en grandes instituciones, representó solo una minoría de las indicaciones de MRR12. Si añadimos las pacientes con cáncer de mama primario y diagnóstico diferido de mutación genética (grupo mixto), se eleva el cómputo final de pacientes operadas con riesgo genético de las 7 iniciales (15%) a 20 definitivas (43%) (tabla 2). Este grupo mixto también se beneficia de la MCRR, pues aunque no haya suficientes evidencias de que mejore la supervivencia, con la técnica se reduce aproximadamente un 94% el riesgo que tienen estas pacientes de padecer un segundo cáncer, que se estima del 22% a los 10 años (frente al 5% en las pacientes no portadoras de mutación)3,6,8,13. Se puede sospechar mutación genética en pacientes con cáncer primario y un determinado perfil, que según Beck et al. serían las diagnosticadas a edades jóvenes (<45 años), con fuerte historia familiar y con tumores receptores hormonales negativos, lo que coincide con un mayor riesgo estimado de CMC14–16. No sorprende por tanto el diagnóstico de mutación BRCA en el 39% de las pacientes del grupo II y el 19% de las del grupo III que conforman el grupo mixto, ya que su media de edad fue de 40 años, inferior a la media global ya de por sí joven de las pacientes de nuestra serie (43,3 años), y presentaban mayor proporción de tumores HER2 que el resto (40% frente al 12%), aunque sin significación estadística (p=0,164). Aunque son pocos casos, los resultados evidencian un riesgo genético mayor del esperado y en pacientes con otros factores que se asocian a un mayor riesgo de desarrollar CMC, lo que justificaría la MCRR.
Otra cuestión es cuando solicitan MCRR las pacientes sin riesgo familiar con cáncer de mama (grupo II) o con cáncer de mama ya operado (grupo III), que son mayoría en este estudio (57%). En estas pacientes se cuestiona la cirugía agresiva, primero porque la supervivencia viene marcada por las características del tumor primario que en muchas ocasiones excede el riesgo del cáncer que se pretende evitar4: en la serie solo 2 pacientes (diagnosticadas en estadio II) desarrollaron metástasis a distancia en el periodo del estudio; segundo, porque la MCRR añade morbilidad en una de cada 8 pacientes en el mejor de los casos17, e incluso algunos estudios predicen 1,5 más posibilidades de complicaciones respecto a las que se someten a una mastectomía unilateral terapéutica no profiláctica18, lo que puede retrasar los tratamientos complementarios. En nuestra experiencia hubo 12 (31%) complicaciones inmediatas relacionadas con la MCRR en ambos grupos, con 4 reintervenciones (7%), cifras similares a las publicadas por Eck et al.17 (27% y 10% de reintervenciones), pero que no retrasaron los tratamientos adyuvantes. Y tercero, porque el deseo de estas pacientes de acabar con la preocupación se frustra cuando se precisan reingresos, recambios o reintervenciones muchas veces dirigidas a mejorar su deteriorada imagen corporal. En este sentido parece tener gran importancia el hecho de la reconstrucción inmediata que reclaman las pacientes.
En la reciente revisión Cochrane se han publicado complicaciones del 20-49% y con una tasa de reintervenciones que van del 64% al 4% según se realicen o no reconstrucciones3. Por un lado, influye la técnica de mastectomía destinada a facilitar la reconstrucción, ya que en las complicaciones inmediatas predominaron los trastornos circulatorios por los finos colgajos cutáneos que se dejan en las MAPC, entre ellas 4 isquemias de piel autolimitadas y 3 necrosis del CAP. Este evento es el único más frecuentemente observado en mama sana que en mama enferma (12,5% frente al 5%, respectivamente, p=0,028), y es debido a la conservación límite del CAP en las MRR frente al autoinjerto rutinario en las mastectomías terapéuticas. Por otro lado, todas las complicaciones tardías o secuelas estéticas se relacionaron con las prótesis (34%), fundamentalmente asimetrías (13) y desplazamientos (2), pero en este caso las complicaciones fueron más frecuentes en las mastectomías terapéuticas (52%) al relacionarse significativamente con los tratamientos complementarios recibidos (el 54% de las pacientes con radioterapia desarrollaron capsulitis, p=0,008)). Los seromas se relacionaron con las pocas mallas colocadas, pero solo un caso requirió punción evacuadora. En nuestra experiencia se efectuaron reintervenciones y recambios en el 39% de las pacientes, pero solo un 14% achacado a complicaciones y secuelas de las MRR (28% por mastectomías terapéuticas).
Si comparamos específicamente los grupos, las pacientes del grupo III presentaron en nuestra experiencia mayor tasa de complicaciones y secuelas estéticas que las del grupo II (p=0,027), y mucho más llamativo al comparar las mamas sanas con las mamas que tuvieron enfermedad (39-73%, p=0,002) porque se manejan mamas ya tratadas, lo que coincide con las conclusiones del trabajo de Allué et al.19. La única extrusión protésica secundaria a isquemia grave se produjo en la única paciente con recidiva de cáncer y en mama previamente radiada. Se ofreció reconstrucción inmediata protésica a todas las mastectomías con intención profiláctica, y reconstrucción diferida con colgajo autólogo a mastectomías terapéuticas en las que se preveía radioterapia, pero esta opción fue rechazada por todas las pacientes del estudio. Consecuentemente, 10 de las 19 mamas reconstruidas que recibieron radioterapia desarrollaron capsulitis, pero a pesar de la exhaustiva información recibida, ninguna paciente deseaba pasar por un periodo de amputación.
Por tanto, si tenemos en cuenta los modelos actuales de riesgo del CMC14–16, y los resultados registrados en el presente estudio, podemos concluir que solo el 43% de las pacientes operadas se beneficiaron de la MRR. Si discriminamos por grupos, las pacientes con lesiones de riesgo o antecedentes de cáncer de mama (grupo III) serían las menos beneficiadas de la cirugía por la mayor tasa de complicaciones. Aunque todas nuestras enfermas han sido informadas de estos riesgos, no hemos tenido recidivas locales, y el antecedente de cáncer, mayoritario en nuestras indicaciones, fue suficiente motivación para preferir la cirugía a la posibilidad remota de repetir la experiencia. Los resultados clínicos los consideramos aceptables, y los estéticos fueron mejores en las pacientes sanas, pues la radioterapia y la mama contralateral reconstruida condicionaron más asimetrías y capsulitis. Como el tiempo de seguimiento no es muy largo en algunas pacientes, las complicaciones tardías de tipo estético pueden condicionar mayor tasa de revisiones quirúrgicas que las registradas.
Sin embargo, esta es una decisión muy personal de las pacientes, y mientras no existan estudios prospectivos que determinen el riesgo exacto en cada caso, coincidimos con Soran et al.9 en que la MRR ofrece a las pacientes suficientes beneficios psicológicos, cosméticos y posiblemente oncológicos como para mantener la indicación a las pacientes bien informadas que la solicitan.
ConclusionesConsiderando la relación riesgo/beneficio de las MRR realizadas, podemos mantener la indicación en mujeres jóvenes con mutación genética conocida. También estaría justificada en aquellas pacientes con riesgo de CMC bien informadas que la soliciten, y en especial aquellas con cáncer en estadio temprano, jóvenes, HER+ y con alta carga familiar, en las que el riesgo genético es mayor que el esperado. En las pacientes ya tratadas por cáncer de mama, el riesgo de complicaciones y malos resultados estéticos supera el valor profiláctico de la técnica.
La reconstrucción mamaria es la principal responsable de complicaciones postoperatorias y las pacientes deben ser plenamente conscientes de ello.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Consideraciones éticasEn este trabajo no aparecen datos identificativos de los pacientes, se han seguido todos los protocolos del centro sanitario para la obtención de datos de las historias clínicas y se han obtenido los correspondientes consentimientos informados de cada uno de los pacientes incluidos en este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
La información del manuscrito fue presentada parcialmente en forma de poster en la I Reunión Ibérica de Cirugía Mamaria, Oporto-Portugal (10-18 de mayo 2018), con el título «Nuestra Experiencia en Mastectomía Reductora de Riesgo».