La pandemia por el nuevo coronavirus (SARS-CoV-2) ha puesto a prueba los sistemas de salud de todo el mundo, de una forma tan apremiante que no se veía hace muchos años. Las implicaciones en la atención en salud no afectan únicamente a los pacientes con la COVID-19, sino que son transversales a todas las enfermedades. Específicamente en cáncer de mama, los esquemas de radioterapia hipofraccionada constituyen una alternativa válida y segura que ayuda a disminuir la exposición de las pacientes al nuevo virus, la congestión de las instituciones de salud y los costos propios de los tratamientos oncológicos especializados. En este artículo, se realizó una revisión de la literatura más relevante sobre los regímenes acortados de radioterapia en cáncer de mama: hipofraccionamiento e hipofraccionamiento extremo, y sobre su equivalencia con el fraccionamiento estándar. Al final, se destacan las recomendaciones de diferentes sociedades científicas y expertos internacionales, para considerar esquemas de radioterapia hipofraccionados, a propósito de la contingencia de salud mundial.
The current pandemic due to the new coronavirus (SARS-CoV-2) has put health systems around the world to the test, in a way so urgent that had not been seen in several years. The implications in health care not only affect patients with COVID-19, but they are transversal to all pathologies. Specifically in breast cancer, hypofractionated radiotherapy schemes constitute a valid and safe alternative that helps reduce the exposure of patients to the new virus, the congestion of health institutions and the costs of specialized cancer treatments. In this article, we conducted a review of the most relevant literature on shortened radiotherapy regimens in breast cancer: hypofractionation and extreme hypofractionation, and their equivalence with fractionation. In the end, the recommendations of different scientific societies and international experts are highlighted, to consider hypofractionated radiotherapy schemes, regarding the global health contingency.
El cáncer de mama es el cáncer más frecuentemente diagnosticado en mujeres a nivel mundial. En el 2020 representó el 24,5% (2.261.419) de todos los nuevos casos. Según GLOBOCAN, para Colombia la incidencia y la mortalidad están calculadas en 48,3 y 13,1 por cada 100 mil mujeres, respectivamente1. El manejo estándar del cáncer de mama incluye un abordaje multidisciplinario desde la cirugía de mama, la oncología clínica y la oncología radioterápica2. No obstante, dependiendo de las características clínico-patológicas de la paciente y el tumor, puede ser necesario involucrar otras especialidades3.
La radioterapia (RT) se considera uno de los pilares del tratamiento en el cáncer de mama, su objetivo en la adyuvancia es eliminar la enfermedad subclínica residual tras la cirugía oncológica óptima4. Esta modalidad terapéutica ha demostrado no solo disminuir de forma significativa el riesgo de recurrencia local (RL), sino también la mortalidad específica por cáncer de mama2, lo cual es cierto tanto en las pacientes que reciben una cirugía conservadora como la mastectomía5–7 (tabla 1).
Impacto de la radioterapia en las pacientes con cáncer de mama tratadas con cirugía conservadora o mastectomía
| Metaanálisis | Estudios(n) | Pacientes(n) | Características de la población | Cualquier primera recurrencia a 10 años | Mortalidad por cáncer de mama a 15 (CC) y 20 (M) años |
|---|---|---|---|---|---|
| EBCTCG5 (2011)CC | 17 | 10.801 | Mujeres con cáncer de mama tratadas con CC y RT, con ganglios positivos o negativos | RR: 0,52(IC 95%: 0,48–0,56) | RR: 0,82(IC 95%: 0,75–0,90) |
| EBCTCG6 (2014)M y VA | 22 | 8.135 | Mujeres con cáncer de mama tratadas con M, VA y RT, con ganglios positivos | RR: 0,75(IC 95%: 0,67–0,83) | RR: 0,84(IC 95%: 0,76–0,94) |
CC: cirugía conservadora; M: mastectomía; RT: radioterapia; VA: vaciamiento axilar.
Como respuesta a la pandemia actual por el nuevo coronavirus (SARS-CoV-2), las indicaciones y los esquemas de tratamiento con RT han sido reevaluados8. El nuevo coronavirus ha puesto a prueba no solo los sistemas de salud en el mundo, sino también la capacidad de los gobiernos para gestionar la situación actual. En este documento, se realiza una revisión de tema que incluye la mejor evidencia disponible sobre los esquemas hipofraccionados de RT en cáncer de mama, y que constituyen una alternativa de tratamiento válida y segura para el manejo de algunas pacientes con cáncer de mama9,10, a propósito de la pandemia.
Materiales y métodosPara la construcción de este artículo, se realizó una búsqueda de la literatura en las bases de datos electrónicas: MEDLINE/PubMed y Google Scholar, con los términos [MeSH]: «Breast Neoplasm», «Hypofractionated Radiotherapy» y «Dose Fractionation, Radiation». Se asignaron filtros para seleccionar únicamente los ensayos clínicos controlados (ECC) publicados en inglés en los últimos 15 años. Esta primera búsqueda arrojó un total de 44 estudios. Se excluyeron los documentos con doble publicación, aquellos que no tenían como objetivo principal la comparación de un esquema hipofraccionado vs. el fraccionamiento estándar, los estudios que solo incluyeron a pacientes con carcinoma ductal in situ (CDIS) o con enfermedad metastásica, y aquellos que solo evaluaron desenlaces de toxicidad aguda o tardía, o de calidad de vida.
El proceso de selección se realizó en 2 etapas. Inicialmente, las autoras revisaron de manera independiente los 44 títulos y resúmenes. Después seleccionaron solo los estudios que cumplieron con todos los criterios de inclusión de la búsqueda delimitada. En este punto no hubo diferencias entre las autoras. Al final, se incluyeron 9 ensayos clínicos: 6 de RT hipofraccionada en cirugía conservadora de la mama (los estudios START-A y B se evaluaron en un artículo que realizó su análisis agrupado), uno de RT hipofraccionada posmastectomía y 2 de hipofraccionamiento extremo.
En una segunda publicación: «Implicaciones de la pandemia en la radioterapia para el cáncer de mama. Omisión de la radioterapia», se revisará la literatura más relevante que existe en torno a la omisión de todo tipo de RT adyuvante, en determinados escenarios del cáncer de mama: CDIS y carcinoma invasivo de bajo riesgo de recurrencia.
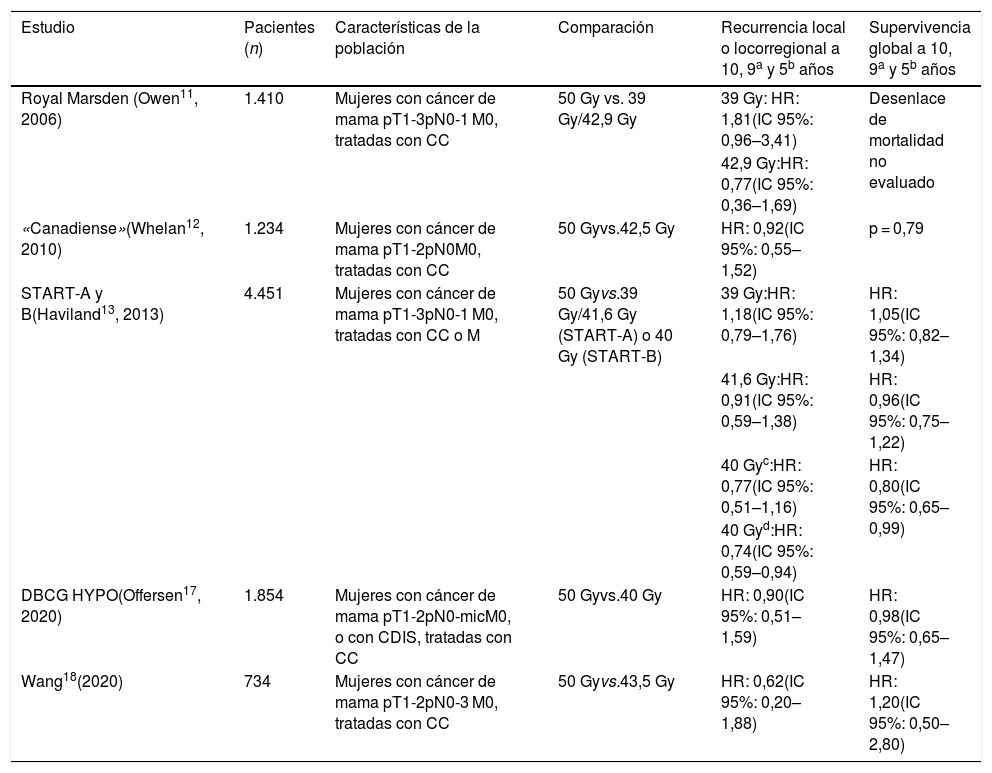
ResultadosRadioterapia hipofraccionadaSeis grandes ensayos clínicos evaluaron la eficacia y la seguridad de los regímenes hipofraccionados en el cáncer de mama, y su rendimiento en comparación con el fraccionamiento estándar11–18. En el estudio del Hospital Royal Marsden se aleatorizaron 1.410 mujeres con tumores pT1-3pN0-1 M0, a recibir un régimen de 50 Gy en 25 fracciones, 39 Gy en 13 fracciones o 42,9 Gy en 13 fracciones. Todas las participantes recibieron una cirugía conservadora, aunque la cirugía axilar varió notablemente (vaciamiento axilar [VA] de los niveles II/III, biopsia de ganglio centinela o ninguna cirugía axilar). Con un seguimiento a 10 años, la tasa de RL ipsilateral de los regímenes hipofraccionados fue similar a la del fraccionamiento estándar: 12,1% con 50 Gy vs. 14,8% con 39 Gy vs. 9,6% con 42,9 Gy. Llamativamente, hubo una diferencia significativa en la probabilidad de RL ipsilateral entre los regímenes de 39 Gy y 42,9 Gy (p < 0,027), pero no entre los otros regímenes analizados. En este estudio, la mortalidad no fue un desenlace evaluado11.
Los resultados a 10 años del estudio «canadiense», que incluyó 1.234 mujeres con tumores pT1-2pN0M0, que recibieron una cirugía conservadora y VA, y aleatorizadas a recibir 42,5 Gy en 16 fracciones vs. 50 Gy en 25 fracciones, mostraron que la tasa de RL fue similar en los 2 regímenes: 6,7% con 50 Gy vs. 6,2% con 42,5 Gy (no inferioridad: p < 0,001). En el análisis por subgrupos la igualdad se mantuvo, con excepción de las pacientes con tumores de alto grado, en donde el hipofraccionamiento fue inferior en cuanto a control local (HR 3,08; IC 95%: 1,22–7,76). La tasa de supervivencia global (SG) fue de 84,4 vs. 84,6% para los grupos control y comparación, respectivamente (p = 0,79). Dado que en este estudio todas las pacientes tenían tumores < 5 cm y ganglios negativos, no se planeó el boost en el lecho tumoral ni la irradiación ganglionar12.
Haviland, et al.13 publicaron en un mismo documento los resultados del seguimiento a 10 años de los estudios START-A y B14–16, que compararon el régimen estándar con los regímenes hipofraccionados de 41,6 Gy y 39 Gy en 13 fracciones (START-A), y 40 Gy en 15 fracciones (START-B). En total, ambos estudios incluyeron 4.451 mujeres con tumores pT1-3pN0-1 M0, que recibieron en su mayoría cirugías conservadoras (A: 85% y B: 82%). Solo un pequeño porcentaje de las pacientes recibió irradiación de la fosa supraclavicular o de la cadena axilar ipsilateral (A: 14% y B: 7%), y boost secuencial del lecho tumoral (A: 61% y B: 43%). En el START-A, las recaídas locorregionales y a distancia, la supervivencia libre de enfermedad (SLE) y la SG no difirieron entre los 3 regímenes. En el START-B, aunque la proporción de las pacientes con recaídas locorregionales fue similar en los 2 esquemas de tratamiento, el régimen de 40 Gy ofreció una ventaja inesperada en SLE a expensas de una menor tasa de recurrencia a distancia: 16,0% para el régimen estándar vs. 12,3% para el hipofraccionado (p = 0,014), lo que se tradujo en un beneficio significativo en SG (p = 0,042)13.
Recientemente, se publicaron los resultados del seguimiento a largo plazo del DBCG HYPO, un estudio que incluyó pacientes > 40 años con cáncer de mama temprano (pT1-2pN0-micM0) o con CDIS. Aquí se aleatorizaron 1.854 pacientes a recibir un régimen estándar de 50 Gy en 25 fracciones vs. 40 Gy en 15 fracciones, después de una cirugía conservadora. El 23,1% recibió un boost secuencial del lecho tumoral, pero ninguna un campo adicional de irradiación ganglionar. A 9 años, el régimen hipofraccionado demostró ser no inferior al fraccionamiento estándar en recurrencia locorregional y SG, con tasas cercanas al 3% (carcinoma invasivo: p = 0,41; CDIS: p = 0,53) y 93% (general: p = 0,93), respectivamente, para ambos grupos de tratamiento. Igualmente, el efecto sobre la piel de los 2 esquemas fue similar (telangiectasias, despigmentación, apariencia de la herida, edema, induración, etc.), así como la aparición de enfermedad cardíaca o pulmonar, que fue muy rara y no se vio influenciada por el tipo de fraccionamiento administrado17.
Existe un sexto estudio, de Wang et al.18 que es ligeramente diferente a los 5 anteriores porque incluyó un 3,3% de las pacientes con estadios clínicos avanzados (pj. pN2 o pN3), algunas de las cuales recibieron también irradiación ganglionar supra/infraclavicular (3,6%) y axilar (0,3%). En contraste con los 5 estudios previamente mencionados, todas las participantes recibieron un boost secuencial del lecho tumoral. Este ECC aleatorizó 734 pacientes con tumores pT1-2pN0-3 M0 y antecedente de cirugía conservadora, a recibir un régimen estándar de 50 Gy en 25 fracciones, o un esquema hipofraccionado de 43,5 Gy en 15 fracciones. Con una mediana de seguimiento mayor a 70 meses, el régimen hipofraccionado demostró ser no inferior al fraccionamiento estándar en recurrencia locorregional (p = 0,75), SLE (p = 0,42) y SG (p = 0,68). Tampoco hubo diferencias entre los grupos en cuanto a resultados cosméticos pos RT (p = 0,55), o toxicidad aguda o tardía, aunque hubo menos toxicidad aguda en la piel grado 2–3 con el esquema acortado (p = 0,01).
Estos 6 ECC muestran la seguridad oncológica de los regímenes hipofraccionados en comparación con el fraccionamiento estándar (tabla 2), y aunque no se detallan en este artículo, los resultados cosméticos tras el seguimiento a largo plazo son similares, pero con menor toxicidad en la piel para los regímenes acortados19–21. La preocupación sobre la posible toxicidad tardía (cardíaca, pulmonar, ósea, etc.) asociada al hipofraccionamiento se ha venido diluyendo con los últimos reportes que confirman su seguridad21–23. Sin embargo, dado que en estos estudios la mayoría de las pacientes tenían más de 50 años, tumores tempranos y manejo con cirugía conservadora, existe controversia en cuanto a si sus resultados son aplicables a las pacientes con tumores localmente avanzados o en quienes se realiza mastectomía. De hecho, en la guía de 2011 de la Sociedad Americana de Oncología Radioterápica (ASTRO, por sus siglas en inglés) solo se soportaba el hipofraccionamiento para las pacientes con tumores T1-2N0M0 y > 50 años, aunque no se hacía referencia al tipo de cirugía de la mama24.
Principales estudios de radioterapia hipofraccionada en cáncer de mama temprano y localmente avanzado
| Estudio | Pacientes (n) | Características de la población | Comparación | Recurrencia local o locorregional a 10, 9a y 5b años | Supervivencia global a 10, 9a y 5b años |
|---|---|---|---|---|---|
| Royal Marsden (Owen11, 2006) | 1.410 | Mujeres con cáncer de mama pT1-3pN0-1 M0, tratadas con CC | 50 Gy vs. 39 Gy/42,9 Gy | 39 Gy: HR: 1,81(IC 95%: 0,96–3,41) | Desenlace de mortalidad no evaluado |
| 42,9 Gy:HR: 0,77(IC 95%: 0,36–1,69) | |||||
| «Canadiense»(Whelan12, 2010) | 1.234 | Mujeres con cáncer de mama pT1-2pN0M0, tratadas con CC | 50 Gyvs.42,5 Gy | HR: 0,92(IC 95%: 0,55–1,52) | p = 0,79 |
| START-A y B(Haviland13, 2013) | 4.451 | Mujeres con cáncer de mama pT1-3pN0-1 M0, tratadas con CC o M | 50 Gyvs.39 Gy/41,6 Gy (START-A) o 40 Gy (START-B) | 39 Gy:HR: 1,18(IC 95%: 0,79–1,76) | HR: 1,05(IC 95%: 0,82–1,34) |
| 41,6 Gy:HR: 0,91(IC 95%: 0,59–1,38) | HR: 0,96(IC 95%: 0,75–1,22) | ||||
| 40 Gyc:HR: 0,77(IC 95%: 0,51–1,16) | HR: 0,80(IC 95%: 0,65–0,99) | ||||
| 40 Gyd:HR: 0,74(IC 95%: 0,59–0,94) | |||||
| DBCG HYPO(Offersen17, 2020) | 1.854 | Mujeres con cáncer de mama pT1-2pN0-micM0, o con CDIS, tratadas con CC | 50 Gyvs.40 Gy | HR: 0,90(IC 95%: 0,51–1,59) | HR: 0,98(IC 95%: 0,65–1,47) |
| Wang18(2020) | 734 | Mujeres con cáncer de mama pT1-2pN0-3 M0, tratadas con CC | 50 Gyvs.43,5 Gy | HR: 0,62(IC 95%: 0,20–1,88) | HR: 1,20(IC 95%: 0,50–2,80) |
BGC: biopsia de ganglio centinela; CC: cirugía conservadora; CDIS: carcinoma ductal in situ; M: mastectomía; VA: vaciamiento axilar.
En la reunión de ASTRO de 2017, se presentaron los resultados preliminares del estudio de Sun et al.25, que incluyó un grupo distinto de mujeres con tumores localmente avanzados (pT3-4pN2-ypN + M0) y un mayor riesgo de recurrencia. Este ECC, actualizado en 2019, incluyó 820 participantes y las aleatorizó a recibir un régimen de 43,5 Gy en 15 fracciones vs. 50 Gy en 25 fracciones. Todas las pacientes recibieron una mastectomía y VA, lo que es sustancialmente diferente a lo realizado en los 6 estudios previamente mencionados. La RT se administró a la pared costal, la fosa supraclavicular y el nivel III axilar. Ninguna paciente recibió RT de los niveles I y II de la axila o de la cadena mamaria interna. A 5 años, no hubo diferencias entre los grupos en recurrencia locorregional (estándar 8,1% vs. hipofraccionado 8,3%; no inferioridad: p < 0,0001), SG (estándar 86% vs. hipofraccionado 84%; p = 0,52) o toxicidad aguda o tardía. Llamativamente, menos pacientes en el esquema acortado tuvieron toxicidad aguda cutánea grado 3 (p < 0,0001)26 (tabla 3).
Características del estudio de Wang et al. Hipofraccionamiento en las pacientes con cáncer de mama localmente avanzado, posmastectomía
| Estudio | Pacientes(n) | Características de la población | Comparación | Recurrencia locorregional a 5 años | Supervivencia global a 5 años |
|---|---|---|---|---|---|
| Wang26(2019) | 820 | Mujeres con cáncer de mama pT3-4pN2-ypN + M0, tratadas con M y VA | 50 Gyvs43,5 Gy | HR: 1,10(IC 95%: 0,72–1,69) | HR: 1,13(IC 95%: 0,78–1,62) |
M: mastectomía; VA: vaciamiento axilar.
Aún faltan datos concluyentes que procedan de ECC consistentes y con seguimiento a largo plazo, que evalúen específicamente el hipofraccionamiento en las pacientes que reciben un campo adicional de irradiación ganglionar, particularmente en la cadena mamaria interna. Por el momento, la evidencia no parece mostrar un empeoramiento de los resultados oncológicos o de la toxicidad aguda o tardía (cutánea, pulmonar, cardíaca, neurológica, de los tejidos de la pared del tórax o de las extremidades superiores, etc.). Los datos de los estudios que hay en curso, y que evalúan técnicas de RT más modernas, están llamados a dilucidar este asunto27.
Conviene resaltar que aunque los estudios anteriormente citados excluyeron a las pacientes con reconstrucción mamaria inmediata, no se ha logrado demostrar que el hipofraccionamiento empeore los desenlaces oncológicos o estéticos de este grupo de pacientes. De hecho, los esquemas acortados disminuyen los efectos de la RT en los tejidos sanos, limitando así la fibrosis y mejorando los resultados cosméticos28. Se esperan los reportes de 2 ECC que están analizando específicamente el papel del hipofraccionamiento en este escenario, el Alliance 221.505 y el del Dana-Faber Cancer Institute (NCT03422003)29,30.
Hipofraccionamiento extremoDesde 2011 se conocen los resultados preliminares del FAST, un estudio piloto que fue diseñado para evaluar si 2 esquemas hipofraccionados extremos de 28,5 Gy o 30 Gy (una fracción/semana, durante 5 semanas) eran equivalentes al fraccionamiento estándar en cuanto a eventos adversos tardíos en los tejidos de la mama: el edema, la induración, la contracción tisular, las telangiectasias, etc. Aunque este estudio no tuvo el poder estadístico para calcular diferencias en otros desenlaces como control local o supervivencia, a 9,9 años los 3 esquemas fueron numéricamente similares en recurrencia tumoral ipsilateral: 50 Gy: 3, 30 Gy: 4, 28,5 Gy: 4 (n = 11); y mortalidad: 50 Gy: 30, 30 Gy: 33, 28,5 Gy: 33 (n = 96)31,32.
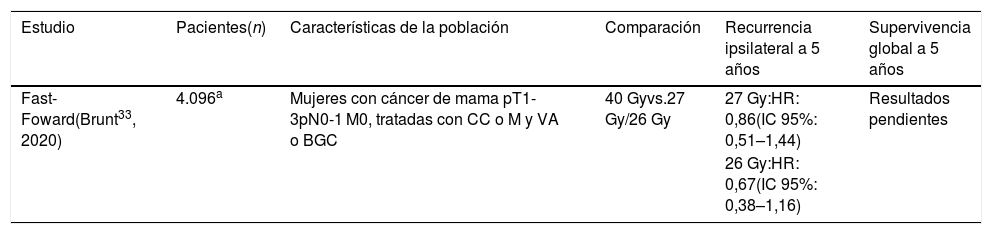
Al inicio de la pandemia por el nuevo coronavirus, cuando más esperados eran sus resultados, se publicó el informe del FAST-Foward, el primer ECC que estableció la seguridad del hipofraccionamiento extremo para las pacientes con tumores pT1-3pN0-1 M0 que recibieron una cirugía conservadora o mastectomía, y biopsia de ganglio centinela o VA. El FAST-Foward comparó 2 esquemas de hipofraccionamiento extremo (27 Gy o 26 Gy en 5 fracciones durante una semana) con el hipofraccionamiento tradicional (40 Gy en 15 fracciones durante 3 semanas). Aunque cerca del 75% de las participantes recibió un boost en el lecho tumoral, ninguna recibió RT ganglionar. En total, se aleatorizaron 4.096 pacientes. Con un seguimiento mayor a 70 meses, los hipofraccionamientos extremos demostraron ser no inferiores al hipofraccionamiento tradicional en control local. No obstante, el régimen de 27 Gy mostró un incremento en el edema, la distorsión, la induración, la contractura de la piel y de los tejidos de la mama/pared del tórax, en comparación con el de 40 Gy. Aún se encuentran pendientes los resultados de supervivencia. Es importante tener en cuenta que si bien este estudio incluyó a pacientes con tamaños tumorales > 5 cm y axila N1, solo el 1,8 y 18,5% de todas las pacientes tenían tumores T3 y metástasis axilares, respectivamente. Adicionalmente, aunque se permitió la inclusión de las pacientes que recibieron una reconstrucción mamaria inmediata, menos del 1% de las participantes recibieron esta intervención33 (tabla 4).
Características del estudio FAST-Foward. Hipofraccionamiento extremo en pacientes con cáncer de mama temprano
| Estudio | Pacientes(n) | Características de la población | Comparación | Recurrencia ipsilateral a 5 años | Supervivencia global a 5 años |
|---|---|---|---|---|---|
| Fast-Foward(Brunt33, 2020) | 4.096a | Mujeres con cáncer de mama pT1-3pN0-1 M0, tratadas con CC o M y VA o BGC | 40 Gyvs.27 Gy/26 Gy | 27 Gy:HR: 0,86(IC 95%: 0,51–1,44) | Resultados pendientes |
| 26 Gy:HR: 0,67(IC 95%: 0,38–1,16) |
CC: cirugía conservadora; M: mastectomía; VA: vaciamiento axilar; BGC: biopsia de ganglio centinela.
Hay en curso un subestudio de FAST-Foward que está evaluando los mismos esquemas de hipofraccionamiento extremo en las pacientes que requieren RT axilar o de la fosa supraclavicular34. Es necesario esperar sus resultados antes de poder extrapolar los hallazgos del FAST-Foward a este grupo específico de pacientes.
¿Cuándo considerar la administración de esquemas acortados, a propósito de la pandemia actual?En un esfuerzo mancomunado por formular oportunamente sugerencias sobre el uso de la RT hipofraccionada (tradicional y extrema) en el cáncer de mama, diferentes sociedades científicas y expertos internacionales publicaron las siguientes recomendaciones9,10:
- a)
Suministrar hipofraccionamiento extremo (5 fracciones) a aquellas pacientes con ganglios negativos, pero que requieran RT (sin boost). Las opciones incluyen 28-30 Gy en 5 fracciones, una vez por semana durante 5 semanas, o 26 Gy en 5 fracciones diarias durante una semana.
- b)
Se debe considerar la RT hipofraccionada en todas las pacientes que requieran irradiación de toda la mama, la pared del tórax o los ganglios linfáticos (40 Gy en 15 fracciones durante 3 semanas). Sin embargo, frente a la irradiación de las cadenas ganglionares, es importante recordar que aunque la evidencia actualmente disponible parece mostrar su equivalencia con la RT estándar, aún falta confirmar estos hallazgos con grandes ECC27.
Desde el inicio de la pandemia por el nuevo coronavirus, numerosos artículos científicos han mostrado cómo los pacientes oncológicos son especialmente vulnerables en esta contingencia, porque tienen un mayor riesgo de presentar complicaciones asociadas a la infección, y por los resultados adversos que frecuentemente se generan producto de las demoras en el diagnóstico y los tratamientos35–37. En esta contingencia, la RT debe ser priorizada en aquellos pacientes con urgencias oncológicas o con cánceres de rápido crecimiento. Cuando la RT se administra con intención curativa, omitirla o protractarla puede significar la pérdida en el control de la enfermedad38–41. Dado que en el cáncer de mama la RT es complementaria a la cirugía, la terapia dirigida, la quimio y la hormonoterapia, resulta imprescindible evaluar la modificación de los esquemas de tratamiento, en lugar de suspenderlos9,10.
La evidencia anteriormente expuesta, valida el uso de los tratamientos acortados de RT en el manejo de muchas de las pacientes con cáncer de mama, aun cuando existe controversia en algunos grupos de pacientes11–18. La RT hipofraccionada y el hipofraccionamiento extremo se convierten en una alternativa terapéutica muy útil, máxime cuando la condición actual demanda el uso de conductas que busquen reducir los tiempos de los tratamientos y la exposición al nuevo virus42,43. Finalmente, no sobra recalcar que el fundamento oncológico debe primar en el manejo de los pacientes con cáncer, y que las conclusiones que se deriven de los estudios antes enunciados se deben individualizar para cada caso.
ConclusionesEl manejo radioterápico de las pacientes con cáncer de mama durante la contingencia actual, debe incluir las medidas restrictivas que la pandemia demanda, como limitar el número de contactos y el distanciamiento físico y social, pero sin poner en peligro los resultados de las intervenciones onco-específicas. Para el caso de las pacientes con cáncer de mama, la prioridad en la administración de la RT debe estar determinada por la presencia de un cáncer de rápido crecimiento, sangrado tumoral activo, u otros factores de mal pronóstico como el carcinoma inflamatorio, los ganglios positivos, la biología tumoral de alto riesgo, etc. Considerando que la RT requiere asistencias reiteradas a las instituciones de salud, la práctica del hipofraccionamiento y el hipofraccionamiento extremo es hoy más demandada que nunca, máxime al ser equivalente, en ciertos grupos de pacientes, al fraccionamiento estándar, tanto en términos oncológicos como estéticos. En este sentido, hoy en día muchas mujeres son candidatas a tratamientos acortados de RT.
LimitacionesAunque esta revisión de tema incluye los estudios más importantes sobre la RT hipofraccionada y el hipofraccionamiento extremo en el manejo adyuvante del cáncer de mama, los criterios de selección empleados por las autoras podrían excluir investigaciones relevantes que se encuentren en curso, o documentos publicados en otros idiomas diferentes al inglés. En este artículo tampoco se puede hacer un análisis en profundidad de los diseños metodológicos y posibles sesgos de los estudios presentados ni de la validez interna de los mismos.
Responsabilidades éticasLas autoras declaran que han seguido todas las normas éticas para la publicación de artículos de revisión.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.