La pandemia actual por el nuevo coronavirus (SARS-CoV-2) exige que los sistemas de salud rápidamente adopten medidas encaminadas a mitigar la crisis, lo que implica redistribuir los recursos económicos, sociales y la fuerza laboral, para que aquellos sectores de la población más afectados puedan ser atendidos de forma óptima y oportuna. En los pacientes con carcinoma mamario in situ e invasivo de bajo riesgo, la radioterapia postoperatoria no ofrece ningún beneficio en supervivencia global, lo que hace atractiva la idea de omitir este recurso oncológico. En este artículo, se realizó una revisión de la literatura sobre los criterios para omitir la radioterapia adyuvante en los pacientes con neoplasias mamarias de bajo riesgo. Adicionalmente, se resumen las recomendaciones emitidas por algunas sociedades científicas internacionales durante la contingencia actual, y se analizan determinadas razones por las cuales los médicos se rehúsan a cambiar conductas clínicas que ofrecen ventajas limitadas, muchas veces contrarrestadas por los riesgos y los efectos adversos asociados.
The current pandemic due to the new Coronavirus (SARS-CoV-2) requires the health systems to rapidly adopt measures aimed at mitigating the crisis, which implies redistributing economic and social resources and the workforce, so that those sectors of the population most affected can be cared for in an optimal and timely manner. In patients with low-risk invasive breast cancer and low-risk ductal carcinoma in situ, postoperative radiation therapy does not offer any benefit in overall survival, making the idea of omitting this oncological resource attractive. In this second article, we conducted a review of the literature on the criteria for omitting adjuvant radiotherapy in patients with low-risk breast neoplasms. In addition, the recommendations issued during the current contingency made by some international scientific societies are summarized, and certain reasons why physicians refuse to change clinical behaviors that offer limited advantages are analyzed, many times outweighed by the associated risks and adverse effects.
El carcinoma ductal in situ (CDIS) es una lesión maligna confinada a los ductos y lóbulos mamarios que no ha transgredido la membrana basal. Por definición, es una lesión no invasiva1,2. Históricamente, se ha considerado un precursor no obligado del carcinoma mamario invasivo, en donde, por el contrario, las células malignas infiltran el tejido adyacente y tienen la capacidad de comprometer órganos a distancia3,4. Algunos investigadores sugieren que ambas entidades hacen parte de la misma enfermedad, pero en etapas diferentes del desarrollo3.
El manejo estándar del CDIS es la resección completa de la lesión, la administración de radioterapia (RT) postoperatoria en caso de haberse realizado una cirugía conservadora (CC), y el uso de hormonoterapia adyuvante en lesiones con expresión de receptores hormonales (RH). Está demostrado que la RT reduce en un 50% el riesgo de recaída local (RL), lo cual es todavía más importante si se considera que cerca de la mitad de las recurrencias ocurrirán en forma de enfermedad invasiva5–8. Para el caso del carcinoma invasivo, la RT se ha considerado un componente constitutivo en el manejo de las pacientes que reciben CC, y un coadyuvante en las pacientes de alto riesgo que reciben una mastectomía9–11. Sin embargo, en ambos escenarios la RT tiene un impacto limitado en la supervivencia global (SG) y en la mortalidad específica por cáncer de mama1,12, lo que ha generado dudas acerca de si todas las pacientes se benefician de esta modalidad de tratamiento3,13.
Este segundo artículo pretende abordar las indicaciones para omitir la RT postoperatoria en las pacientes con CDIS y carcinoma mamario invasivo de bajo riesgo, y la evidencia sobre la cual se sustentan dichas recomendaciones.
Materiales y métodosSe realizó una búsqueda de la literatura por cada uno de los escenarios de interés: 1) CDIS de bajo riesgo, y 2) carcinoma mamario invasivo de bajo riesgo. Para el CDIS de bajo riesgo se revisaron las bases de datos electrónicas: MEDLINE/PubMed y Scholar Google, con los términos [MeSH]: «Ductal Carcinoma in Situ» y «Adjuvant Radiotherapy». Se asignaron filtros a la búsqueda para seleccionar únicamente los ensayos clínicos controlados (ECC) publicados en inglés en los últimos 15 años. Esta primera búsqueda arrojó un total de 37 estudios. Se excluyeron los documentos con doble publicación, que incluían a pacientes con carcinoma mamario invasivo o con CDIS de riesgo intermedio o alto, los estudios que tenían como objetivo principal la comparación del tratamiento quirúrgico vs. la vigilancia más la terapia hormonal, la comparación entre el tamoxifeno vs. un inhibidor de aromatasa, o la comparación entre distintas técnicas de RT. Igualmente, se excluyeron los documentos que solo evaluaron desenlaces de calidad de vida o toxicidad aguda o tardía. Debido a que solo se encontró un ECC, para complementar la revisión del tema se incluyeron 2 estudios prospectivos.
El carcinoma mamario invasivo se definió como de bajo riesgo cuando las pacientes cumplían con todos los siguientes criterios: estado posmenopáusico, tumor < = 3 cm, ganglios negativos y RH positivos. Se realizó una búsqueda en las bases de datos electrónicas: MEDLINE/PubMed y Scholar Google, con los términos [MeSH]: «Breast Neoplasm» y «Adjuvant Radiotherapy» y «Breast-Conservig Surgery». Se asignaron filtros a la búsqueda para seleccionar únicamente los ECC publicados en inglés en los últimos 16 años. Esta primera búsqueda arrojó un total de 131 estudios. Se excluyeron los documentos con doble publicación, que incluían a pacientes con CDIS, los estudios que tenían como objetivo principal la comparación del tratamiento quirúrgico vs. la RT con o sin hormonoterapia, o la comparación entre un esquema de RT estándar vs. un esquema hipofraccionado. Igualmente, se excluyeron los documentos que evaluaron intervenciones terapéuticas distintas a la RT o la hormonoterapia. Se identificaron 9 ECC que comparaban la terapia hormonal adyuvante sola vs. la hormonoterapia y la RT adyuvantes en las pacientes tratadas con CC. Una de las publicaciones, si bien incluía pacientes con tumores > 3 cm, realizó un análisis planeado de las mujeres con tumores T1 e informó adecuadamente las tasas de RL para este subgrupo de pacientes. De estos ECC se excluyeron 3 que incluían a pacientes con ganglios positivos, y uno que no reportó la información sobre la SG de las participantes. Finalmente, se incluyeron 5 ECC.
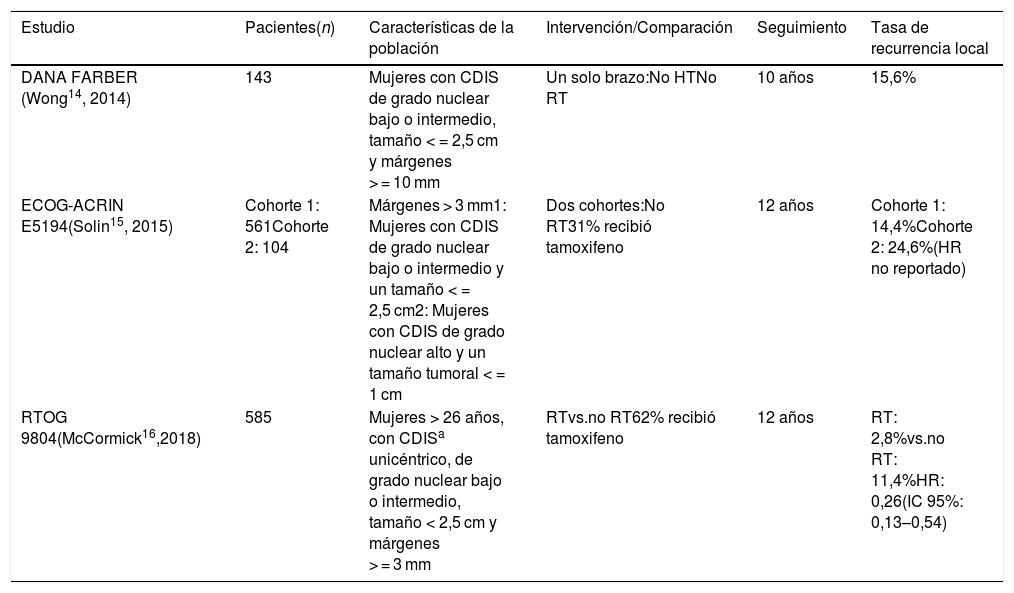
ResultadosCarcinoma ductal in situSon 3 los estudios principales que evaluaron específicamente el papel de la RT adyuvante en las pacientes con CDIS de bajo riesgo, que recibieron cirugía CC (tabla 1)14–17. El primer estudio, desarrollado en el hospital DANA FARBER por Wong et al.14, incluyó a 143 pacientes con CDIS de grado nuclear bajo o intermedio, tamaño < = 2,5 cm y márgenes > = 10 mm, a quienes se les omitió la RT. No se especifica el porcentaje de tumores con expresión de RH y el consumo de tamoxifeno no fue permitido. Este estudio se cerró de forma prematura en 2006 debido a una tasa «inaceptablemente» alta de RL a 5 años (12%). El seguimiento a 10 años mostró una tasa de RL de 15,6%. Aunque a la fecha no se conocen los datos sobre la mortalidad, es claro que aún en las pacientes seleccionadas la omisión de la RT se traduce en un porcentaje alto de RL, y que este riesgo continúa incrementando con el paso del tiempo.
Estudios que respaldan la omisión de la radioterapia en las pacientes con CDIS de bajo riesgo que recibieron cirugía conservadora
| Estudio | Pacientes(n) | Características de la población | Intervención/Comparación | Seguimiento | Tasa de recurrencia local |
|---|---|---|---|---|---|
| DANA FARBER (Wong14, 2014) | 143 | Mujeres con CDIS de grado nuclear bajo o intermedio, tamaño < = 2,5 cm y márgenes > = 10 mm | Un solo brazo:No HTNo RT | 10 años | 15,6% |
| ECOG-ACRIN E5194(Solin15, 2015) | Cohorte 1: 561Cohorte 2: 104 | Márgenes > 3 mm1: Mujeres con CDIS de grado nuclear bajo o intermedio y un tamaño < = 2,5 cm2: Mujeres con CDIS de grado nuclear alto y un tamaño tumoral < = 1 cm | Dos cohortes:No RT31% recibió tamoxifeno | 12 años | Cohorte 1: 14,4%Cohorte 2: 24,6%(HR no reportado) |
| RTOG 9804(McCormick16,2018) | 585 | Mujeres > 26 años, con CDISa unicéntrico, de grado nuclear bajo o intermedio, tamaño < 2,5 cm y márgenes > = 3 mm | RTvs.no RT62% recibió tamoxifeno | 12 años | RT: 2,8%vs.no RT: 11,4%HR: 0,26(IC 95%: 0,13–0,54) |
CDIS: carcinoma ductal in situ; HT: hormonoterapia; RT: radioterapia.
El estudio ECOG-ACRIN E5194 de Solin et al.15, analizó los desenlaces de 2 distintas cohortes de pacientes a las que se les omitió la RT tras la resección de la lesión con márgenes negativos > 3 mm: 1) 561 mujeres con CDIS de grado nuclear bajo o intermedio y un tamaño < = 2,5 cm, y 2) 104 mujeres con CDIS de grado nuclear alto y un tamaño < = 1 cm. No se evaluó el estado de los RH y solo el 31% de las participantes recibió tamoxifeno adyuvante. Por su diseño, este fue un estudio no aleatorizado. Luego de un seguimiento a 12 años, la tasa de eventos mamarios ipsilaterales (invasivos y no invasivos) fue de 14,4 y 24,6% para las cohortes 1 y 2, respectivamente (p = 0,003). La mitad de los eventos fueron en forma de enfermedad invasiva. En este estudio, solo el tamaño tumoral > 5 mm se asoció con un incremento significativo en el riesgo de un evento mamario ipsilateral. Otras variables como la edad, la amplitud del margen, el método de detección de la lesión y el uso de tamoxifeno, no tuvieron una asociación significativa con ninguno de los desenlaces evaluados. A pesar del incremento significativo en la RL, la SG y los eventos mamarios contralaterales no difirieron entre las 2 cohortes.
Finalmente, existe un solo ECC publicado sobre la omisión de la RT en las pacientes con CDIS de bajo riesgo, el RTOG 9804, desarrollado por McCormick et al.16. En este ECC se aleatorizaron 585 pacientes > 26 años, con diagnóstico mamográfico o incidental de CDIS unicéntrico, de grado nuclear bajo o intermedio, tamaño < 2,5 cm y márgenes > = 3 mm, a recibir RT o no. Aunque no se especifica el porcentaje de pacientes con expresión de RH, el 62% recibió tamoxifeno adyuvante. El seguimiento a 12 años reportó que la tasa de RL fue de 2,8 y 11,4% para los grupos de RT y no RT, respectivamente (p < 0,0001). Nuevamente, la mitad de las recurrencias ocurrieron como carcinoma invasivo. No hubo diferencias entre los grupos en recurrencia en la mama contralateral, supervivencia libre de enfermedad a distancia (SLED) y SG. Sin embargo, las pacientes asignadas a RT tuvieron una mayor incidencia de toxicidad aguda grado 1 y 2 (p < 0,001)17.
El análisis agrupado de los anteriores estudios resulta difícil, puesto que difieren en sus protocolos, en el uso de tamoxifeno adyuvante y en los parámetros utilizados para clasificar el bajo riesgo3. Queda claro que existe una disminución importante de la RL cuando la RT se adiciona a la CC, aún en los pacientes de bajo riesgo2. Sin embargo, cuando la probabilidad de RL es baja, como en aquellas pacientes con una edad > 40 años18–20, un volumen tumoral pequeño21 y márgenes de resección > 2 mm22–24, es posible que los beneficios de la RT se vean sobrepasados por los posibles riesgos2,3.
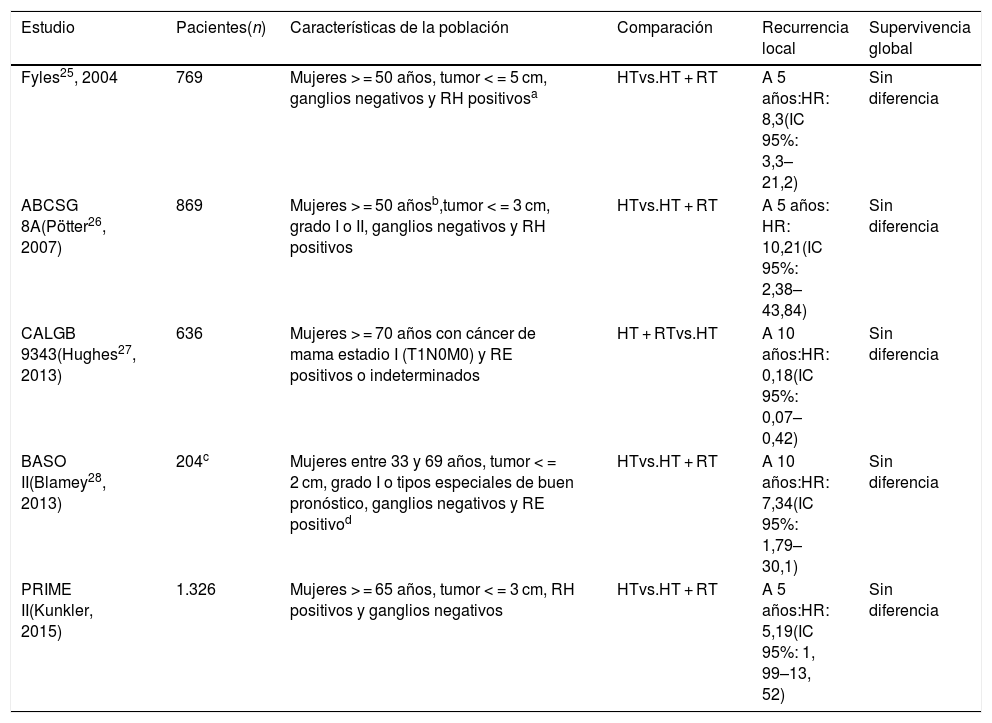
Carcinoma mamario invasivoLos ECC que evaluaron la omisión de la RT en las pacientes con cáncer de mama invasivo que recibieron CC, tienen diseños metodológicos diferentes y han considerado el bajo riesgo de acuerdo con diversos factores combinados (tabla 2). Si bien en estos estudios no existe uniformidad en cuanto a lo que se considera bajo riesgo, en general, incluyeron mujeres con una edad entre los 46 y los 70 años, tamaños tumorales < = 3 cm, RH positivos y ganglios negativos25–29.
Estudios que respaldan la omisión de la radioterapia en las pacientes con carcinoma mamario invasivo en estadio temprano que recibieron cirugía conservadora
| Estudio | Pacientes(n) | Características de la población | Comparación | Recurrencia local | Supervivencia global |
|---|---|---|---|---|---|
| Fyles25, 2004 | 769 | Mujeres > = 50 años, tumor < = 5 cm, ganglios negativos y RH positivosa | HTvs.HT + RT | A 5 años:HR: 8,3(IC 95%: 3,3–21,2) | Sin diferencia |
| ABCSG 8A(Pötter26, 2007) | 869 | Mujeres > = 50 añosb,tumor < = 3 cm, grado I o II, ganglios negativos y RH positivos | HTvs.HT + RT | A 5 años: HR: 10,21(IC 95%: 2,38–43,84) | Sin diferencia |
| CALGB 9343(Hughes27, 2013) | 636 | Mujeres > = 70 años con cáncer de mama estadio I (T1N0M0) y RE positivos o indeterminados | HT + RTvs.HT | A 10 años:HR: 0,18(IC 95%: 0,07–0,42) | Sin diferencia |
| BASO II(Blamey28, 2013) | 204c | Mujeres entre 33 y 69 años, tumor < = 2 cm, grado I o tipos especiales de buen pronóstico, ganglios negativos y RE positivod | HTvs.HT + RT | A 10 años:HR: 7,34(IC 95%: 1,79–30,1) | Sin diferencia |
| PRIME II(Kunkler, 2015) | 1.326 | Mujeres > = 65 años, tumor < = 3 cm, RH positivos y ganglios negativos | HTvs.HT + RT | A 5 años:HR: 5,19(IC 95%: 1, 99–13, 52) | Sin diferencia |
HT: hormonoterapia; RE: receptores de estrógenos; RH: receptores hormonales; RT: radioterapia.
El estudio canadiense de Fyles et al.25, investigó el efecto de la RT más el tamoxifeno sobre la SLE y el tiempo hasta la RL, en mujeres de 50 años o más, con tumores T1-2 y ganglios negativos. Un total de 769 participantes fueron aleatorizadas a tamoxifeno solo (383) vs. tamoxifeno más RT (386). La mediana de seguimiento fue de 5,6 años. La tasa de RL a 5 años fue de 7,7% en el grupo de tamoxifeno y de 0,6% en el grupo de tamoxifeno más RT (p < 0,001). La tasa de SLE a 5 años fue de 84 y 91% para los grupos de tamoxifeno y tamoxifeno más RT, respectivamente (p = 0,004). Los autores encontraron una diferencia significativa en la tasa de recaída axilar a 5 años (2,5% en el grupo de tamoxifeno y 0,5% en el grupo de tamoxifeno más RT, p = 0,049), pero no hallaron diferencias en cuanto a la recaída a distancia o la SG. En este estudio más del 80% de las participantes de ambos grupos tenían RH positivos. Un análisis planeado por subgrupos mostró que las 611 mujeres con tumores T1 y RH positivos, también tuvieron una disminución en la tasa de RL a 5 años con la adición de la RT al tamoxifeno (0,4% con tamoxifeno más RT vs. 5,9% con tamoxifeno solo; p < 0,001).
El Grupo Austriaco para el Estudio del Cáncer de Mama y Cáncer Colorrectal (ABCSG, Estudio 8A)26, aleatorizó 869 mujeres de 50 años o más (salvo 3 participantes) con cáncer de mama temprano: tumor < = 3 cm, grado 1 o 2, ganglios negativos y RH positivos, a recibir hormonoterapia más RT, con o sin boost (414), u hormonoterapia sin RT (417). El desenlace primario fue la supervivencia libre de RL. Tras una mediana de seguimiento de 53,8 meses, se detectaron 21 recaídas locales: 19 en el grupo de no RT (5,1%) y 2 en el grupo de RT (0,4%) (p = 0,0001). Los investigadores no encontraron diferencias significativas en la tasa de metástasis a distancia o en la SG.
En el estudio CALGB 9343, Hughes et al.27, aleatorizaron 636 pacientes con cáncer de mama en estadio I (T1N0M0), edad > = 70 años y receptores de estrógenos positivos o indeterminados, a recibir adyuvancia con tamoxifeno más RT (317) vs. tamoxifeno solo (319). El seguimiento a 10 años mostró que el 98% de las pacientes que recibieron tamoxifeno más RT vs. el 90% de las que recibieron tamoxifeno solo, se encontraban libres de recurrencia locorregional (p < 0,001). No obstante, la adición de la RT no demostró un beneficio significativo en la SG, la SLED y la preservación de la mama. La SG a 10 años fue de 67 y 66% en los grupos de tamoxifeno más RT y tamoxifeno solo, respectivamente (HR; 0,95; p = 0,64).
El estudio británico BASO II28 incluyó mujeres entre los 33 y 69 años, con cáncer de mama invasivo < = 2 cm, grado 1 o tipo especial de buen pronóstico (tubular, cribiforme, mucinoso, entre otros) y ganglios negativos. Las pacientes se aleatorizaron a recibir o no RT, con o sin tamoxifeno (diseño factorial de 2x2). En el análisis por intención a tratar los autores encontraron que la RL se redujo en aquellas pacientes que recibieron RT (HR: 0,37; p < 0,001) y tamoxifeno (HR: 0,33; p < 0,004). La mediana de seguimiento fue de 121 meses. El análisis de las participantes ingresadas en la aleatorización de 4 vías, mostró una RL anual de 1,9, 0,7 y 0,8%, para la CC sola, CC más RT y CC más tamoxifeno, respectivamente. Ninguna de las pacientes incluidas en el grupo que recibió RT más tamoxifeno presentó una RL. A 10 años, la comparación entre las mujeres (204) que recibieron tamoxifeno solo (106) vs. tamoxifeno más RT (98), resultó en un aumento significativo del riesgo de RL para el primer grupo (p = 0,006). La supervivencia específica por cáncer de mama en el total de las pacientes aleatorizadas (1.135) fue de 96%, y tanto el tamoxifeno como la RT no se asociaron con una mejoría significativa en la supervivencia.
Finalmente, en el estudio PRIME II, Kunkler et al.29 aleatorizaron 1.326 pacientes con cáncer de mama temprano (T < = 3 cm y ganglios negativos), RH positivos, edad > = 65 años y que fueran a ser tratadas con hormonoterapia adyuvante, a recibir RT postoperatoria (658) vs. no RT (668). A 5 años, los autores encontraron un aumento significativo en la tasa de RL en aquellas participantes que recibieron hormonoterapia sola vs. hormonoterapia más RT adyuvante: 4,1 y 1,3%, respectivamente (p = 0,0002), pero no hallaron beneficio en la supervivencia: tasa de SG de 93,9% para ambos grupos (p = 0,34).
¿Cuándo considerar la omisión de la radioterapia, a propósito de la pandemia actual?CDISSe puede considerar omitir la RT en las pacientes con CDIS detectado por mamografía, con lesiones < = 2,5 cm, márgenes de resección > = 2 mm y grado nuclear bajo o intermedio. Es necesario tener precaución con la omisión de la RT en las pacientes jóvenes, ya que, aunque los estudios no excluyeron explícitamente a las pacientes < 40 años, la mediana de la edad fue de 51, 58 y 60 años, para los estudios de Wong, McCormick y Solin, respectivamente30,31.
Carcinoma mamario invasivoSe puede considerar omitir la RT en las pacientes con una edad > = 65 años, tumores < = 3 cm, márgenes y ganglios negativos, grado histológico 1 o 2, RH positivos, HER2 negativo y que vayan a recibir hormonoterapia adyuvante30.
Situaciones especialesSe puede considerar retrasar la RT (cuando no es posible omitirla) en las pacientes con CDIS, hasta por 12 semanas, y en las pacientes con carcinoma mamario invasivo, hasta por 8 a 12 semanas. Existe evidencia que señala que la RT puede posponerse hasta por 6 meses después de la cirugía, tras la finalización del régimen estándar de quimioterapia, sin detrimento del control local o la supervivencia. En estos casos se aconseja el inicio temprano de la hormonoterapia31,32.
DiscusiónEl nuevo coronavirus ha puesto a prueba los sistemas de salud y la capacidad de los gobiernos para gestionar esta nueva y apremiante realidad. A nivel mundial, se observa una movilización del capital económico para aumentar las unidades de terapia intensiva y de atención de las pacientes con enfermedad respiratoria33. Si se tiene en cuenta que en Estados Unidos el costo de la irradiación de toda la mama se calcula en US$7.000 por paciente34, y en Colombia en $4–5 millones de pesos35, se entiende porqué las indicaciones y los esquemas de tratamiento con RT son reconsiderados durante la pandemia actual36. Con anterioridad, los autores del PRIME I, estudio que tuvo como objetivos principales evaluar la calidad de vida y la costo-efectividad de la omisión de la RT en las pacientes con cáncer de mama de bajo riesgo, que recibieron CC y terapia hormonal adyuvante, habían planteado que la RT postoperatoria solo es rentable económicamente si produce un descenso absoluto de al menos un 5% en la tasa de recurrencia, en comparación con aquellas pacientes tratadas sin RT37,38.
Teniendo en cuenta que el análisis de los estudios antes mencionados muestra cómo en las pacientes con CDIS y cáncer de mama invasivo de bajo riesgo, la RT reduce el riesgo de desarrollar una RL sin mejorar la SG14–17,25–29, algunos investigadores han cuestionado por qué los estudios de omisión de RT no han tenido un mayor impacto en la práctica clínica actual13,39. Dentro de las posibles explicaciones se encuentran las siguientes: en primer lugar, es más probable que los médicos adopten un cambio en la práctica clínica que agregue un tratamiento, en lugar de uno que retire una conducta sin causar daño; dado que los resultados de los estudios de omisión de RT no proporcionan una terapia nueva, los médicos se inclinan por la ventaja en la disminución de la RL que ofrece esta modalidad de tratamiento, sin considerar los ahorros potenciales en tiempo, costo y efectos adversos que se pueden obtener con su omisión13. Segundo, no es infrecuente que las recaídas por cánceres de mama luminales sean tardías, por lo que algunos médicos podrían considerar necesario esperar un tiempo mayor para analizar de forma segura los resultados de estudios como el CALGB 9343 y del PRIME II39. Finalmente, la omisión de la RT también puede tardar en generalizarse debido a factores económicos40. Algunas investigaciones han mostrado cómo la retribución económica tras la adopción de una conducta terapéutica, puede conducir a su utilización inadecuada41,42. Se espera que este último factor no sea el determinante fundamental para la administración de la RT en el cáncer de mama.
A pesar de lo anterior, es importante aclarar que los seguimientos a largo plazo de los estudios que evalúan el papel de la RT en el cáncer de mama, sí han demostrado una mejoría en la SG. Es decir, una reducción en la recurrencia sí tiene un impacto en la mortalidad, aunque este beneficio ocurre después del año 1043. En CC, por ejemplo, por cada 4 recurrencias prevenidas a 10 años se evita una muerte por cáncer de mama a 15 años44. En mastectomía, por cada 15 recurrencias prevenidas, se evita una muerte por cáncer de mama a 10 años, independientemente de la administración de la terapia sistémica45. Solo el tiempo dirá si la RT en las pacientes con CDIS o cáncer de mama invasivo de bajo riesgo, ofrece alguna ventaja en supervivencia. No obstante, si se considera que la RT solo se omitiría en las pacientes > 65 años, es probable que en ellas el cáncer de mama juegue un papel menos determinante que las comorbilidades de base27, y que una esperanza de vida menor a 5-10 años sea un criterio para considerar su omisión46. En este grupo de pacientes, los estudios de omisión de la RT han mostrado que la mayoría de las muertes (> 87%) ocurre por causas distintas al cáncer de mama27,29.
ConclusionesCon la evidencia médica actualmente disponible no es claro que exista un subgrupo de pacientes con CDIS o carcinoma mamario invasivo de bajo riesgo, que no se beneficie de la RT adyuvante. Tampoco se puede predecir con certeza si en un fututo va a existir una ventaja en SG, sobre todo si se consideran las características tumorales, la edad, las comorbilidades y la esperanza de vida de las pacientes. El manejo del cáncer de mama debe incluir, entre otros asuntos, un análisis crítico de los beneficios vs. los riesgos de recibir o no RT, ya que omitir esta modalidad de tratamiento podría ser una opción válida en las pacientes seleccionadas, teniendo en cuenta el crítico momento que viven los sistemas de salud a propósito de la pandemia por el nuevo coronavirus. La regla debe ser la elección de conductas médicas basadas en la mejor evidencia científica, que individualicen cada caso y tengan en cuenta no solo los desenlaces clínicos tradicionales como la supervivencia, sino también los análisis de costo-efectividad y calidad de vida.
LimitacionesAunque esta revisión de tema incluye los estudios más importantes sobre la omisión de la RT en el manejo adyuvante del CDIS e invasivo de bajo riesgo, los criterios de selección empleados por las autoras podrían excluir investigaciones relevantes en curso, o documentos publicados en otros idiomas diferentes al inglés. En este documento tampoco se hace un análisis a profundidad de los diseños metodológicos y posibles sesgos de los estudios presentados, ni de la validez interna de los mismos.
Responsabilidades éticasLas autoras declaran que han seguido todas las normas éticas para la publicación de artículos de revisión.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.