Actualmente existen métodos de localización con ventajas frente al arpón. Nuestro objetivo fue analizar la precisión y seguridad de la semilla ferromagnética Magseed® para la localización de tumores no palpables y adenopatías axilares en pacientes con cáncer de mama en nuestro centro.
MétodosEstudio observacional y retrospectivo, desde marzo de 2021 hasta julio de 2022, que incluyó a las pacientes intervenidas por cáncer de mama en nuestra institución en las que se utilizó el sistema Sentimag-Magseed® (Endomag Ltd.) para la localización de tumores no palpables y adenopatías axilares marcadas con clip.
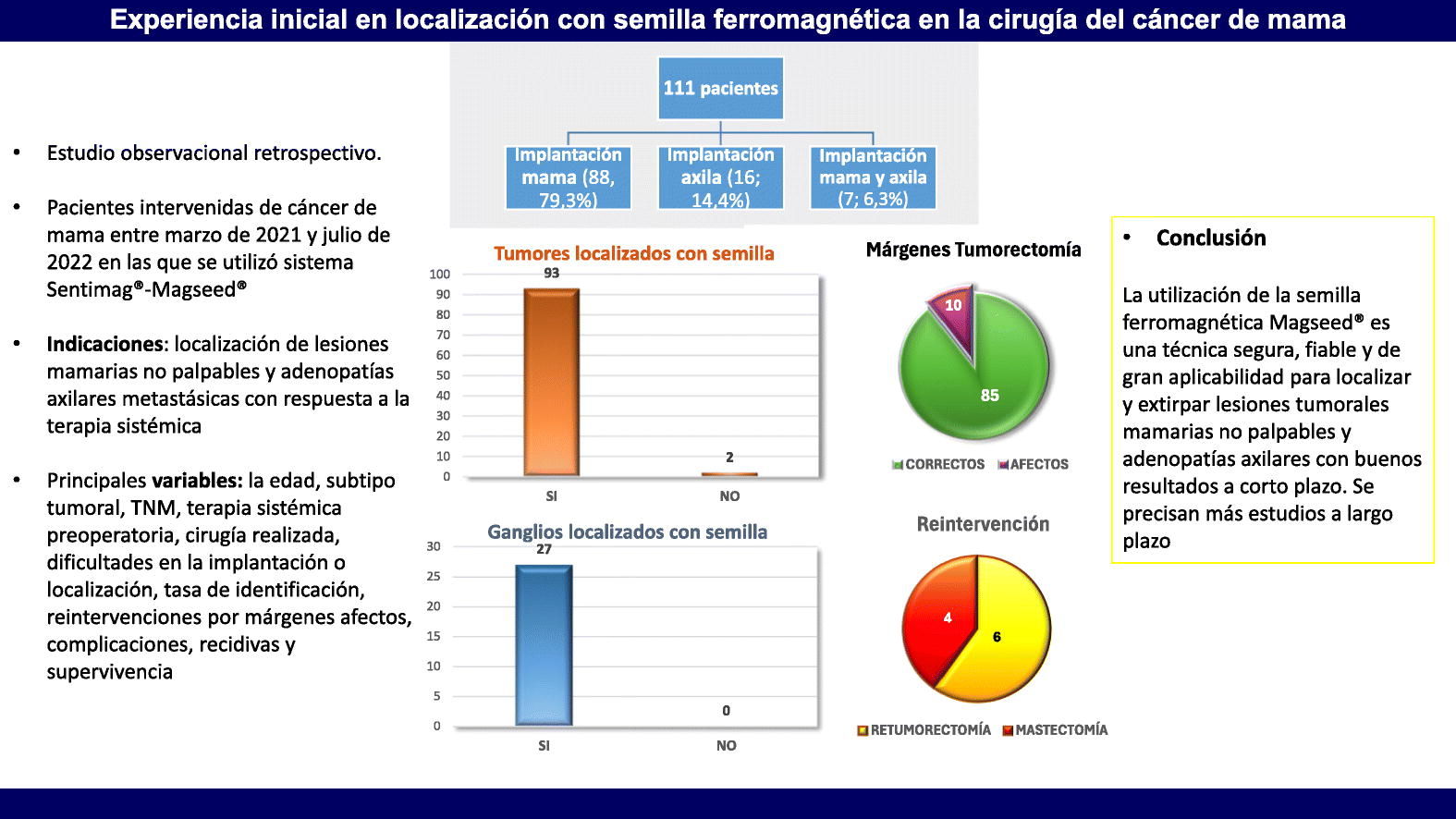
ResultadosSe utilizó Magseed® en 111 pacientes, implantándose en la mama en 88 de ellas (79,3%), en la axila en 16 (14,4%) y en la mama y la axila en 7 (6,3%). Se extirparon en todos los casos los tumores, los ganglios marcados y las semillas. En 2 pacientes (2%) hubo que localizar el tumor con arpón (tasa de identificación [TI]: 98%). En otro caso, se produjo un fallo en la implantación de la semilla en el tumor (1%). En la axila, en 2 casos (7%) la semilla estaba en la grasa periganglionar. La TI de ganglios fue del 100%. Diez pacientes (11%), tuvieron afectación de márgenes, 8 pacientes (8%) tuvieron complicaciones sin relación con el uso de la semilla. La mortalidad operatoria fue del 0% y no hubo recidivas.
ConclusionesEl uso de la semilla Magseed® para la localización de tumores no palpables y adenopatías axilares es un método seguro, fiable y reproducible. Se precisan estudios para valorar sus resultados a largo plazo.
Para la exéresis quirúrgica de lesiones no palpables en la mama es necesario realizar el marcaje del tumor. También se precisa para la disección axilar dirigida (TAD en inglés: Targeted Axillary Dissection), que combina la biopsia selectiva del ganglio centinela (BSGC) con trazadores y la biopsia del ganglio afecto antes de la neoadyuvancia, para lo cual se utiliza un método de localización1,2. Su indicación principal es la estadificación axilar tras terapia sistémica primaria de pacientes con cáncer de mama con ganglios axilares positivos, con respuesta a la misma.
Tradicionalmente, la forma de localizar estas lesiones no palpables y los ganglios axilares ha sido mediante arpones2–5; sin embargo, este método presenta varios inconvenientes, principalmente, el riesgo de movilización y la dependencia de radiología. Actualmente, existen otros métodos de localización como semillas radiactivas6,7, inyección de radiotrazador (técnica ROLL8 y, la más novedosa, A-ROLL)9,10, la ecografía intraoperatoria11,12, tatuaje con tinta de carbón13–15, sistema SAVI-SCOUT®16,17, etc., todos con sus ventajas y sus inconvenientes.
También, recientemente se ha introducido como localizador la semilla ferromagnética (sistema Sentimag®-Magseed®)18–20. Se trata de un sistema compuesto por un localizador–semilla de acero inoxidable (Magseed®) que se introduce de forma radioguiada dentro del tumor o ganglio linfático y se detecta intraoperatoriamente mediante un sistema de detección con una sonda que genera un campo magnético, permitiendo su localización y la extirpación precisa del tejido que la contiene. Se han publicado estudios sobre este método de localización en la mama y en ganglios linfáticos axilares, pero no hay muchos estudios relacionados con la viabilidad de la técnica y sus resultados en nuestro país, y ninguno que analice su experiencia conjunta en localización mamaria y axilar21–24.
El objetivo de este estudio fue analizar la precisión y seguridad de la semilla ferromagnética Magseed® para la localización de tumores no palpables y adenopatías axilares en pacientes con cáncer de mama intervenidas en nuestro centro.
MétodoEstudio observacional retrospectivo, en el que se incluyeron todas las pacientes intervenidas por cáncer de mama en nuestra institución entre marzo de 2021 y julio de 2022, en las cuales se utilizó el sistema Sentimag®-Magseed® (Sysmex-Endomag Ltd.) para la localización de tumores no palpables mamarios y de adenopatías axilares. Se excluyeron aquellas pacientes portadoras de dispositivos cardíacos electrónicos implantables, con stents metálicos coronarios o prótesis valvulares mecánicas, y con alergias que impedían la implantación de la semilla ferromagnética.
El estudio fue aprobado por el Comité de Ética e Investigación Clínica del Hospital Universitario de Gran Canaria Dr. Negrín (código 2020–333-1).
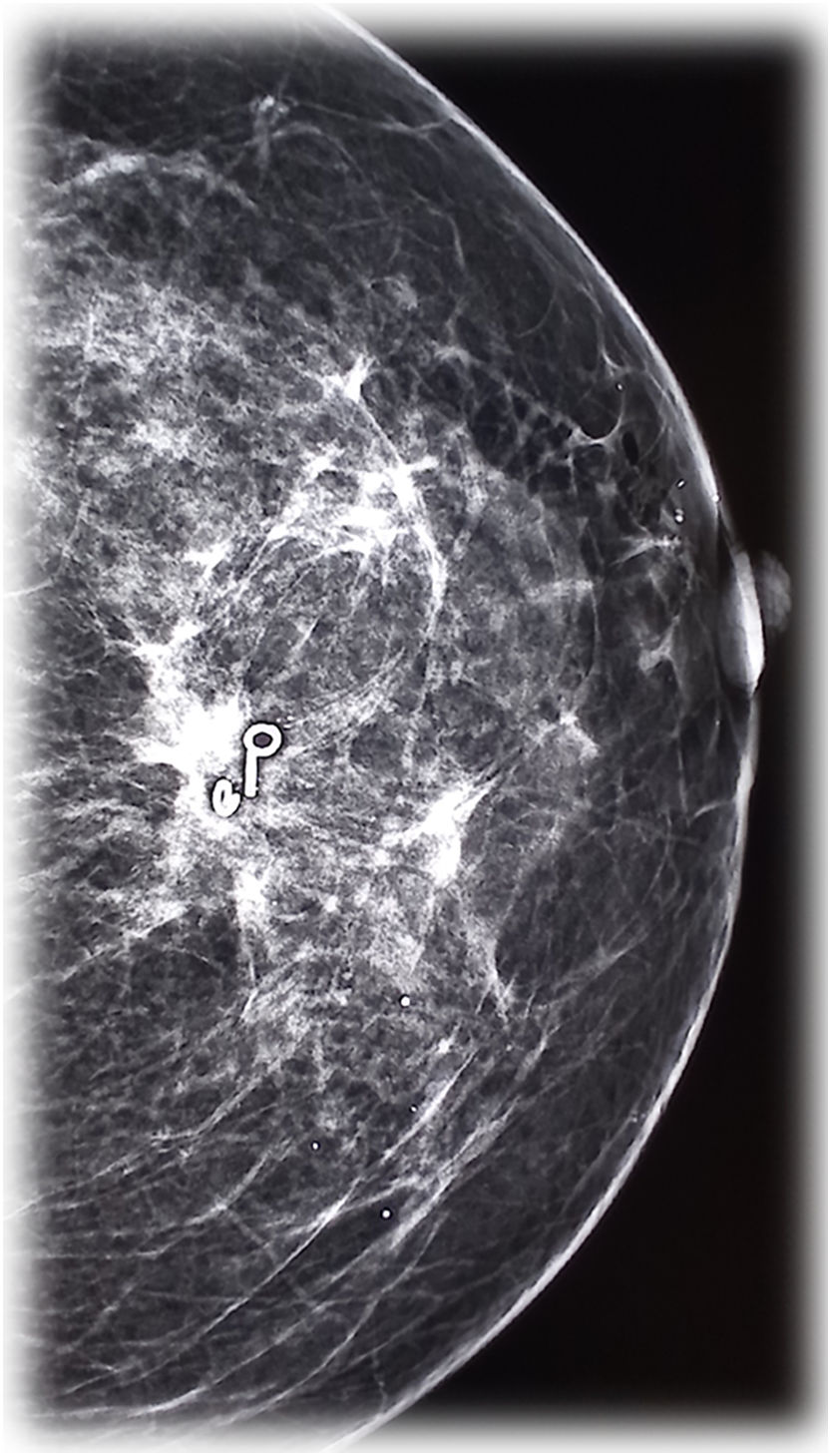
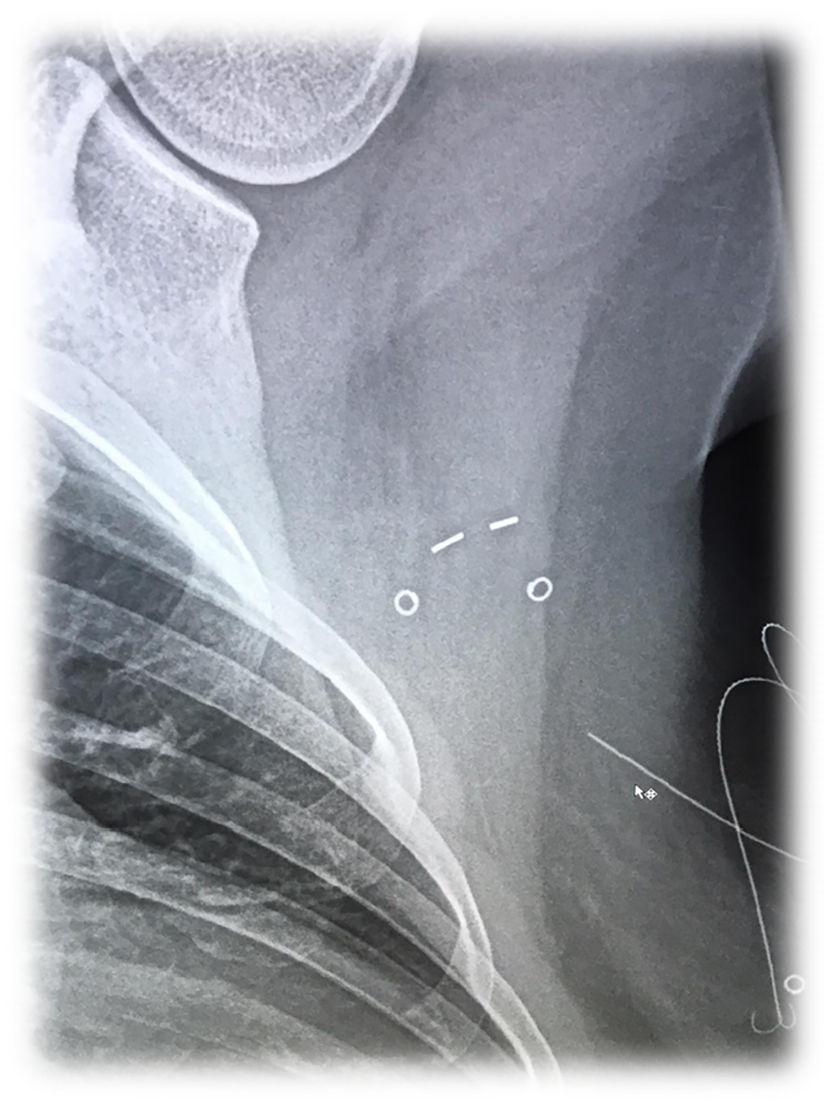
Las indicaciones para la utilización de la semilla ferromagnética fueron: localización preoperatoria y operatoria de tumores malignos mamarios no palpables uni- o multifocales/multicéntricos, susceptibles de ser extirpados mediante cirugía conservadora, antes y después de terapia sistémica (fig. 1) y la localización preoperatoria y operatoria para la exéresis dirigida de adenopatías axilares metastásicas, marcadas antes de la terapia sistémica primaria con clips metálicos (fig. 2).
Se marcó con clips de nitinol (UltraCor® Twirl® de BD-BARD, y en algunos casos, para la axila, Tumark Vision de Somatex® - LELEMAN) antes de la terapia sistémica las lesiones mamarias si la paciente era candidata a cirugía conservadora y en los casos con enfermedad axilar limitada (máximo 3 ganglios axilares metastásicos confirmados por histología, N1), marcando el ganglio más caudal y el más craneal al inicio del estudio y posteriormente, solo el ganglio afecto dominante más caudal21–23.
La semilla ferromagnética Magseed® es una semilla de acero inoxidable y, minoritariamente, de níquel, de 5 × 1 mm, que se coloca dentro del tumor o en el ganglio mediante una aguja de 18 G precargada con la semilla. La técnica consiste en la colocación de la semilla antes de la cirugía por radiología, de forma ecoguiada o mediante estereotaxia. En nuestras pacientes se implantó el mismo día o el día anterior a la cirugía.
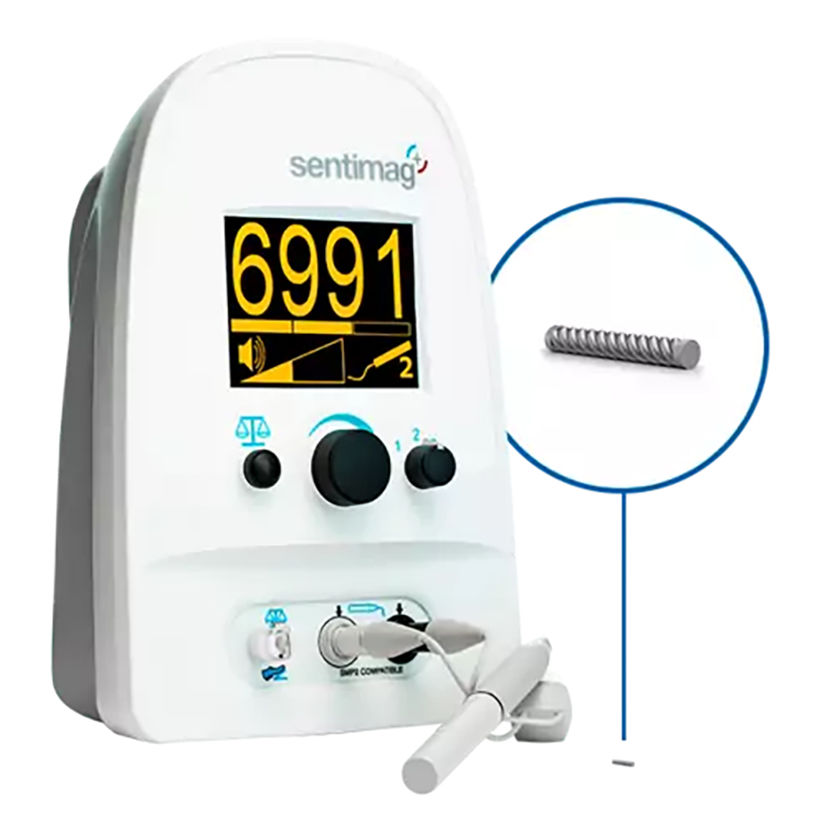
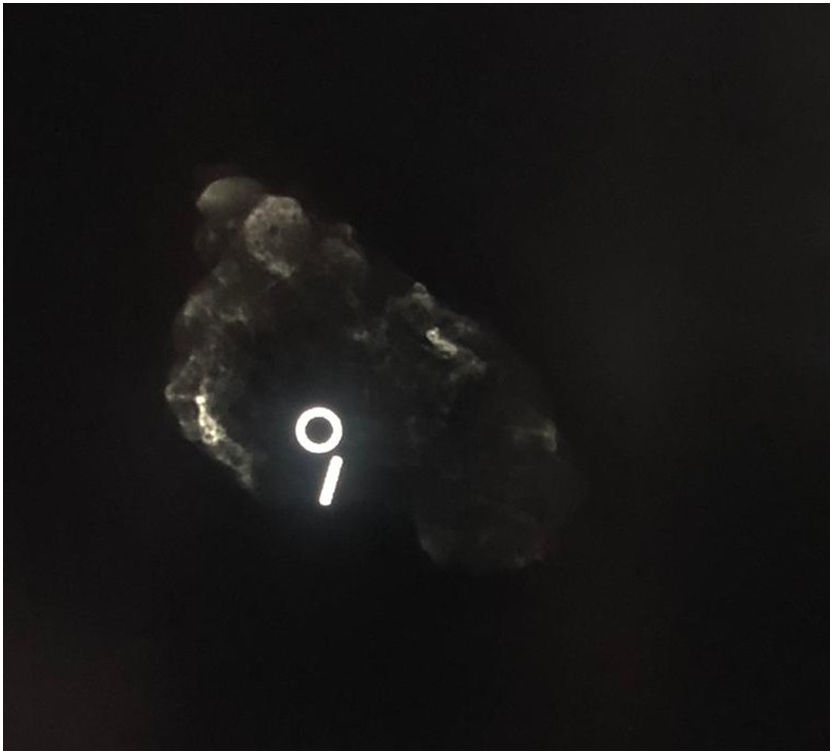
La semilla se localizaba intraoperatoriamente mediante el sistema de detección Sentimag®. Este sistema dispone de una sonda que genera un campo magnético más potente conforme se acerca a la semilla, traduciéndose en un recuento mayor en la pantalla del dispositivo. Este recuento permite calcular la distancia a la que se encuentra la semilla de la sonda, facilitando la exéresis de las lesiones no palpables y adenopatías, de forma precisa y con margen (fig. 3). Se realizó comprobación radiológica mediante mamografía y ecografía, tanto de las adenopatías (fig. 4) como de las piezas de tumorectomía (fig. 5). Se realizó el análisis intraoperatorio histológico macroscópico de la tumorectomía para corroborar márgenes libres, cuando la paciente no había recibido terapia sistémica primaria.
En la axila, tras la terapia sistémica primaria, se realizó TAD guiada por Magseed® si había habido respuesta completa del ganglio marcado. En caso contrario, se realizó biopsia escisional de los ganglios marcados (BE) con clips, guiada por Magseed®, asociada a la linfadenectomía axilar (LA). Ante dudas sobre la respuesta completa, se realizaba previamente una PAAF o BAG confirmatoria antes de la intervención.
Las variables analizadas fueron: edad, localización tumoral, tipo tumoral, tamaño tumoral, TNM, uso de terapia sistémica preoperatoria, cirugía realizada, dificultades perioperatorias en la implantación o localización, tasa de identificación/localización, reintervenciones por márgenes afectos, complicaciones posoperatorias según la clasificación de Clavien-Dindo25, recidivas y supervivencia.
Se realizó un análisis descriptivo. Para las variables cualitativas se utilizó la frecuencia y porcentaje. Para las variables numéricas la media (±desviación estándar) o mediana (rango intercuartil) según siguieran o no una distribución normal.
ResultadosDurante el periodo de estudio, se utilizó la semilla ferromagnética en 111 pacientes. Se implantó en la mama en 88 pacientes (79,3%), en la axila en 16 (14,4%) y en 7 (6,3%) en la mama y en la axila (tabla 1).
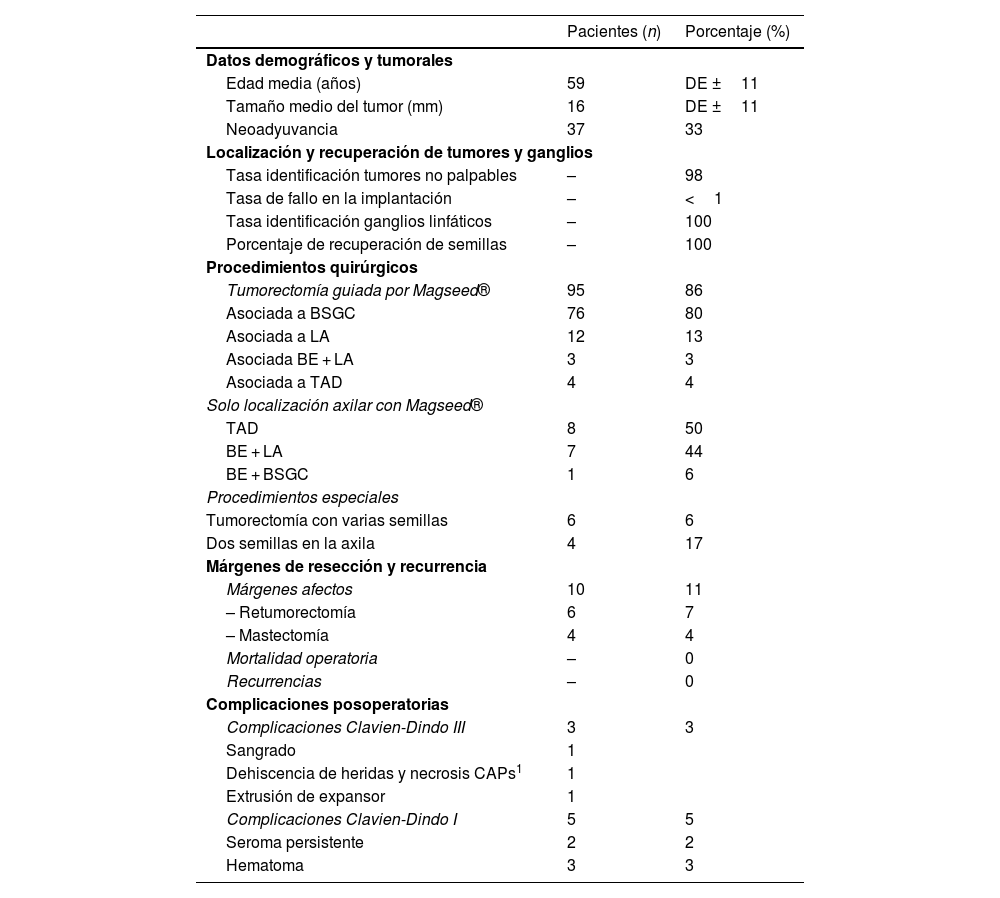
Resultados de las principales variables a estudio en localización mamaria y axilar con semilla ferromagnética en la cirugía del cáncer de mama
| Pacientes (n) | Porcentaje (%) | |
|---|---|---|
| Datos demográficos y tumorales | ||
| Edad media (años) | 59 | DE ±11 |
| Tamaño medio del tumor (mm) | 16 | DE ±11 |
| Neoadyuvancia | 37 | 33 |
| Localización y recuperación de tumores y ganglios | ||
| Tasa identificación tumores no palpables | – | 98 |
| Tasa de fallo en la implantación | – | <1 |
| Tasa identificación ganglios linfáticos | – | 100 |
| Porcentaje de recuperación de semillas | – | 100 |
| Procedimientos quirúrgicos | ||
| Tumorectomía guiada por Magseed® | 95 | 86 |
| Asociada a BSGC | 76 | 80 |
| Asociada a LA | 12 | 13 |
| Asociada BE + LA | 3 | 3 |
| Asociada a TAD | 4 | 4 |
| Solo localización axilar con Magseed® | ||
| TAD | 8 | 50 |
| BE + LA | 7 | 44 |
| BE + BSGC | 1 | 6 |
| Procedimientos especiales | ||
| Tumorectomía con varias semillas | 6 | 6 |
| Dos semillas en la axila | 4 | 17 |
| Márgenes de resección y recurrencia | ||
| Márgenes afectos | 10 | 11 |
| – Retumorectomía | 6 | 7 |
| – Mastectomía | 4 | 4 |
| Mortalidad operatoria | – | 0 |
| Recurrencias | – | 0 |
| Complicaciones posoperatorias | ||
| Complicaciones Clavien-Dindo III | 3 | 3 |
| Sangrado | 1 | |
| Dehiscencia de heridas y necrosis CAPs1 | 1 | |
| Extrusión de expansor | 1 | |
| Complicaciones Clavien-Dindo I | 5 | 5 |
| Seroma persistente | 2 | 2 |
| Hematoma | 3 | 3 |
BSGC: biopsia selectiva del ganglio centinela; CAPs1: complejos areola-pezón; LA: linfadenectomía axilar; BE: biopsia escisional de ganglio marcado; TAD: disección axilar dirigida (Targeted Axillary Dissection).
La edad media fue de 59 años (DE ±11). El tamaño medio del tumor mamario en la histología definitiva de la pieza quirúrgica fue de 16 mm (DE ±11) y la media de ganglios extirpados con TAD fue de 3. Treinta y siete pacientes (33%) habían recibido neoadyuvancia. El subtipo tumoral más frecuente fue Luminal B HER2 negativo (68 pacientes [61%]).
Con respecto a la cirugía realizada, en 95 pacientes (86%) se realizó una tumorectomía guiada por Magseed®. La tumorectomía se realizó asociada a BSGC en 76 pacientes (80%), a linfadenectomía axilar (LA) en 12 (13%), a LA con biopsia escisional de ganglio marcado (BE) con Magseed® en 3 (3%) y a TAD con Magseed® en 4 pacientes (4%).
En las pacientes con únicamente localización axilar con semilla la cirugía axilar correspondió a TAD-Magseed® en 8 casos (50%), a BE-Magseed® + LA en 7 casos (44%) y a BE-Magseed® + BSGC en un caso (6%). Esta última paciente presentaba una adenopatía sospechosa con punción negativa, que fue extirpada mediante marcaje con semilla asociada a BSGC.
En 6 pacientes con tumores multifocales o multicéntricos (6%) se realizó tumorectomía guiada por varias semillas, y en otras 4 pacientes (17%) se colocaron 2 semillas en la axila para la exéresis dirigida de varios ganglios marcados (27 semillas axilares).
En todos los casos se pudo localizar la lesión y los ganglios marcados y extirparlos, aunque en 2 pacientes (2%) hubo que colocar un arpón en el tumor marcado con la semilla porque esta no se detectaba de forma fiable. Por lo tanto, la tasa de localización/identificación (TI) de tumores no palpables con semilla fue del 98%. En otro caso, se produjo un depósito prematuro de la semilla durante la manipulación del sistema de implantación antes de colocarla en el tumor, y se tuvo que colocar otra semilla en la lesión, siendo extirpadas tanto la lesión marcada como la primera semilla, sin incidencias, siendo la tasa de fallo en la implantación menor del 1%.
Con respecto a la axila, en un caso (4%), al realizar la mamografía del ganglio solo se evidenció la semilla magnética, encontrando el clip en la gasa con la que se había llevado la pieza a radiología. En este caso y en otro más (7%), la semilla estaba en la grasa axilar periganglionar. La tasa de localización de ganglios linfáticos con semilla ferromagnética fue del 100%. Todas las semillas fueron recuperadas, tanto en la mama como en la axila.
En 10 pacientes (11%), el margen de resección de la tumorectomía se consideró afecto y se realizó en 6 (7%) retumorectomía y en 4 (4%) mastectomía.
Sobre las complicaciones posoperatorias, 3 pacientes (3%) tuvieron una complicación Clavien-Dindo III y requirieron reintervención: una paciente anticoagulada presentó una hemorragia en el posoperatorio inmediato, otra paciente a la que se le realizó oncoplastia y simetrización presentó dehiscencia de las heridas y necrosis de ambos complejos aréola-pezón, y una tercera paciente a la que se le realizó mastectomía con colocación de expansor submuscular, tuvo la extrusión del expansor. Otras 5 pacientes (5%), tuvieron complicaciones leves (Clavien-Dindo I): 2 pacientes (2%) tuvieron un seroma persistente en la mama y otras 3 (3%), tuvieron un hematoma que se trató de forma conservadora.
La mortalidad operatoria fue del 0%. No ha habido recidivas, si bien el tiempo de seguimiento ha sido corto.
DiscusiónNo hay muchos estudios publicados que analicen la utilidad de la semilla ferromagnética en la cirugía mamaria y axilar en el cáncer de mama de forma conjunta26–28. De los 3 disponibles, 2 son multicéntricos26,27: uno con 39 pacientes26 que se enfoca exclusivamente en lesiones malignas, y el otro, con 100 pacientes, incluyó 82 con lesiones malignas27. El tercer estudio, unicéntrico28, incluyó 673 pacientes, con un 60 y 65% de lesiones mamarias malignas y adenopatías axilares metastásicas, respectivamente.
Entre los métodos de localización mamaria, el arpón, aunque fue el primero, tiene desventajas, como la posible movilización, dependencia de radiología y menor aprovechamiento del quirófano. Las semillas radiactivas7 son eficientes, pero requieren un estricto protocolo regulatorio, además de una compleja coordinación entre los servicios implicados (medicina nuclear, radiología, ginecología-cirugía, etc.) y de una estricta ventana temporal de colocación prequirúrgica.
La técnica ROLL-SNOLL8, descrita en el IEO de Milán, se extendió globalmente por sus buenos resultados, aunque precisa servicio de medicina nuclear y puede haber difusión del radiotrazador.
La ecografía intraoperatoria es un método con buenos resultados, pero requiere experiencia en imagen mamaria, especialmente tras la neoadyuvancia12.
El tatuaje con tinta de carbón tiene inconvenientes, como tatuaje residual, dificultad en la localización de lesiones multifocales y profundas y posibles granulomas residuales13.
El sistema SAVI-SCOUT® tiene una alta precisión (100%) y ventajas como la medición exacta de la distancia en mm y poco artefacto en RM, aunque el tamaño del reflector y su desactivación con electrocauterio son limitaciones. Se ha descrito migración del reflector en contexto de hematomas16.
En nuestra experiencia con la semilla ferromagnética, se extirparon todas las lesiones mamarias y semillas, aunque hubo un fallo en la implantación de una semilla, que requirió la colocación de otra, y en 2 casos no se detectó la semilla intraoperatoriamente, probablemente por la profundidad tumoral (> 5 cm), siendo necesario colocar arpones. El fallo en la implantación y la detección se describen en la literatura27,28. No se recomienda la implantación a más de 4 cm de profundidad, pero con la práctica, esta limitación se resuelve realizando mayor presión en la piel y el parénquima sabiendo la localización por pruebas de imagen. No hubo migración de la semilla, pero sí ha sido documentada en otros estudios, probablemente durante la escisión tumoral26. Todas las semillas fueron implantadas el día anterior o el mismo día de la cirugía.
Se reintervinieron por márgenes afectos a 10 pacientes (11%), cifra similar a la literatura (10–17,2%)18,6–30, demostrando la fiabilidad y reproducibilidad de la técnica, no inferior al arpón, con una tasa de reescisión del 16–20%29,30.
Para la localización de ganglios axilares, también se ha utilizado el arpón. Plecha et al.4 lograron extirpar el 97,3% de los ganglios clipados con arpón, mientras que García-Novoa et al.5 alcanzaron el 100%. Sin embargo, Hartmann et al.3 solo lograron marcar el 80% con clip y extirpar el 70,8%. Las desventajas incluyen la necesidad de colocación inmediata antes de la intervención3,4 y la dificultad técnica, incluso para cirujanos experimentados. La semilla ferromagnética, en cambio, ofrece mayor facilidad para el marcaje y menor tiempo quirúrgico21,7.
Las semillas radiactivas también se utilizan para localizar adenopatías axilares1,6, presentando los inconvenientes comentados anteriormente. Además, deben ser colocadas después de la neoadyuvancia y antes de la intervención quirúrgica, lo que implica que la localización del ganglio que era positivo y ha respondido de forma completa puede ser desafiante y dificultosa.
La ecografía intraoperatoria tiene una tasa de identificación del 95,7%11, pero requiere experiencia en imagen ecográfica.
El sistema SAVI-SCOUT® ha mostrado una tasa de identificación del 100% en ganglios clipados, incluso colocándose antes de la neoadyuvancia17, aunque su tamaño puede ser una limitación.
La inyección de radiotrazador en macroagregados en ganglios clipados (técnica A-ROLL) ha mostrado tasas de localización del 87–97,5%9,10, pero todavía hay pocos estudios en la literatura.
El tatuaje de ganglios con tinta de carbón es económico y visual, sin clips y posible antes de la neoadyuvancia. Boniface et al.14 tuvieron una tasa de identificación del 82,6%, mientras Goyal et al.15 encontraron una tasa de identificación baja en neoadyuvancia (64%).
En nuestra experiencia con Magseed® no hubo dificultades en la implantación axilar y se localizaron todas las semillas y ganglios. En 2 pacientes, la semilla se localizó en la grasa periganglionar y no en el ganglio, posiblemente por desplazamiento del clip tras la terapia sistémica (7%)21,27,28. Este problema podría solucionarse colocando la semilla en el ganglio antes de la terapia sistémica. No se ha documentado migración de la semilla cuando se coloca antes de la neoadyuvancia20,22 y es lo que realizamos en nuestra práctica clínica actualmente. Valoramos la respuesta a la neoadyuvancia mediante RM mamaria y ecografías. Cuando el tumor está muy próximo a la axila y se precisa de marcaje axilar, para evitar el artefacto de la semilla axilar en la RM posterapia sistémica y que se pueda valorar la respuesta en la mama, se emplea un clip para marcar la adenopatía. La semilla se implanta tras la valoración de la respuesta, antes de la intervención.
No hubo complicaciones posoperatorias relacionadas con el uso de la semilla.
Las principales desventajas de la semilla ferromagnética son el coste, el artefacto en RM, la necesidad de material quirúrgico especial de plástico y la calibración frecuente del sistema21,26–28. Sin embargo, las ventajas incluyen incisiones más cosméticas, una trayectoria de disección más directa y mayor eficiencia del quirófano28. Además, cuando se implanta de forma independiente al procedimiento quirúrgico, podría reducir la ansiedad de las pacientes al evitar procedimientos invasivos adicionales antes de la cirugía30.
Las limitaciones del estudio son su naturaleza retrospectiva y monocéntrica, la falta de análisis comparativo con técnicas similares y un seguimiento relativamente corto. A pesar de esto, se demuestran las ventajas e inconvenientes de la semilla ferromagnética para la localización de lesiones no palpables en mama y axila.
ConclusionesLa utilización de la semilla ferromagnética Magseed® se presenta como una técnica segura, fiable y con gran aplicabilidad para localizar y facilitar la extirpación de lesiones no palpables tumorales mamarias y de adenopatías axilares, con buenos resultados a corto plazo. Se precisan más estudios para valorar sus resultados a largo plazo.
Consideraciones éticasEl estudio fue aprobado por el Comité de Ética e Investigación Clínica del Hospital Universitario de Gran Canaria Dr. Negrín (Código 2020–333-1).
Consentimiento informadoLos autores confirman que cuentan con el consentimiento informado de las pacientes.
FinanciaciónLos autores declaran que el presente estudio fue financiado recibiendo la Beca Especial de Investigación Dr. González-Jaraba del Colegio Oficial de Médicos de Las Palmas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Declaración de la IA generativa y las tecnologías asistidas por IA en el proceso de escrituraDurante la preparación de este trabajo los autores utilizaron Gemini Advanced® y Copilot® para la redacción, con el único fin de mejorar la legibilidad, el lenguaje y adecuar la extensión de los apartados originales previamente redactados por los autores. Tras utilizar dichas herramientas, los autores revisaron minuciosamente y editaron el contenido según necesidad, asumiendo la plena responsabilidad del contenido de la publicación.