¿ INTRODUCCIÓN
En México, el cáncer de próstata (CaP) es la segunda neoplasia más común después del cáncer de piel en los varones y en 2001 ocupó el primer lugar como causa de muerte por tumores malignos en varones.1
El estrés oxidativo se considera un estado en que hay un exceso de especies reactivas de oxígeno (EROs) así como una disminución de antioxidantes endógenos.2,3
De tal manera que en éste estado de estrés oxidativo es en donde se manifiestan las lesiones que producen los radicales libres. Estos reaccionan con lípidos, proteínas, carbohidratos y con el ADN de las células; pero también con componentes de la matriz extracelular, por lo que pueden desencadenar un daño irreversible que, si es muy extenso, puede llevar a la muerte celular. El desbalance entre oxidantes y antioxidantes está asociado a la fisiopatología de varias entidades patológicas, el mismo el proceso biológico del envejecimiento se acelera en relación directa con la magnitud del estrés oxidativo.4
Recientemente se ha relacionado que el daño oxidativo juega un papel crítico en varias condiciones clínicas como lo son las enfermedades malignas. Las EROs pueden causar oxidación del ADN y daño a proteínas, daño a genes supresores tumorales y un aumento en la expresión de protooncogenes. El cáncer muestra un cambio prooxidativo en el estado oxidoreducción. Las EROs son potenciales carcinógenos ya que facilitan la mutagénesis, además de la promoción y progresión de los tumores; incluso células normales muestran una incrementada proliferación y expresión de genes relacionados con el crecimiento si son expuestas a peróxido de hidrógeno o superóxido.
La óxido nítrico sintasa (NOS) es una enzima que contiene un grupo con secuencia similar al citocromo P-450 reductasa. En el humano existen a tres isoformas de NOS localizadas en el cromosoma 17; las isoformas constitutivas: óxido nítrico sintasa neuronal (nNOS) y óxido nítrico sintasa endotelial (eNOS), son reguladas por concentraciones de calcio entre 70 nM a 100 nM y la isoforma inducible, la sintasa de óxido nítrico inducible (iNOS), que solamente requiere concentraciones de calcio entre 30 nm a 70 nm porque está unida constitutivamente a calmodulina, a diferencia de las otras isoformas. La iNOS, además de que se induce por lipopolisacaridos (LPS) y citocinas como INF, FNT e IL1, está presente constitutivamente en el epitelio bronquial, riñón y algunos tejidos fetales. La eNOS se regula constitutivamente en endotelio por la tensión que ejerce el flujo sanguíneo sobre la pared vascular (tensión de fricción) pero puede inducirse con el ejercicio crónico o con el embarazo.
La regulación de la expresión de las NOS es controlada tanto a nivel transcripcional como postranscripcional. Estas enzimas son fosforiladas por una variedad de proteincinasas y por la tetrahidrobiopterina (H4B).
El papel funcional del NO puede variar por cada estirpe celular y de isotipo de enzima que lo produce. La principal función de la eNOS es la regulación vascular. La isoforma inducible de la NOS, se detecta principalmente en células inmunes y es activada principalmente por el componente de la pared celular de las bacterias.5
La iNOS se puede encontrar en diferentes tejidos que cursan con procesos inflamatorios. La resultante generación de NO puede ser benéfica, pero en ocasiones puede estar involucrado en procesos patológicos, dependiendo en parte en la cantidad generada de NO y la prevalencia de condiciones oxidantes en el tejido.5
La inmunoestimulación de citocinas o la actividad patógena bacteriana activa la iNOS y genera altas concentraciones de NO a través de la activación de factores nucleares inducibles incluyendo NFk-B. La sobreproducción de NO en los organismos vivos, está determinado a diferentes niveles celulares, los tratamiento a esta sobreproducción NO, a veces se logra sin afectar los niveles fisiológicos del mismo.6
Cabe mencionar que la NOS está involucrada en la promoción del crecimiento tumoral; por lo que existirán diferencias importantes en la regulación de la expresión de la oxido nítrico sintasa endotelial e inducible en tejidos con cáncer de próstata, en comparación con tejidos con HPB, de tal manera que esta regulación pueda ser utilizada en el diagnóstico de esta enfermedad.
¿ MÉTODOS
Sujetos de estudio: La recolección de muestras se llevó a cabo del mes de septiembre de 2008 a abril de 2009, de pacientes atendidos en el Hospital Central Militar, que cumplieron con los siguientes criterios; de inclusión: a) pacientes con diagnóstico de CaP, candidatos a cirugía radical de próstata; b) pacientes con diagnóstico de CaP con indicación de tunelización prostática; c) pacientes con diagnóstico de HPB con indicación de resección transuretral prostática (RTUP). Criterios de exclusión: a) pacientes que no autorizan participar en el procedimiento; b) pacientes que no sean candidatos a RTUP. Criterios de eliminación: a) cantidad de tejido insuficiente; b) pacientes cuyo RNA extraído y purificado presentaba una concentración y pureza inadecuada para el estudio; c) tejido que en el traslado sufriera desnaturalización de material nucléico. La cantidad de tejido necesaria para la investigación fue de 200 mg, como mínimo.
La cantidad de tejido necesaria para la Investigación fue de uno hasta cinco gramos, la obtención de las muestras se hizo inmediatamente después de la realización de la intervención quirúrgica, el tiempo de traslado que se tomó como máximo fue de una hora; desde la obtención de la muestra hasta su traslado al laboratorio de Biología Molecular de la Escuela Médico Militar, donde se mantuvieron a una temperatura de -70°C en el ultracongelador Revco® (Legaci ULT2186 3-35 Dupont SVVA Refrigerants).
Inmunohistoquímica: Por microscopía de luz, las muestras de tejidos de CaP y HPB fueron fijadas por inmersión en formalina (pH = 7.4) y se embebieron en parafina. Para el análisis histológico, secciones de tejido (3 mm) fueron teñidas con hematoxilina y eosina (H&E). Las secciones de tejido fueron teñidas con ácido periódico de Shiff`s (PAS) para mostrar los polisacáridos, mucopolisacáridos y glicoproteínas de la membrana celular.
Los cortes fueron incubados con ácido peryódico durante cinco minutos y lavados con agua destilada. Los cortes fueron incubados con el reactivo de Schiff`s durante cinco minutos y contrateñidos con hematoxilina por 30 segundos. El perfil histológico de cinco campos seleccionados aleatoriamente fueron registrados utilizando el software KS-300 (Carl Zeiss, Jena, Germany). El porcentaje de área dañada con alteraciones histopatológicas fue obtenido (magnificación 400x). Para la inmunohistoquímica las secciones de tejido (3 mm) se desparafinaron y se calentaron para desenmascarar los sitios antigénicos; la actividad endógena de la peroxidasa fue bloqueada con 0.03% de H2O2 en metanol absoluto. Las secciones de tejido fueron incubadas toda la noche a 4ºC a una dilución 1:200 de anticuerpo monoclonal contra eNOS en solución TRIS Se removió el anticuerpo primario y se realizaron dos lavados repetitivos con TRIS, los cortes fueron incubados con una dilución 1:500 de anticuerpo policlonal de conejo como anticuerpo secundario y se realizaron dos lavados repetitivos con TRIS. Los anticuerpos unidos se detectaron con el complejo avidina-biotina (ABC-kit Vectatastain) y la diaminobenzidina como sustrato. Después de lavar repetidamente con TRIS los cortes fueron contrateñidos con hematoxilina. Todos los cortes fueron incubados bajo las mismas condiciones con la misma concentración de anticuerpo y en la misma corrida, por lo tanto, la inmunotinción fue comparable. Todos los especimenes fueron examinados por el microscopio de luz Axiovert 200M (Carl Zeiss, Jena, Germany). Para el análisis morfométrico automatizado, el porcentaje de células positivas (color marrón) se determinaron con un analizador de imágenes computarizado KS-300 3.0 (Carl Zeiss, Jena, Germany). Este equipo detecta automáticamente las células positivas determinando su porcentaje por campo. Cinco campos aleatorios fueron estudiados a una magnificación de 100 (área total 1584 000 m2). Los resultados fueron expresados como porcentaje.
Análisis de datos: Los datos de la inmunorreactividad para eNOS se analizaron con la prueba t de student y los datos se expresaron como media ± error estándar de la media (EEM), se compararon ambos grupos (CaP y HPB) y se consideró un valor de p < 0.05, como diferencia estadísticamente significativa. Para la aplicación de las pruebas estadísticas se utilizó el programa Graph Prism versión 3.32. Los datos se expresaron como media ± desviación estándar, se compararon ambos grupos (CaP y HPB) y se considero una p < 0.05 como diferencia estadísticamente significativa.
Para la aplicación de las pruebas estadísticas se utilizó el programa Graph Prisma versión 3.32.
¿ RESULTADOS
Del total de los 81 pacientes se obtuvieron las muestras biológicas, 42 pacientes (51.85 %) tenían diagnóstico establecido de CaP (Gleason 4.47 ± 3.1, edad: 67.77 ± 8.65 años, APE = 35.29), mientras que 39 pacientes (48.14%) tuvieron diagnóstico establecido de HPB (edad: 64.37 ± 11.07 años, APE = 26.32).
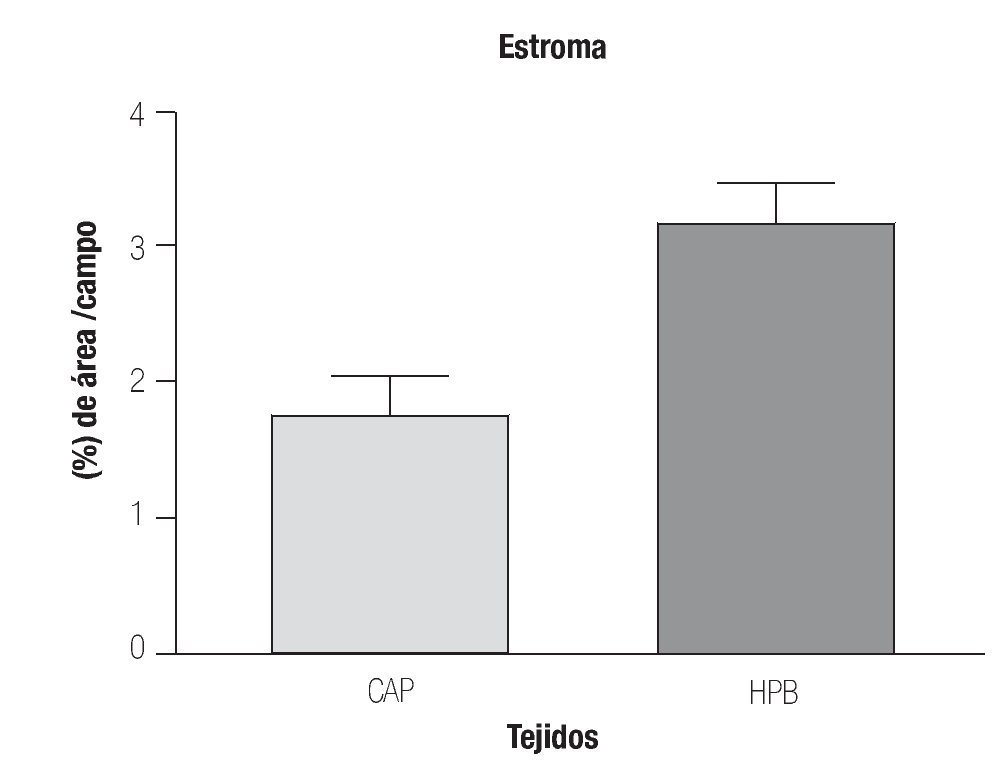
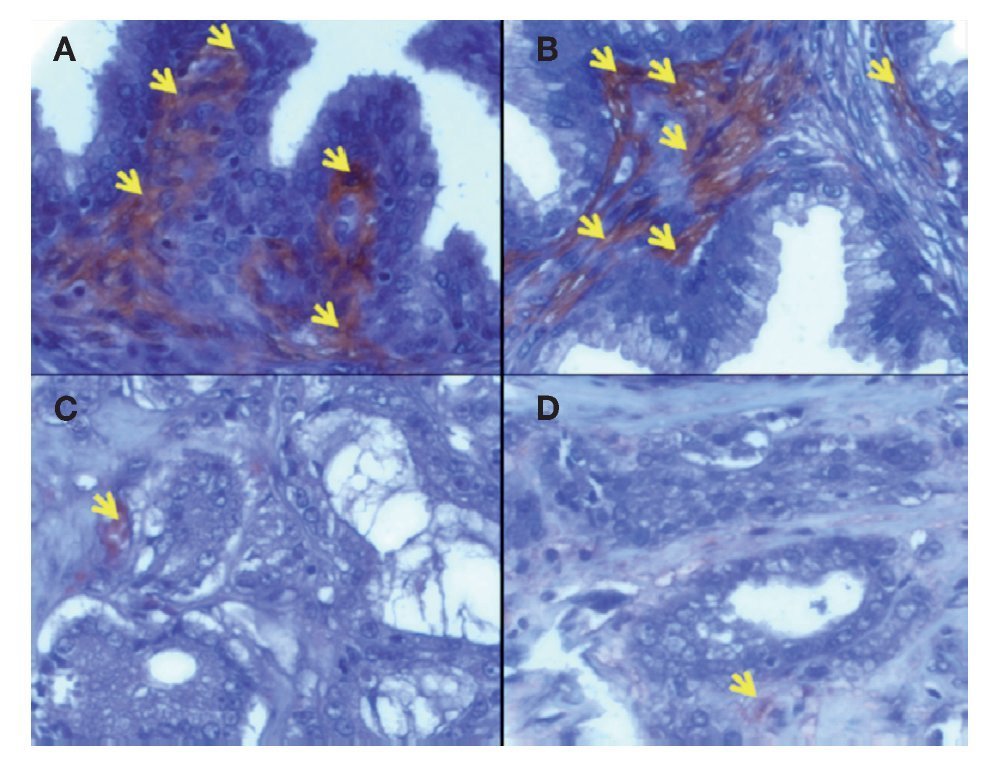
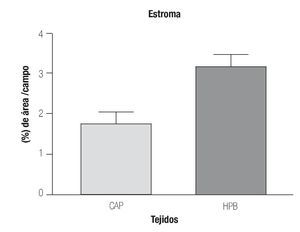
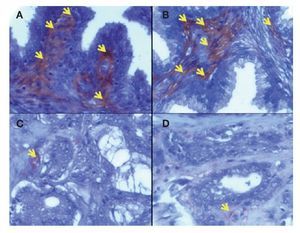
Expresión cuantitativa de eNOS en hiperplasia prostática benigna y cáncer de próstata en tejido estromal. En la Imagen1 se puede observar mayor expresión de la eNOS en estroma de HPB (3.162 ± 0.32%) en comparación con el estroma en CaP (1.1779 ± 0.25%) (p = 0.0014) y en la Imagen 2 (A y B en estroma de hiperplasia prostática benigna y C y D en estroma de cáncer de próstata).
Imagen 1. Determinación por inmunohistoquímica de la expresión de eNOS en estroma de CaP y HPB.
Imagen 2.Localización de eNOS por inmunohistoquímica. Imágenes representativas de la expresión de eNOS en cortes de tejido humano con diagnóstico histopatológico de HPB (A, B) y CaP (C, D) con Gleason de 8.
¿ DISCUSIÓN
La evidencia indica que las alteraciones en las EROs y ERNs promueven el crecimiento neoplásico, ya que estas especies reactivas están involucradas en la transducción de señales, teniendo importantes actividades en la regulación de las funciones biológicas, por lo que se ha sugerido que el NO y la nitración de las proteínas puedan tener efectos importantes en el desarrollo tumoral.
Por otra parte, en diversas entidades patológicas, como es el cáncer, se ha evidenciado que la expresión de las tres isoformas de las sintetasas de NO (inducible: iNOS, endotelial: eNOS y neuronal: nNOS) están aumentadas, como lo mencionan Klotz T. Blochw y colaboradores en 1998, que sugirieron que aumenta el NO a expensas de la iNOS, teniendo una función importante en el desarrollo de tumores y de la angiogénesis. Estas sintasas no han sido suficientemente estudiadas en el CaP, el dato indica que las concentraciones de estas enzimas son bajas en el tejido benigno de este órgano y ellos concluyen que la expresión de iNOS epitelial puede ser usada como un marcador especifico de CaP, ya que el NO en parte, tiene una función importante en el desarrollo de la enfermedad. Gradini y colaboradores (1999) en parte apoyan esta conclusión, ya que encontraron que hay un aumento en la expresión de iNOS en tejidos de HPB, lo que no se observa en tejidos normales de próstata.7
Cronauer y colaboradores (2007), demostraron que la inflamación crónica incrementa el riesgo a desarrollar diversos tipos de cáncer, entre ellos, el de próstata; en este estudio se evidenció que la iNOS está implicada en el desarrollo y aumento del proceso inflamatorio, ya que a expensas de esta enzima la producción de NO está aumentado, lo que condiciona la presencia de inflamación aguda o crónica; incluso la presencia de enfermedades autoinmunes o en la génesis tumoral, como en nuestro estudio, lo que podría estar condicionando aumento de los procesos inflamatorios tanto agudos como crónicos, procesos que ya hemos comentado pueden estar implicados en la etiopatogenia de las neoplasias, aunque en la bibliografía, en la mayoría de las enfermedades el papel de la actividad de la iNOS es poco entendida y no hay todavía consistencia en los datos encontrados en diversos estudios. En el mismo estudio, en biopsias de CaP y por inmunohistoquímica, encontraron que la expresión de la proteína iNOS en las células tumorales está fuertemente relacionada con la concentración de 3-NT, lo cual indica que tiene una función muy importante en el proceso, desarrollo y progresión tumoral.8 En el estudio mencionado, sus autores sugirieron que la actividad intratumoral del iNOS favorece el desarrollo de células y que éstas son capaces de proliferar de manera independiente, promoviendo de este modo el desarrollo a células neoplásicas. Las observaciones anteriores parecen sugerir la importancia que posee el óxido nítrico en la señalización de la oncogénesis.
¿ CONCLUSIONES
Los resultados anteriores parecen sugerir que el eNOS tiene un importante papel en el desarrollo del CaP.
Abreviaturas
CaP: Cáncer de próstata
EROs: Especies Reactivas de Oxígeno
ERNs: Especies Reactivas de Nitrógeno
HPB: Hiperplasia Prostática Benigna
eNOS: sintasa de óxido nítrico endotelial
Correspondencia: Dr. Esaú Floriano Sánchez.
Cerrada de palomas S/N. Colonia Lomas de San Isidro. México, D.F.
Teléfono: 5540 7728 extensión 175. Fax: 5255 20 2121.
Correo electrónico: