El crecimiento prostático benigno, secundario a la hiperplasia prostática benigna, es una patología altamente prevalente en el mundo, que afecta la calidad de vida de muchos hombres y causa un gasto en salud muy alto.
Actualmente, se ha puesto énfasis en los síntomas del tracto urinario inferior, que pueden ser causados por la hiperplasia prostática benigna, así como por otras etiologías. La etiopatogenia exacta de estos síntomas no está claramente establecida, pero se relaciona con la edad (aparece más frecuentemente en hombres >50 años), con el crecimiento prostático, con antecedentes familiares, con patología vascular, con procesos inflamatorios prostáticos y, eventualmente, con la hipertensión arterial y el síndrome metabólico.
Para un adecuado tratamiento, se requiere de un diagnóstico preciso, con estudios diagnósticos específicos, pero no complejos.
El tratamiento ha cambiado en las últimas décadas y con la evolución de la tecnología, han aparecido diferentes alternativas. Las opciones van desde la observación, tratamiento médico y diferentes alternativas quirúrgicas, a las terapias mínimamente invasivas. La cirugía abierta y la resección transuretral de la próstata son, posiblemente, las terapias más usadas en el mundo entero. Las técnicas que utilizan el láser (vaporización y enucleación) ofrecen una excelente alternativa a las dos anteriores, pero requieren de un costoso equipamiento y un aprendizaje adecuado. Otras técnicas mínimamente invasivas no han demostrado un efecto duradero a largo. Los resultados de los tratamientos médico y quirúrgicos son efectivos y a largo plazo.
En el futuro seguiremos conociendo nuevas opciones de manejo para esta frecuente enfermedad.
Benign prostatic enlargement (BPE), secondary to benign prostatic hyperplasia, is a highly prevalent pathology in the world, which affects the quality of life of many men and causes a very high health expenditure.
Currently, emphasis has been placed on lower urinary tract symptoms, which may be caused by benign prostatic hyperplasia, as well as other etiologies. The exact etiopathogenesis of these symptoms is not clearly established, but it is related to age, prostate growth, family history, vascular pathology, prostatic inflammation, and possibly hypertension and metabolic syndrome.
For an adequate treatment, an accurate diagnosis is required, with specific, but not complex diagnostic studies.
The treatment has changed in the last decades and with the evolution of technology, different alternatives have appeared. Options range from observation, medical treatment and different surgical alternatives to minimally invasive therapies. Open surgery and transurethral resection of the prostate (TURP) are possibly the most widely used therapies in the world. The use of laser (vaporization and enucleation) offers an excellent alternative to surgery and TURP, but it requires an expensive equipment and has a considerable learning curve. Other minimally invasive techniques have not demonstrated long lasting effect. The results of medical and surgical treatments are effective and have a long term result.
In the future new options will be developed for this frequent disease.
La hiperplasia prostática benigna (HPB) es un término histológico, que se refiere al crecimiento benigno de la próstata, que aparece con la edad y por estímulo de la testosterona, generalmente, después de los 35 a 40 años de edad. El crecimiento prostático benigno (CPB) es un término clínico más apropiado y así nos referiremos en adelante. El conjunto de síntomas y signos clínicos asociados al crecimiento prostático, que constituían el llamado “prostatismo”, hoy se denominan síntomas del tracto urinario inferior (STUI) o LUTS (del inglés, Lower Urinary Tract Symptoms).
La disfunción eréctil (DE) se define como la incapacidad permanente para iniciar o mantener una erección suficiente como para permitir una relación sexual satisfactoria. El término “impotencia”, que fue usado por largo tiempo como sinónimo de DE, ha sido objetado por sus implicancias peyorativas y falta de precisión para definir este fenómeno, por lo que las guías internacionales recomiendan abandonar su uso.
Tanto los síntomas derivados del CPB como la disfunción eréctil son cuadros clínicos que cada vez se presentarán con más frecuencia en la práctica de médicos generales, por lo que es fundamental que estos sean capaces de realizar un adecuado diagnóstico y manejo inicial de estas patologías.
Se debe mencionar que, en Chile, la hiperplasia prostática benigna (HPB) o CPB es una patología GES (AUGE). Por tanto, el paciente tiene derecho a acogerse a los beneficios que otorga la ley (1).
Epidemiología, etiología y fisiopatología del crecimiento prostático benignoLos STUI pueden ser agrupados en tres categorías: de almacenamiento, de micción o vaciamiento y síntomas post miccionales (2). Estos síntomas son muy prevalentes y, habitualmente, afectan la calidad de vida del paciente. Pueden ser causados por diferentes condiciones clínicas (ver Tabla 1).
Condiciones clínicas que causan STUI
| Obstrucción prostática benigna |
| Cálculo ureteral distal |
| Tumor vesical |
| Estenosis uretral |
| Cuerpo extraño vesical |
| Infección urinaria |
| Disfunción vesical neurogénica |
| Síndrome dolor pelviano crónico |
| Poliuria nocturna |
| Hiperactividad del detrusor |
| Hipoactividad del detrusor |
Los STUI están claramente relacionados con la edad. Si se toma en consideración el CPB, su prevalencia va desde un 8% en hombres entre 31 y 40 años, 40-50% entre 51 y 60 años y sobre el 80% en mayores de 80 años (3). La historia familiar también juega un rol importante, ya que la HPB es más frecuente en hombres cuyos padres fueron operados de cirugía prostática antes de los 50 años (4).
Existen también factores vasculares (asociación de cardiopatía coronaria y disfunción eréctil (DE)) que juegan un rol en el desarrollo de STUI (5).
La enfermedad cardiovascular podría ser el origen compartido de la HPB y la DE. La hipertensión arterial y los síntomas de CPB estarían relacionados con el síndrome metabólico y la hiperactividad del sistema nervioso simpático (6).
Los factores de riesgo metabólico han sido asociados al desarrollo y progresión de CPB. Se ha visto una relación entre el crecimiento prostático y el índice de masa corporal (7).
Los STUI se han relacionado tradicionalmente con la obstrucción de salida vesical (bladder outlet obstruction: BOO), habitualmente, producida por el CPB (2,8). Sin embargo, en estudios recientes se ha visto que los STUI muchas veces no están relacionados con la próstata.
La inflamación prostática también parece jugar un rol en la patogénesis y la progresión del CPB. La inflamación prostática es multifactorial, postulándose como mecanismo, el reflujo urinario hacia los conductos prostáticos y la colonización e infección bacteriana.
En pacientes con CPB se ve con frecuencia la asociación entre STUI, disfunción eréctil y dolor pelviano crónico. Es así como se habla de una disfunción del tracto urinario inferior.
Epidemiología, etiología y fisiopatología de la disfunción eréctilLos primeros estudios poblacionales publicados sobre DE datan de principios de los 90 y conservan aún su vigencia. Todos reflejan la influencia que la edad tiene sobre la prevalencia de esta patología, así como su estrecha relación con las enfermedades cardiovasculares. Dependiendo de la definición utilizada y del diseño del estudio, la prevalencia varía entre el 10 y el 52%, en particular en hombres entre 40 y 70 años, con una incidencia en occidente de 25-30 nuevos casos por 1000 habitantes y año (9,10).
La DE comparte factores de riesgo con la enfermedad cardiovascular, tales como sedentarismo, obesidad, hipertensión, tabaquismo, hipercolesterolemia y síndrome metabólico.
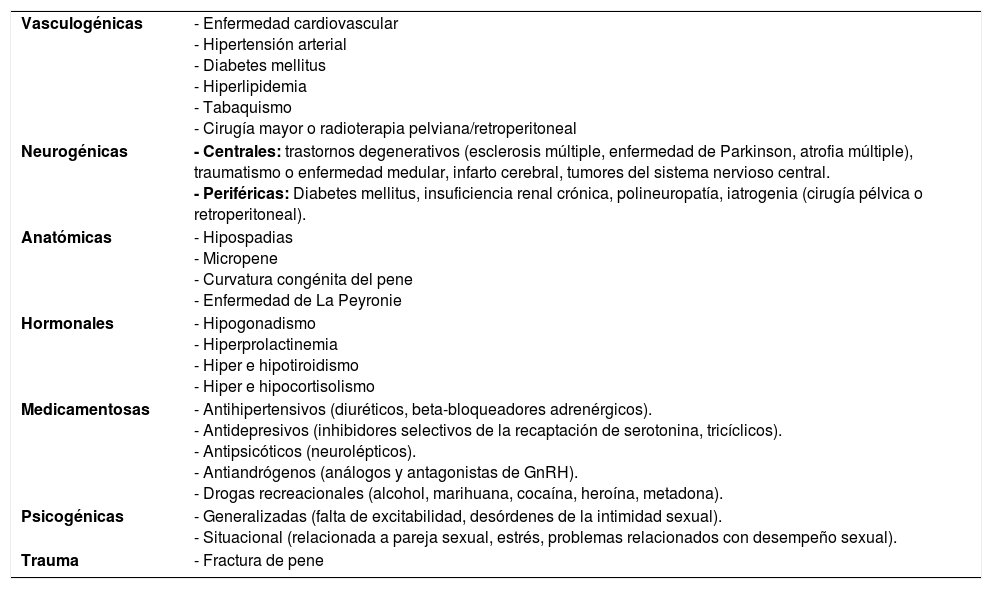
La etiología de la DE es multifactorial (ver Tabla 2), encontrándose causas orgánicas (25%), psicógenas (25%), mixtas (45%). Dentro de los factores orgánicos se pueden organizar en vasculares (45%), diabetes (30%), drogas y medicamentos (15%), neurológicos (10%), cirugía pelviana, traumas, y radiaciones (6%), endocrinológicos (3%) y otros (1%) (10).
Etiología de la disfunción eréctil (DE)
| Vasculogénicas | - Enfermedad cardiovascular - Hipertensión arterial - Diabetes mellitus - Hiperlipidemia - Tabaquismo - Cirugía mayor o radioterapia pelviana/retroperitoneal |
| Neurogénicas | - Centrales: trastornos degenerativos (esclerosis múltiple, enfermedad de Parkinson, atrofia múltiple), traumatismo o enfermedad medular, infarto cerebral, tumores del sistema nervioso central. - Periféricas: Diabetes mellitus, insuficiencia renal crónica, polineuropatía, iatrogenia (cirugía pélvica o retroperitoneal). |
| Anatómicas | - Hipospadias - Micropene - Curvatura congénita del pene - Enfermedad de La Peyronie |
| Hormonales | - Hipogonadismo - Hiperprolactinemia - Hiper e hipotiroidismo - Hiper e hipocortisolismo |
| Medicamentosas | - Antihipertensivos (diuréticos, beta-bloqueadores adrenérgicos). - Antidepresivos (inhibidores selectivos de la recaptación de serotonina, tricíclicos). - Antipsicóticos (neurolépticos). - Antiandrógenos (análogos y antagonistas de GnRH). - Drogas recreacionales (alcohol, marihuana, cocaína, heroína, metadona). |
| Psicogénicas | - Generalizadas (falta de excitabilidad, desórdenes de la intimidad sexual). - Situacional (relacionada a pareja sexual, estrés, problemas relacionados con desempeño sexual). |
| Trauma | - Fractura de pene |
Una función sexual normal requiere una adecuada función e interacción de múltiples sistemas del organismo: Cardiovascular, Endocrino, Nervioso (Central y Periférico). El impulso sexual se origina en respuesta a estímulos eróticos visuales, auditivos o generados a través de fantasías. Dicha percepción sexual a nivel central se retransmite a un centro nervioso de la médula espinal que se encuentra entre T-11 y L-2, denominado “centro de la erección toracolumbar”. A partir de ahí, los impulsos neuronales fluyen hacia el lecho vascular de la pelvis, donde se redistribuye la sangre en los cuerpos cavernosos. Por otra parte existen erecciones reflejas creadas por el estímulo táctil del pene o del área genital, que son producto de un arco reflejo en la región sacra originada entre S2 a S4 (centro de erección sacra).
Una erección normal requiere indemnidad del sistema arterial, en especial del territorio ilíaco interno, especialmente las cámaras especializadas que conforman los cuerpos cavernosos. Las neuronas que inervan los cuerpos cavernosos secretan Acetilcolina, la cual a nivel de las células endoteliales induce la secreción de Óxido Nítrico (ON). El ON difunde a través de las membranas llegando a la célula muscular lisa, donde estimula a la enzima Guanilato Ciclasa (GC), ésta a su vez genera GMP cíclico (GMPc), el cual activa la Proteína Kinasa G (PKG), la cual inhibe la secreción de Calcio por parte del retículo endoplasmático liso, logrando con esto la relajación del músculo liso y vasodilatación arterial. A medida que el flujo sanguíneo aumenta, la presión intracavernosa aumenta dramáticamente, esto genera un importante aumento de la tensión de la túnica albugínea, lo que provoca el cierre de las venas emisarias que la atraviesan, disminuyendo el retorno venoso. Esta combinación permite adquirir y mantener una erección firme. La detumescencia (pérdida de erección) ocurre cuando la vasodilatación inducida por ON desaparece por el metabolismo del GMPc, mediado por la GMPc fosfodiesterasa tipo V (PDE-5). La detumescencia también en parte es regulada por la norepinefrina (11,12).
Con respecto al control hormonal, la testosterona juega un rol integral en la función sexual masculina. La aparición de erecciones nocturnas adolescentes coincide con la liberación en pulsos de factor liberador de gonadotrofinas (GnRH) y hormona Luteinizante (LH), activando la secreción de testosterona. La deficiencia de testosterona puede provocar disfunción eréctil, porque participa aumentando el deseo y es necesaria para mantener los niveles de ON intrapeniano.
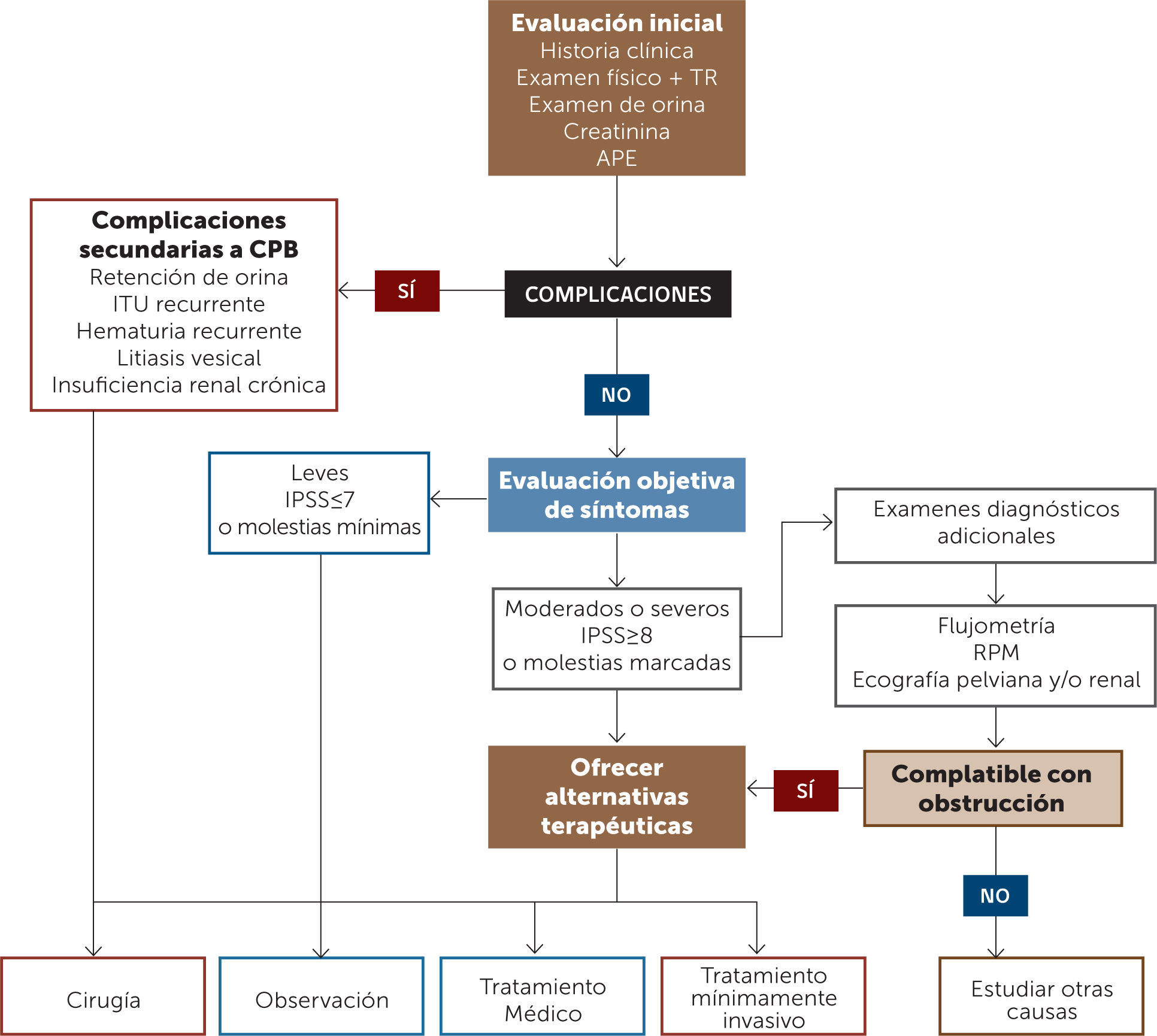
Evaluación diagnóstica del crecimiento prostático benignoLos estudios utilizados permiten hacer el diagnóstico, controlar la evolución y la progresión de la enfermedad, planear el tratamiento y, eventualmente, predecir los resultados de la terapia.
La evaluación clínica tiene dos objetivos principales:
- -
Hacer el diagnóstico diferencial, ya que el origen de los STUI en el hombre es multifactorial y puede deberse a diferentes condiciones (ver Tabla 1).
- -
Definir el perfil clínico del paciente para decidir el mejor tratamiento, así como detectar y corregir factores de riesgo.
Es fundamental una historia médica precisa. Es necesario identificar potenciales causas y comorbilidades significativas, que incluye enfermedades médicas (HTA, diabetes, etc.) y neurológicas. Así también es necesario conocer tratamientos farmacológicos, estilos de vida, aspectos emocionales y psicológicos. Dentro de los fármacos, cobran especial importancia, los antidepresivos, diuréticos, broncodilatadores, antihistamínicos, anticolinérgicos y adrenérgicos.
Existen cuestionarios validados para objetivar la severidad de los síntomas y evaluar la respuesta al tratamiento, por ejemplo, el International Prostate Symptom Score (IPSS) (13). En la práctica clínica, este cuestionario se reserva al ámbito académico y para estudios de investigación, ya que es subutilizado por los urólogos clínicos.
Examen físicoEl examen debe enfocarse en el hipogastrio, periné y genitales. Evaluar el meato uretral por eventual descarga y/o estenosis, la presencia de fimosis o de un tumor peniano.
Es aconsejable realizar una evaluación neurológica básica.
El tacto rectal permite objetivar el tamaño de la próstata, el tono del esfínter y descartar un eventual cáncer de próstata. La correlación entre el tacto rectal y el tamaño real de la próstata es baja, especialmente, en próstatas >30-40cc (14,15).
El tono del esfínter anal puede orientarnos a una enfermedad neurológica. Debe también pesquisarse la presencia de masas rectales o de un fecaloma.
Exámenes básicos de laboratorioSe incluyen:
Examen de orina completa: Para detección de infección urinaria, hematuria, proteinuria y presencia de cilindros.
Antígeno prostático específico (APE): Permite sospechar un cáncer prostático, sin embargo, la elevación del APE no es sinónimo de un cáncer. Enfermedades inflamatorias, infecciosas y traumáticas de la próstata, así como la CPB pueden elevar el APE.
Creatininemia: Permite evaluar la función renal, ya que pacientes con CPB pueden tener hidronefrosis, retención urinaria crónica e insuficiencia renal post renal. Si la creatinina plasmática está elevada, se recomienda realizar una ecografía renal.
Uroflujometría: Consiste en evaluar y objetivar el flujo urinario de manera no invasiva. La uroflujometría se puede realizar en el estudio inicial de un paciente con STUI y en todo paciente previo a cualquier tratamiento.
Los parámetros más importantes son el flujo máximo (Qmáx), el flujo promedio, el volumen evacuado, la forma de la curva y en algunos casos, el residuo postmiccional (RPM). Para darle valor al examen, el volumen emitido debe ser de, al menos, 150mL. El flujo urinario máximo normal es entre 20-25mL/s. Un Qmáx de 10mL/s tiene una especificidad de un 70%, un valor predictivo positivo de un 70% y una sensibilidad de un 47% para obstrucción infravesical (16).
Residuo post miccional (RPM): Puede ser evaluado con una ecografía vesical o con un equipo denominado bladder scan (equipo de ultrasonido que permite objetivar el volumen residual, pero sin imagen). También es posible evaluarlo a través de un cateterismo. Un RPM elevado puede deberse a una obstrucción infravesical o a una mala contractilidad del detrusor. En general, se acepta como normal o fisiológico un RPM de hasta el 10% del volumen vesical, o hasta 50cc.
Un RPM elevado se asocia a una mala respuesta al tratamiento médico. Así también, es un factor de riesgo de posibles infecciones urinarias y de retención aguda de orina. En caso de existir un RPM alto, se recomienda ser muy cauto al considerar el uso de anticolinérgicos.
Cartilla miccional: Consiste en registrar el horario y volumen de cada micción en 24 horas, por 1, 3 o más días. Es útil en la evaluación de pacientes que orinan más de 3 lt al día o cuando la diuresis nocturna es mayor a un tercio del volumen diario.
ImágenesSe incluyen:
Ecografía pelviana: La ecografía pelviana masculina (o vésico-prostática) permite evaluar la capacidad vesical, las paredes de la vejiga (engrosadas o vejiga de lucha), el tamaño de la próstata y el vaciamiento vesical. El tamaño de la próstata es importante para seleccionar el tratamiento quirúrgico (prostatectomía abierta, técnicas de enucleación, cirugía endoscópica o tratamientos mínimamente invasivos). El tamaño de la próstata predice la progresión de los síntomas y el riesgo de complicaciones. Así también, es útil, antes de considerar el tratamiento con inhibidores de la 5 reductasa (I5AR).
Al combinar estos exámenes, se ha visto que un APE >1.6ng/mL, volumen prostático >30cc, Qmáx <10mL/s y edad >62años, son factores de riesgo de progresión de los síntomas y de requerir tratamiento quirúrgico.
Otros estudiosLos siguientes estudios no están indicados en forma rutinaria para la evaluación de los pacientes con STUI.
Ecografía renal: La ecografía renal no está recomendada en todos los pacientes con STUI (17,18). Sí está indicada en pacientes con un gran RPM, con hematuria o historia de litiasis.
Estudio Flujo/Presión (F/P): Es un estudio invasivo, que permite objetivar la obstrucción infravesical, caracterizada por un aumento de la presión del detrusor y un flujo urinario bajo, durante la micción. El principal objetivo de este estudio urodinámico es explorar los mecanismos funcionales de los STUI e identificar factores de riesgo de mala respuesta a los tratamientos.
El estudio f/p es particularmente útil en ciertas situaciones específicas, como en pacientes de edad avanzada (>80 años), pacientes <50años, personas con volumen orinado menor a 150ml, en hombres con un Qmáx mayor a 10ml/s, y en pacientes con enfermedad neurológica (19).
Cistoscopía: Este examen debe realizarse en pacientes con STUI y que se sospeche alguna patología uretral o vesical (como estenosis uretral, cálculos vesicales, hematuria o cáncer vesical), y previo a algún tratamiento quirúrgico o mínimamente invasivo, en los cuales los hallazgos cistoscópicos hagan cambiar la conducta terapéutica.
Resonancia magnética o tomografía computarizada de próstata: Tanto la resonancia como la tomografía axial computarizada no están indicadas en el estudio rutinario de un paciente con STUI.
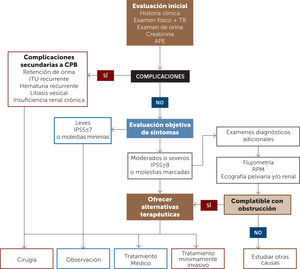
En la Figura 1 se presenta un flujograma de diagnóstico y tratamiento de pacientes con STUI.
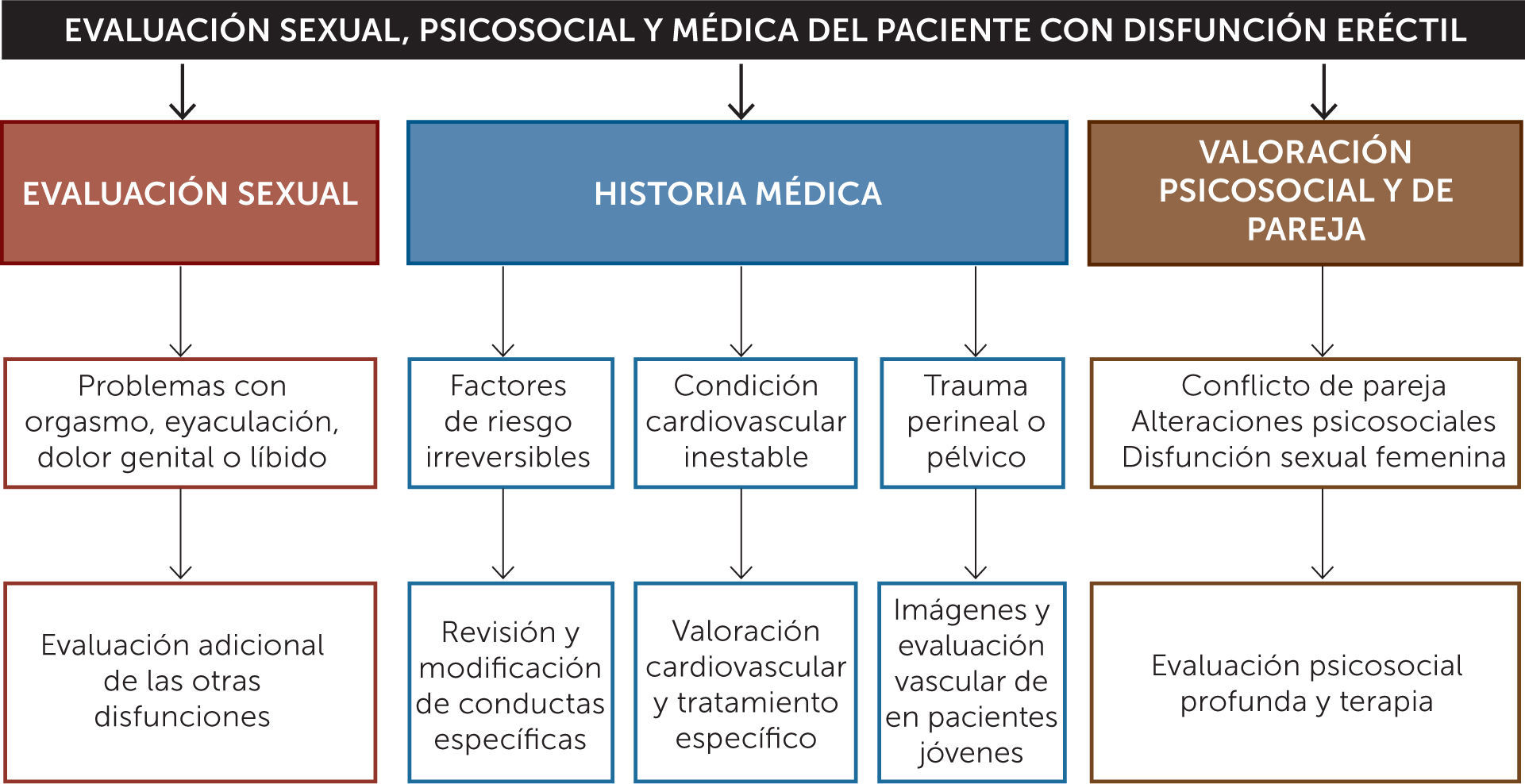
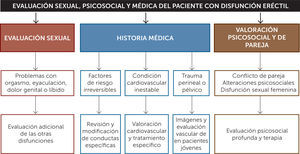
Evaluación diagnóstica de la disfunción eréctilEl diagnóstico de DE (Figura 2) es principalmente clínico, por lo que es fundamental obtener una buena anamnesis tanto próxima como remota, además de un completo examen físico, poniendo énfasis en la presencia de factores de riesgo y comorbilidades asociadas que puedan influir en la función eréctil.
Historia clínicaAl evaluar la DE es importante comenzar obteniendo antecedentes médicos y psicológicos detallados de los pacientes y sus parejas. Es importante crear un ambiente relajado y lograr una buena relación médico-paciente, pues de ese modo se facilita la obtención de datos y la adherencia al tratamiento. Además, es importante averiguar sobre las relaciones sexuales actuales y anteriores, sobre el estado anímico y emocional del paciente, el inicio y duración del problema de erección, así como también las consultas y tratamientos previos. Se debe obtener una descripción detallada de la rigidez y duración de las erecciones eróticas y matutinas y de los problemas de excitación, eyaculación y orgasmo. Algunos cuestionarios validados, como el Índice Internacional de la Función Eréctil (IIEF-5), ayudan a evaluar la función sexual masculina. La anamnesis remota debe estar enfocada en detectar comorbilidades, hábitos u otros elementos que constituyan factores de riesgo cardiovascular o enfermedades causantes de disfunción eréctil de otra índole: enfermedades endocrinas, neurológicas, psiquiátricas, entre otras. Se debe tener un registro detallado de todos los fármacos de uso habitual y esporádico y/o el consumo de alcohol o drogas en todo paciente que consulta por DE.
Examen físicoPuede revelar diagnósticos como enfermedad de Peyronie, hipertrofia o cáncer de próstata o signos y síntomas indicativos de hipogonadismo (testículos pequeños, alteraciones de los caracteres sexuales secundarios).
Exámenes complementariosLos exámenes complementarios se solicitarían en función de los síntomas y factores de riesgo cardiovascular del paciente (20-22). No obstante, a todos los pacientes se les debería solicitar un perfil bioquímico y lipídico. Ante sospecha de hipogonadismo se deben solicitar niveles de testosterona total (23) complementando con la medición de niveles de Prolactina, FSH y LH, en caso de bajos niveles de testosterona.
Manejo del paciente con stui y crecimiento prostático benignoExisten múltiples alternativas de tratamiento para el paciente con STUI/CPB, que incluyen la observación, tratamiento médico y tratamiento quirúrgico.
En general, aquellos pacientes con sintomatología leve y que no le afecta su calidad de vida, pueden ser manejados con observación y control periódico. Este grupo de pacientes puede beneficiarse de algunos cambios conductuales y dietéticos.
En pacientes con sintomatología moderada o severa, y en aquellos con complicaciones, está indicado el tratamiento médico y/o quirúrgico. La elección de cada tratamiento va a depender de las expectativas del paciente, considerando los riesgos y beneficios de cada una de las terapias.
ObservaciónUna gran parte de los pacientes con STUI leves o moderados, sin complicaciones y que no se ven afectados en su calidad de vida, pueden ser manejados con observación. En el manejo de los pacientes con observación expectante se incluyen una serie de medidas que pueden tener un efecto beneficioso en los STUI, evitando o postergando el tratamiento médico o quirúrgico (ver Tabla 3) (24,25).
Medidas NO farmacológicas en el manejo de STUI
| 1. Educación respecto de la condición del paciente y de su patología (entre otros, que no tiene relación con el cáncer de próstata). |
| 2. Reducción en la ingesta de líquidos, en especial, cuando se quiere evitar una micción frecuente (ej., antes de dormir o antes de asistir a eventos públicos). |
| 3. Evitar o disminuir el consumo de cafeína y alcohol. |
| 4. Orinar en forma relajada y promover un doble vaciado vesical. |
| 5. Estrujar u ordeñar la uretra para evitar el goteo postmiccional. |
| 6. Utilizar técnicas de distracción para sacarse de la mente la vejiga y el baño, que ayuden a un mejor almacenamiento. |
| 7. Revisar medicamentos que pudieran tener efectos en la micción (horarios de administración y efectos; aplica especialmente para los diuréticos). |
| 8. Tratar la constipación y estimular la actividad física. |
| 9. Advertir sobre el efecto de ciertos medicamentos en el empeoramiento de los STUI (anticolinérgicos, simpaticomiméticos, antidepresivos tricíclicos, etc.). |
| 10. Bajar de peso. |
| 11. Evitar el frío y el estrés. |
Entre los tratamientos farmacológicos disponibles se cuenta con:
Bloqueadores alfa-adrenérgicos: Estas drogas bloquean los receptores adrenérgicos alfa 1; son de efecto prolongado y están aprobadas por la FDA. En Chile disponemos de Terazosina, Tamsulosina, Alfuzosina y Doxazosina. Los bloqueadores alfa 1 actúan relajando el músculo liso del cuello vesical, de la cápsula prostática y de la uretra prostática (componente dinámico o funcional de la obstrucción infravesical). El efecto completo puede verse a las pocas semanas, pero incluso en los primeros días. Los bloqueadores alfa 1 parecen ser igualmente efectivos cada uno de ellos (26). Los pacientes tratados disminuyen el promedio de síntomas (IPSS) entre un 30 a 40% y los flujos urinarios máximos aumentan un 20-25% (27). Los síntomas que mejor responden a este tratamiento son los de almacenamiento y vaciado (polaquiuria, nicturia, urgencia y chorro débil). El efecto de estos medicamentos no está influenciado por el tamaño de la próstata, sin embargo, en estudios a largo plazo, los mejores resultados se ven en próstatas de <40cc (28-30). Los efectos adversos más frecuentes de estos medicamentos son la hipotensión ortostática y los mareos. Otro efecto conocido es la congestión nasal y la astenia. Debe advertirse a los pacientes que, con el uso de los alfa bloqueadores, es frecuente la eyaculación retrógrada. Otro aspecto a tener presente es el síndrome del iris lacso intra operatorio (SILI) o Intraoperative Floppy Iris Syndrome (IFIS), que se puede producir durante la cirugía de cataratas. Desde un punto de vista práctico, el uso de bloqueadores alfa 1 es, en general, de primera elección para el tratamiento médico de STUI asociado a CPB.
Inhibidores de la 5-alfa reductasa (I5AR): Las dos drogas aprobadas son Finasteride y Dutasteride. Estos fármacos actúan inhibiendo la acción de la 5 alfa reductasa tipo 2, que cataliza el paso de testosterona a dihidrotestosterona en las células prostáticas, los folículos pilosos y en otros tejidos dependientes de andrógenos. De este modo, reducen el tamaño de la próstata y la obstrucción secundaria, aliviando los síntomas. Este efecto se ve al cabo de 6 a 12 meses.
La disminución de tamaño de la próstata es de un 15-30%; que conlleva a una baja del APE de aproximadamente un 50%. Clínicamente, después de un mínimo de 6 a 12 meses de tratamiento, los I5AR disminuyen los STUI (IPSS) en un 15-30%, el volumen prostático en un 18-28% y aumentan el Qmáx en 1.5-2.0 mL/s. Este efecto es mayor en próstatas >40cc (31).
Está demostrado que el uso de I5AR disminuye el riesgo de retención de orina, la necesidad de cirugía y la hematuria (32-34). Los efectos adversos más importantes de estos fármacos consisten en la disminución de la libido, la disfunción eréctil y, con menos frecuencia, trastornos de la eyaculación. Su incidencia va entre un 4-13% de los pacientes (32,35). En relación al uso clínico, los I5AR debieran considerarse sólo para pacientes con STUI moderados a severos y con próstatas aumentadas de volumen (>40cc).
Antagonistas de receptores muscarínicos de acetilcolina: El músculo detrusor está inervado por nervios parasimpáticos, cuyo principal neurotransmisor es la acetilcolina, que estimula los receptores muscarínicos del músculo liso. Los fármacos disponibles en Chile son: Oxibutinina, Tolterodina, Solifenacina, Cloruro de Trospio y Darifenacina. En general, se ha visto que estas drogas mejoran síntomas como urgencia, polaquiuria, nicturia, tenesmo vesical, urgeincontinencia y el puntaje IPSS, otorgando un beneficio sintomático y de bienestar vesical (36-39). Este efecto sería mayor en hombres con próstatas más pequeñas y APE <1.3ng/mL (40). Los efectos adversos más frecuentes son sequedad de la boca (16%), mareos (5%), constipación (4%), infección de las vías respiratorias superiores (3%) y dificultad miccional (2%). En pacientes con obstrucción a la salida de la vejiga, por el riesgo de retención urinaria aguda, no debieran usarse en pacientes con RPM >150cc.
Inhibidores de la fosfodiesterasa 5 (IPDE5): Entre las tres drogas aprobadas para el tratamiento de la disfunción eréctil, solo Tadalafil ha sido autorizada para el tratamiento de STUI. Posiblemente, por su larga vida media y la opción de uso diario en dosis de 5mg. El mecanismo de acción descrito es el aumento en la concentración intracelular de GMP cíclico, lo que lleva a la relajación del músculo detrusor y de la musculatura lisa prostática y uretral. El mecanismo de acción exacto de los IPDE5 aún no está claro. Se ha visto que el uso de IPDE5 (5mg al día) disminuye el IPSS (22-37%), disminuye los síntomas de almacenamiento, de vaciamiento y mejora la calidad de vida, pero no aumenta el Qmáx. Los efectos adversos del Tadalafil son cefalea (2-3%), bochornos, dolor lumbar, mareos, dispepsia y congestión nasal. Su uso está contraindicado en combinación con nitratos, Doxazosina o Terazosina. El paciente que más se beneficia con el uso de Tadalafil 5mg es un hombre joven, con bajo IMC y STUI severos (41).
Tratamientos médicos combinados: Se pueden combinar los principios activos antes mencionados para el manejo de estos pacientes. Algunos ejemplos de combinaciones se discuten a continuación.
- Bloqueadores alfa 1 adrenérgicos con inhibidores de la 5-alfa reductasa: Se ha estudiado la asociación entre Alfuzosina, Terazosina y Doxazosina con Finasteride y, últimamente, Dutasteride con Tamsulosina. La combinación más utilizada actualmente es de Tamsulosina y Dutasteride. El objetivo es potenciar el efecto de cada una de estas drogas: efecto rápido (horas o días de Tamsulosina) y efecto tardío (varios meses, de Dutasteride). Estudios a largo plazo (2–4 años), han mostrado que el tratamiento combinado es superior a la monoterapia en cuanto a la disminución de síntomas, mejoría del flujo máximo, necesidad de cirugía y riesgo de retención urinaria (MTOPS y CombAT) (30,32). Desde un punto de vista práctico, la terapia combinada ofrece mejores resultados que la monoterapia, pero los efectos adversos son mayores. Por este motivo, la combinación debiera ofrecerse a pacientes con STUI moderados a severos y con mayor riesgo de progresión (próstatas grandes, mayor nivel de APE y edad avanzada), y en los cuales se piensa un tratamiento a largo plazo (>1 año).
- Bloqueadores alfa 1-adrenérgicos con antagonistas de receptores muscarínicos: El objetivo de esta combinación es el bloqueo de los receptores adrenérgicos alfa 1 y los receptores colinérgicos muscarínicos (M2 y M3) de las vías urinarias inferiores, y lograr así, un efecto sinérgico. La terapia combinada es más eficaz en reducir la urgencia, la urgeincontinencia, la frecuencia, nicturia y los síntomas IPSS, al compararlo con un bloqueador alfa 1 o placebo por separado (38,42). La eficacia de esta terapia se ve, especialmente, en aquellos pacientes con STUI moderados a severos. El principal efecto adverso de la combinación es la xerostomía. El riesgo de retención urinaria aguda es bajo (0.7 a 1.1%) (43).
Fitoterapia y extractos de plantas: Existen diferentes productos fitoterapéuticos (extractos de plantas) que se han usado para mejorar los STUI en pacientes con CPB. Dentro de estos productos, se mencionan: Cucurbita (pepas de calabaza), Hypoxis Rooperi (patata silvestre africana), Pygeum africanum (corteza de ciruelo africano), Cecale cereale (polen de centeno), Serenoa repens (Saw Palmetto) y Urtica dioica (raíces de la ortiga mayor). Su uso es controversial. No hay estudios clínicos serios que confirmen la eficacia de algún producto sobre otro. Las concentraciones y compuestos de los distintos preparados son diferentes, dependiendo de la marca, lo cual hace muy difícil su evaluación clínica. Por este y otros motivos metodológicos, no existe una recomendación específica al respecto.
Tratamiento quirúrgicoExisten diferentes abordajes y técnicas quirúrgicas:
Adenomectomía abierta: Es la técnica más antigua para resolver quirúrgicamente este problema. Consiste en la enucleación del tejido hiperplásico (adenomectomía transvesical o retropúbica transcapsular (técnica de Millin) (44). Los resultados a largo plazo son los mejores, con tasas de retratamiento por recurrencia, menores al 1%. Es una técnica simple de realizar y que no requiere de instrumental especial. Está indicada especialmente en pacientes con próstatas mayores de 80-100cc. Las desventajas son el largo período de hospitalización (5-6 días), uso prolongado de sonda Foley (4-6 días) y moderado riesgo de sangrado (tasa de transfusión entre 6.8 y 8.2%) (45,46).
Resección transuretral de la próstata (RTUP): Es posiblemente la técnica quirúrgica más utilizada universalmente. Se puede realizar con energía monopolar (clásica) o bipolar. Esta última utiliza como líquido de irrigación, suero fisiológico. Requiere de instrumental específico. En general, se acepta como volumen máximo de la próstata hasta 80cc. Sin embargo, el tamaño máximo para esta técnica no está definido por estudios científicos, sino que depende de la habilidad y decisión del cirujano. A mayor volumen, mayor riesgo de sangrado (tasa de transfusión de aprox. 2%) y de síndrome post-RTU (0.8%; por hemodilución e hiponatremia, secundaria a absorción de líquido hipotónico de irrigación, en el caso de técnica monopolar). En el caso de energía bipolar, este riesgo es muy bajo o nulo. Otras complicaciones a corto plazo son: sangrado y retención por coágulos (4%), e infección urinaria (4.1%) (47). Las complicaciones a largo plazo pueden ser incontinencia urinaria (2.2%), estenosis de cuello (4.7%), infección urinaria, estenosis uretral (3.8%), eyaculación retrógrada (65%) y disfunción eréctil (6.5%) (48).
Incisión prostática transuretral (transurethral incision of the prostate, TUIP): Consiste en realizar dos incisiones que van desde el cuello vesical hasta el veru montanum, sin resecar tejido.
Está indicada en pacientes con STUI refractarios a tratamiento médico, con un volumen prostático menor a 30cc y sin lóbulo medio.
Enucleación prostática con láser: La técnica se denomina según el láser utilizado, por ejemplo, HoLEP (Holmium Laser Enucleation of the Prostate) o ThuLEP (Thulium Laser Enucleation of the Prostate). La enucleación con láser está indicada en pacientes con síntomas moderados a severos y con próstatas >80-100cc, aunque también puede realizarse en próstatas más pequeñas (49-51). La enucleación con Holmium (láser con longitud de onda de 2140nm y penetración de 3-4mm) consiste en enuclear el adenoma por vía endoscópica, que luego debe ser morcelado con otro instrumento. Las ventajas, al comparar con cirugía abierta, serían el menor tiempo de sonda uretrovesical, menos días de hospitalización y la menor necesidad de transfusión (0.84% vs 9.8%).
Vaporización prostática con láser verde: A diferencia del láser de Holmium, al láser de neodimio YAG se le adiciona un cristal de KTP (potasio titanyl fosfato) o LBO (litio triborato), quedando una longitud de onda de 532nm; energía que es absorbida por la hemoglobina (y no por el agua, como en el caso del Holmium). El láser verde actualmente en uso es el de 180 W XPS (LBO), de disparo lateral, que vaporiza el tejido (no hay muestra para patología). Al comparar RTUP con el láser verde (180W XPS), los resultados clínicos son similares (síntomas IPSS, Qmáx y RPM). El sangrado, el tiempo de hospitalización y el tiempo de sonda son significativamente menores para el láser (52-55). El láser verde puede utilizarse, en teoría, en próstatas de cualquier tamaño, sin embargo, el índice de retratamiento en próstatas >100cc es de 5.4% a 24 meses y de 9.3% a 3 años (56). Esta técnica permite su uso, en forma segura, en pacientes en tratamiento antiagregante plaquetario o anticoagulante (57).
Tratamiento de la disfunción eréctilEl objetivo principal en la estrategia de tratamiento de los pacientes con DE consiste en determinar la etiología de la enfermedad y en tratarla siempre que sea posible y no tratar solamente los síntomas.
La DE puede asociarse a factores de riesgo modificables o reversibles, pues puede estar relacionada a hábitos, aspectos psicológicos o al uso de medicamentos que afecten la erección (58,59).
En general, las DE tienen buena respuesta a las opciones terapéuticas actuales, sin embargo, en la mayoría de los casos no existe curación definitiva.
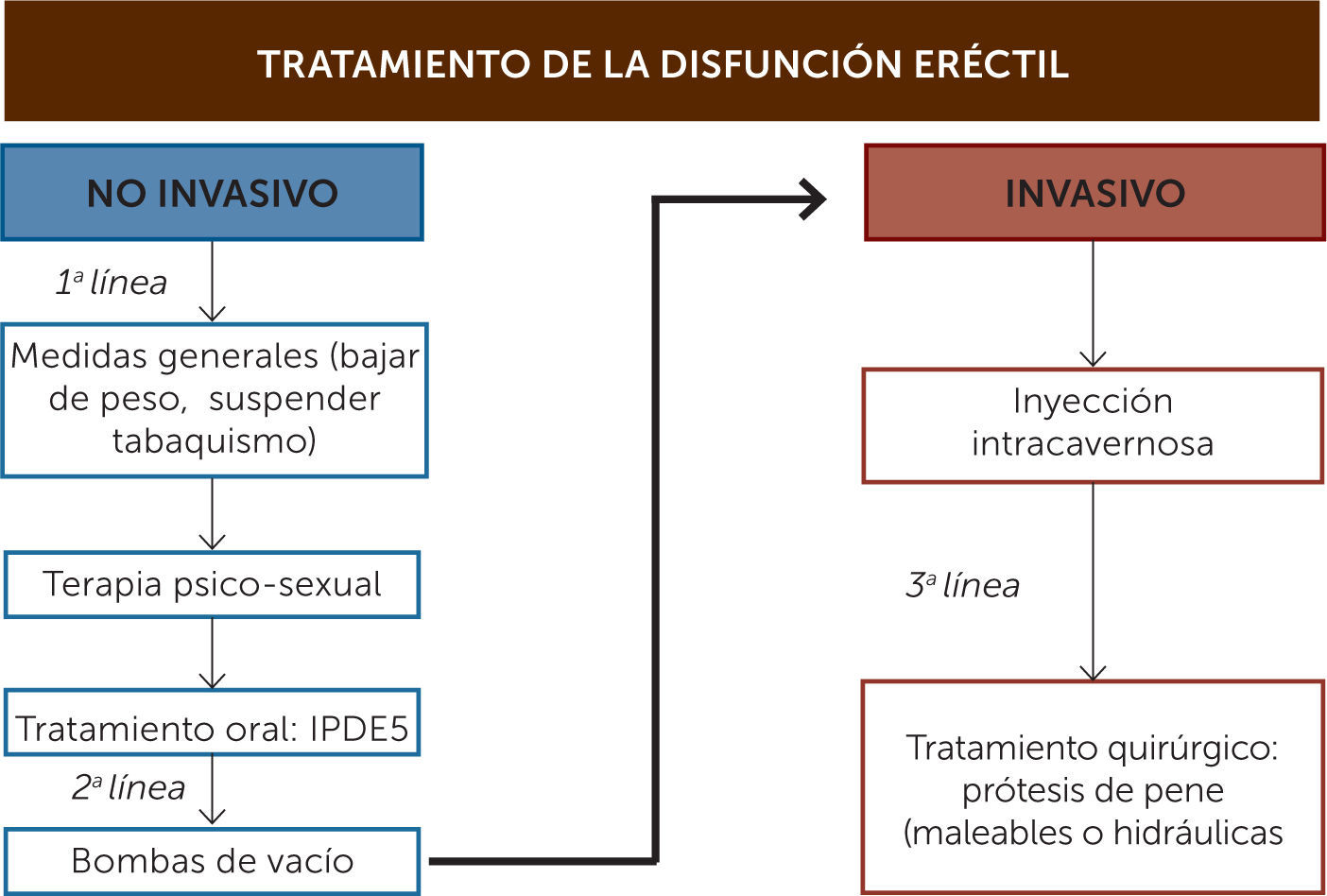
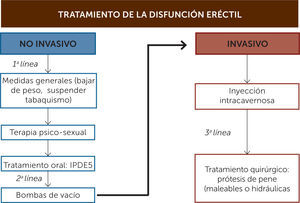
Informar al paciente (y a la pareja) de las opciones de tratamiento disponibles (Figura 3) es un aspecto importante de la primera visita.
Primera líneaDentro de la primera línea de tratamiento se encuentran intervenciones no invasivas tales como la terapia psicosexual y el tratamiento farmacológico oral.
- Psicoterapia: A los pacientes con problemas psicológicos se les puede ofrecer terapia psicosexual sola o junto con otra estrategia terapéutica (60).
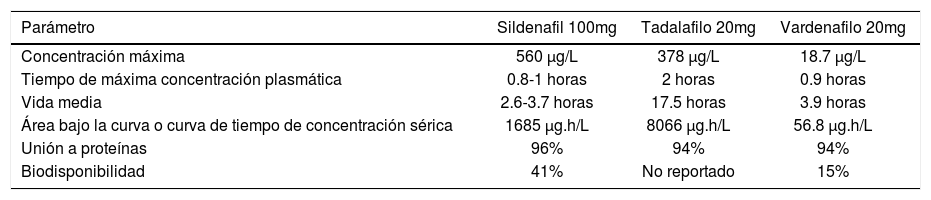
- Inhibidores de la fosfodiesterasa 5 (IPDE5): El tratamiento oral es la principal terapia actual utilizada para el manejo de la DE, tiene la ventaja de ser la de mayor aceptación, seguridad, fácil administración, eficacia y menor tasa de abandono. Actualmente existen tres sustancias de esta familia disponibles en la actualidad: sildenafilo, vardenafilo y tadalafilo. Es importante educar a los pacientes a cerca del uso de estos fármacos, puesto a que no son iniciadores de la erección, si no que requieren estimulación sexual para facilitar la erección. Esta clase de medicamentos están contraindicados en pacientes que reciban nitratos. Los tres inhibidores de la PDE 5 están asociados con efectos adversos relativos a esta familia de medicamentos como cefalea, dispepsia, enrojecimiento facial y congestión nasal. La duración de acción es de 5 horas para sildenafilo, hasta 36 horas para tadalafilo y el vardenafilo de duración intermedia (ver Tabla 4) (61). Además, el Tadafilo es el único inhibidor cuya velocidad o magnitud de absorción no se ven influidas por la ingesta de alimentos y se utiliza actualmente para el tratamiento de síntomas asociados a la hiperplasia prostática benigna (36). Con respecto a la seguridad cardiovascular asociado a estos fármacos, los resultados de los ensayos han mostrado ausencia de una mayor frecuencia de infartos de miocardio en los pacientes tratados con inhibidores de la PDE5, como parte de ensayos doble ciego, controlados con placebo o de estudios abiertos, o en comparación con las tasas previstas en poblaciones de varones emparejados por la edad (23).
Resumen de información farmacocinética clave para los tres IPDE5 disponibles en Chile
| Parámetro | Sildenafil 100mg | Tadalafilo 20mg | Vardenafilo 20mg |
|---|---|---|---|
| Concentración máxima | 560 μg/L | 378 μg/L | 18.7 μg/L |
| Tiempo de máxima concentración plasmática | 0.8-1 horas | 2 horas | 0.9 horas |
| Vida media | 2.6-3.7 horas | 17.5 horas | 3.9 horas |
| Área bajo la curva o curva de tiempo de concentración sérica | 1685 μg.h/L | 8066 μg.h/L | 56.8 μg.h/L |
| Unión a proteínas | 96% | 94% | 94% |
| Biodisponibilidad | 41% | No reportado | 15% |
Adaptado desde referencia (23).
Incluye dos tipos de tratamiento:
- Terapia intracavernosa: La inyectoterapia intracavernosa constituye el inicio de la segunda línea de tratamiento. Este método consta de la directa inyección intracavernosa de drogas como la Prostaglandina E1 (PGE1), Papaverina y Fentolamina, siendo PGE1 la más usada como droga única por su alta eficacia y buena tolerancia. La Papaverina fue la primera en usarse, pero por su escaso efecto fue siendo reemplazada por la PGE1, lo mismo que la Fentolamina. Cuando se usan asociadas (Bimix: Papaverina+fentolamina y Trimix: Papaverina +fentolamina+ PGE1) se ha logrado muy buenas respuestas, pero existe el riesgo de erecciones prolongadas y Priapismo (erección prolongada dolorosa), por lo que la titulación en el paciente en particular debe ser muy cuidadosa (10).
- Bomba de vacío: El mecanismo de erección por vacío produce una dilatación pasiva de los cuerpos cavernosos junto con un anillo constrictor colocado en la base del pene para retener la sangre en el interior de los cuerpos, provocando erecciones no fisiológicas. La eficacia, en cuanto a erecciones satisfactorias para la penetración, alcanza el 90%, con independencia de la causa de la DE, y las tasas de satisfacción oscilan entre el 27% y el 94%, pero la mayoría de los pacientes suspenden el uso de este método en el plazo de 3 meses.
Tercera líneaCorresponde al tratamiento quirúrgico definitivo de la patología y se reserva para los pacientes refractarios a tratamientos de primera o de segunda línea, o que no desean seguir usando las alternativas antes mencionadas, ya sea por efectos adversos o por insatisfacción relacionada con su uso. Su manejo, indicación e implementación es de resorte del especialista y está basada principalmente en el uso de prótesis peneanas. Estas se clasifican en dos tipos:
- -
Prótesis maleables: Corresponden a 2 cilindros de silicona, flexibles, de diferentes tamaños y diámetros según las medidas del paciente, que se implantan dentro de los cuerpos cavernosos, provocando una adecuada rigidez que permite la penetración.
- -
Prótesis hidráulicas: Corresponden a dos cilindros que se insertan en los cuerpos cavernosos y conectados a un reservorio-bomba que se instala en escroto para activar el inflado y desinflado (rigidez y flacidez) de los cilindros a demanda del paciente. El implante de prótesis ha mostrado altas tasas de satisfacción (92-100% en los pacientes y de 91-95% en las parejas) (62).
Los autores declaran no tener conflictos de interés, en relación a este artículo.