El síndrome de ovario poliquístico (SOP) es un trastorno endocrino metabólico altamente prevalente y se considera en la actualidad una patología familiar. Su presencia debe sospecharse en cualquier adolescente o mujer en edad reproductiva con hirsutismo u otras manifestaciones cutáneas de hiper-androgenismo, irregularidades menstruales y obesidad. El síndrome de ovario poliquístico es un diagnóstico de exclusión y por lo tanto, debe diferenciarse de los cambios fisiológicos propios de la edad y de otros trastornos hiperandrogénicos que requieren de una terapia específica. El diagnóstico oportuno es importante ya que este síndrome se asocia a riesgos reproductivos, oncológicos y metabólicos. Lo anterior implica que estas pacientes deben ser diagnosticadas y tratadas oportunamente, necesitan ser informadas y educadas sobre su patología y finalmente, ser controladas en forma prolongada. Independiente del motivo por el cual consulta la paciente, el tratamiento debe iniciarse siempre con la corrección de las alteraciones metabólicas.
Polycystic ovary syndrome (PCOS) is a highly prevalent endocrine metabolic disorder and it is presently considered as a family pathology. Its presence should be suspected in any adolescent or woman in reproductive age with hirsutism or other skin manifestations of hyperandrogenism, menstrual irregularities and obesity. Polycystic ovary syndrome is an exclusion diagnosis and, therefore, should be distinguished from the physiological changes typical for the age and from other hyperandrogenic disorders requiring specific therapy. Early diagnosis is important since this syndrome is associated with reproductive, oncologic and metabolic risks. The above implies that these patients should be timely diagnosed and treated, they need to be informed and educated about their pathology and, finally, followed up for a long term. Independent of the reason for patient consultation, the treatment should always begin with correction of the metabolic derangements.
El síndrome de ovario poliquístico (SOP), también denominado hiperandrogenismo ovárico funcional o anovulación crónica hiperandrogénica, es una disfunción endocrino-metabólica de alta prevalencia. Es la causa más común de hiperandrogenismo con una incidencia de un 3% tanto en mujeres adolescentes como adultas. Se estima, que está presente en el 75% de las mujeres hirsutas y en el 10% de las mujeres premenopaúsicas. En los últimos años se ha podido establecer, que este trastorno no sólo está limitado a la mujer en etapa reproductiva sino que puede manifestarse desde el período prepuberal y quizás antes. Su etiología es incierta y se manifiesta por síntomas y signos variados que afectan a cada mujer en forma particular. Entre ellos destacan las irregularidades menstruales, las manifestaciones cutáneas del hiperandrogenismo, la obesidad, la infertilidad, la resistencia insulínica (RI) y el aspecto poliquístico de los ovarios en la ultrasonografía.
Además, la mayoría de las mujeres con SOP (60-80%) presentan RI y una hiperinsulinemia compensatoria que puede presentarse en personas de peso corporal normal (1). La RI juega un papel preponderante en las consecuencias metabólicas a largo plazo del síndrome, entre las que cabe destacar la diabetes tipo 2, la enfermedad cardiovascular y el hígado graso no alcohólico (2, 3).
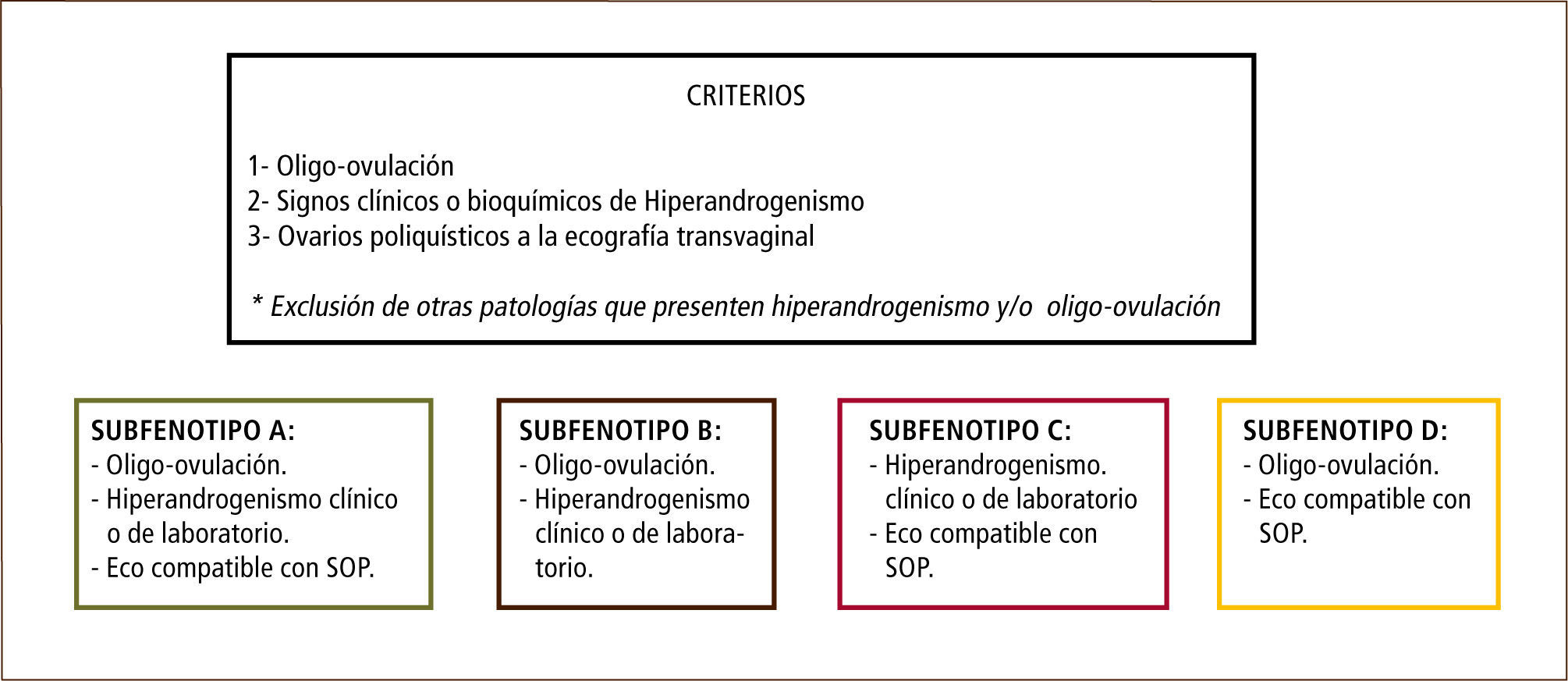
DefiniciónEn 1935 Stein y Leventhal, describieron una entidad clínica consistente en trastornos menstruales, esterilidad, hirsutismo y obesidad. Además, los ovarios de estas pacientes presentaban ciertas características morfológicas particulares tales como: aumento de tamaño, engrosamiento de la túnica albugínea y microquistes múltiples situados periféricamente en la zona subcortical ovárica. Con el advenimiento de la ultrasonografía, se pudo establecer que las mujeres sanas podían presentar imágenes ultrasonográficas sugerentes de ovarios poliquísticos sin el síndrome clínico, y por otro lado pacientes con el síndrome clínico florido no tenían las imágenes típicas a la ultrasonografía (4), todo lo cual indicaría que el clásico síndrome de Stein Leventhal sería una excepción. Debido a lo anterior, en 1990, en una conferencia de consenso de la National Institutes of Health de los EE.UU., se lo definió como la “presencia de hiperandrogenismo asociado a anovulación crónica sin otra causa específica de enfermedad adrenal o hipofisiaria que curse con irregularidades menstruales o exceso de andrógenos” (5). No obstante, esta definición no incorporó el aspecto morfológico de los ovarios. Posteriormente, la Sociedad Europea de Reproducción y Embriología (ESHRE) y la Sociedad Americana de Medicina Reproductiva (ASRM) en una conferencia de consenso realizada en Rotterdam en el año 2003, propuso una nueva definición del síndrome que incorporó la presencia de ovarios poliquísticos en la ultrasonografía como un criterio diagnóstico (6). Se propuso, que luego de excluir otras formas de hiperandrogenismo, el SOP podía ser diagnosticado en pacientes que presentaran a lo menos dos de las tres características siguientes: hiperandrogenismo clínico o bioquímico, oligo-ovulación y presencia de ovarios de morfología poliquística, dando origen a cuatro fenotipos (Figura 1).
Los fenotipos A y B cumplen con los criterios NIH y son considerados formas clásicas (7). Mientras que los fenotipos C y D están en discusión (8, 9). Por lo tanto, de acuerdo al consenso de Rotterdam, los ovarios poliquísticos no necesariamente deben estar presentes para definir la enfermedad y la presencia de ovarios poliquísticos por sí solo no establecen el diagnóstico.
En las adolescentes no hay un criterio establecido para definir este síndrome. El hirsutismo, las irregularidades menstruales, el acné y el sobrepeso pueden representar cambios fisiológicos propios de la edad. Dos tercios de las adolescentes aparentemente normales desarrollan acné, la mitad presenta irregularidades menstruales y un alto porcentaje se hacen obesas y de ellas, un cuarto desarrolla un síndrome metabólico. Además, durante los dos años que siguen a la menarquia las niñas pueden presentar en forma fisiológica ovarios multifoliculares que, asociados a los trastornos menstruales, pueden erróneamente confundirse con un síndrome de ovario poliquístico (10, 11). Debido a estas características, se ha planteado que a esta edad, el diagnóstico debería basarse en el hiperandrogenismo bioquímico asociado a irregularidades menstruales y morfología de ovarios poliquísticos (12, 13).
FisiopatologíaEn la compleja fisiopatología del síndrome de ovario poliquístico, destacan al menos tres tipos de alteraciones interrelacionadas entre sí: una disfunción neuroendocrina (hipersecreción de LH), un trastorno metabólico (resistencia insulínica e hiperinsulinemia) y una disfunción de la esteroidogénesis y de la foliculogénesis ovárica.
Disfunción neuroendocrinaSe caracteriza por un aumento de la secre-ción de LH y una secreción de FSH normal o disminuida (14). En estas pacientes se ha observado un aumento de la amplitud y frecuencia de los pulsos de LH, lo que reflejaría un aumento de los pulsos del factor liberador de gonadotrofinas (GnRH). No se han identificado alteraciones en neurotransmisores específicos que expliquen este trastorno y las evidencias actuales sugieren que se trataría probablemente de una disfunción hipotalámica secundaria a los niveles elevados de andrógenos e insulina (15, 16).
Disfunción metabólicaEstá representada principalmente por una RI periférica que se expresa por una hipersecreción de insulina. Esta a su vez, promueve una mayor secreción de andrógenos por el ovario y las suprarrenales; estimula la secreción de LH y además disminuye la síntesis hepática de la SHBG (globulina trasportadora de hormonas sexuales) con lo cual aumenta la fracción libre y actividad biológica de los andrógenos. De acuerdo a estudios de nuestro grupo, la hipersecreción de insulina se manifiesta desde la pubertad temprana y precede al hiperandrogenismo bioquímico (17). Además, cabe hacer notar que la disfunción metabólica se asocia fundamentalmente a los fenotipos clásicos que cursan con hiperandrogenemia (7).
El mecanismo por el cual se genera una resistencia insulínica en el síndrome de ovario poliquístico no está claro. En estas pacientes se ha establecido, que no habría una alteración del receptor de insulina ni del número de ellos sino que de los eventos post-receptor en cualquier punto de la señalización insulínica. En el síndrome de ovario poliquístico semejante a lo descrito en la diabetes 2, la RI precede a la disminución de la tolerancia a la glucosa. No todas las pacientes con SOP y RI desarrollan una intolerancia a la glucosa y una diabetes tipo 2, por lo que se ha sugerido que en estos casos, debe coexistir una disfunción de la célula â-pancreática la cual podría ser condicionada por el mismo defecto que genera la resistencia insulínica o por otros factores (1). En la minoría de los casos (20-30 %), el SOP puede manifestarse sin resistencia insulínica, lo que se debería a que por ser una enfermedad multigénica compleja no siempre se heredan conjuntamente genes asociados a RI con genes asociados a la disfunción reproductiva.
Disfunción de la esteroidogénesis ovárica/suprarrenalEs un pilar fundamental en este síndrome y se caracteriza por una alteración de la biosíntesis de los andrógenos, la cual tanto en el ovario como en la suprarrenal está determinada por la actividad de una enzima denominada citocromo P450c17. En pacientes con síndrome de ovario poliquístico la actividad de esta enzima está aumentada, lo que lleva a una mayor producción de andrógenos ováricos y adrenales. El aumento de los andrógenos intraováricos, alteran el desarrollo de los folículos y la ovulación. El hiperandrogenismo adrenal funcional está presente en alrededor del 50% de las mujeres con síndrome de ovario poliquístico, y se expresa por una elevación moderada de DHEAS. Se ha propuesto que la disfunción de esta enzima (P450c17) sería exclusiva del síndrome de ovario poliquístico pudiendo ser un evento primario o secundario al exceso de LH y/o insulina; la cual potenciaría esta disfunción (18). Además, cabe destacar que el tejido adiposo juega un papel preponderante en la fisiopatología del SOP ya que tiene una función esteroidogénica intrínseca y es un tejido blanco para los andrógenos (19).
Disfunción de la foliculogénesisSe ha podido establecer, mediante estudios ultrasonográficos y biopsias ováricas, que las pacientes con SOP presentan un pool de folículos en crecimiento 2 a 3 veces superior que las mujeres sanas. La histología del síndrome de ovario poliquístico se caracteriza por un aumento de folículos preantrales y antrales pequeños y un mayor reclutamiento folicular. Esta situación se acompaña además de una detención del proceso de selección folicular, lo que explica la ausencia de ovulación. Por lo tanto, en el síndrome de ovario poliquístico habría mayor reclutamiento y una menor selección, lo que mantiene un aumento del pool de folículos en crecimiento productores de andrógenos (20, 21).
En los últimos años se ha propuesto que la Hormona Antimülleriana (AMH) podría ser utilizada como un marcador sérico de la reserva folicular. La AMH es una glicoproteína dimérica miembro de la superfamilia TGFâ, producida exclusivamente por las células de la granulosa en la mujer. Su concentración es independiente de las gonadotrofinas y por lo tanto refleja la reserva ovárica en cualquier momento de la vida de la mujer. Además, recientemente hemos podido establecer que las hijas de mujeres con síndrome de ovario poliquístico tienen niveles significativamente mayores de AMH desde la infancia temprana (2 a 3 meses de vida) hasta la peripubertad, lo que sugiere que estas niñas nacen con una masa de folículos aumentada, lo que podría constituir un eslabón para el desarrollo ulterior de SOP (22, 23).
EtiopatogeniaEl síndrome de ovario poliquístico tiene una base genética y puede comprometer a otros miembros de la familia. Tanto las hijas como las hermanas así como los hijos y los hermanos del caso índice pueden manifestar algún rasgo fenotípico de este síndrome, que es considerado en la actualidad una enfermedad familiar multigénica compleja (24, 25), que afecta además al varón. Entre los factores ambientales destacan la obesidad y los eventos que ocurren en la vida intrauterina (hiperandrogenismo, diabetes gestacional y sobrepeso de la madre durante el embarazo) (26). Por lo tanto, es de suma importancia el manejo adecuado de la embarazada, ya que estudios epidemiológicos y clínicos sugieren una relación entre el ambiente prenatal y el riesgo de desarrollar enfermedades metabólicas durante la edad adulta (17, 27-30).
Aspectos clínicosEl cuadro clínico es muy polimorfo y varía de acuerdo a la edad de la paciente. Por lo general las manifestaciones clínicas se inician en el período perimenárquico con la aparición de alteraciones menstruales en los dos tercios de las adolescentes principalmente oligomenorrea (sangrados con intervalos mayores de 45 días o menos de 9 sangrados al año) alternados con períodos de amenorrea secundaria (ausencia de sangrado por lo menos en tres meses consecutivos), las que cursan con buen nivel estrogénico y responden con sangrado a la administración de progesterona. Ocasionalmente se presentan además episodios de metrorragia disfuncional (sangramiento excesivo fuera de ciclo) por hiperplasia endometrial. En raras oportunidades, una amenorrea primaria (ausencia de menarquia a los 16 años), una adrenarquia prematura o una pubertad precoz pueden ser el debut del cuadro clínico. En forma excepcional, las pacientes pueden presentar una eumenorrea. Los trastornos menstruales se asocian frecuentemente a la obesidad por lo general de tipo androide y a manifestaciones del hiperandrogenismo siendo el hirsutismo la manifestación más clásica. El hirsutismo por lo general es discreto o moderado (entre 8 y 15 puntos en la escala de Ferriman y Gallowey) (31), se presenta en dos tercios de las pacientes, aparece después de la pubertad y progresa lentamente o se detiene alcanzada la madurez sexual. La virilización es rara y su presencia debe hacer sospechar otras etiologías como un tumor secretor de andrógenos o una hiperplasia adrenal congénita. Entre las manifestaciones cutáneas del hiperandrogenismo, sólo el hirsutismo, el acné y la alopecía han sido aceptadas por ambos consensos como cri-terio diagnóstico de hiperandrogenismo. La obesidad está presente en alrededor de la mitad de las pacientes y es típicamente de tipo androide o “forma de manzana” (índice cintura/cadera > 0.85); por lo general se inicia en la niñez y se acentúa en la pubertad. En las pacientes obesas y/o hiperinsulinémicas puede observarse acantosis nigricans que es un marcador cutáneo de resistencia insulínica, la que se presenta como una pigmentación verrucosa de color pardo oscuro que suele observarse en las zonas de pliegues. Además, estas pacientes pueden adquirir un aspecto cushingoideo (obesidad central, dorso de búfalo y aumento de la grasa supraclavicular semejante a lo que se observa en el Cushing, pero sin atrofia muscular) o acromegaloideo (aumento del grosor de los rasgos faciales por efecto trófico de la insulina, pero sin prognatismo) que muchas veces obliga a descartar estas patologías. El cuadro clínico constituido no regresa espontáneamente (no se mejora, sólo se compensa). Con el tiempo van cambiando las manifestaciones fenotípicas. Durante la post- menarquía y edad reproductiva temprana predominan alteraciones reproductivas, mientras que durante la edad reproductiva tardía y peri-menopausia se acentúan las alteraciones metabólicas (32). Los riesgos a largo plazo derivan del hiperestrogenismo relativo (por falta de ovulación) el cual se asocia a cáncer endometrial y de la hiperinsulinemia crónica (diabetes 2 y síndrome metabólico).
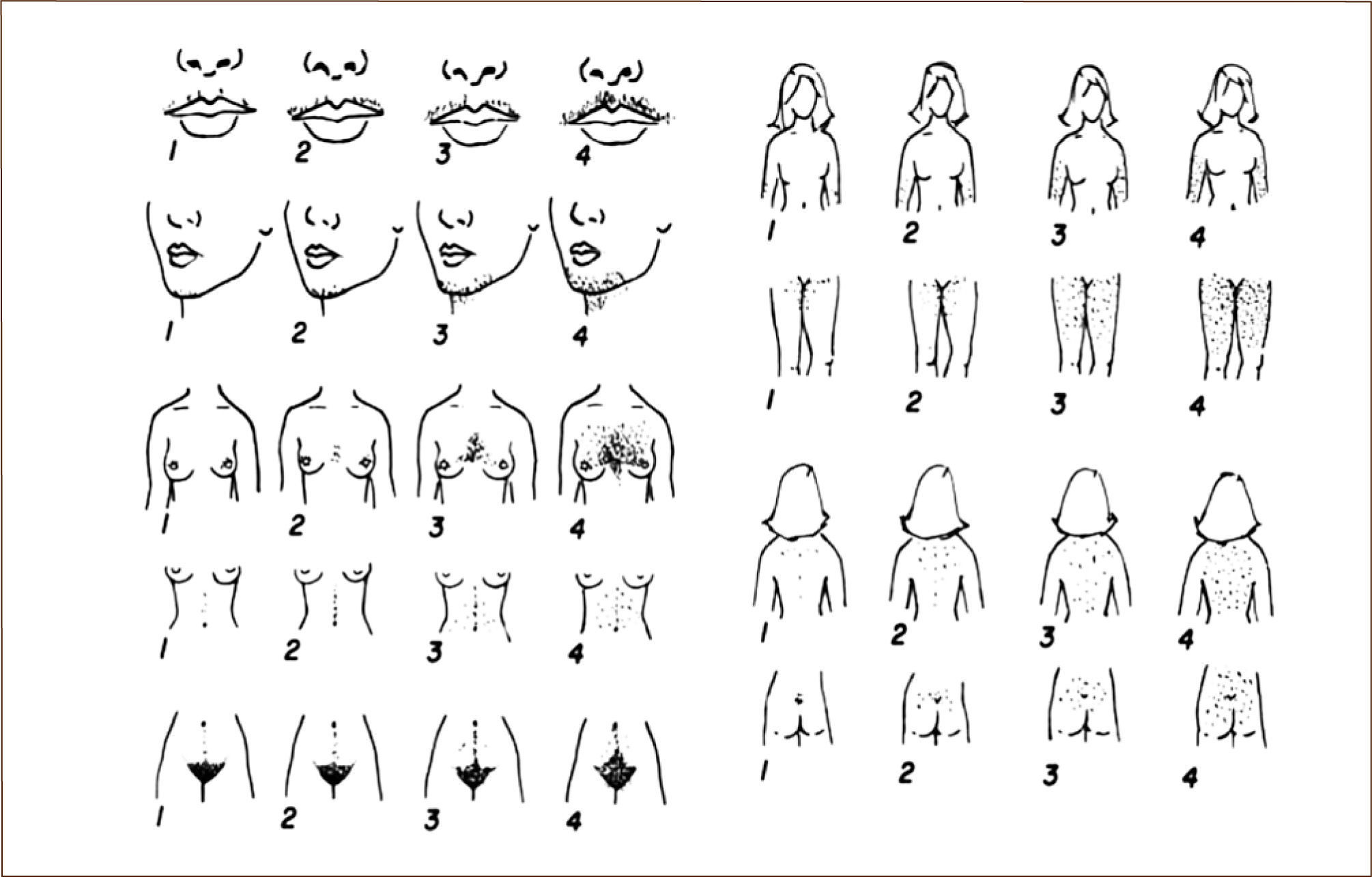
Examen físicoDebe ponerse especial atención a las manifestaciones clínicas del hiperandrogenismo e hiperinsulinismo. Para consignar la distribución del vello y su cuantificación se utiliza el score de Ferriman-Gallwey (Figura 2). Clásicamente en mujeres en edad reproductiva se considera que un cómputo superior a 8 indicaría hirsutismo. No obstante, en poblaciones de descendencia amerindia como Chile, debido a una menor actividad de la 5á reductasa cutánea, el hirsutismo podría definirse con valores de corte más bajos (mayor o igual a 6) sobre todo en las adolescentes (33). Debe consignarse además: el acné, la alopecia androgénica (pérdida del cabello de acuerdo al patrón masculino) y la acantosis nigricans en las zonas de pliegues como cuello, nuca, axilas y cara interna de los muslos. Debe calcularse el índice de masa corporal y la distribución de la grasa (relación cintura mínima /cadera máxima).
Es aconsejable completar el examen físico con la medición de la presión arterial, el examen del tiroides y de las mamas y la inspección de los genitales externos en busca de clitoromegalia en las niñas y un examen ginecológico en las mujeres sexualmente activas.
En síntesis, debe documentarse el hiperandrogenismo, descartar otras patologías y establecer anormalidades metabólicas que comúnmente acompañan a este síndrome.
Recordar que el cuadro clínico es polimorfo. No todas las mujeres presentan la totalidad de los síntomas. Sin embargo es importante conocerlos ya que pueden ser la pista que lleven a un diagnóstico oportuno.
Investigación del laboratorioLas pacientes con síndrome de ovario poliquístico tienen andrógenos elevados en forma discreta o moderada ya sea testosterona, androstenediona, dehidroepiandrosterona sulfato, o todos ellos. Aunque el aumento de los andrógenos es muy frecuente, algunas determinaciones caen dentro del rango de normalidad y ello no implica exclusión diagnóstica. Debe considerarse además el método utilizado para medir los andrógenos y recordar que a partir de los 35 años las concentraciones de andrógenos disminuyen en un 50% en la mujer.
Testosterona totalEs el andrógeno circulante más importante en la mujer y es también el principal andrógeno causante de hirsutismo en ella. No obstante, en el SOP la testosterona total sólo está elevada discretamente en el 50% de los casos. Además existen numerosos ensayos para medir esta hormona, lo que puede ser confundente para determinar su elevación. De acuerdo a nuestra experiencia, la testosterona medida por RIA (Diagnostic System Labs, TX, USA) es la que da una mejor correlación con la espectrofotometría de masa que es el método más fino para medir testosterona (29). Por esta razón, para establecer la presencia de hiperandrogenismo, el consenso de Rotterdam sugiere utilizar el índice de andrógenos libres (IAL), el cual fue descrito inicialmente por Fox y cols (34) y consiste en la relación entre la testosterona total y su proteína transportadora (SHBG) de acuerdo a la siguiente fórmula: Testosterona (nmol)/ SHBG (nmol)x 100 (Valor normal < 4.5). Para transformar la T en ng/ml a nmol/l debe multiplicarse el valor x 3.467.
Dehidroepiandrosterona sulfato (DHEAS)Esta hormona se origina exclusivamente en las suprarrenales por lo que se la utiliza como marcador de hiperandrogenismo suprarrenal. Aproximadamente entre 25-40% de estas pacientes pueden presentar un aumento de la concentración sérica de DHEAS la cual raramente excede los 600 ng/dl.
AndrostenedionaEs un andrógeno fundamentalmente de origen ovárico y puede ser el único andrógeno elevado en una mujer con SOP. En comparación a la testosterona, este andrógeno se mantiene elevado hasta etapas tardías de la transición menopáusica. Además, tiene la ventaja que su determinación se realiza con un solo tipo de ensayo lo que no genera variabilidad de los resultados. Aunque no es un andrógeno de primera línea, puede ser determinado en caso de duda diagnóstica.
17 hidroxiprogesterona (17-OHP)Es el mejor metabolito para descartar déficit de la enzima 21-hidroxilasa; su valor normal en ayunas en fase folicular temprana del ciclo menstrual es inferior a 2 ng/ml. Valores superiores a 6 son indicadores de bloqueo enzimático; Concentraciones entre 2 y 4 ng/ml hacen necesario efectuar un test de ACTH, el cual consiste en la administración endovenosa de 0,25 ug de ACTH (Valores de OHP superiores a 10 ng/ml a los 60 minutos post ACTH establecen el diagnóstico). Alrededor del 50% de las pacientes con SOP pueden presentar elevaciones muy discretas de esta hormona.
Relación LH/FSHLas pacientes con síndrome de ovario poliquístico frecuentemente (60%) tienen una relación LH/FSH aumentada (mayor de 2), la cual por lo general se observa en mujeres de peso corporal normal. Originalmente se la consideró un marcador de síndrome de ovario poliquístico. No obstante, debido a que su normalidad no descarta el diagnóstico, no se la utiliza en la actualidad como parte de los criterios de SOP, pero sigue siendo un elemento orientador.
Debe completarse el estudio hormonal con la determinación de prolactina y hormonas tiroideas cuyas alteraciones pueden cursar con irregularidades menstruales.
Evaluación del componente metabólico del sopLa mayoría de las pacientes con síndrome de ovario poliquístico tienen anormalidades metabólicas como resistencia insulínica con hiperinsulinemia compensatoria, obesidad y dislipidemia (aumento de triglicéridos y colesterol-LDL y disminución del colesterol-HDL), por lo que es aconsejable hacer en todas ellas, independiente del peso corporal, una evaluación de la enfermedad metabólica mediante un perfil lípídico para descartar una dislipidemia y un test de tolerancia a la glucosa oral con medición de insulina para evaluar tolerancia a la glucosa y resistencia insulínica. Los siguientes valores son sugerentes de resistencia insulínica en las niñas hasta dos años postmenarquia: una insulinemia basal > de 18uU/ml y una insulinemia post carga de glucosa mayor de 100uU/ml. En las niñas postmenárquicas tardías (más de dos años post-menarquia) se utilizan los valores de corte establecidos para los adultos: una insulinemia basal > de 12.5uU/ml, una insulinemia post-carga a los 60 minutos mayor de 100uU/ml y a los 120 minutos mayor de 60uU/ml. Es importante destacar que estos valores de corte son válidos para las insulinemias medidas por radioinmunoensayo y no por otros métodos. Además, cabe hacer notar que la determinación aislada de insulina basal tiene escaso valor diagnóstico ya que suele ser normal.
El test de HOMA(Homeostasis Model Assessment of Insulin Resistance) es un modelo matemático desarrollado por Matthews para estudiar resistencia insulínica en una población y no para establecer resistencia insulínica en un individuo determinado, debido a que su normalidad no permite descartar una RI (35).
UltrasonografíaLa ultrasonografía especialmente transvaginal es un procedimiento útil para detectar morfología de ovarios poliquísticos. Se debe tener en cuenta que la vía abdominal tiene limitaciones sobretodo en niñitas obesas. Frente a un diagnóstico diferencial ominoso, se recomienda actualmente realizar una resonancia nuclear magnética de abdomen (36). En las mujeres sexualmente maduras el ovario alcanza un volumen aprox de 6cc y no excede los 8cc cuando contiene un cuerpo lúteo o un folículo maduro. En pacientes portadoras de SOP el volumen es significativamente mayor, superiores a 10cc. No obstante, un 30% de las pacientes pueden presentar volúmenes ováricos normales.
Los criterios actualmente utilizados para definir ovarios poliquísticos son: presencia de 12 o más folículos en cada ovario (barrido completo) que midan entre 2-9mm de diámetro y/o un volumen ovárico aumentado (> 10ml) en fase folicular temprana. Esta definición no se aplica a mujeres que toman anticonceptivos orales. Sólo un ovario afectado es suficiente para definir el síndrome. Si hay evidencia de un folículo dominante (>10mm) o un cuerpo lúteo, el examen debe repetirse durante el próximo ciclo.
El estroma ovárico no está considerado en la definición ecográfica actual de SOP. No obstante, cabe destacar que hasta un 94% de los casos de SOP presentan aumento de la ecogenicidad ovárica.
EL SOP suele confundirse con los ovarios multifoliculares los que se observan como ovarios aumentados de volumen con varios folículos en desarrollo hasta 9mm sin dominancia y que aparecen dispersos en el estroma ovárico. Se presentan durante el desarrollo puberal y después de la reanudación de la ciclicidad ovárica que sigue a una fase de amenorrea (lactancia, pubertad).
Enfoque diagnósticoEl diagnóstico del síndrome de ovario poliquístico se basa en la combinación de sus características clínicas, bioquímicas y ultrasonográficas. El diagnóstico debe ser planteado clínicamente y confirmado bioquímicamente. La ultrasonografía sugerente de síndrome de ovario poliquístico por si sola no permite establecer el diagnóstico y su normalidad no lo descarta.
El diagnóstico diferencial del síndrome de ovario poliquístico debe establecerse con otros cuadros clínicos que suelen presentar la asociación de hirsutismo y trastornos menstruales como: hiperplasia adrenal congénita, tumores virilizantes, hiperprolactinemia, síndrome de Cushing, acromegalia y el uso de drogas como esteroides anabólicos y ácido valproico.
TratamientoEstá orientado a corregir el hiperandrogenismo, los trastornos menstruales, las alteraciones metabólicas asociadas (obesidad y RI) y la ovulación, en los casos en que la mujer desee embarazo.
Por ser el síndrome de ovario poliquístico una disfunción endocrinometabólica crónica, con un fuerte componente genético, su curación espontánea es dudosa, por lo que los tratamientos deben iniciarse precozmente y ser prolongados.
Recordar que el tratamiento oportuno permite prevenir las graves consecuencias que puede tener el SoP para la salud de las mujeres, tales como: enfermedad cardiovascular e hipertensión, resistencia insulínica, diabetes, diabetes gestacional, cáncer endometrial, mayor tasa de abortos y pre-eclampsia.
Tratamiento del hiperandrogenismoUno de los factores decisivos en la elección inicial de la terapia en la mujer en edad reproductiva es el deseo o no de embarazo, no obstante, la corrección de las alteraciones metabólicas debe preceder o acompañar a las otras medidas terapéuticas.
En la mujer que no desea embarazo, el tratamiento está orientado a corregir la hiperandrogenemia, las manifestaciones cutáneas del hiperandrogenismo (hirsutismo, acné y alopecía androgénica), los trastornos menstruales y las alteraciones metabólicas asociadas a la resistencia insulínica y al hiperinsulinismo.
Tratamiento de las manifestaciones clínicas del HA y de la hiperandrogenemiaBasados en las recomendaciones del tratamiento del hiperandrogenismo de la Soceidad Americana de Endocrinología (37).
Los métodos que se pueden utilizar para un adecuado manejo del hiperandrogenismo están dirigidos a: inhibir la esteroidogénesis ovárica, suprarrenal o ambas, aumentar la concentración de SHbG, evitar la acción de andrógenos en tejidos blancos, bloqueando la unión a sus receptores e inhibir la conversión periférica (5-α reductasa) de testosterona a dihidrotestosterona (hormona 3 veces más potente) y por último, actuar directamente sobre los tegumentos, utilizando recursos cosméticos.
Los anticonceptivos oralesSon considerados la primera alternativa terapéutica para mujeres en edad reproductiva, estos fármacos suprimen la secreción de LH y, por lo tanto disminuyen la biosíntesis de andrógenos ováricos, aumentan la concentración plasmática de SHBG disminuyendo los andrógenos libres y además permite una descamación regular del endometrio, con lo que se evita el riesgo de hiperplasia endometrial y cáncer de endometrio. El inconveniente de los anticonceptivos orales es que pueden deteriorar la resistencia insulínica y aumentar la síntesis hepática de triglicéridos, lo que dependerá del tipo de progestina que contenga. Las progestinas que tienen actividad androgénica son el norgestrel y el levonorgestrel que no son recomendables, justamente porque exacerban las manifestaciones cutáneas del hiperandrogenismo. Otras progestinas como el acetato de ciproterona, la drospirenona, el acetato de clormadinona y el dienogest tienen efecto antiandrogénico. De éstas, el acetato de ciproterona, por su actividad glucocorticoidea, tiene más efecto anabólico y puede producir aumento del peso corporal y de la resistencia insulínica. Las progestinas más recomendables son, la drosperinona, al ser un derivado de la espironolactona, tendría un efecto beneficioso sobre la resistencia insulínica y el dienogest y acetato de clormadinona tendrían la capacidad de reducir la actividad de la 5 alfa reductasa a nivel de la piel (38).
Las pacientes que más se benefician con los anticonceptivos orales son aquellas con anovulación crónica y niveles elevados de andrógenos y de LH.
Los antiandrógenosSon compuestos de tipo esteroidal, como el acetato de ciproterona y la espironolactona, o no esteroidal, como la flutamida y el finasteride, que antagonizan al receptor de andrógenos en el folículo piloso y la glándula sebácea. La elección del antiandrógeno depende de cada caso en particular, tomando en cuenta el mecanismo de acción y los efectos adversos de cada droga. Los dos primeros son muy efectivos en suprimir la hiperandrogenemia, mientras que la flutamida y el finasteride son efectivos como bloqueadores periféricos de la acción androgénica, pero no modifican el nivel de andrógenos. Los antiandrógenos, sin excepción, están contraindicados en el embarazo, ya que pueden provocar feminización de un feto masculino. Por lo tanto, deben usarse en combinación con un anticonceptivo en aquellas pacientes que tienen actividad sexual. La asociación de un antiandrógeno con un anticonceptivo oral potencia el efecto antiandrogénico. Los antiandrógenos también pueden asociarse entre sí, como por ejemplo el acetato de ciproterona con finasteride o la espironolactona con flutamida. Sin embargo, la asociación de acetato de ciproterona con flutamida no es recomendada por el aumento en el riesgo de compromiso hepático.
Los glucocorticoides no están indicados en el tratamiento del hiperandrogenismo. Manejo de la oligo-ovulación crónica.
Debe corregirse en primer lugar la obesidad, ya que está demostrado que esta sola medida en pacientes obesas disminuye los niveles de insulina, testosterona y LH, permitiendo la reanudación espontánea de la ciclicidad ovárica y de la ovulación. En las pacientes que no menstrúan espontáneamente y que no desean embarazo se puede utilizar progestinas en dosis bajas en forma cíclica o anticonceptivos orales, con el fin de lograr una protección endometrial. En las pacientes que desean embarazo está indicado llevar a cabo una inducción de ovulación.
Se ha descrito que las pacientes con SOP tienen hasta 3 veces más riesgo que la población general de desarrollar hiperplasia endometrial y cáncer de endometrio, lo que se debe a: hiperestrogenismo relativo por ausencia de ovulación, presencia de factores de crecimiento e inflamatorios por obesidad, RI y diabetes; y nuliparidad (39). Las pacientes que presentan amenorrea, metrorragias disfuncionales y engrosamiento endometrial a la ecografía deberían ser derivados a un especialista.
Inducción de ovulaciónConsiste en el tratamiento farmacológico o quirúrgico destinado a inducir ciclos ovulatorios normales (mono foliculares) en pacientes con oligo-anovulación.
Estos procedimientos son de resorte del especialista en medicina reproductiva.
Recordar que las mujeres con SoP que logran embarazarse tienen mayor riesgo de diabetes gestacional, síndrome hipertensivo del embarazo, pre-eclampsia, parto prematuro y recién nacidos pequeños para la edad gestacional, por lo que su control endocrino-metabólico y sobre todo su control prenatal son cruciales. Lo que se atenúa con el tratamiento de las alteraciones metabólicas.
Perspectivas futurasPor ser una disfunción endocrino-metabólica con un variado espectro de anormalidades, muchas de las cuales son sutiles, las pacientes suelen consultar en diversas especialidades donde, por lo general, se da énfasis al motivo de consulta con lo cual el diagnóstico de SOP pasa desapercibido y se pierde la visión global de lo que involucra su diagnóstico.
El diagnóstico de SOP es particularmente importante debido a que identifica riesgos metabólicos y cardiovasculares así como el potencial reproductivo de estas pacientes. Lo anterior implica que las pacientes en las cuales se establece el diagnóstico de SOP deben ser informadas y educadas respecto a su patología, deben ser diagnosticadas y tratadas oportunamente y deben ser controladas en forma prolongada.
El SOP es un trastorno común que afecta aproximadamente a 5 millones de mujeres en edad reproductiva en los EE.UU. y se estima que el costo en salud para identificar y tratar a estas pacientes es de aprox. 4 billones de dólares anuales. La causas del SOP aún no están bien identificadas, algunos estudios sugieren que sería una alteración con un fuerte componente genético, mientras que otros sugieren que los factores del ambiente intra o extrauterinos jugarían un rol importante. En la actualidad se le considera una alteración endocrino-metabólica familiar que comprometería al varón y que se asocia a la diabetes tipo 2. Debido a que esta implica una alta demanda en salud, las estrategias están encaminadas a prevenir o por lo menos retrasar su inicio. Una de estas estrategias es identificar poblaciones con alto riesgo de desarrollar diabetes 2 para permitir una intervención oportuna. Las pacientes con SOP constituirían una de estas poblaciones, pero a diferencia de otras, sería una población ideal para implementar medidas de prevención, ya que por el inicio precoz de su sintomatología, las pacientes son identificables a una edad temprana.
El futuro de este síndrome estará en la prevención de los factores epigenéticos y marcadores genéticos que permitan instaurar medidas preventivas precoces.
Los autores declaran no tener conflictos de interés, relacionados a este artículo.