La respuesta inflamatoria asociada al parto prematuro extremo tiene un rol relevante en el pronóstico del recién nacido. La inmadurez de su sistema inmune no logra modular los mecanismos proinflamatorios y antiinflamatorios, lo que desencadena daños secundarios con secuelas en el corto, mediano y largo plazo. Objetivo: revisar los mecanismos inmunológicos involucrados en el síndrome inflamatorio perinatal persistente, presentando posibles ejes de prevención y tratamiento.
The inflammatory response associated with extreme preterm birth plays a relevant role in the prognosis of the newborn. The immaturity of the immune system fails to modulate the pro-inflammatory and anti-inflammatory mechanisms, triggering secondary damage with short, medium and long term sequelae.
Objectiveto review the immunological mechanisms involved in the sustained perinatal inflammatory syndrome, presenting possible prevention and treatment targets.
A medida que aumenta la sobrevida de los prematuros de menor edad gestacional y peso, ha comenzado a observarse una cantidad creciente de secuelas resultantes de la respuesta inflamatoria perinatal desregulada. En este trabajo se revisarán los conceptos más importantes de los mecanismos inmunológicos involucrados en el síndrome inflamatorio perinatal persistente del prematuro extremo y, así, entender algunos de sus objetivos de intervención terapéutica.
2Nociones básicas de inmunologíaEl sistema inmune se compone de la inmunidad innata y adquirida.
La respuesta innata que está presente desde el nacimiento es inespecífica, de acción rápida y tiene un mecanismo complejo de resolución. La respuesta adaptativa tiene alta especificidad, responde a una amplia variedad de antígenos y es especializada.
A pesar de que por mucho tiempo se pensó que la memoria inmunológica era una característica exclusiva del sistema adaptativo, actualmente se sabe que también el sistema innato es capaz de generar memoria, conocida como inmunidad entrenada1–4.
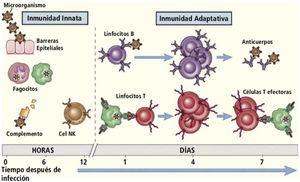
Comparación entre inmunidad innata e inmunidad adaptativa. Se muestran en la figura algunas de las células de la inmunidad innata y adaptativa. La inmunidad innata es la primera defensa contra las infecciones, y posteriormente se activa el sistema adaptativo. Sin embargo, funcionan de manera integrada, ya que el sistema innato activa al sistema adaptativo, y a su vez, este sistema utiliza los mecanismos efectores de la inmunidad innata para eliminar la infección. Traducido de: Abbas A, et al. Cellular and Molecular Immunology. 9th Edition. Ed. Elsevier. 2016.
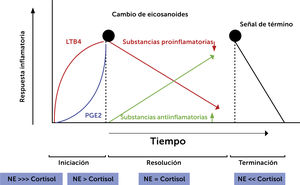
Fases de la inflamación y ejes de estrés. El gráfico representa la respuesta inflamatoria en el tiempo y sus redes involucradas. Muestra la relación de noradrenalina y cortisol en las distintas fases, y el cambio de eicosanoides que se produce paralelamente. NE: noradrenalina; PGE2: prostaglandina E2; LTB4: Leutrieno B4. Traducido de: Bosma-den Boer M, et al. (Ref.7).
A la respuesta innata pertenecen las barreras epiteliales (piel y mucosas), macrófagos, granulocitos, células dendríticas, mastocitos, células T citolíticas naturales (NK), complemento, microbiota y factores de inflamación local3,5.
Las principales células del sistema adaptativo son los linfocitos T y B, que actúan en la respuesta celular y humoral respectivamente2,3.
Los linfocitos T cooperadores (linfocitosT “helper” (Th), en la literatura de habla inglesa) tienen un receptor de membrana CD4+ y están encargados de iniciar y determinar el tipo de respuesta. Los linfocitos T citotóxicos, tienen un marcador de membrana CD8+ y pueden actuar como células efectoras. Por último, los linfocitos T reguladores (Treg) son aquellos que limitan la reacción inmune2,3. Existen otros tipos de linfocitos T, que exceden los objetivos de esta revisión, por lo que no serán analizados.
Hay una gran sinergia y comunicación entre ambos sistemas por actividad de una compleja red de citoquinas1,2. Las interleuquinas (IL), son una familia de citoquinas encargadas de la interacción entre leucocitos. Aquellas propias de la inmunidad innata son el factor de necrosis tumoral-alfa (TNF-α), IL-1, IL-6 e IL-8, esta última, muy importante en la quimiotaxis de granulocitos. En la respuesta adaptativa están interferón-gamma (IFN-γ), IL-2, IL-4, IL-5, IL-10, IL-35 y el factor de crecimiento transformante-beta (TGF-β), característico de Treg2,3.
3Inmunidad innataLa inmunidad innata es la primera línea de defensa, su función principal es el reclutamiento de células inmunitarias en los focos de infección e inflamación mediante la producción de citoquinas5.
Se activa por medio de un factor estresor que altera la homeostasis. Dicho factor puede ser un patrón molecular asociado a patógenos (PAMP) o asociado a daño (DAMP). Estos son detectados por los receptores de reconocimiento de patrones (PRR, por sus siglas en inglés) ubicados en la superficie de las células del huésped, gatillando la descarga de proteinasas y metaloproteinasas desde los granulocitos, que generan gran inflamación2.
La activación macrofágica permite fagocitar los restos de este proceso inflamatorio y la proliferación de células mesenquimales inicia la restauración de la homeostasis. Noxas de muy alta energía o condiciones mesenquimales severamente alteradas -enfermedades crónicas - pueden impedir la regeneración ad-integrum y evolucionar hacia un tejido fibrótico6.
La adecuada activación, desarrollo y resolución de los fenómenos inflamatorios depende de tres factores:
- 1.
Equilibrio de los eicosanoides
- a.
Proinflamatorios: tromboxanos, leucotrienos y prostaciclinas. Derivados del ácido araquidónico (ARA), de la familia omega-6.
- b.
Antiinflamatorios: mediadores especializados pro-resolución (SPM, por sus siglas en inglés). Derivados del ácido docosahexaenoico (DHA) y del ácido eicosapentaeonoico (EPA), de la familia omega-3.
- a.
- 2.
Tono adrenérgico: sistema nervioso autónomo simpático (noradrenalina).
- 3.
Niveles de cortisol: dependiente del eje hipotálamo-hipofisario-adrenal7.
El equilibrio de los eicosanoides depende del balance entre mecanismos proinflamatorios y antiinflamatorios. Los precursores vegetales como el ácido linoleico en la familia omega-6 y ácido alfa-linolénico (ALA) en la familia omega-3, son biológicamente inactivos. A través de sucesivas elongaciones y desaturaciones pueden convertirse en ARA y DHA/EPA respectivamente, formas biológicamente activas8.
Los ácidos grasos EPA y DHA disminuyen la inflamación por dos mecanismos. En primer lugar, aumentan la producción de SPM entre los que se encuentran diferentes grupos moleculares:9. En segundo lugar, al restaurar el balance omega-6/omega-3, disminuyen la producción de eicosanoides proinflamatorios derivados del ARA (tromboxanos, prostaglandina E2 y leucotrienos proinflamatorios) y, disminuye las citoquinas propias de la inmunidad innata como TNF-α, IL-1, IL-8 e IL-610.
El alto consumo de omega-6, propio de las dietas occidentales, ha llevado a un desequilibrio en el balance de los eicosanoides. La proporción fisiológica omega-6/omega-3 de 4/1 o 5/1, ha sido reemplazada por tasas superiores a 15/1, promoviendo una mayor prevalencia de enfermedades inflamatorias crónicas11,12.
El sistema inmune inmaduro es muy susceptible a las condiciones ambientales, especialmente en el periodo pre y postnatal11. La suplementación nutricional con EPA podría ser considerada como tratamiento o prevención de enfermedades inflamatorias crónicas10. Su administración durante el embarazo ha mostrado algunos beneficios en prevención del asma, lo que sugiere un rol inmunomodulador en el recién nacido13.
La suplementación neonatal se puede hacer a través de la leche materna rica en ARA/DHA, y una óptima relación omega-6/omega-3.
Las fórmulas de reemplazo o complemento debieran ser suplementadas con estos lípidos12. Además, la leche materna posee otras biomoléculas. Es rica en proteínas, vitaminas, minerales, prebióticos, además de citoquinas y factores inmunomoduladores, dentro de los cuales, los más importantes son la lactoferrina humana y la inmunoglobulina A secretora. Diversos estudios evidencian una reducción significativa de las infecciones de los niños que son amamantados respecto a los que no lo son, y la reducción en morbilidad en asma y alergias14.
Acorde a lo revisado previamente, otros factores involucrados son los corticoides y catecolaminas, que participan en el ciclo inflamatorio al acoplarse a receptores de células inmunes e influir en la liberación de citoquinas. Así se ha visto, que en las tres fases de este ciclo las relaciones de estas hormonas son diferentes:
- 1.
Inicio: catecolaminas altas y cortisol bajo.
- 2.
Resolución: catecolaminas tienden a igualarse con cortisol.
- 3.
Terminación: catecolaminas bajas y cortisol más alto7.
Es necesaria la apropiada interacción de estas tres redes (eicosanoides, sistema nervioso autónomo y eje hipotálamo - hipofisiario - adrenal) para permitir un ciclo inflamatorio adecuado, que permita controlar los PAMP o DAMP que lo gatillan, los posteriores procesos de remoción de detritus, proliferación de células mesenquimales y remodelación, para finalmente lograr una regeneración ad-integrum7.
4Factor nuclear potenciador de las cadenas ligeras kappa de las células B activadas (NF-κB)El NF-κB tiene importantes funciones en la regulación de la inmunidad innata, el proceso inflamatorio y fenómenos de control celular15. Su déficit se asocia a defectos inmunes graves, y su sobreexpresión a enfermedades metabólicas, inflamatorias y cáncer16.
Algunas citoquinas y PAMPs estimulan receptores de la superficie celular, incluyendo los receptores tipo toll (TLRs), para iniciar una cascada de señalización que resulta en la activación de FN-κB, a través del desacoplamiento del complejo de moléculas de adhesión intercelular (ICAM)16,17. Así, entra al núcleo donde promueve la expresión de genes diana que median la proliferación celular y síntesis de citoquinas activadoras de la respuesta inmunitaria adaptativa. De esta manera, el FN-κB, puede perpetuar la inflamación, si su activación no es detenida. Actualmente se sabe que este factor juega un rol central en enfermedades inflamatorias del tejido adiposo, hígado, sistema nervioso central y otros17.
En la práctica clínica, algunos antagonistas específicos de interleuquinas activadas por el FN-κB son blanco terapéutico en enfermedades autoinmunes o inflamatorias, como las terapias biológicas dirigidas específicamente contra IL-1 o IL-6.
La quinasa inductora de FN-κB (NIK), ampliamente estudiada, ha demostrado su importancia en la función de células B, células T, macrófagos, células dendríticas y células madre hematopoyéticas16. Tiene un potencial interés terapéutico en enfermedades cuya patogenia incluye desregulación inmunológica, como el cáncer y enfermedades cardiovasculares16.
El FN-κB cumple un rol fundamental en la fisiopatología del parto prematuro al controlar la síntesis de prostaglandinas y citoquinas proinflamatorias involucrados en este proceso18. Evidencia en prematuros con infección intraamniótica, sugiere una mayor activación de este factor en membrana fetal y sangre materna19.
5Inmunidad adaptativaLa inmunidad adaptativa se activa por interacción con componentes celulares y citoquinas de la inmunidad innata, al ser ésta ineficaz para eliminar la noxa gatillante5.
Sus principales células efectoras son los linfocitos T y B, propios de las respuestas celular y humoral (anticuerpos) respectivamente. En la activación de éstas, juegan un rol muy importante las células presentadoras de antígenos (CPA)1,5.
5.1Activación o inducción de la inmunidad adaptativaLas células T se originan en la médula ósea y se diferencian en el timo. Previo a su activación, tienen la potencialidad de montar cualquiera de las diferentes respuestas, por lo que se les llama Th0 o Th “naïve”. Tienen en su membrana receptores específicos de células T (TCR, por sus siglas en inglés) que serán reconocidos por las células presentadoras de antígenos (CPA)5. Pueden actuar como CPA los macrófagos, mastocitos, células de la mucosa digestiva (célulasM) y, las más importantes, las células dendríticas.
Las células dendríticas, presentes en diferentes mucosas, tienen la capacidad de reconocer y fagocitar antígenos. Una vez dentro de las vacuolas, son digeridos hasta llegar a pequeños péptidos que se unen a estructuras proteicas llamadas complejo mayor de histocompatibilidad tipo II (CMH-II) y migran a la membrana celular formando los que se conoce como epítope. Cada CPA puede expresar una significativa cantidad de epítopes diferentes, posibles de ser presentados a un Th01,3.
El epítope, unido al TCR, iniciará la activación del Th0 que evolucionará a una célula especializada en un cierto tipo de respuesta, dependiendo de las citoquinas intercurrentes al momento de la presentación. Aquí, sólo nos centraremos en las de tipo celular (Th1), humoral (Th2) y reguladoras (Treg)5.
Una vez activado, el Th0 iniciará la diferenciación comenzando a producir interleuquinas específicas, las que promoverán dicho proceso. Simultáneamente, comenzará a dividirse formando un clon, aumentando la producción de estas citoquinas, que, además, son específicas para cada tipo de respuesta:
- -
Th1 o celular: la presentación de antígenos es en presencia de ciertas IL propias de inmunidad innata, habitualmente elevadas en reacciones inflamatorias. Las más frecuentes son IL-1, IL-6, IL-8 y TNF-α. El Th, diferenciado a Th1, inicia un rápido proceso de división y secreción de IL específicas como IFN-γ, IL-12 e IL-2. Estas activan macrófagos y linfocitos T CD8+, que cumplen un importante rol citotóxico directo. Esta forma de respuesta celular es muy importante frente a agresores intracelulares, como virus.
- -
Th2 o humoral: la presentación de antígenos ocurre en presencia de IL-4, frecuentemente secretada por mastocitos de piel, promoviendo una diferenciación hacia Th2. Las IL más importantes producidas por este clon son, IL-4 fundamental en la activación y diferenciación de linfocitos B a células plasmáticas productoras de anticuerpos (IgE), IL-5 en la activación de eosinófilos, e IL-10 en modular a la baja la respuesta Th1. La respuesta Th2 es muy importante en las infestaciones cutáneas por parásitos y, su hiperexpresión, condiciona reacciones alérgicas.
- -
Treg: la presentación en presencia de TGF-β, IL-10 e IL-35. La amplificación de estos, cumple un importante rol en la limitación de la respuesta inflamatoria y desarrollo de tolerancia. IL-10 inhibe específicamente a Th1 y, TGF-β, a Th1/Th21–3.
El inmunobalance Th1/Th2 es lo fisiológico. El desbalance hacia una u otra forma de respuesta, debe persistir lo suficiente para controlar la noxa gatillante y posteriormente, volver al equilibrio mantenido por la expresión de IL-10 e IL-12, producidas por Th2 y Th1 respectivamente21,22.
La persistencia de Th1 favorece condiciones como las enfermedades inflamatorias intestinales y síndrome metabólico. La de Th2, alergias, infecciones recidivantes y enfermedades autoinmunes21–23.
Las células B también se originan en la médula ósea, pero no migran hasta completar su maduración. Expresan sólo un tipo de receptor y no necesitan CPA para su activación, sino IL-4 (Th2). Su principal función es la formación de anticuerpos (inmunidad humoral), de los que existen diferentes tipos dependiendo del patógeno: IgA, IgD, IgE, IgG e IgM1,3.
5.2Actividad efectora de la inmunidad adaptativaTodas las mucosas y epitelios, que durante la embriogénesis y después, hubieren estado en contacto con el medio externo, tienen un tejido linfático asociado (conocido por su sigla en inglés, MALT), que puede actuar como sitio activador o efector de la respuesta inmune. Los linfocitos tienen la capacidad de migrar y permanecer en los diferentes componentes de éste (conocido por la palabra inglesa “homing”). Por esta razón, frecuentemente concurren procesos inflamatorios en zonas aparentemente no relacionadas y distantes. Los procesos de inducción ocurren en componentes del MALT más expuestos a antígenos externos, como el tubo digestivo (GALT), vía respiratoria alta (NALT) y piel (SALT). Pero las reacciones inmunológicas pueden ocurrir en cualquiera de ellas, incluso en SNC (CNSALT), mucosa ocular, glándula mamaria y otras24,25.
5.3MicrobiotaLa flora bacteriana cumple un rol importante en la inmunomodulación, ya que tapiza de manera extensa el tubo digestivo, vía respiratoria alta y baja, y piel, demostrando que la interacción con el sistema inmune es amplia24,25.
Consiguientemente, la colonización es esencial en el desarrollo del sistema inmunológico, facilitando un equilibrio entre los antígenos ambientales y la respuesta inmune. Esta se adquiere por exposición al canal del parto, contacto parental y con el ambiente8,10.
Varios factores como el estrés, antibioterapia, fórmulas lácteas o infecciones intestinales, pueden alterar la flora normal (disbiosis)26.
Hoy, las intervenciones sobre la microbiota son promisorias estrategias terapéuticas en enfermedades inflamatorias27,28.
6Otros elementos que cumplen un rol en la actividad inflamatoria6.1Radicales libres (RL)Los RL, átomos o moléculas con uno o más electrones no apareados, son altamente reactivos, tienen vida media corta, e inducen la formación de otros RL por reacción en cadena29. Entre los derivados de oxígeno se encuentra el superóxido (O2•-), radical hidroxilo (•OH), peróxido de hidrógeno (H2O2), radical peroxilo, hidroperóxido orgánico y el oxígeno singlete o singulete 1O230.
Los RL de oxígeno pueden provenir de fuentes endógenas o exógenas. En su producción intracelular participan procesos enzimáticos de la mitocondria, peroxisomas y microbiota comensal, sumado a actividad enzimática de xantina oxidasa, mieloperoxidasa y otras31. La mitocondria es la principal productora endógena de especies reactivas del oxígeno (ROS, por sus siglas en inglés), a través de la fosforilación oxidativa32. Además, los macrófagos y neutrófilos al ser activados producen ROS con el fin de combatir microorganismos invasores30. Entre otras células productoras de RL están los fibroblastos y células endoteliales33. De origen exógeno son los contaminantes ambientales y otros, que no se analizarán por exceder el propósito de esta revisión.
Los RL participan en funciones fisiológicas del organismo, como la lisis de microorganismos patógenos por daño directo en sus biomoléculas34, sin embargo, su elevada reactividad y altos niveles, pueden causar daño estructural en ADN, proteínas, carbohidratos y lípidos35. A este desbalance crónico, se le llama estrés oxidativo36 y puede promover enfermedades inflamatorias crónicas, neoplásicas y degenerativas37. Los niveles plasmáticos de RL están estrechamente regulados por mecanismos antioxidantes endógenos y exógenos. En el primer grupo se encuentran los sistemas enzimáticos: superóxido dismutasa, catalasa, glutatión peroxidasa y los “atrapadores” de radicales libres como el glutatión38. Este último es el principal antioxidante intracelular39. La enzima glutatión peroxidasa requiere Selenio como cofactor, que debe ser aportado, aunque en bajas concentraciones37.
Entre los antioxidantes exógenos se encuentra el ácido ascórbico–vitamina C–, abundante antioxidante hidrosoluble, los tocoferoles - vitamina E - importante antioxidante lipofílico, y los carotenoides. A este grupo pertenecen los alfa y betacarotenos, licopenos, luteínas, xantinas y criptoxantinas. Por último, los fenoles: polifenoles (flavonoides y taninos), flavonoides (antocianidinas, catequinas, citroflavonoides, isoflavonoides y protoantocianidinas) y ácidos fenólicos40,41. Por su participación como cofactores de los sistemas enzimáticos se debe aportar minerales como Cu, Zn, Se, Mn y Fe, por lo que se consideran antioxidantes, aunque su rol no es directo sobre los RL42.
7Inmunidad en el recién nacido pretérminoEl feto cercano a término presenta una predominancia Treg en la interfaz materno-fetal, que sostiene una situación de tolerancia, la cual, permite llegar al final del embarazo. En el trabajo de parto prematuro (TPP) de origen infeccioso hay un desbalance de tipo Th1, con elevación de IFN-γ, TNF-α e incremento de Linfocitos T CD4+ y CD8+. En aquellos TPP sin elementos infecciosos, también hay una activación de células T CD4+ con incremento predominante en niveles de IL-13 e IL-4 (Th2)43.
En prematuros, la inmunidad innata es insuficiente por la inmadurez de diversas barreras:
- -
Cutánea: Piel extremadamente delgada y permeable. Además, muy vulnerable por la ausencia de unto sebáceo, que en condiciones de madurez le confiere proteínas, péptidos antimicrobianos y un fino estrato córneo44.
- -
Mucosa respiratoria:clearance mucociliar ineficiente, baja expresión de TLR4 y TLR2, lo que determina una menor capacidad en el reclutamiento de neutrófilos. La insuficiente producción de surfactante priva de ciertas proteínas como son la SP-D y SP-A con capacidad opsonizante.
- -
Mucosa intestinal: baja motilidad intestinal y mayor permeabilidad, que facilita el sobrecrecimiento y translocación bacteriana26.
- -
Inmadurez en componentes celulares de la inmunidad innata:
- •
Neutrófilos: menor recuento y baja capacidad funcional en la quimiotaxis, diapédesis y fagocitosis45.
- •
Células fagocíticas: Inmadurez de monocitos, macrófagos y células dendríticas, lo que lleva a una disminución de la reacción inflamatoria por una menor activación de co-estimuladores necesarios para la presentación de antígenos y activación de linfocitos T y B26.
- •
“Natural Killers” (NK) inmaduros y con escasa secreción de IFN-γ, TNF-α y citoquinas46.
- •
La inmunidad adaptativa tiene aún menor expresión, con baja producción de anticuerpos y escasa respuesta a antígenos polisacáridos favoreciendo una mayor propensión a infecciones. Se debe mencionar también, que la capacidad inmunomoduladora determinada por IL-10 y TGF-β es aún muy ineficiente44. En prematuros, la concentración de IgG es muy inferior, ya que la principal transferencia transplacentaria de anticuerpos ocurre durante el tercer trimestre. Otras inmunoglobulinas, como IgA, IgD, IgM e IgE no participan de este proceso26. Las células productoras de IgA en el intestino del recién nacido no aparecen hasta el mes de vida y depende del balance en la microbiota intestinal, por lo que una disbiosis altera más esta función47.
El desbalance de células T hacia Th2 en el período neonatal está bien estudiado, y parece asociarse a una reducción en la producción de IL-12 e IFN-α48. Esto puede tener un efecto sobre la respuesta inmunitaria a antígenos y alérgenos en las primeras etapas de la vida, generando una posible predisposición a respuestas de tipo alérgica21. El contacto con la microbiota y el medio ambiente ayudan en el desplazamiento hacia Th1. Por esta razón, el uso temprano de antibióticos y la hiper-higiene, pueden promover condiciones alérgicas al mantener el desequilibrio inicial23,26. Esta condición, como consecuencia, favorece una mayor susceptibilidad a infecciones, una disminución de la eficacia de las vacunas y el desarrollo de asma y alergia21.
El cambio de citoquinas que genera un proceso infeccioso intrauterino lleva a una modificación en la predominancia de células T con un desplazamiento hacia Th1 y decremento de Treg, lo que finalmente gatilla el parto prematuro49.
Estos microorganismos y los mediadores proinflamatorios presentes en el líquido amniótico pueden ser ingeridos por el feto y provocar así, una respuesta inflamatoria fetal (SRIF) que se caracteriza por un aumento de reactantes de fase aguda propios de la inmunidad innata: IL-6, proteína C reactiva (PCR), IL-1, factor estimulante de granulocitos (GM-CSF) e IL-8 en el plasma fetal. Este último, tiene un poderoso efecto quimiotáctico en la atracción de granulocitos a los sitios de inflamación. Si a todo esto se suma la escasa capacidad de limitar la respuesta, lleva a una cascada inflamatoria descontrolada50.
8ConclusiónLos avances en el conocimiento inmunológico nos permiten entender los procesos involucrados, y distinguir las diferencias entre la respuesta inmune madura e inmadura en el prematuro extremo. La identificación de los mecanismos proinflamatorios y antiinflamatorios participantes en el síndrome inflamatorio perinatal persistente, como en otras enfermedades inflamatorias, permite plantear nuevos enfoques terapéuticos basados en la inmunomodulación, evitando así las secuelas producidas por la inflamación. La intervención sobre el equilibrio de los eicosanoides con EPA/DHA, la suplementación con vitaminas y minerales con efecto antioxidante, el control de factores determinantes de disbiosis y, el uso del FN-κB como marcador de función inmunológica, son promisorias estrategias tendientes a lograr el objetivo inmunomodulador.
Declaración de conflicto de interésLos autores declaran no tener conflicto de interés en relación a este artículo.
Referencia no citada20.