La infección por Clostridium difficile (ICD) es la principal causa de diarrea infecciosa en pacientes hospitalizados. Su incidencia ha cambiado durante las últimas décadas, con un alarmante aumento tanto de la incidencia como de la severidad de presentación del cuadro clínico. Los pacientes pueden ser portadores asintomáticos o presentar desde una diarrea leve a una colitis pseudomembranosa, megacolon tóxico, sepsis y muerte. El enfrentamiento de la ICD sigue presentando puntos de controversia, tanto en la elección del mejor método diagnóstico como en el tratamiento. El objetivo de esta revisión es entregar una información actualizada sobre la patogénesis, diagnóstico y estrategias terapéuticas sobre el manejo de la ICD.
Clostridium difficile infection (CDI) is the leading cause of hospital acquired diarrhea. The incidence of Clostridium difficile has changed the last decades, with an alarming increase of the frequency and severity of the clinical manifestations. The patients can be asymptomatic carriers or present a mild diarrhea, a pseudomembranous colitis, toxic megacolon, sepsis and death. The approach of the CDI continues presenting points of controversy in the choice of the best method of diagnosis and also in the treatment. The aim of this review is to provide an update on the pathogenesis, diagnosis and therapeutic strategies on the management of the CDI.
El Clostridium difficile (CD) es el principal patógeno responsable de la diarrea adquirida en pacientes hospitalizados, entidad conocida como infección por CD (ICD) (1–3). La incidencia de la ICD ha ido en aumento, tanto en pacientes hospitalizados como en la comunidad. Esto se debe en parte a la aparición de cepas hipervirulentas, pero también a la mejora en los métodos diagnósticos disponibles y al uso a veces indiscriminado de antibióticos, en particular en relación al uso de fluoroquinolonas (2–7).
PatogeniaEl organismo actualmente conocido como CD se describió por primera vez en 1930, pero recién en 1978 se identificó como agente causal de la colitis pseudomembranosa, aislada en las deposiciones de un paciente en tratamiento con clindamicina (2, 3).
El CD es una bacteria anaerobia Gram positiva, formadora de esporas y es transmitida vía fecal-oral, frecuentemente por contacto con personas infectadas sintomáticas o asintomáticas (3, 8, 9). La mayoría de las formas vegetativas de CD ingeridas son eliminadas en el estómago y sólo un 1% del inóculo llega al intestino delgado. Sin embargo, las esporas de CD son resistentes a la acidez del estómago y pueden germinar en el intestino delgado con la exposición a las sales biliares, reactivándose a su forma vegetativa. Cuando estas formas vegetativas llegan al ambiente anaerobio del ciego y colon en un hospedero susceptible, proliferan y colonizan la mucosa (3, 8–10). La alteración de la microbiota intestinal normal permite que las células en su forma vegetativa penetren la mucosa y se adhieran a la superficie del epitelio (9).
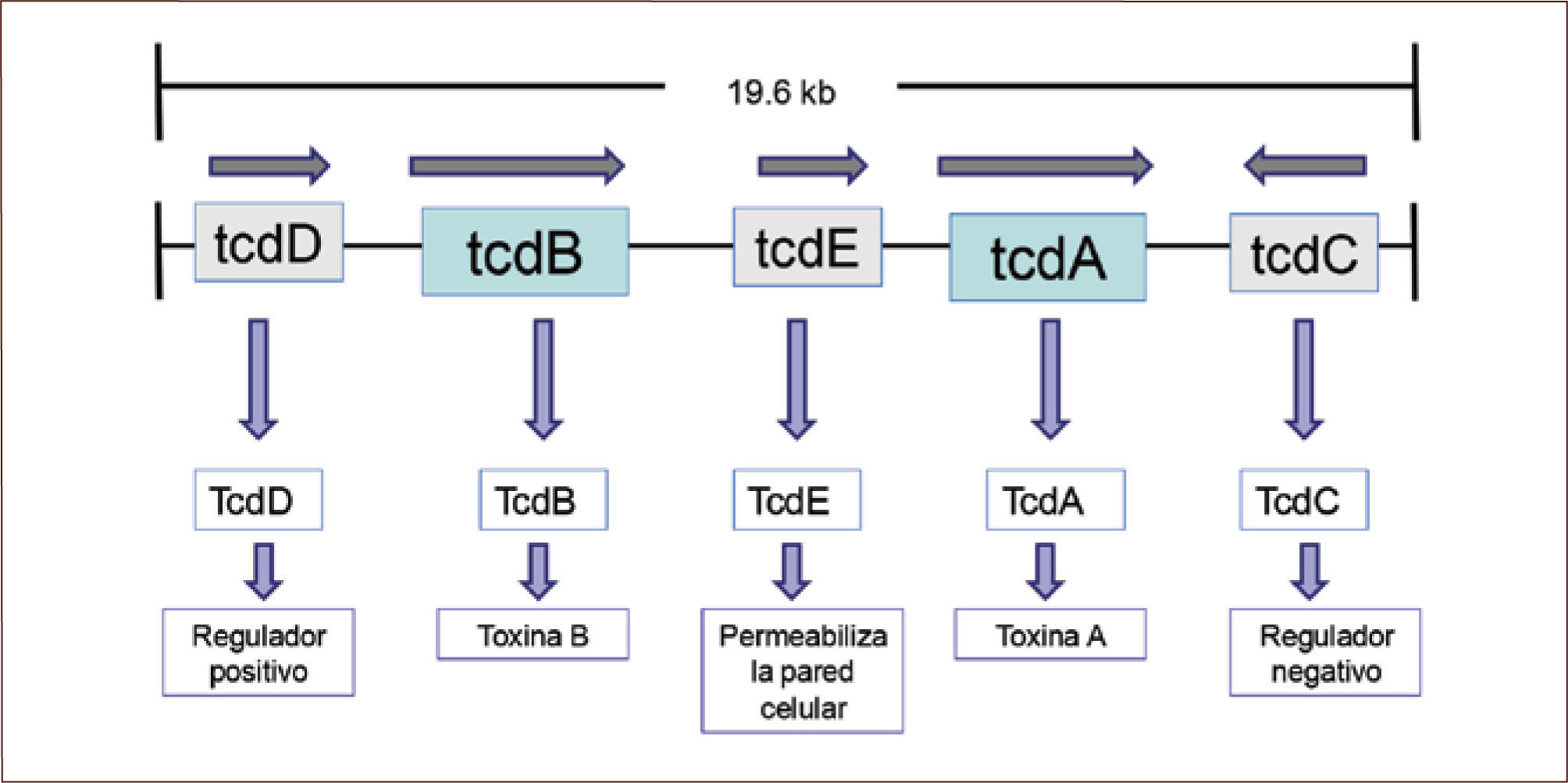
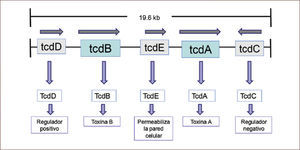
Diversos factores de virulencia se asocian al desarrollo de la enfermedad. Los más conocidos son las toxinas A y B, codificadas por los genes tcdA y tcdB, respectivamente. Juntos a dos genes regulatorios (tcdC y tcdD) y un gen porina (tcdE) forman el locus de patogenicidad cromosómica (PaLoc) (figura 1). La expresión de tcdA y tcdB está regulada en forma positiva por tcdD y en forma negativa por el gen tcdC. Los polimorfismos o deleciones parciales de tcdC pueden llevar a una producción aumentada de las toxinas A y B. El gen tcdE facilitaría la liberación de las toxinas mediante la permeabilización de la pared celular del CD (3, 10, 11). Se ha estudiado en extenso la función por separado de las toxinas A y B, pero en concreto, todas las cepas toxigénicas de CD producen la toxina B, pero no necesariamente la toxina A, sugiriendo estos hallazgos que la toxina B jugaría un rol predominante en la ICD (9).
Otros factores de virulencia que se han descrito son la toxina binaria y las proteínas de superficie que median la adherencia de CD a las células epiteliales del hospedero. La presencia de estas varía en las diferentes cepas de CD y podrían influir en la capacidad del patógeno de unir al epitelio del colon, actuando en forma sinérgica con las toxinas A y B (3, 9, 11, 12).
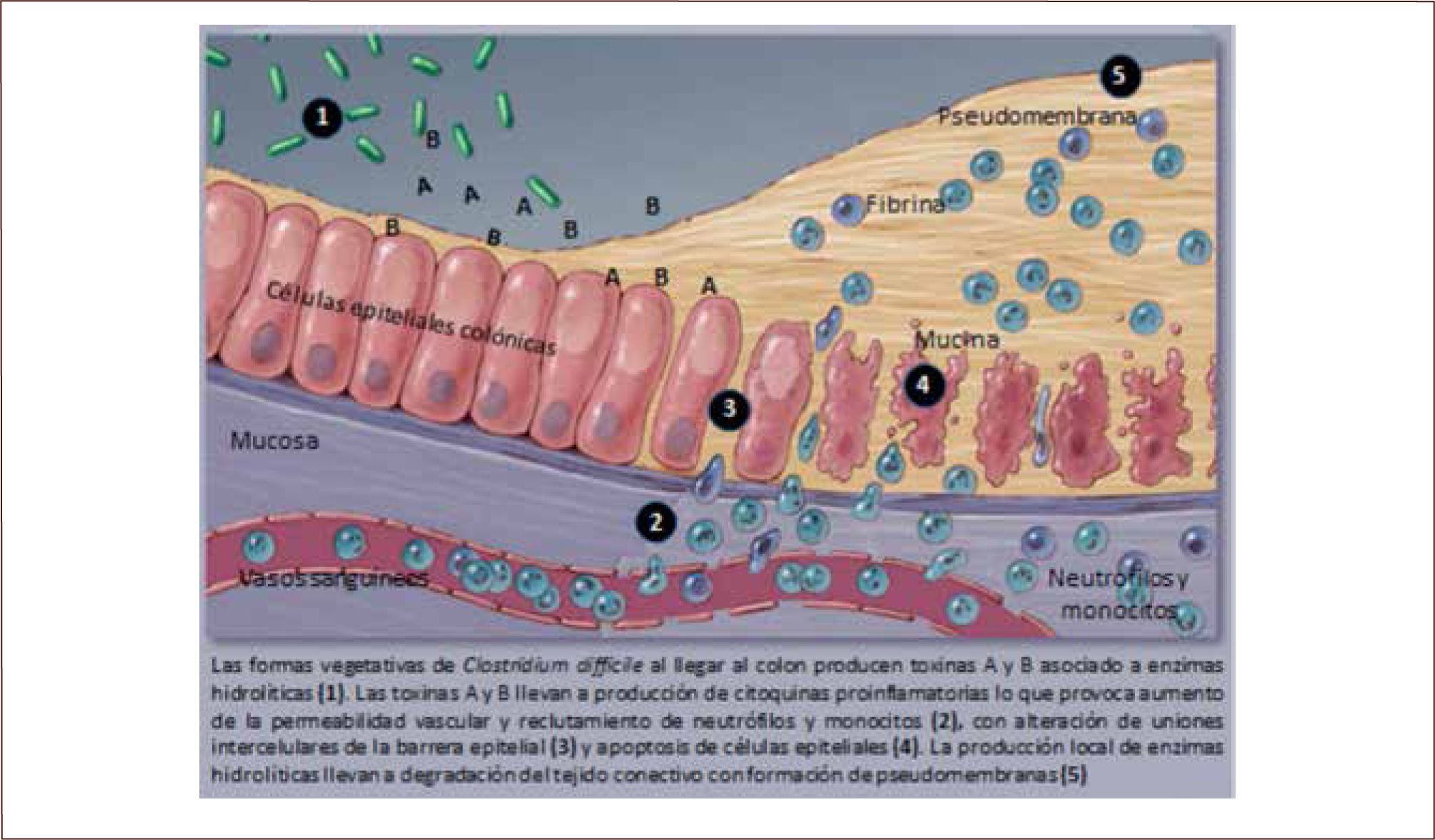
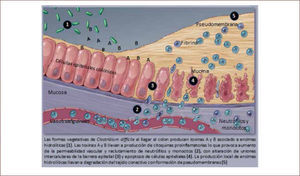
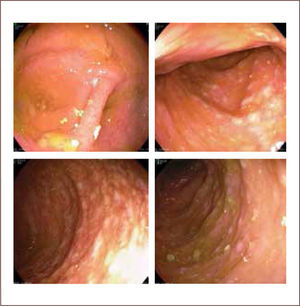
Las toxinas A y B provocan inflamación a nivel de intestino grueso, aunque se ha descrito aumento de la incidencia de inflamación por CD en la mucosa ileal con formación de pseudomembranas en pacientes sometidos a colectomía (13). Las toxinas generan aumento de la permeabilidad epitelial, producción de citoquinas, infiltración de neutrófilos, producción de intermediarios reactivos del oxígeno, activación de mastocitos, producción de sustancia P y daño directo a la mucosa intestinal (3, 9). Uno de los eventos más importantes atribuidos a las toxinas durante la colitis pseudomembranosa es su capacidad para alterar las uniones intercelulares estrechas de la barrera epitelial. Esta pérdida de integridad del epitelio favorece la migración de neutrófilos al lumen intestinal, lo que contribuye en forma significativa a la formación de pseudomembranas (figura 2). Estas últimas tienen una apariencia característica de placas adherentes solevantadas blancas amarillentas intercaladas con mucosa inflamada que en ocasiones confluyen, formando las clásicas pseudomembranas (figura 3). Histológicamente, las pseudomembranas corresponden a neutrófilos, fibrina, mucina y restos celulares (3, 10, 13). Gran protagonismo en la fisiopatología de la ICD ha tomado la microbiota intestinal. Está bien establecido que su indemnidad previene la ICD y su recurrencia (14), pero se ha visto que hay metabolitos específicos de la microbiota alterada que pueden promover la ICD. Los antibióticos no sólo disminuyen la biodiversidad de la microbiota intestinal, también se asocian a disminución de los niveles de ácidos grasos de cadena corta, aminoácidos y sales biliares primarias. Los ácidos grasos de cadena corta regulan múltiples procesos, incluyendo la proliferación y diferenciación celular, activación de respuesta inflamatoria y reclutamiento de neutrófilos. Las sales biliares juegan un importante rol en la regulación de la germinación de esporas de CD (9, 15).
Tanto los factores de virulencia de CD como las alteraciones de la microbiota intestinal y la incapacidad del hospedero de mostrar una efectiva respuesta inmune ante el CD se relacionan con la elevada tasa de recurrencia de la ICD (2, 13, 16).
EpidemiologíaDurante la última década se han presentado brotes intrahospitalarios graves en Norteamérica y Europa, alcanzando la ICD una incidencia de hasta 92 por 100.000 habitantes. En Estados Unidos la incidencia de diarrea por CD en pacientes adultos hospitalizados se dobló de 5,5 casos por 10.000 habitantes a 11,2 por 10.000 habitantes en 2005. La tasa de hospitalización por CD aumentó aproximadamente 23% por año entre 2000 y 2005, destacando un incremento entre las personas mayores de 65 años, con una incidencia cinco veces más alta en comparación a personas entre 45 y 64 años (4, 6, 12).
Los agentes etiológicos de los brotes en Quebec y en varios hospitales de Estados Unidos fueron cepas hipervirulentas casi idénticas de CD, conocidas como ribotipo 027, NAP1 (North American pulsed-field gel electrophoresis type 1). Esta cepa presenta una variación en el gen represor tcdC (figura 1), lo que se manifiesta en hiperproducción de toxinas A y B. Estos brotes tuvieron menor respuesta a la terapia estándar, con mayor necesidad de colectomías de urgencia por colitis fulminante, mayor frecuencia de recurrencia y mayor mortalidad (2, 5, 13, 17–20). Loo y colaboradores (21) describió en su estudio realizado en 12 hospitales de Quebec una mortalidad a 30 días atribuible a CD de 6,9 %. Con el reconocimiento de los brotes de CD, se implementaron medidas de control de la infección, con lo cual la incidencia disminuyó de 22,5 por cada 1.000 ingresos a 12,4 por cada 1.000 ingresos (12).
Las infecciones asociadas a CD poseen una elevada tasa de recurrencia, desde 15–30% después de un primer episodio de diarrea por CD. Luego de una primera recurrencia, las tasas de recurrencia llegan a 40% y sobre 60% después de dos o más recurrencias (1, 8, 16, 22). De estos pacientes, entre un 3–5 % tendrán hasta más de seis recurrencias (1). Generalmente estos episodios se presentan dentro de los primeros dos a 21 días posterior a la suspensión de los antibióticos, con un promedio de seis días (1, 17).
El principal reservorio de CD incluye pacientes colonizados o infectados junto con ambientes y superficies contaminadas, ya sea en hospitales o instituciones relacionadas con la atención de salud. Se ha relacionado el riesgo de colonización por CD en forma directa con la duración de la hospitalización (10).
La Sociedad de Salud Epidemiológica de Norteamérica (SHEA) y la Sociedad de Enfermedades Infecciosas de Norteamérica (IDSA) recomiendan diferenciar para vigilancia epidemiológica los casos de infección por CD como se detalla a continuación: (18)
- •
Asociada a centros de salud: paciente que desarrolla diarrea 48 horas posterior al ingreso al hospital hasta el alta o dentro de las cuatro semanas posterior al alta.
- •
Comunitaria: infección por CD que ocurre en la comunidad o en las primeras 48 horas de hospitalización, sin hospitalización en un período mayor a 12 semanas.
- •
Indeterminada: aquellos pacientes con infección por CD que se desarrolla en la comunidad entre 4 y 12 semanas del alta hospitalaria.
Cualquier factor relacionado con la alteración de la microbiota colónica normal aumenta el riesgo de colonización por CD posterior a la exposición al patógeno y eventual diarrea. El factor de riesgo más conocido para el desarrollo de la ICD es el uso de antibióticos (tabla 1). El tiempo entre la exposición al antibiótico y el desarrollo de síntomas puede ir desde un día a 10 semanas (10, 12, 13). La hospitalización reciente es también un factor de riesgo importante a considerar (13, 14).
La ICD afecta principalmente a adultos mayores, quienes además tienen mayor riesgo de una enfermedad severa y complicada (7, 20). También son de mayor riesgo aquellos pacientes con múltiples comorbilidades e inmunosuprimidos, éstos son aquellos con presencia de malignidad, quimioterapia, corticoterapia, trasplante de órgano y cirróticos (2, 8, 10, 13, 16, 20).
Los pacientes con Enfermedad Inflamatoria Intestinal (Ell) tienen mayor riesgo de desarrollar una ICD, especialmente colitis ulcerosa; independiente de la exposición a antibióticos, probablemente en relación a la alteración que presentan en su microbiota intestinal. En estos pacientes la inmunosupresión, específicamente el uso de corticoides, se asocia a tres veces mayor riesgo de ICD. No se ha encontrado que el efecto de los corticoides sea dosis o duración dependiente (8, 13, 16). Junto con esto, la Ell se ha relacionado con formas fulminantes de presentación de la ICD (13).
Otros factores de riesgo comúnmente citados son la cirugía digestiva, sondas nasogástricas y uso de inhibidores de la bomba de protones (IBP) y antagonistas de receptores de histamina (8, 10, 14). En relación a los IBP, hay resultados controvertidos. En un metaanálisis, éstos se asocian a dos veces más riesgo de infección por CD (23), lo que se podría relacionar a que la supresión de la acidez gástrica aumentaría el paso de CD en su forma vegetativa, favoreciendo la llegada de CD al intestino grueso (8, 24). Sin embargo, un estudio retrospectivo reciente en 849 pacientes hospitalizados con ICD tratados en forma concomitante con IBP, no demostró asociación con recurrencia de ICD (25). Pese a esto, la FDA (US Food and Drug Administration) puso recientemente una advertencia que asocia a los IBP con mayor riesgo de desarrollar una ICD (20).
Se ha señalado que pacientes que no se consideraban en grupos de riesgo, jóvenes y previamente sanos, también pueden desarrollar una ICD sin haber estado hospitalizados ni haber recibido tratamiento antibiótico, situación que es importante de considerar ya que facilita el diagnóstico y tratamiento precoz en este subgrupo de pacientes (13, 18, 20).
Hay factores de riesgo independientes para la recurrencia de la infección por CD, destacando aquellos pacientes >65 años, comorbilidades y la exposición a antibióticos posterior a diarrea por CD (10, 13, 25).
Cuadro clínicoEl cuadro clínico de la infección por CD va desde portadores asintomáticos a una diarrea leve, colitis o una colitis pseudomembranosa y megacolon tóxico con riesgo vital (10, 16, 18, 26). La ICD se clasifica según su severidad. Esta clasificación es fundamental ya que entrega las directrices del tratamiento que se utilizará (tabla 2) (2, 16, 19).
Clasificaciún segên severidad de la infección por Clostridium difficile
| Leve - moderado | Menos de 6 deposiciones al día Leucocitosis < 15000/mm3 |
| Severo | Diarrea profusa (> 6 deposiciones al día) Que desarrolle en el curso de la diarrea:
|
| Severo complicado | ICD severa asociada a: (7)
|
La ICD severa y complicada ocurre en 3–10% de los pacientes (19, 27). Aunque la diarrea generalmente está presente, cuando hay un megacolon tóxico con íleo los pacientes pueden no tener diarrea e incluso presentar cuadro de constipación, situación que muchas veces se asocia a diagnóstico tardío de la ICD (19). Las complicaciones incluyen perforación colónica y peritonitis. La mortalidad asociada al megacolon tóxico es alta, llegando incluso al 38% (10, 16, 18).
Se considera como recurrencia a la infección por CD que ocurra dentro de las ocho semanas de inicio de un episodio primario, tras haber finalizado el tratamiento antibiótico adecuado, existiendo un período asintomático (18, 20).
Métodos diagnósticosEl diagnóstico de la ICD se hace en función al cuadro clínico y al estudio de deposiciones positivo o menos frecuente, en relación a los hallazgos de la colonoscopía (20). El tratamiento empírico sin pruebas de diagnóstico es inapropiado si existen pruebas de diagnóstico disponibles. Esta sugerencia se basa en que incluso en un ambiente epidémico, no más de un 30% de los pacientes hospitalizados que tengan diarrea asociada a antibióticos será secundaria a CD (1).
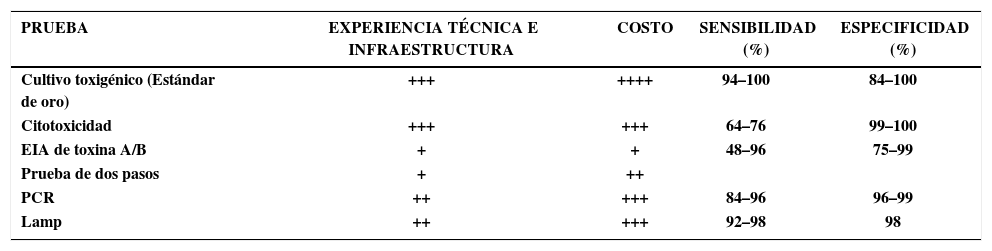
El diagnóstico de una ICD en un tiempo corto y de manera certera es fundamental tanto en el manejo del paciente como en la toma de medidas de aislamiento, limitando el riesgo de un brote nosocomial (11, 18, 28). Sin embargo, las estrategias óptimas para proporcionar resultados oportunos, económicos y precisos continúa siendo tema de controversia (tabla 3).
Tabla resumen de diferentes pruebas diagnosticas para Clostridium difficile
| PRUEBA | EXPERIENCIA TÉCNICA E INFRAESTRUCTURA | COSTO | SENSIBILIDAD (%) | ESPECIFICIDAD (%) |
|---|---|---|---|---|
| Cultivo toxigénico (Estándar de oro) | +++ | ++++ | 94–100 | 84–100 |
| Citotoxicidad | +++ | +++ | 64–76 | 99–100 |
| EIA de toxina A/B | + | + | 48–96 | 75–99 |
| Prueba de dos pasos | + | ++ | ||
| PCR | ++ | +++ | 84–96 | 96–99 |
| Lamp | ++ | +++ | 92–98 | 98 |
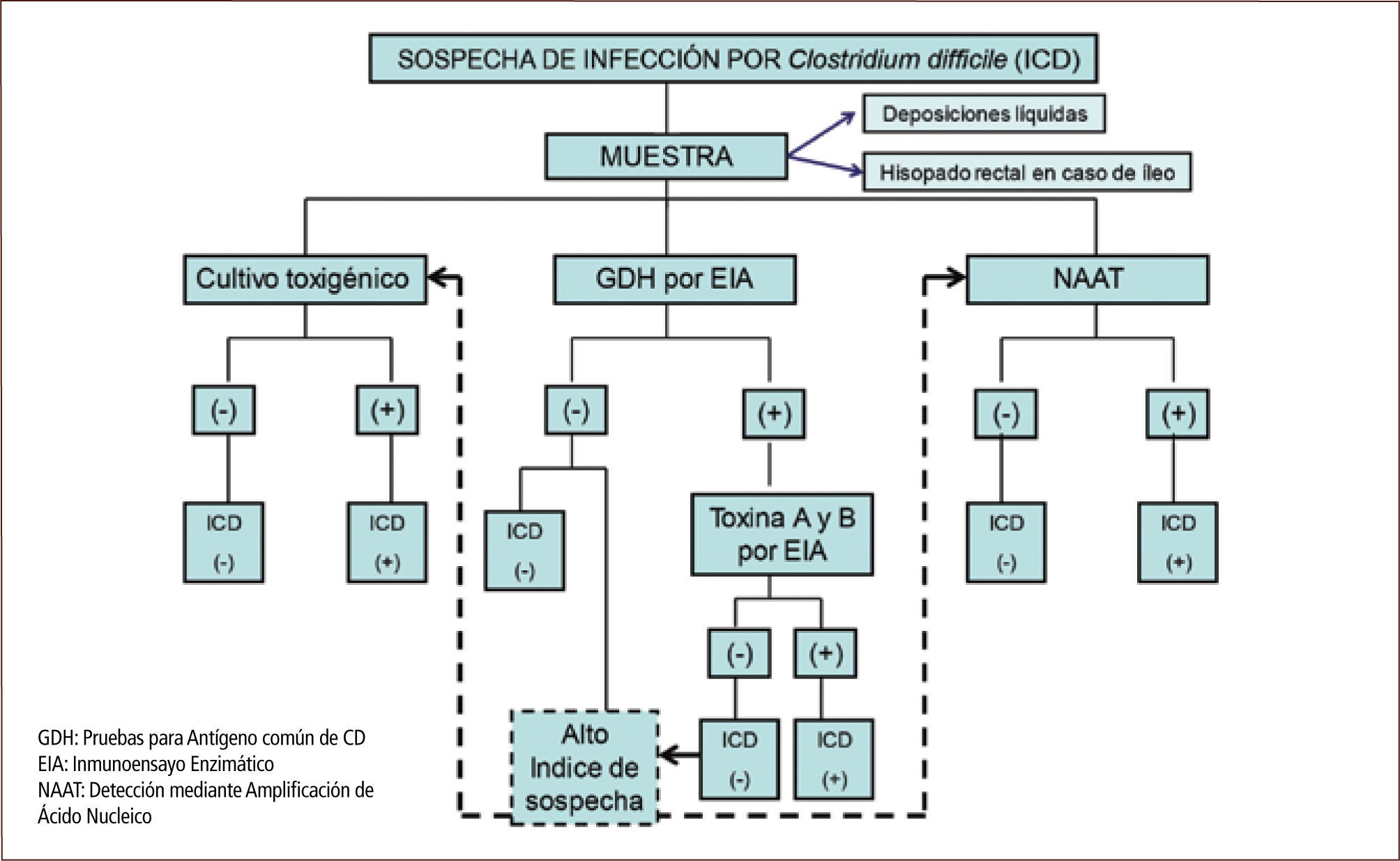
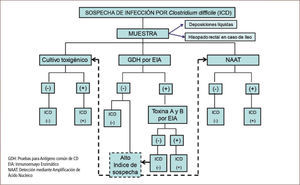
La muestra de laboratorio adecuada para el diagnóstico de CD es la materia fecal líquida no formada, la cual debe ser entregada rápidamente al laboratorio (figura 4). Excepto en raras ocasiones, en las que un paciente tiene íleo sin diarrea, las muestras en hisopo no son aceptables debido a que la portación de CD es alta (16, 18).
El procesamiento de una sola muestra de un paciente al inicio de un episodio sintomático generalmente es suficiente. Diversos estudios han demostrado que repetir la prueba posterior a un resultado negativo obtiene resultados positivos en menos del 5% de los casos y junto con esto, presenta la posibilidad de resultados falsos positivos. Por ende se debe evitar repetir el estudio de deposiciones en busca de CD (8, 10, 16, 18).
No es necesario realizar pruebas microbiológicas para confirmar que el paciente se ha curado si ya no presenta síntomas (13, 16, 18).
Análisis de citotoxicidad en cultivo celular o neutralización de citotoxinaIdentifica el efecto citopático inducido por toxina B en muestras fecales en cultivo de fibroblastos, observada como un halo característico alrededor de la célula y la neutralización de este efecto con antisueros (13, 18). Por mucho tiempo este método diagnóstico fue considerado el estándar de oro para el diagnóstico de CD. Publicaciones han mostrado que esta prueba tiene insuficiente sensibilidad para la detección de cepas productoras de toxinas, debido a la degradación de la toxina en el tiempo (11). En comparación con el cultivo toxigénico, la detección de citotoxicidad celular tiene una sensibilidad de un 67% (18, 29).
Cultivo toxigénico en deposicionesSe cultiva la muestra en un medio selectivo en anaerobiosis y luego de aislar las cepas de CD, se realiza la detección de la producción de toxinas. Por su gran sensibilidad ha reemplazado el análisis de citoxicidad como el método de referencia en la mayoría de los estudios, siendo el actual estándar de oro. El cultivo toxigénico permite además tipificar las cepas de CD para investigación (11, 13, 17, 18, 29).
Inmunoensayo enzimático (eia) de toxina A o toxinas A y BEn la actualidad es el método más utilizado para el diagnóstico de CD. Existen pruebas de EIA disponibles comercialmente que detectan ya sea únicamente la toxina A o ambas toxinas, A y B. La mayoría de los ensayos en que se usaba EIA eran comparados con el análisis de citotoxicidad celular, por lo que aparentemente tenían adecuada sensibilidad para el uso rutinario. Sin embargo, estudios recientes en que se comparó con el cultivo toxigénico como método de referencia, han mostrado que este método tiene sensibilidad no superior al 60%, por ende no se recomienda su uso como método único de diagnóstico (11, 13, 16, 29).
Pruebas para antígeno común de CD (GDH) por EIAGDH es un antígeno enzimático producido por CD y ocasionalmente otras especies de Clostridium. Se propuso como método de screening sensible, pero no específico de CD en deposiciones. Los kit comerciales de GDH demoran entre 15 y 45 minutos en estar listos, por lo que se usa en múltiples laboratorios. Tiene un alto valor predictivo negativo, lo que la convierte en útil para detección rápida, si se combina con otro método que detecte toxinas (11, 29).
Algoritmo de dos pasosSe basa en la detección de GDH, que es el primer paso. Un resultado negativo se considera negativo para el patógeno, pero un resultado positivo requiere de análisis posterior para determinar si la cepa de CD es toxigénica. La prueba de confirmación ha sido EIA de toxina A y B o cultivo con prueba de citotoxina en cultivo celular como prueba de confirmación (8, 10, 11, 18). Las guías de la SHEA-IDSA recomiendan el estudio en deposiciones líquidas usando inicialmente GDH por EIA y confirmación de un resultado positivo, ya sea con análisis de citotoxicidad celular o cultivo toxigénico (18). Sin embargo, esta aproximación requiere de varios días para obtener resultados y estos métodos no están disponibles en forma rutinaria en laboratorios clínicos. Otra alternativa es la confirmación con EIA de toxina A y B, pero la sensibilidad de esta estrategia es inferior a la detección mediante amplificación de ácido nucleico (11, 16, 17).
Se ha puesto en duda la utilización de este algoritmo debido a que la detección de GDH por EIA muestra gran variabilidad en su rendimiento, dependiendo de la prevalencia de la ICD, con hasta 15% de falsos negativos (11, 16). Esta variabilidad en los métodos de detección por EIA, especialmente GDH y toxinas A y/o B, se puede deber a la degradación de las toxinas en el transporte o durante su almacenamiento previo a su testeo. La toxina A y especialmente la toxina B son tiempo-dependiente en su degradación debido a la proteólisis y a los efectos del pH. Son generalmente estables en deposiciones a 4°C; ésta no es la temperatura ambiental del tracto gastrointestinal en el cual probablemente la degradación es un proceso continuo. Las muestras de deposiciones pueden permanecer desde minutos a horas a temperatura ambiente antes de ser situadas en un contenedor de transporte y enviadas al laboratorio para su procesamiento, existiendo así múltiples oportunidades para la degradación de las toxinas previo a su llegada al laboratorio. Otra explicación posible para la variación en la sensibilidad es el secuestro de las toxinas por polímeros en el intestino, ya sea de la dieta o fármacos como el sucralfato, que pueden unir toxinas, reduciendo su detección. Una tercera explicación para la disparidad de los resultados se relaciona a la diversidad genética de las proteínas blanco, particularmente la variación antigénica de las toxinas, lo que puede disminuir la sensibilidad de los ensayos basados en anticuerpos, dependiendo de la cepa de CD presente (11).
Detección mediante amplificación de ácido nucleico (AAN)Estas pruebas requieren de 45 minutos a tres horas y varían de complejidad, desde tres a 13 pasos. Este método es superior a la detección de toxinas por EIA y al algoritmo de dos pasos con GDH y posterior toxina por EIA, por ende pese a que no está disponible en todos los centros, es el método diagnóstico de elección (11, 16).
Existen dos tipos:
- •
Ensayos moleculares por Reacción de la Polimerasa en Cadena (PCR) para detección de toxinas. Identifica el gen tcdB que codifica la toxina B. Se ha planteado que es el método más sensible y específico para la detección de CD, siendo actualmente recomendado como método diagnóstico (11, 16, 18, 28). El valor predictivo positivo va de un 80–95% y aumenta al aumentar la prevalencia, alcanzando un 95% para una prevalencia ≥ 20%. El valor predictivo negativo es de 96–99% (11,28).
El 2008 la FDA aprobó el primer kit comercial para PCR en tiempo real para detección de las toxinas de CD. La mayoría de las cepas variantes muestran mutación de los genes tcdA y tcdB. Los kit de PCR disponibles comercialmente detectan correctamente la mayoría de las cepas variantes de CD y están diseñados para detectar una región conservada de tcdB (29).
- •
Ensayos moleculares por LAMP (loop mediated isothermal amplification). Consiste en una reacción isotérmica de AAN que no requiere instrumentación de alto costo para su implementación. Los kit comerciales detectan el gen tcdA del locus de patogenicidad. Tiene alta sensibilidad y especificidad, pero es controversial el hecho de que detecte tcdA ya que existen cepas toxina A negativas. Estas últimas tienen una prevalencia de entre 0,2–8% (30, 31). Se ha descrito que este subtipo de CD tendría secuencias vestigiales de tcdA que sería suficiente para la amplificación de la señal. Faltan estudios para avalar su uso (11, 28, 29).
La detección mediante AAN representa un problema en pacientes colonizados, en que un resultado positivo puede llevar a tratar pacientes que no lo requieran. Es por esto que este método de detección se debe reservar para pacientes con cuadro clínico sugerente. Se requieren mayores estudios para determinar si la identificación de pacientes colonizados con CD toxigénico se debiese realizar para control de infección en un intento de prevenir la transmisión (16, 32).
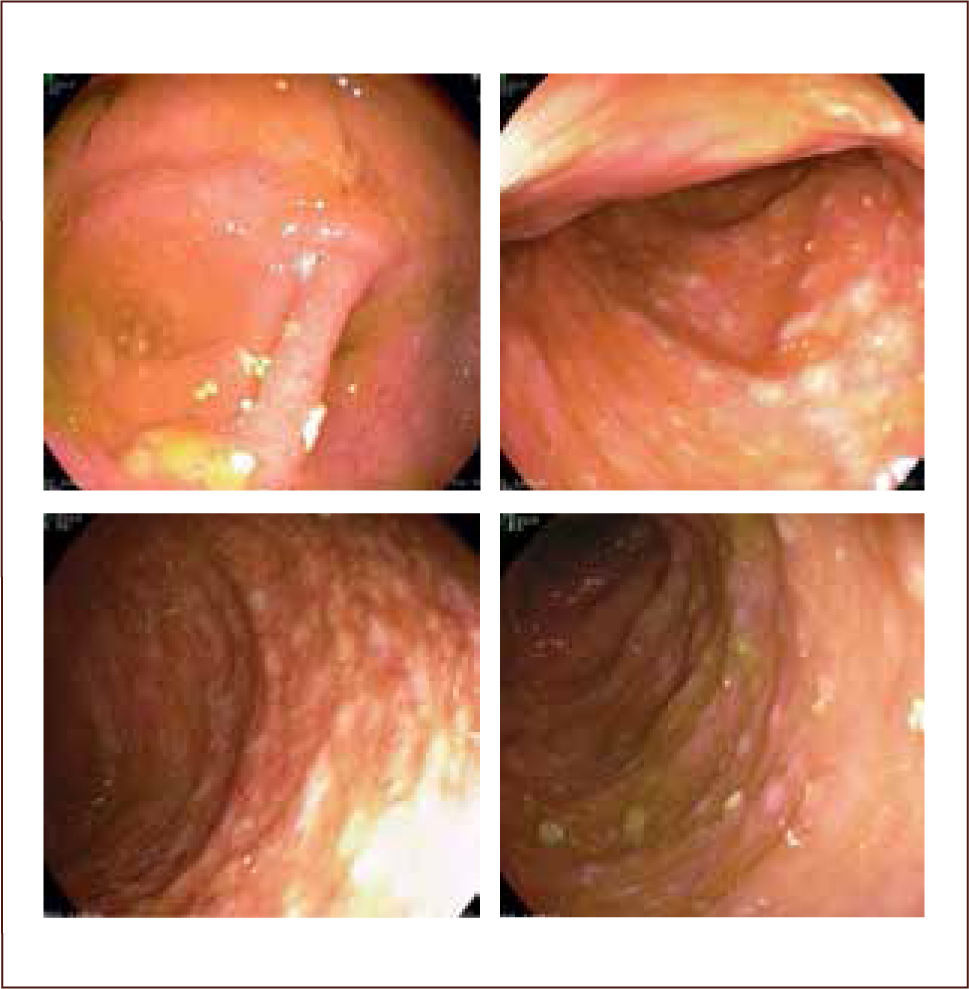
La colitis pseudomembranosa se puede diagnosticar únicamente mediante visualización directa de las pseudomembranas en una colonoscopía o mediante un examen histopatológico, aunque este método diagnóstico no se usa en general para el diagnóstico inicial de una ICD (10, 16, 18, 20). La visualización de las pseudomembranas es patognomónico de ICD (figura 3), sin embargo éstas se visualizan en el 50–60% de las ICD (19).
Se recomienda realizar una tomografía computarizada (TC) de abdomen y pelvis en pacientes con infección por CD complicada (16). El hallazgo más común y que se puede visualizar precozmente en la TC es el engrosamiento parietal del colon, mayor a cuatro milímetros asociado a edema. Se puede observar también ascitis, estriación de la grasa pericolónica y con menos frecuencia distensión colónica. El valor predictivo positivo de la TC para diagnóstico de la colitis por CD es de hasta 88%. La TC puede ser útil como diagnoóstico diferencial de otras causas de dolor abdominal (19).
Estudios han mostrado que las toxinas por EIA y el cultivo toxigénico pueden permanecer positivos por hasta 30 días en pacientes con resolución de los síntomas, por ende no se recomienda el estudio posterior a la cura clínica (16, 18).
TratamientoSe debe evitar la exposición a otros antibióticos no seleccionados para tratar la ICD, a menos que estén absolutamente indicados (8, 10, 16, 18). Un metanálisis de 12 estudios observacionales y ensayos clínicos randomizados mostró que el uso continuado de antibióticos para infecciones diferentes a ICD se asociaba a mayor riesgo de recurrencia (33). Junto con esto, se recomienda evitar el uso de agentes antiperistálticos ya que pueden enmascarar los síntomas y precipitar un megacolon tóxico (16, 18, 19).
El tratamiento a indicar se basa en la estratificación de la severidad de la ICD (tabla 4). Para el episodio de diarrea leve a moderado, el antibiótico de elección es Metronidazol por un período de 10 días. Esta indicación surge de un ensayo clínico prospectivo doble ciego en que se randomizaron 150 pacientes con ICD para tratamiento ya sea con Vancomicina o Metronidazol. De los pacientes con enfermedad leve, presentó cura clínica un 90% de los tratados con Metronidazol y un 98% de los tratados con Vancomicina (p=0,36). Sin embargo, en el grupo de ICD severa, la respuesta a Vancomicina fue significativamente mejor que con Metronidazol (97% vs 76%, p=0,02) (34).
Tratamiento de la infección por Clostridium difficile
| PRIMER EPISODIO | |
|---|---|
| Infección leve a moderada | Metronidazol 500mg 3 veces al día VO por un período de 10 días |
| Infección severa | Vancomicina 125–500mg 4 veces al día VO por 14 días o Fidaxomicina 200mg 2 veces al día VO por 10 días |
| Infección severa y complicada | Vancomicina 125–500mg 4 veces al día VO o por sonda nasoenteral o 500mg en 500ml de suero fisiológico 4 veces al día vía rectal como enema de retención en caso de íleo o distensión abdominal significativa junto con Metronidazol 500mg 3 veces al día EV por 14 días |
| PRIMERA RECURRENCIA | Mismo esquema que primer episodio, estratificando al paciente según severidad de la diarrea |
| SEGUNDA RECURRENCIA | Vancomicina 125mg 4 veces al día VO por 14 días, seguido de 125mg dos veces al día VO por 7 días, seguido de 125mg cada 48 horas VO por 7 días, seguido de 125mg cada 72 horas al día VO por 14 días, o Vancomicina 125mg cuatro veces al día VO por 10 días seguido por pulsos de Vancomicina 125mg cada 3 días por 10 veces |
| TERCERA O MÁS RECURRENCIAS | Transplante de microbiota fecal |
VO: vía oral; EV: endovenoso
En relación a la duración es común prescribir 10–14 días de tratamiento para la ICD. Sin embargo, no hay evidencia que señale una mayor efectividad con el uso prolongado de antibióticos, por ende no se recomienda el tratamiento por 14 días para la ICD leve a moderada cuando ya ha habido respuesta al tratamiento al décimo día. Si no responde a la terapia con Metronidazol a los 5–7 días, se debe escalar a Vancomicina vía ral (16, 35, 36).
Para la ICD severa, no se debe suspender la alimentación vía oral o enteral en pacientes sin íleo o distensión abdominal significativa, ya que los carbohidratos fermentables, éstos son fórmulas que contengan fibra o prebióticos, son cruciales para la microbiota intestinal y pueden contribuir a su normalización (5, 16, 37). El tratamiento de elección es Vancomicina vía oral por 14 días; indicación demostrada en múltiples ensayos clínicos (2, 16, 34). No hay estudios disponibles para guiar la recomendación en relación a la dosis exacta de Vancomicina (tabla 4). Las recomendaciones son extrapoladas de la experiencia clínica y de consideraciones como la alteración en la motilidad gastrointestinal o el íleo que ocurre en estos pacientes.
Cuando la ICD es severa y complicada, se debe manejar al paciente en una unidad de paciente crítico, con adecuado aporte de volumen y reposición de electrolitos (16). En relación al tratamiento antibiótico (tabla 4), se debe asociar Vancomicina oral, por sonda nasoenteral o vía rectal omo enema de retención en caso de íleo o gran distensión abdominal junto con Metronidazol endovenoso por 14 días (8, 10, 16, 18).
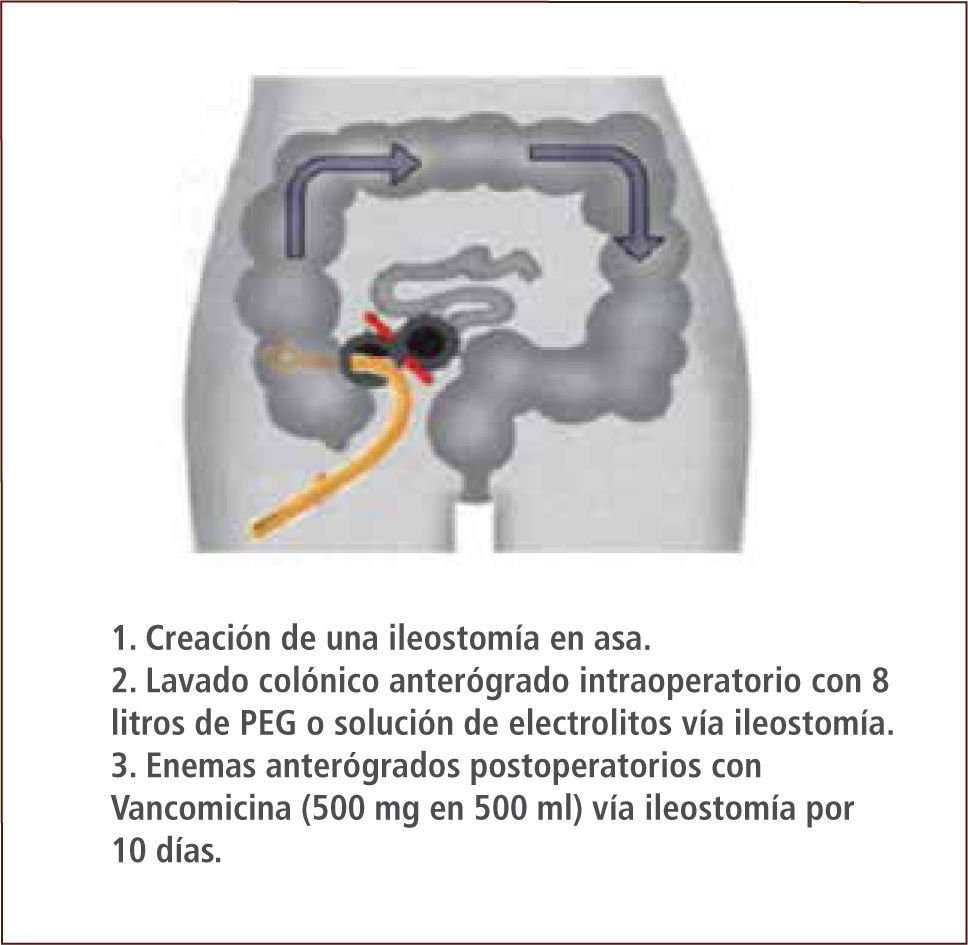
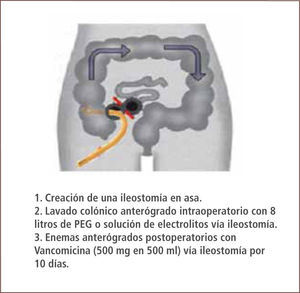
Es un desafío médico predecir en qué pacientes con colitis fulminante la terapia médica fracasará. El manejo quirúrgico de la ICD severa y complicada ha sido la colectomía total con ileostomía terminal, que ha mostrado tener una mejor sobrevida en comparación a los pacientes no sometidos a cirugía. Sin embargo, la mortalidad postoperatoria descrita es de 35–80%. Esta alta mortalidad se debe principalmente al retraso de la intervención quirúrgica y a la falta de consenso en relación a la selección del paciente adecuado (14, 19, 27). Es por esto que la evaluación por cirugía debe ser precoz, en pacientes con hipotensión pese a drogas vasoactivas, sepsis y falla multiorgánica, compromiso de conciencia, lactato >5mmol/l, leucocitosis >50.000 /mm3 y ausencia de respuesta a los cinco días de antibióticos (16). La cirugía precoz se ha asociado a mejoría en la sobrevida sin embargo, puede haber resistencia inicial a este tratamiento por parte del médico tratante, paciente y/o sus familiares, debido a la morbimortalidad asociada, considerando que los pacientes que sobreviven a la cirugía muchas veces requerirán de una ileostomía en forma permanente. Se ha descrito como alternativa quirúrgica la ileostomía en asa vía laparoscópica con lavado de colon con polietilenglicol o solución de electrolitos de manera anterógrada con instilación de Vancomicina por la ileostomía (figura 5). Esta alternativa disminuyó la mortalidad a un 19% (en comparación con controles históricos) y preservación del colon en un 93% de los pacientes (27). Dado que esta técnica conlleva el concepto de preservación del colon y reversibilidad, podría asociarse a mayor aceptación del paciente y/o familiares en la realización de esta cirugía de manera más precoz que las otras opciones quirúrgicas (19, 27).
RecurrenciaEl primer episodio de recurrencia se puede tratar con Metronidazol o Vancomicina según la severidad de la ICD, sin alterar la probabilidad de una segunda recurrencia (2, 16, 18).
Se han usado nuevos antibacterianos como Rifaximina y Fidaxomicina. El primero es muy activo contra CD in vitro y no genera gran desbalance en la microbiota intestinal (38). Ha sido efectivo en reducir la recurrencia al ser administrado por dos semanas luego de un curso de dos semanas de Vancomicina oral. Se trata sin embargo, de estudios pequeños y faltan ensayos clínicos que permitan dar una recomendación clara. Junto con esto, parece presentar un elevado desarrollo de resistencia (13, 14, 16, 38). Fidaxomicina es un antibiótico macrocíclico de primera clase con actividad bactericida frente a CD, aprobado en varios países para el tratamiento de la ICD. En dos ensayos clínicos doble ciego de no inferioridad fase III multinacionales (39, 40), Fidaxomicina a dosis de 200mg dos veces vía oral no fue inferior a Vancomicina en relación a las tasas de cura clínica. Además al compararlo con Vancomicina, se asoció a una menor tasa de recurrencia, diferencia que se dio solo en ICD por cepas no hipervirulentas. En estos estudios se excluyeron pacientes con ICD severa y complicada, EII o más de una recurrencia de ICD. Fidaxomicina tiene un perfil farmacocinético favorable, con bajo potencial de resistencia y no confiere resistencia cruzada a otros antibióticos. Tiene mínima absorción sistémica, manteniéndose en el tracto gastrointestinal con impacto mínimo en la microbiota intestinal, alcanzando altas concentraciones fecales (13, 39–41). Fidaxomicina es un antibiótico emergente, efectivo y bien tolerado en pacientes adultos para el primer episodio o primera recurrencia de ICD sin embargo, es de alto costo en comparación a Metronidazol o Vancomicina y que en la actualidad no está disponible en Chile (38, 41). Se requieren más estudios para evaluar la efectividad de Fidaxomicina en pacientes con ICD severa y complicada y aquéllos con múltiples recurrencias.
Otros antibióticos que se han usado son Tigeciclina para la ICD severa y refractaria. Teicoplanina que tendría mejor respuesta que Vancomicina en estudios iniciales. Doxiciclina y Linezolid que serían protectores contra la ICD y Nitazoxanida como terapia alternativa. La experiencia con estos fármacos es limitada y faltan ensayos clínicos para poder recomendar su uso (38).
Para las siguientes recurrencias existe gran controversia. Hay consenso en que no se debe volver a usar Metronidazol por el riesgo de neuropatía con su administración repetida (16, 18). De primera línea para la segunda recurrencia la Sociedad de Infectologia Americana ha planteado el uso de Vancomicina oral por períodos prolongados y con reducción progresiva de la dosis (1, 18, 22). Esta recomendación surge de un ensayo clínico de probióticos asociados a antibióticos en pacientes que tenían más de una recurrencia. En la rama de pacientes en que se utilizó placebo más antibiótico se evaluó el éxito a diferentes estrategias de tratamiento en una cohorte de 163 pacientes con ICD recurrente. Los pacientes que tenían un tratamiento estándar con Vancomicina por 10 a 14 días tenían una tasa de recurrencia de 54%. El tratamiento con Vancomicina en dosis decrecientes resultó en disminución de las recurrencias a un 31% (p=0,01) y el tratamiento de Vancomicina en pulsos cada 2–3 días a un 14,3% (p=0,02), concluyendo así que las dosis decrecientes y en pulsos de Vancomicina podrían resultar en mejores tasas de cura de la recurrencia por ICD. Esta recomendación no ha sido estudiada en estudios clínicos randomizados (22). Surawicz y colaboradores por otro lado, propone un régimen simple y costo-efectivo: un curso de Vancomicina 125mg 4v/d por 10 días seguido por pulsos de Vancomicina de 125mg al día cada tres días por 10 veces que conlleva a inhibir las formas vegetativas de CD mientras se recupera la microbiota intestinal, pero sin ensayos que avalen su uso (16, 36).
Para la tercera y futuras recurrencias, así como después de al menos dos episodios de recurrencia severa, el trasplante de microbiota fecal (TMF) ha tenido resultados promisorios, con reducción significativa de síntomas y prevención de la recurrencia, teniendo esta alternativa la mayor tasa de éxito, >90% en comparación con otras terapias, incluso en cepas de CD NAP1/BI/027 (16, 43).
Hay creciente evidencia de que la alteración de la microbiota colónica es un factor determinante en la fisiopatología de la recurrencia de la infección por CD, teniendo este grupo de pacientes una marcada disminución en la diversidad de la microbiota intestinal (37, 43, 44). La reintroducción de bacterias normales mediante la donación de heces corrige este desequilibrio, restaurando la riqueza filogenética y la resistencia a la colonización (14, 16, 45). Un estudio clínico randomizado de TMF administrado por infusión duodenal asociado a lavado intestinal (45), mostró efectividad significativa al ser comparado con Vancomicina y con Vancomicina más lavado intestinal sin TMF. El estudio debió ser interrumpido tras el análisis interino considerando no ético continuarlo, ya que la tasa de cura para TMF fue de 81% posterior a la primera infusión comparado con Vancomicina sola (23%) y Vancomicina más lavado intestinal (31%).
El TMF se ha descrito como un procedimiento seguro y sin efectos adversos o complicaciones atribuidas directamente al procedimiento (43–46), pero recientemente publicamos un caso de bacteremia posterior a TMF en un paciente con Enfermedad de Crohn e ICD recurrente (47), por lo que este procedimiento no está exento de riesgos. El potencial de transmisión de infecciones es una preocupación, pero hay publicaciones que han normado en forma rigurosa el estudio previo al trasplante en sangre y deposiciones del donante en busca de enteropatógenos bacterianos y virales comunes (16, 18, 43, 44). Un metaanálisis y revisión sistemática reciente sugiere que el TMF realizado vía colonoscopia es preferible, pero no existen ensayos clínicos que comparen la efectividad de las diferentes vías de administración (46). Se debe considerar que los estudios a largo plazo de TMF son limitados. Son necesarios ensayos clínicos randomizados para determinar la vía más óptima de administración y establecer la seguridad del TMF. La creación de una comunidad bacteriana definida para bacterioterapia que reemplace el TMF es prometedora y está en actual desarrollo (44).
El rol de los probióticos en la ICD es de gran controversia. Aunque existen numerosos ensayos clínicos en relación a la efectividad de Saccharomyces boulardii en la prevención de diarrea asociada a antibióticos (16, 22, 48, 49), Pillai y colaboradores, en una revisión de Cochrane (50), concluyó que la evidencia para la efectividad de este probiótico en el tratamiento de diarrea por CD como adyuvante al antibiótico es débil y se requieren más estudios. En relación a lo anterior descrito, no existe evidencia sólida que avale el uso de probióticos en el tratamiento de la ICD inicial o severa ni su recurrencia Hay casos publicados de fungemia por Saccharomyces boulardii en pacientes con catéter venoso central, por ende su uso en UCI o en pacientes inmunocomprometidos no se recomienda (16, 18).
Con respecto a inmunoterapia, la inmunoglobulina intravenosa no tiene rol por sí sola en el tratamiento de la ICD recurrente, pero podría ser útil en los pacientes con hipogammaglobulinemia. El grado de evidencia en relación a su uso es débil, principalmente descripción y series de casos, todos con variados criterios de inclusión, edad, dosis de tratamiento indicado y duración de terapia. Varios usaron además la terapia estándar, siendo los datos difíciles de interpretar (16).
Se ha utilizado anticuerpos monoclonales contra las toxinas A y B asociado a los antibióticos, disminuyendo la tasa de recurrencia de ICD de forma significativa y mostrando tener gran potencial sin embargo, aún no hay recomendación formal para su uso (16, 17, 38). Es prometedora la inmunización activa de CD mediante el desarrollo de vacunas. Se ha probado en voluntarios sanos una vacuna que contenía toxina A y B, registrando niveles de IgG contra la toxina A más altos que los presentados posterior a la infección. Están en desarrollo una variedad de vacunas que podrían representar una estrategia costo-efectiva en la prevención de la ICD (16, 17, 36).
La Colestiramina puede disminuir la diarrea, pero puede además ligar Vancomicina, siendo una contraindicación relativa para su uso. No hay evidencia que agregar Colestiramina a la terapia disminuya futuras recurrencias (8, 13, 16, 18).
Situaciones EspecialesEn pacientes embarazadas o con lactancia materna está contraindicado el uso de Metronidazol, por ende el tratamiento de elección será con Vancomicina (16).
El diagnóstico diferencial entre una exacerbación de una EII y la diarrea por CD como causa de una crisis puede ser difícil y por lo tanto, requiere de un alto índice de sospecha. Junto con esto, los pacientes con EII presentan cuadros más severos de infección por CD, con mayor frecuencia de colectomía y muerte atribuible a CD en comparación a pacientes sin EII. Es así como se debe solicitar estudio de CD a todo paciente con EII que presente una crisis sin haber suspendido su tratamiento, independiente que no haya utilizado tratamiento antibiótico los últimos tres meses. Esto incluye a los pacientes con reservorio posterior a una colectomía. El tratamiento de elección de la ICD en pacientes con EII es la Vancomicina, independiente de la severidad del episodio. Los medicamentos inmunosupresores se pueden mantener, pero se debe evitar escalar esta terapia si no se ha descartado la infección por CD (8, 13, 16).
Control y prevencion de la infecciónLos programas de control de infección en los hospitales ayudan a disminuir la incidencia de ICD. No se recomienda la pesquisa de rutina de CD en pacientes hospitalizados sin diarrea y/o tratamiento a portadores asintomáticos de CD (8, 10, 13, 16, 18, 32).
La higiene de manos y las precauciones de barrera, que incluyen guante y pechera, deben ser implementadas tanto por el personal de salud como por los visitantes del paciente con sospecha o infección por CD. La precaución de contacto en un paciente con diarrea por CD se debe mantener al menos hasta la resolución de la diarrea. En los pacientes con ICD se recomienda la hospitalización en pieza individual y en caso de ser compartida, que sea con pacientes con ICD documentada (10, 16, 22). Las esporas de CD son resistentes al calor y al alcohol junto con otros agentes antisépticos, y pueden permanecer viables en el ambiente hospitalario por semanas. La desinfección de las superficies con potencial de contaminación por CD se debe realizar meticulosamente con agentes efectivos contra las esporas como soluciones en base a hipoclorito (8, 10, 16, 17, 18,39).
Las estrategias para prevenir el desarrollo de la diarrea por CD, incluyen principalmente la restricción de antibióticos, detección precoz de pacientes infectados, cumplimiento de medidas de control y prevención de ICD y la inmunización activa y pasiva, éstas últimas aún en desarrollo (8, 10, 13, 16, 18).
ConclusiónLa ICD ha cambiado en su epidemiología, destacando su aparición en pacientes sin factores de riesgo. Es por esto que debe ser considerada en el diagnóstico diferencial de cualquier paciente con diarrea, incluso en ausencia de los factores de riesgo. Es fundamental la detección precoz, el tratamiento adecuado y oportuno según las características clínicas del paciente y la implementación de medidas de control de la infección en el hospital o clínica. El uso de otras opciones como la Fidaxomicina permitirá obtener mejores resultados en el manejo de estos pacientes. Aunque la literatura avala el TMF en el tratamiento de la ICD recurrente, esta estrategia sólo debe ser indicada después de al menos dos episodios de recurrencia severo o tres leves y una vez que otros tratamientos hayan fracasado.
Los autores declaran no tener conflictos de interés, con relacióna este artículo.