La Gastroenteritis Aguda (GEA) infecciosa es una patología frecuente y de alto impacto, especialmente en niños menores de cinco años y adultos mayores. En nuestro medio, la causa más frecuente es viral (rotavirus y norovirus) seguido de Salmonella, Shigella, E.coli diarreogénicas y Campylobacter. Habitualmente son cuadros autolimitados que no requieren estudio de laboratorio específico y cuyo manejo debe centrarse en la reposición hidro-electrolítica de acuerdo al grado de deshidratación. Existe evidencia sobre beneficio sintomático del uso de probióticos (Lactobacillus GG y S.boulardii); racecadotrilo en cuanto a la diarrea; y ondasetrón para los vómitos. En caso de sospecha de agente invasor (bacteria o parásito) debe realizarse un estudio etiológico e iniciar terapia antimicrobiana de acuerdo al microorganismo identificado. La prevención de contagio mediante medidas de saneamiento y adecuada manipulación de agua y alimentos es fundamental. Actualmente se dispone de vacunas efectivas contra algunos de los agentes involucrados (ej. rotavirus), que deben recomendarse en grupos de riesgo.
Acute infectious gastroenteritis (AIGE) is a frequent and high burden disease, especially in children less than five years and elder patients. In Chile, it predominates viral etiology (rotavirus and norovirus), followed by Salmonella, Shigella, diarrheogenic E. coli and Campylobacter. Most of AIGE episodes are self-limited, do not need laboratory workup and their management must be centered on hidroelectrolytic restitution according to dehydration severity. Evidence suggests symptomatic benefit of the use of probiotics (Lactobacillus GG and S. boulardii) and racecadotril for diarrhea and ondasetron for vomits. Etiologic study is indicated whenever an invading agent (bacterium or parasite) is suspected and antimicrobial therapy should be directed against the identified pathogen. Prevention by environmental sanitation measures and appropriate water and food manipulation is crucial for control of AIGE. Currently effective vaccines against some of the agents involved in AIGE (ej. rotavirus) are available and should be recommended in high risk groups.
Se define Gastroenteritis Aguda (GEA) como aquel cuadro de menos de dos semanas de evolución caracterizado por diarrea (deposiciones de menor consistencia y mayor frecuencia que la habitual; operacionalmente se define como ≥3 deposiciones anormales en 24 hrs.), que puede o no ir acompañado de vómitos, dolor abdominal y/o febre (1).
Si bien en los últimos 30 años la mortalidad por GEA Infecciosa (GEAI) ha disminuido significativamente producto de mejorías en las condiciones sanitarias, nutricionales y terapia de rehidratación, en la actualidad esta entidad sigue siendo causa importante de morbilidad. Este impacto es particularmente relevante en los extremos de la vida. Se estima que cada año ocurren alrededor de 1.700 millones de episodios de GEAI y 700 mil muertes por esta causa en niños menores de cinco años a nivel mundial (2). De éstos, la mayoría se presentan en lactantes de países en vías de desarrollo, grupo en el cual aún representa la segunda causa de muerte infecciosa (3, 4). En adultos, la mayor incidencia y severidad de GEAI se presenta en adultos mayores institucionalizados; en este contexto puede producir deshidratación severa, insuficiencia renal y eventualmente la muerte (5). En niños mayores y adulto medio, la relevancia de la GEAI está dada principalmente por la pérdida de funcionalidad transitoria y ausentismo escolar/laboral.
Etiología de la gastroenteritis aguda infecciosa en niños y adultosExiste una diversidad de bacterias, virus y parásitos que puede causar GEAI (1,6). Los agentes más frecuentemente involucrados varían de acuerdo a las condiciones socioeconómicas y sanitarias de la región y con la edad del paciente (6,7). En países con mejores condiciones sanitarias, como sería el caso de Chile, tiende a predominar la etiología viral, mientras que las bacterias y parásitos son más frecuentes en zonas menos desarrolladas (1,6). Las variaciones por edad se explicarían por los cambios en hábitos alimentarios y conductas (fuente de contagio), adquisición de respuesta inmune efectiva y presencia de co-morbilidades. En aproximadamente 45–60% de los casos no es posible identificar el agente infeccioso responsable (1).
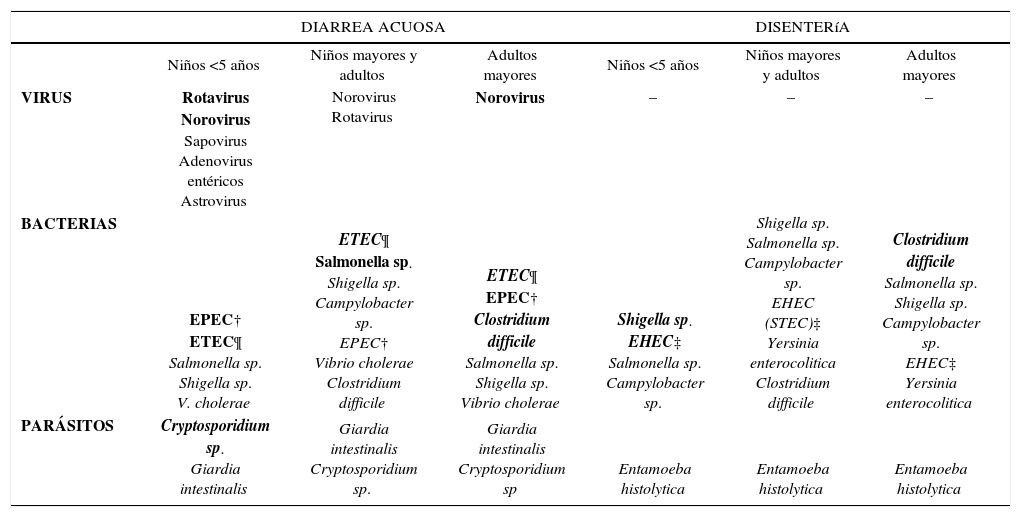
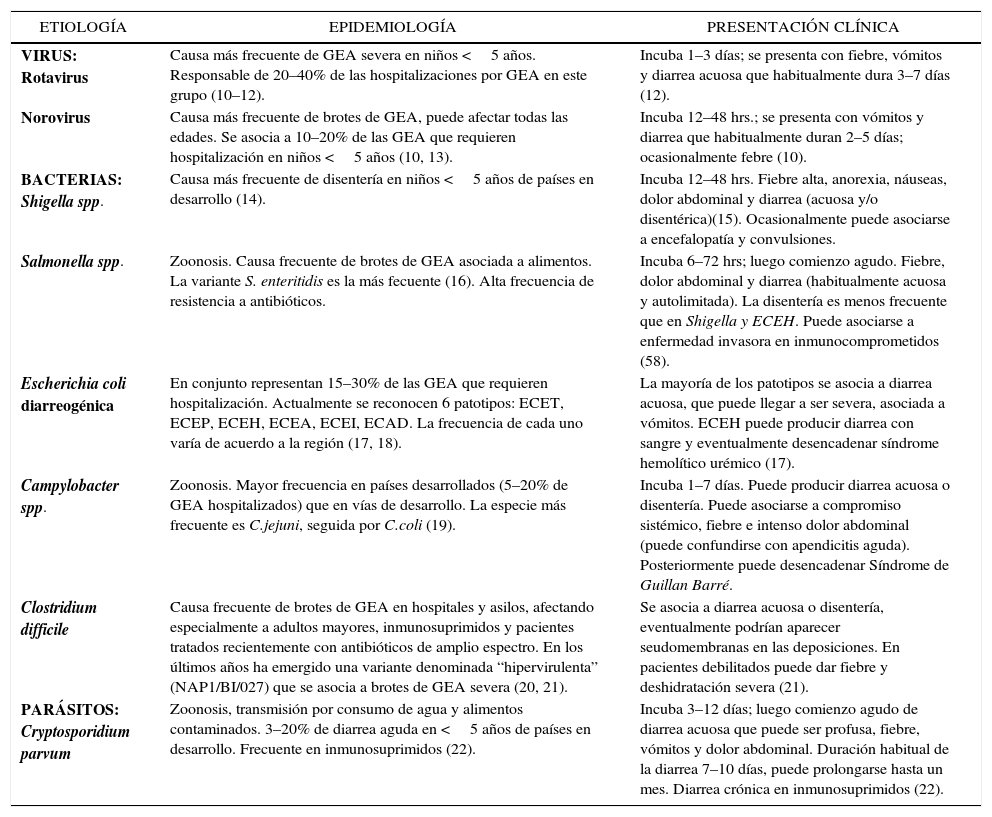
En la tabla 1 se muestran los agentes más frecuentes según grupo etario y según presentación clínica (diarrea acuosa vs disentería) (1, 6–9). En la tabla 2 se resumen los principales elementos epidemiológicos y clínicos que orientan a la sospecha de cada agente (10–22).
| DIARREA ACUOSA | DISENTERíA | |||||
|---|---|---|---|---|---|---|
| Niños <5 años | Niños mayores y adultos | Adultos mayores | Niños <5 años | Niños mayores y adultos | Adultos mayores | |
| VIRUS | Rotavirus Norovirus Sapovirus Adenovirus entéricos Astrovirus | Norovirus Rotavirus | Norovirus | – | – | – |
| BACTERIAS | EPEC† ETEC¶ Salmonella sp. Shigella sp. V. cholerae | ETEC¶ Salmonella sp. Shigella sp. Campylobacter sp. EPEC† Vibrio cholerae Clostridium difficile | ETEC¶ EPEC† Clostridium difficile Salmonella sp. Shigella sp. Vibrio cholerae | Shigella sp. EHEC‡ Salmonella sp. Campylobacter sp. | Shigella sp. Salmonella sp. Campylobacter sp. EHEC (STEC)‡ Yersinia enterocolitica Clostridium difficile | Clostridium difficile Salmonella sp. Shigella sp. Campylobacter sp. EHEC‡ Yersinia enterocolitica |
| PARÁSITOS | Cryptosporidium sp. Giardia intestinalis | Giardia intestinalis Cryptosporidium sp. | Giardia intestinalis Cryptosporidium sp | Entamoeba histolytica | Entamoeba histolytica | Entamoeba histolytica |
Características epidemiológicas y clínicas de los agentes más frecuentes de gastroenteritis aguda (GEA)
| ETIOLOGÍA | EPIDEMIOLOGÍA | PRESENTACIÓN CLÍNICA |
|---|---|---|
| VIRUS: Rotavirus | Causa más frecuente de GEA severa en niños <5 años. Responsable de 20–40% de las hospitalizaciones por GEA en este grupo (10–12). | Incuba 1–3 días; se presenta con fiebre, vómitos y diarrea acuosa que habitualmente dura 3–7 días (12). |
| Norovirus | Causa más frecuente de brotes de GEA, puede afectar todas las edades. Se asocia a 10–20% de las GEA que requieren hospitalización en niños <5 años (10, 13). | Incuba 12–48 hrs.; se presenta con vómitos y diarrea que habitualmente duran 2–5 días; ocasionalmente febre (10). |
| BACTERIAS: Shigella spp. | Causa más frecuente de disentería en niños <5 años de países en desarrollo (14). | Incuba 12–48 hrs. Fiebre alta, anorexia, náuseas, dolor abdominal y diarrea (acuosa y/o disentérica)(15). Ocasionalmente puede asociarse a encefalopatía y convulsiones. |
| Salmonella spp. | Zoonosis. Causa frecuente de brotes de GEA asociada a alimentos. La variante S. enteritidis es la más fecuente (16). Alta frecuencia de resistencia a antibióticos. | Incuba 6–72 hrs; luego comienzo agudo. Fiebre, dolor abdominal y diarrea (habitualmente acuosa y autolimitada). La disentería es menos frecuente que en Shigella y ECEH. Puede asociarse a enfermedad invasora en inmunocomprometidos (58). |
| Escherichia coli diarreogénica | En conjunto representan 15–30% de las GEA que requieren hospitalización. Actualmente se reconocen 6 patotipos: ECET, ECEP, ECEH, ECEA, ECEI, ECAD. La frecuencia de cada uno varía de acuerdo a la región (17, 18). | La mayoría de los patotipos se asocia a diarrea acuosa, que puede llegar a ser severa, asociada a vómitos. ECEH puede producir diarrea con sangre y eventualmente desencadenar síndrome hemolítico urémico (17). |
| Campylobacter spp. | Zoonosis. Mayor frecuencia en países desarrollados (5–20% de GEA hospitalizados) que en vías de desarrollo. La especie más frecuente es C.jejuni, seguida por C.coli (19). | Incuba 1–7 días. Puede producir diarrea acuosa o disentería. Puede asociarse a compromiso sistémico, fiebre e intenso dolor abdominal (puede confundirse con apendicitis aguda). Posteriormente puede desencadenar Síndrome de Guillan Barré. |
| Clostridium difficile | Causa frecuente de brotes de GEA en hospitales y asilos, afectando especialmente a adultos mayores, inmunosuprimidos y pacientes tratados recientemente con antibióticos de amplio espectro. En los últimos años ha emergido una variante denominada “hipervirulenta” (NAP1/BI/027) que se asocia a brotes de GEA severa (20, 21). | Se asocia a diarrea acuosa o disentería, eventualmente podrían aparecer seudomembranas en las deposiciones. En pacientes debilitados puede dar fiebre y deshidratación severa (21). |
| PARÁSITOS: Cryptosporidium parvum | Zoonosis, transmisión por consumo de agua y alimentos contaminados. 3–20% de diarrea aguda en <5 años de países en desarrollo. Frecuente en inmunosuprimidos (22). | Incuba 3–12 días; luego comienzo agudo de diarrea acuosa que puede ser profusa, fiebre, vómitos y dolor abdominal. Duración habitual de la diarrea 7–10 días, puede prolongarse hasta un mes. Diarrea crónica en inmunosuprimidos (22). |
ECET: E.coli enterotoxigénica; ECEP: E.coli enteropatogénica; ECEH: E.coli enterohemorrágica; ECEA: E.coli enteroagregativa; ECEI: E.coli enteroinvasora; ECAD: E.coli de adherencia difusa.
De acuerdo a la información disponible en nuestro país, podemos decir que Rotavirus y Norovirus son la principal causa de GEAI endémica en niños menores de cinco años (10, 23); en niños mayores y adultos Escherichia coli diarreogénica, Salmonella sp., Shigella sp., Campylobacter jejuni y Norovirus serían las causas más frecuentes (24, 25); en adultos mayores se agrega a estas causas Clostridium difficile (26, 27).
En situación de brote de GEA, los agentes más frecuentes son Norovirus y Salmonella sp, independiente de la edad (24). Vibrio cholerae es causa frecuente de diarrea aguda severa en países en vías de desarrollo sin embargo, en Chile se ha logrado controlar muy eficientemente la transmisión de este agente. No se han observado brotes desde 1998 y sólo ocasionalmente se reportan casos importados desde zonas endémicas (28).
Enfoque diagnósticoEn la evaluación inicial es necesario determinar tres puntos principales:
- 1)
Confirmar que estamos frente a un cuadro de GEA (y que no es un cuadro crónico o una infección extradigestiva).
- 2)
Determinar su severidad (grado de deshidratación) y posibles complicaciones.
- 3)
Distinguir la causa más probable.
Respecto al primer punto, debemos recordar que se habla de GEA cuando el cuadro tiene una duración menor a dos semanas, gastroenteritis prolongada cuando dura entre dos y cuatro semanas y crónica cuando dura más de cuatro semanas. Las causas más frecuentes difieren entre estas tres entidades. Especialmente en lactantes y ancianos deben buscarse elementos que sugieran una infección extra-intestinal como causa indirecta de la diarrea aguda y/o vómitos, como son otitis media aguda (particularmente en lactantes), neumonía e infección urinaria.
En relación a la severidad, es importante evaluar el inicio, la frecuencia, la cantidad y las características de los vómitos y la diarrea, evaluar la ingesta reciente de líquidos e identificar signos de deshidratación. Las recomendaciones internacionales actuales proponen un manejo individualizado de la GEA de acuerdo al grado de deshidratación (29, 30); de ahí la importancia de determinarlo de la manera más precisa posible. En niños, el patrón de oro es la determinación del porcentaje de pérdida de peso. Sin embargo, habitualmente no se encuentra disponible un valor de peso cercano al inicio del episodio de diarrea. Si se tiene la información de la última curva de peso-para-edad del niño, podría extrapolarse el peso actual para usarlo como referencia (30, 31). En caso contrario, deben buscarse en el examen físico signos de deshidratación (tabla 3) y complicaciones. Deben evaluarse temperatura, frecuencia cardiaca, frecuencia respiratoria, presión arterial, tiempo de llene capilar, turgencia de la piel (pliegue cutáneo), nivel de fontanela anterior, hidratación de mucosas (ocular y bucal) y estado mental. Estudios dirigidos a relacionar la presencia de signos clínicos con el peso después de lograr la rehidratación, indican que los primeros signos de deshidratación recién son evidentes cuando la pérdida de peso alcanza el 3–4%. En la medida que la deshidratación aumenta en severidad, se incrementa también el número de hallazgos al examen físico; el compromiso hemodinámico es un signo tardío que se hace evidente sólo después pérdidas de fluidos >10% (30, 32). De acuerdo a las guías internacionales más recientes para manejo de GAE (European Society of Pediatric Gastroenterology, Hepatology and Nutrition, ESPGHAN; Center for Disease Control and Prevention, CDC) se distinguen tres categorías de severidad: deshidratación mínima o ausente (con <3% de pérdida de peso), deshidratación leve a moderada (3–9% de pérdida de peso) y deshidratación severa (>9% pérdida de peso) (30, 31). La tabla 3 resume los hallazgos principales que caracterizan cada nivel de deshidratación. La presencia de sólo un signo de deshidratación severa es suficiente para ser asignado a esa categoría y dos o más signos de deshidratación leve a moderada son necesarios para ser clasificado en ese grupo (30, 31). En un análisis sistemático sobre la exactitud de los signos clínicos para detectar deshidratación por GEA en niños menores de cinco años, la presencia de llene capilar enlentecido, pliegue cutáneo enlentecido y un patrón respiratorio anormal se relacionan con alta probabilidad con una pérdida de peso >5%, con un likelihood ratio positivo (LR+) de 4,1, 2,5 y 2,0 respectivamente (33). La presencia de deshidratación severa constituye un factor de riesgo de complicaciones y muerte por GEA y por ende, exige un manejo más agresivo (30).
| Deshidratación mínima o ausente (<3% de pérdida de peso) | Deshidratación leve a moderada (3–9% de pérdida de peso) | Deshidratación severa (>9% de pérdida de peso) | |
|---|---|---|---|
| Estado mental | Bien, alerta | Normal, fatigado o inquieto, irritable | Letárgico, nivel de conciencia disminuida |
| Sed | Bebe normalmente, podría rechazar líquidos | Sediento, avidez por los líquidos | Bebe con dificultad, incapaz de beber |
| Frecuencia cardíaca | Normal | Normal a aumentada | Taquicardia, bradicardia en los casos más severos |
| Calidad del pulso | Normal | Normal a disminuido | Débil, filiforme o no palpable |
| Patrón respiratorio | Normal | Normal a rápido | Profundo |
| Ojos | Normal | Levemente hundidos | Profundamente hundidos |
| Lágrimas | Presentes | Disminuidas | Ausentes |
| Boca y lengua | Húmedas | Secas | Agrietadas |
| Pliegue cutáneo | Recuperación instantánea | Recuperación en <2 segundos | Recuperación en >2 segundos |
| Llene capilar | Normal | Prolongado | Prolongado, mínimo |
| Extremidades | Tibias | Frías | Frías, moteadas, cianóticas |
| Flujo urinario | Normal a disminuido | Disminuido | Mínimo |
Deben descartarse condiciones asociadas que puedan aumentar el riesgo de deshidratación o complicaciones, como son desnutrición, prematurez, inmunodeficiencia, insuficiencia cardiaca e insuficiencia renal (30). En niños y ancianos no autovalentes debe explorarse la capacidad de los cuidadores para proporcionar el apoyo adecuado en casa, especialmente la administración de líquidos y la facilidad para acceder a control médico en caso de ser necesario (30).
También debe explorarse la presencia de síntomas asociados que pudieran necesitar un manejo específico, incluyendo fiebre, vómitos y dolor abdominal.
Finalmente debe abordarse la búsqueda de etiología, particularmente de causas que requieran tratamiento o control epidemiológico específico. Deben buscarse posibles causas no infecciosas de diarrea aguda como fármacos e intolerancias a alimentos. Frente a la sospecha de causa infecciosa debe interrogarse respecto a la presencia de sangre, mucosidad y/o pus en las deposiciones (disentería) o fiebre alta que orienten a una causa bacteriana o parasitaria probablemente invasora. Debe interrogarse respecto a contacto con otros individuos que hayan presentado un cuadro similar (en la casa, jardín infantil, colegio, o lugar de trabajo), la identificación de una fuente potencial de infección (agua o alimento), viajes a países extranjeros, y las vacunas recibidas, con énfasis en la vacuna anti-rotavirus en niños menores de tres años.
La mayoría de los casos de GEAI son leves a moderados, autolimitados y se puede establecer una sospecha etiológica en base a la epidemiología y clínica, por lo que no requieren estudio de laboratorio. En la tabla 4 se resumen las situaciones clínicas en las cuales son de utilidad realizar un estudio de laboratorio.
Situaciones clínicas en las cuales es recomendable realizar estudio etiológico de gastroenteritis aguda
| Diarrea con sangre |
| Fiebre alta persistente y/o compromiso de estado general severo |
| Diarrea persistente >7 días |
| Uso reciente de antibióticos (descartar C. difficile) |
| Paciente inmunocomprometido |
| Situación de brote |
En los casos en que se sospecha sepsis o debe hacerse diagnóstico diferencial con infección urinaria o neumonía (principalmente lactantes y adultos mayores), se debe realizar hemograma, proteína C reactiva, hemocultivos, examen de orina, urocultivo y/o radiografía de tórax según corresponda.
En casos severos o que han tenido fracaso de la rehidratación oral es de utilidad la determinación de gases en sangre venosa, electrolitos plasmáticos y creatininemia/nitrógeno ureico en sangre para evaluar la repercusión de las pérdidas y definir el plan de reposición hidroelectrolítica. Son orientadores de deshidratación severa la presencia de acidosis metabólica y elevación de creatininemia/nitrógeno ureico (31, 34, 35).
En pacientes con disentería, fiebre alta y compromiso de estado general importante, en los que se sospeche un agente bacteriano invasor, la búsqueda de leucocitos fecales y lactoferrina en deposiciones puede ser útil. De acuerdo a un meta-análisis realizado por Gill y colaboradores, el rendimiento de estas pruebas sería mayor en países industrializados que en vías de desarrollo. El LR+ de leucocitos fecales para detección de patógeno invasor fue 4,6 y 2,9 mientras que el LR-fue 0,3 y 0,6 en países industrializados y en vías de desarrollo, respectivamente. En el caso de la lactoferrina, el LR+ fue 1,3 y LR-de 0,2 en países en desarrollo, comparado con 4,3 y 0,1 en países industrializados respectivamente (36). Los motivos para esta diferencia pueden incluir menos acceso a tecnología y manejo inadecuado de las muestras, que podrían explicar los falsos negativos; y la mayor incidencia de GEA bacteriana, parasitaria y deficiencia de vitaminas que podrían relacionarse con falsos positivos en países en vías de desarrollo.
En los casos en que el paciente se beneficiaría del uso de antimicrobianos o con fines de control epidemiológico, se justifica la búsqueda de patógenos en deposiciones. Para la detección de bacterias se dispone ampliamente de coprocultivo corriente y en medios específicos. En caso de identificar alguna bacteria debe realizarse antibiograma, debido a la alta frecuencia de resistencia a antibióticos en nuestro medio (37–39). La detección de toxina-Shiga mediante test inmunológicos en deposición resulta de utilidad en caso de sospecha de E. coli enterohemorrágica, particularmente en presencia de diarrea con sangre (40).
En el caso de los virus (rotavirus y adenovirus) la detección de antígenos en deposición mediante test inmunológicos tiene adecuada sensibilidad, especificidad y también se encuentran ampliamente disponibles.
El examen parasitológico seriado de deposiciones, si bien tiene baja sensibilidad y es operador dependiente, sigue siendo el examen de primera línea frente a la sospecha de este grupo de agentes.
Algunos centros cuentan además con reacción de polimerasa en cadena para detección de patógenos específicos (Shigella sp, E. coli diarreogénico, Salmonella sp, Campylobacter sp, rotavirus, norovirus, adenovirus entérico, astrovirus, entre otros). Este examen tiene mayor sensibilidad que el coprocultivo, pero por su costo se sugiere reservarlo para casos severos e inmunosuprimidos.
Sólo debería realizarse determinación de pH y cuerpos reductores en deposiciones en caso de diarrea acuosa persistente en la que se sospeche intolerancia a la lactosa secundaria (30).
Tratamiento de la geaiEl principal objetivo de la terapia, aun antes de conocer la etiología del cuadro, es evitar o en su defecto compensar la deshidratación. Es así como los esfuerzos deben concentrarse en reponer las pérdidas de agua y electrolitos que ocurren por vía intestinal y no en la administración de antimicrobianos (30).
1)Manejo hidroelectrolíticoPara planificar la terapia debe determinarse el estado de hidratación y tolerancia oral del paciente. En los casos en que se ha mantenido una hidratación adecuada, las pérdidas deben reponerse con cualquier líquido que el paciente tolere, idealmente con solución para hidratación oral hipo-osmolar (con 40–60mEq/L de sodio) (29–31). En los niños alimentados al pecho, debe priorizarse la lactancia materna fraccionada y frecuente.
En caso de constatarse deshidratación deben utilizarse fórmulas diseñadas para rehidratar. Si la deshidratación es leve a moderada y la tolerancia oral es adecuada, puede intentarse rehidratación oral con una solución con 60mEq/L de sodio, ya que el aporte electrolítico de esta fórmula es similar a las pérdidas por deposiciones de la mayoría de las infecciones gastrointestinales (excepto el cólera que requiere reposición con fórmulas con 90mEq/l de sodio). Una revisión sistemática reciente de Cochrane concluyó que en niños con deshidratación leve a moderada, la rehidratación oral es la primera elección, considerando dentro de sus ventajas que es menos invasiva, menos costosa y tiene similar eficacia clínica que la vía endovenosa en este grupo (41). La base del éxito de esta terapia es administrar la solución en volúmenes pequeños y repetidos. Recientemente se han realizado estudios para comparar la eficacia de la solución de rehidratación oral estándar (con glucosa y 60mEq/L de sodio) con diversas soluciones modificadas en base a la adición de endulzantes (sucralosa), polímeros de glucosa (arroz), zinc, prebióticos y péptidos (isoleucina). Hasta ahora no se ha demostrado mayor eficacia clínica de estas nuevas soluciones respecto a la estándar (42).
Los pacientes con deshidratación severa y/o vómitos persistentes en los que fracasa la fase de rehidratación oral inicial deben ser hospitalizados, al menos transitoriamente, para reposición de líquidos por vía enteral o endovenosa. En niños con deshidratación moderada e hipermesis puede administrarse la misma solución de rehidratación oral, con 60mEq/L de sodio, pero a goteo continuo por sonda nasogástrica (gastroclisis). Los que ingresen con deshidratación severa, shock hipovolémico o que no toleren la gastroclisis deberán hidratarse por vía endovenosa.
La revisión exhaustiva de la terapia de rehidratación va más allá del objetivo de este artículo y se invita a los lectores interesados a revisar los artículos de King y colaboradores (30), Guarino y colaboradores (31) y Pieścik-Lech y colaboradores (42).
2)RégimenEl objetivo debe ser optimizar la nutrición de acuerdo a la tolerancia. En pacientes sin deshidratación debe mantenerse la alimentación a tolerancia; no se ha demostrado la efectividad de excluir la fibra en reducir la duración de la diarrea. La leche materna no debe suspenderse ni limitarse en lactantes. En casos de deshidratación debe suspenderse la alimentación durante las primeras horas de rehidratación, pero ésta debe reiniciarse tan pronto como el paciente se encuentre estable y con tolerancia adecuada (4 hrs. en deshidratación leve a moderada y según estabilidad clínica en deshidratación severa) (42). Sólo ocasionalmente se requerirá utilizar fórmulas lácteas sin lactosa, cuando una diarrea acuosa (especialmente por rotavirus) se prolonga >7 días, frente a la sospecha de una intolerancia secundaria a la lactosa.
3)AntieméticosEn caso de vómitos persistentes, existe evidencia de que la administración de ondansetrón, ya sea por vía oral o endovenoso, mejora el éxito de la fase de rehidratación oral, disminuyendo la necesidad de hospitalización y administración de líquidos intravenosos (43). En una revisión sistemática reciente de Freedman y colaboradores, que incluyó cuatro ensayos clínicos realizados en servicios de urgencia pediátricos, se evidenció la superioridad de ondansetrón oral comparado con placebo en cuanto a disminuir la necesidad de hospitalización (RR 0,40 IC95% 0,19-0,83; NNT 17) y la necesidad de rehidratación endovenosa (RR 0,41 IC95% 0,29-0,59; NNT 5)(41). Este beneficio se mantendría hasta 72 hrs. luego de la consulta en urgencia. En esta misma revisión se analizaron dos ensayos clínicos pediátricos que compararon ondansetrón endovenoso versus placebo. De acuerdo a los autores, los pacientes que recibieron ondansetrón ev disminuyeron su probabilidad de hospitalización significativamente (RR 0,21; IC95% 0,05-0,93; NNT 7). Se ha reportado un aumento de la frecuencia de deposiciones en los pacientes que reciben ondansetrón (41, 43). Por otra parte, este fármaco puede potencialmente prolongar el intervalo QT, por lo que debería utilizarse con precaución y previa realización de ECG en pacientes con alteraciones hidroelectrolíticas y otros factores de riesgo de arritmia (42). Hasta ahora no se ha demostrado la utilidad de otros antieméticos, como metoclopramida, dexametasona y dimenhidrinato (43, 44).
4)ProbióticosSe han realizado numerosos ensayos clínicos para determinar la utilidad de diversas cepas de probióticos en GEA. Dada la heterogeneidad de los estudios, hasta ahora ha sido difícil interpretar su eficacia global. La evidencia sugiere que el efecto de los probióticos sería especie específica, y en el caso de la GEAI los que han demostrado eficacia son Saccharomyces boulardii y Lactobacillus GG (45, 46). El análisis agrupado de diversos estudios pediátricos sugiere que estos probióticos reducirían la duración de la diarrea (acortan el cuadro aproximadamente un día; IC 95% en 16–34 hrs.), disminuyen el riesgo de diarrea ≥4 días, reducen la severidad del episodio y en los casos más severos, acortan el tiempo de hospitalización (en promedio 1,12 días la estadía) (41, 47).
5)Anti-secretoresExiste evidencia sobre los beneficios clínicos de racecadotrilo en GEAI en niños. Este fármaco es un inhibidor de las encefalinasas intestinales, que disminuye la producción de AMPc, a través de lo cual se controlaría el componente secretor de la diarrea. En un metaanálisis de Lehert y colaboradores, que incluyó nueve ensayos clínicos y 1.348 pacientes menores de 15 años con GEA, se comparó el efecto de racecadotrilo versus placebo y se evidenció un reducción significativa de la frecuencia de deposiciones (razón de promedios de deposiciones por día racecadotrilo/placebo 0,59 y 0,63 para pacientes hospitalizados y ambulatorios, respectivamente); y de la duración de la diarrea (2,8 días y 1,7 días respectivamente). También se evidenció una disminución en la tasa de re-consultas y necesidad de líquidos endovenosos (48).
6)ZincEn países en vías de desarrollo con alta prevalencia de desnutrición y por ende, de déficit de zinc, se ha demostrado la eficacia de la suplementación de zinc (10–40mg/d dependiendo de la edad del paciente) para disminuir la frecuencia de deposiciones, duración de la diarrea y riesgo de evolucionar hacia diarrea prolongada (49). Por este motivo, la OMS recomienda la suplementación de zinc durante 10–14 días en niños con GEA (29). Sin embargo, este efecto beneficioso no ha sido replicado hasta ahora en países desarrollados, donde el déficit de zinc es poco frecuente (50). En nuestro medio, la prevalencia de desnutrición actualmente es baja y probablemente la de déficit de zinc también lo sea, por lo que la utilidad poblacional de la suplementación de zinc es cuestionable. No obstante, estaría indicada en pacientes con sospecha de déficit de zinc.
7)AntiespasmódicosSalvo excepciones, su uso está contraindicado ya que puede dar una falsa sensación de término de la diarrea y favorecer complicaciones, incluso fatales, como el megacolon tóxico.
8)AntimicrobianosSu uso debe reservarse para casos de disentería y/o diarrea acuosa severa con etiología bacteriana o parasitaria documentada. En la tabla 5 se señalan las opciones de terapia empírica según bacteria identificada. Idealmente el tratamiento debería ser guiado o ajustado de acuerdo al resultado de un antibiograma. En el caso de la infección por ECEH, no está indicado el uso de antibióticos y existen datos que sugieren que su administración en estos pacientes podría aumentar el riesgo de desarrollar Síndrome Hemolítico Urémico.
| ETIOLOGY | 1° LÍNEA | 2° LÍNEA |
|---|---|---|
| Shigella spp. | Ciprofloxacino Azitromicina | Cloranfenicol Cotrimoxazol |
| E.coli diarreogénicos ECET | Cefalosporina de 3ra generación Ciprofoxacino Debería evitarse el uso de antibióticos por posible aumento de riesgo de síndrome hemolítico urémico | Cotrimoxazol |
| ECEH | Cotrimoxazol | |
| Salmonella spp** | Cefalosporina de 3ra generación Ciprofloxacino | Cloranfenicol Cotrimoxazol |
| Campylobacter spp. | Azitromicina Eritromicina | Ciprofloxacino Gentamicina |
| Clostridium difficile | Metronidazol | Vancomicina oral |
| V. cholera | Doxiciclina Cotrimoxazol | Ciprofloxacino Cloranfenicol Furazolidona |
Las medidas de saneamiento ambiental, lavado de manos y manipulación adecuada de alimentos, constituyen herramientas fundamentales para prevenir la transmisión de agentes causantes de GEAI. En caso de pacientes con GEA en lugares cerrados, como hospitales, guarderías o casas de reposo, es primordial evitar el contagio mediante aislamiento de contacto. El aseo de superficies con cloro permite eliminar tanto agentes bacterianos como virales y disminuir la probabilidad de propagación (51). Debe recordarse que los brotes de enfermedad transmitida por alimentos (incluye GEA) son de Notificación Obligatoria e inmediata en nuestro país, de acuerdo a lo establecido en el Decreto Supremo 158, emitido en 2005. El objetivo de esta regulación es identificar precozmente la fuente de infección de manera de controlarlos forma oportuna (52).
Actualmente se encuentran licenciadas dos vacunas anti-rotavirus de probada eficacia contra episodios moderados a severos de GEA por este agente; ambas vacunas han probado ser seguras en lactantes (53, 54). Se recomienda la administración de alguna de estas vacunas en lactantes menores de seis meses, idealmente iniciando el esquema entre las seis y ocho semanas de vida. Dado que ambas vacunas son en base a virus atenuados (una de ellas contiene una variante humana y la otra es recombinante de cinco variantes bovino/humano) no deberían administrarse a pacientes inmunosuprimidos (55, 56). Si bien estas vacunas han sido incorporadas en los programas de vacunación de diversos países, en Chile es de indicación extra-programática.
También se cuenta en la actualidad con una vacuna licenciada contra Vibrio cholerae, de probada eficacia y seguridad. Hasta ahora, esta vacuna es de costo elevado, lo que ha limitado su uso en áreas endémicas. Se reserva para administración en caso de brotes y grupos vulnerables, incluidos viajeros a zonas endémicas (57).
Se encuentran en fase de investigación vacunas contra norovirus, Shigella spp., ECET y C.jejuni (31).
ConclusionesLa GEAI sigue siendo una patología de alto impacto en Salud Pública debido a su incidencia y eventuales complicaciones (relacionadas con deshidratación), especialmente en los extremos de la vida. Su manejo general debe ser por lo tanto, de resorte de todo el equipo de salud, particularmente a nivel de atención primaria y urgencia. El ideal es su prevención, mediante medidas de saneamiento ambiental y adecuada manipulación de alimentos. El surgimiento de vacunas abre una oportunidad para prevenir estos cuadros en grupos de mayor riesgo (ej: rotavirus en lactantes; Vibrio cholerae en viajeros).
El diagnóstico debe centrarse sobre todo en determinar el estado de hidratación pues eso comandará las decisiones terapéuticas. Habitualmente son cuadros autolimitados, que no requieren estudio de laboratorio específico ni terapia antimicrobiana. En los últimos años ha surgido evidencia que apoya el beneficio, si bien aun modesto, del uso de probióticos (Lactobacillus GG y S.boulardii) y racecadotrilo en cuanto a la diarrea y ondasetrón para los vómitos. El uso de suplementos de zinc debería reservarse para casos con sospecha de déficit de éste. En caso de sospecha de agente invasor (bacteria o parásito), debe realizarse estudio etiológico e iniciar terapia antimicrobiana de acuerdo al microorganismo identificado.
Las investigaciones actuales están dirigidas tanto a determinar el rol epidemiológico de cada agente (con fines de racionalizar terapia y prevención), como a optimizar la terapia de rehidratación (especialmente oral) y el desarrollo de nuevas vacunas contra los microorganismos más frecuentes.
La autora declara no tener conflictos de interés, en relación a este artículo.