La legislación en Chile ha regulado el desarrollo de investigación clínica aplicada. Actualmente, es posible utilizar los datos de la ficha clínica de los pacientes, con fines de investigación, previa autorización del sujeto a través del proceso de consentimiento informado respectivo. La gran cantidad de datos clínicos acumulados en los registros de salud representan una oportunidad para el desarrollo de investigación, más aún cuando los registros son electrónicos.
En el año 2012, la Subdirección de Investigación en conjunto con el Comité de Ética de Clínica Las Condes, elaboraron un documento para regular, orientar y potenciar el uso de registros con fines de investigación biomédica por los profesionales de la salud de la institución.
El objetivo de este artículo es compartir la experiencia en la creación de registros con fines de investigación científica, su desarrollo y la modalidad de funcionamiento en base a la regulación ético-legal chilena.
Legislation in Chile has regulated the development of clinical research. At present, it is possible to use patient's health clinical records for research purposes, with prior authorization of the subject through the respective informed consent process. The large amount of clinical data accumulated in health records represents an opportunity for research development, especially when the records are electronic.
In 2012, the Academic Research Unit and the Ethics Committee of Clínica Las Condes, developed a Protocol to regulate, guide and enhance the use of health clinical records for biomedical research purposes by healthcare professionals of the institution.
The aim of this article is to share the experience of the development of clinical registries for scientific research, based on the local ethics and legal regulation.
Durante las últimas décadas, el desarrollo de la investigación en Chile ha crecido considerablemente, así como también ha aumentado el número de investigadores clínicos1.
Gracias a los estudios de investigación desarrollados en nuestro país, se han implementado mejoras en la salud, avances en el diagnóstico y tratamiento, un aumento en las medidas de prevención de enfermedades y el desarrollo de políticas públicas basadas en evidencia científica1.
Las fuentes de información para desarrollar investigación en salud son múltiples, y dependen del tipo de estudio que se desea realizar2. El investigador puede generar un registro o base de datos específica para recabar la información de su proyecto de investigación, o bien, es posible utilizar registros en salud o bases de datos existentes, analizando la información contenida en ellas, principalmente en estudios descriptivos o epidemiológicos, así como también para la generación de nuevas hipótesis de investigación.
Un registro en salud se define como “un sistema para recopilar, organizar y almacenar información”3. Ha sido definido también como “todo documento que contiene datos de salud de las personas junto con su identificación personal en cualquier formato”4. Algunos ejemplos de registros en salud son: la ficha clínica de los pacientes, registro de certificados de defunción, seguros médicos, reporte de notificaciones obligatorias de diferentes enfermedades, entre otros.
Los registros en salud se crearon para recoger información de forma sistemática e individualizada sobre el uso de recursos clínicos, como atenciones de urgencia, cumplimiento de medidas sanitarias nacionales, consultas a especialistas, egresos hospitalarios e intervenciones quirúrgicas, entre otras. Por otro lado, la ficha clínica de salud se creó para recoger la información referente a la historia clínica de cada paciente para su atención de salud integral, controlada y segura4. El uso de los datos, tanto de los registros sistematizados en salud como la ficha clínica para estudios de investigación epidemiológica fue inicialmente colateral y secundario2. La gran cantidad de datos clínicos acumulados en los registros de salud representan una oportunidad para el desarrollo de investigación, más aún cuando los registros son electrónicos.
Han sido ampliamente descritos los beneficios del uso de registros de salud con fines de investigación. El uso de registros existentes reduce considerablemente el tiempo y el costo, facilitando la incorporación de gran cantidad de sujetos a las investigaciones, permitiendo estudiar una cohorte por largos períodos de tiempo2. Asimismo, representan una oportunidad para estudiar la incidencia, prevalencia, etiología y factores de riesgo de las enfermedades, como también su historia natural a lo largo del tiempo5. El análisis de los registros en salud permite también evaluar la calidad y efectividad de la atención de salud, identificando necesidades locales, favoreciendo la distribución del personal y de los recursos de cada institución de salud6.
El objetivo de este artículo es compartir la experiencia en la creación de registros con fines de investigación científica, su desarrollo y la modalidad de funcionamiento en base a la regulación ético-legal chilena.
REGULACIÓN LEGAL EN CHILE PARA EL DESARROLLO DE REGISTROS CON FINES DE INVESTIGACIÓNLa legislación en Chile ha regulado el desarrollo de investigación clínica aplicada. En relación a la regulación de registros clínicos con fines de investigación, hay cuatro leyes que se deben mencionar.
La Ley N°19.628 “Sobre Protección de la Vida Privada”, publicada en agosto de 1999 y vigente desde julio de 2011, fue la primera en regular el tratamiento de los datos de carácter personal en registros o bancos de datos almacenados por organismos públicos o particulares7. Esta Ley define registro o banco de datos como “el conjunto organizado de datos de carácter personal, sea automatizado o no y cualquiera sea la forma o modalidad de su creación u organización, que permita relacionar los datos entre sí, así como realizar todo tipo de tratamiento de datos”. Esta Ley define, además, dos importantes conceptos relativos al manejo de datos; datos de carácter personal o datos personales: “los relativos a cualquier información concerniente a personas naturales, identificadas o identificables” y datos sensibles: “aquellos datos personales que se refieren a las características físicas o morales de las personas o a hechos o circunstancias de su vida privada o intimidad, tales como los hábitos personales, el origen racial, las ideologías y opiniones políticas, las creencias o convicciones religiosas, los estados de salud físicos o psíquicos y la vida sexual”. En relación al consentimiento informado, en su Artículo 4, permite el tratamiento de datos personales si el titular consiente expresamente por escrito, debidamente informado respecto al propósito del almacenamiento de los datos personales y su posible comunicación al público. Por último, en su Artículo 7, la ley obliga a las personas que trabajan en el tratamiento de los datos personales a guardar secreto sobre los mismos (confidencialidad), cuando provengan o hayan sido recolectados de fuentes no accesibles al público.
En el año 2001, surge la necesidad de crear un marco regulatorio para las investigaciones realizadas en seres humanos que garantizara un marco ético aceptado internacionalmente. En base a esto, se desarrolló la Norma Técnica N°57, la cual se centra en la regulación de la ejecución de ensayos clínicos que utilizan productos farmacéuticos en seres humanos; además, se abordaron los principales temas de la investigación médica en general8.
En el año 2006 se promulgó la Ley 20120, que nace principalmente con el objetivo de legislar la clonación humana, además especifica que las investigaciones deben tener aprobación en primer lugar por el Comité Ético-Científico y luego por el director del establecimiento9.
Por último, en el año 2012, se promulgó la Ley 20.584 que se refiere a los derechos y deberes de los pacientes10. Los artículos 12 y 13 hacen referencia a la prohibición de terceros, que no estén relacionados directamente con la atención de salud al acceso a la ficha clínica, a excepción de tener un poder simple ante notario del paciente; sin embargo, la misma Ley se refiere, en sus artículos 21 y 22, al derecho de toda persona en incorporarse a cualquier tipo de investigación científica biomédica. Producto de lo establecido en esta Ley sobre cómo se ve afectado el acceso a la revisión de fichas clínicas con fines de investigación, la Comisión Ministerial de Investigación en Salud (CMEIS) elaboró un informe con recomendaciones en relación al uso de la ficha clínica con fines de investigación, que fue en parte promulgada por la División Jurídica del Ministerio de Salud en el año 2013 (Circular A15/15), aclarando la preeminencia de la Ley N° 20.120 sobre la Ley 20.584, respecto de los requisitos para obtener consentimiento del titular de los datos de la ficha clínica11. Actualmente, es posible utilizar los datos de la ficha clínica con fines de investigación, previa autorización del sujeto a través del proceso de consentimiento informado respectivo.
CONSIDERACIONES ÉTICAS EN LA CREACIÓN DE REGISTROS CON FINES DE INVESTIGACIÓNLa información contenida en la ficha clínica de una persona contiene datos de carácter personal y sensibles, por lo cual se debe mantener siempre su confidencialidad12. Por esta razón se hace necesario una regulación ética de la investigación, con estándares internacionales que garanticen el bienestar de los participantes13.
En la Declaración de la Asamblea General de la Asociación Médica Mundial sobre las consideraciones éticas de las bases de datos de salud y los biobancos, revisada por última vez en Taiwán en octubre de 2016, se establecen los principios éticos para la investigación médica en seres humanos, incluida la importancia de proteger la dignidad, autonomía, privacidad y confidencialidad de los participantes en la investigación y de obtener el consentimiento informado para utilizar el material biológico y la información identificable, contenida en los registros de salud3.
Por otra parte, es importante considerar lo estipulado en las pautas éticas internacionales para la investigación relacionada con la salud con seres humanos, del Consejo de Organizaciones Internacionales de las Ciencias Médicas (CIOMS), actualizadas en 201614. En su pauta 12, señala que cuando se recolectan y almacenan datos con fines de investigación, es posible usar un consentimiento informado amplio para un uso futuro no especificado de los datos. En los registros con fines de investigación (RFI), al no existir una pregunta de investigación definida al momento de recolectar los datos, es recomendable utilizar este tipo de consentimiento informado. En relación al uso de datos que fueron recolectados para investigaciones, usos clínicos u otros propósitos pasados, sin haber obtenido consentimiento informado, se podría elevar una solicitud de exención de éste al Comité de Ética, si fuese impracticable la realización de la investigación sin el consentimiento informado, la investigación tenga un valor social importante e implique un riesgo mínimo para los participantes.
Todo proyecto de investigación en el que se utilicen los datos del RFI debe presentarse al Comité de Ética de Investigación, el cual debe asegurar que la información que se pretende utilizar esté contenida dentro de los objetivos del registro y del consentimiento informado acordado con el sujeto2,14.
BENEFICIOS DE UN RFIEl objetivo primordial de todo RFI es la generación de investigación a partir de él. Los RFI son una oportunidad para descubrir factores de riesgo irreconocibles, estudiar la epidemiología de las enfermedades, conocer la realidad local, calcular las expectativas de vida, distinguir las mejores prácticas médicas para obtener los mejores resultados y reconocer oportunidades para un mejor cuidado en salud5.
La planificación para la creación de un RFI obliga al equipo de salud involucrado a discutir, consensuar y finalmente protocolizar la información a recolectar en la atención de los pacientes.
Usar la ficha de salud como la fuente de información demográfica y clínica del paciente con fines de investigación tiene ventajas respecto a completar una base de datos secundaria en forma retrospectiva con dicha información: se reducen los errores de transcripción, ya que la información es completada directamente por el profesional de la salud que está involucrado en la atención del paciente versus una base de datos secundaria completada por un tercero en forma retrospectiva. Además, el hecho de que el registro clínico no sólo tenga como objetivo el registro de la atención de salud del paciente, sino que al mismo tiempo, tenga fines de investigación, fomenta la completitud de los datos por parte del profesional, disminuyendo datos perdidos. También, se reduce el tiempo invertido que implicaría revisar cada una de las fichas clínicas de los sujetos incluidos en estudios observacionales retrospectivos, cuando no se cuenta con un RFI15. Por último, facilita el estudio de factibilidad y la selección de pacientes que cumplan con criterios de inclusión específicos en caso de ser requeridos para posibles estudios clínicos16.
El RFI es una herramienta que facilita el desarrollo de investigación en base al análisis periódico de la información contenida en él. La discusión de esta información con el equipo de salud que participa del RFI, permite identificar preguntas de investigación y reconocer oportunidades para mejorar la calidad de la atención, estimulando al grupo en la búsqueda de nueva evidencia científica.
En conclusión, un RFI permite realizar investigación a partir de la práctica clínica habitual, de manera que, todo dato clínico pueda ser usado con fines de investigación.
EXPERIENCIA LOCAL EN EL DESARROLLO DE REGISTROS CON FINES DE INVESTIGACIÓN CIENTÍFICA EN BASE A LA FICHA CLÍNICA ELECTRÓNICACreación del protocolo de registros con fines de investigaciónEn el año 2012, la Subdirección de Investigación en conjunto con el Comité de Ética de CLC, elaboraron un documento para normar el uso de RFI, basándose en las directrices publicadas por el Comité de Ética del Instituto de Enfermedades Raras del Instituto de Salud Carlos III, de España en el año 200917 y en las directrices ético-legales vigentes.
Este protocolo consta de siete puntos claves que orientan y regulan el uso de registros clínicos con fines de investigación biomédica utilizando la ficha clínica electrónica, los cuales detallamos a continuación:
- 1.
Introducción/justificación
Se debe detallar por qué es necesaria la creación del RFI, incluyendo quiénes se beneficiarán y qué conocimiento se espera generar. Esto tiene que estar sustentado con evidencia internacional, nacional y ojalá también local, si es que hubiere.
- 2.
Objetivos
Todo RFI tiene que tener un objetivo claro, especificando el grupo de pacientes y las principales variables que se espera incluir en él.
- 3.
Responsables
Todo RFI debe tener un profesional de la salud responsable (médico u otro profesional), el cual debe asegurar la confidencialidad de la información y conocer la información contenida en el registro y la investigación que se genere a partir de él. Además, debe contar con la aprobación explícita por escrito del Jefe de Departamento, Centro o Servicio del cual se originan los datos, siendo la institución responsable la que acoge y custodia dicho registro. Se sugiere que el responsable se defina como un cargo dentro de la institución, independiente de quién lo ocupe en ese momento, para que así el RFI trascienda en el tiempo.
- 4.
Confidencialidad de la información
Los responsables del RFI y los investigadores que participen de él, deben garantizar que las medidas de seguridad puestas en marcha sean suficientes para evitar quiebres de la confidencialidad. Es requisito la codificación de los sujetos, la cual sólo estará en conocimiento del responsable del RFI. Para mantener la confidencialidad, toda la información debe ser registrada en formularios clínicos electrónicos en la ficha de cada paciente, la cual cuenta con todas las medidas de seguridad institucional. Por otra parte, cada vez que se utilicen los datos para una investigación específica, éstos deberán ser analizados anónimamente.
- 5.
Población de estudio y recolección de la información
En este punto es necesario detallar los criterios de inclusión y exclusión de los sujetos al RFI. Se deben explicitar todas las variables que se incluirán (demográficas, clínicas, quirúrgicas, propias de la patología e imagenológicas, entre otras) y anexar los instrumentos que se utilizarán para medir cada una de ellas. Por último, se debe detallar el proceso de recolección de la información, incluyendo los responsables, el momento en que se hará y la periodicidad. Se sugiere anexar un flujograma esquematizando este proceso.
- 6.
Cesión de datos a terceros
La cesión de datos de carácter personal a terceros implica la donación de información contenida en el RFI a otro registro, institución o proyecto de investigación en particular. Si en el momento de crear el RFI se prevé la cesión de los datos a terceras partes, por ejemplo, a un registro internacional, lo aconsejable es incluir esta posibilidad en el proceso de consentimiento informado inicial. Se debe informar al sujeto de los motivos de la cesión, los datos que se van a ceder y la identidad de aquellos que van a recibir la información. Es importante explicitar en el protocolo cómo se realizará la cesión, quiénes serán los responsables y cómo se mantendrá la confidencialidad de la información en el proceso. Toda cesión de datos a terceros debe ser autorizada por escrito por el responsable del registro y aprobada por el Comité de Ética de Investigación de la institución.
- 7.
Proceso de consentimiento informado
La creación y/o el uso de RFI, que contienen datos de carácter personal, requiere que el responsable del registro o el investigador, solicite el consentimiento informado aprobado para este RFI a los sujetos, después de haberles informado adecuadamente de todos los aspectos relevantes concernientes al mismo. Asimismo, se debe informar los procedimientos de seguridad que se van a adoptar para su manejo, incluyendo las personas que tendrán acceso a los datos. Se debe adjuntar el formulario de consentimiento informado en el protocolo, detallando cómo será el proceso.
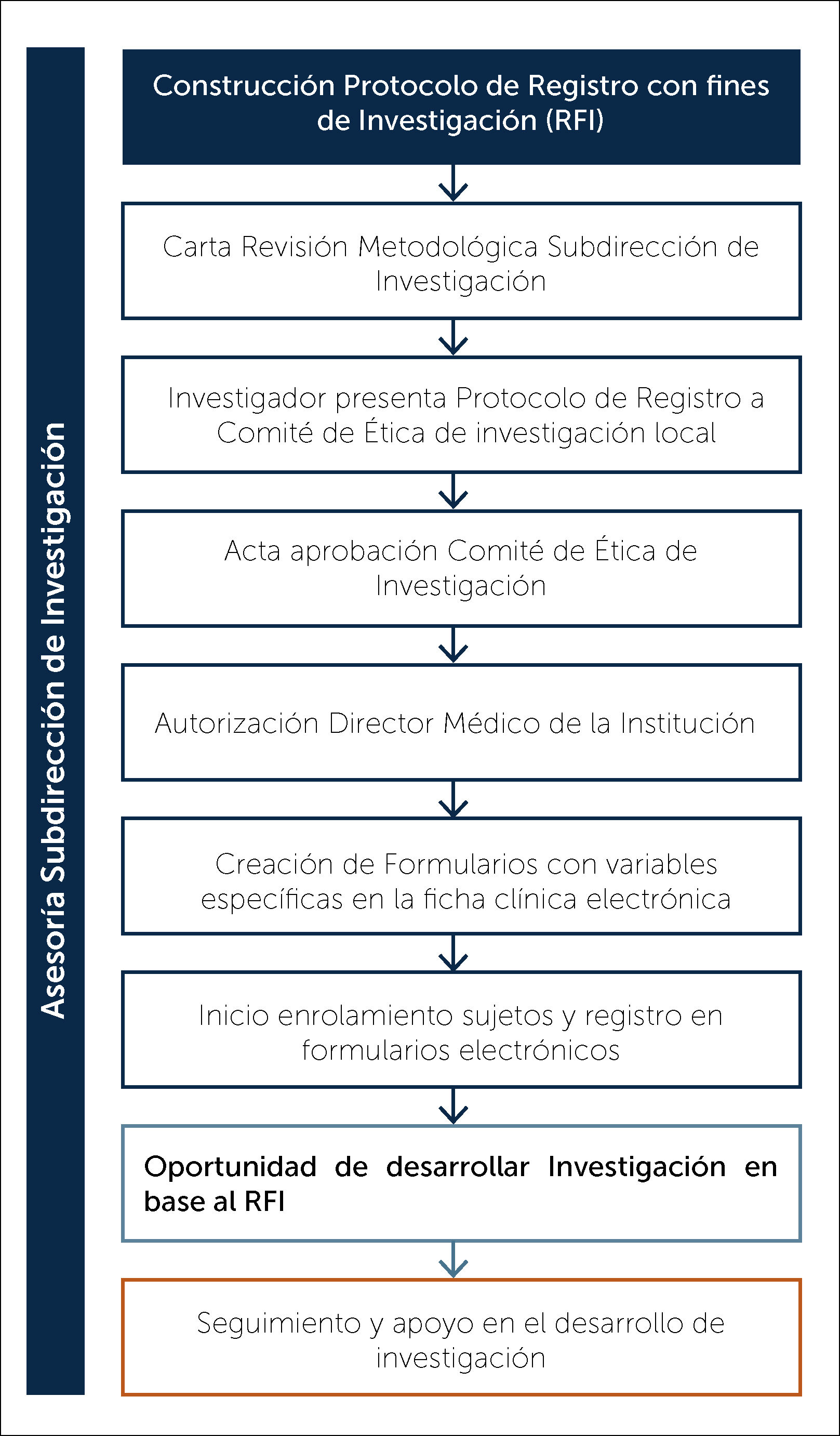
La Subdirección de Investigación de la Dirección Académica de CLC, cuenta con un equipo de profesionales formados en investigación, que apoyan el proceso de creación del RFI con los grupos interesados, en base al “Protocolo de Registros con Fines de Investigación de Clínica Las Condes” (Figura 1).
Los profesionales de la salud pueden acercarse a la Subdirección de Investigación manifestando su interés en la creación de un RFI en un determinado grupo de sujetos o patología en particular, en busca de asesoría para su creación. Por otra parte, la Dirección Académica de CLC en su contacto permanente con los profesionales de la salud, está atenta a los grupos que se verían beneficiados con la creación de un RFI, ofreciéndoles apoyo para su creación.
La asesoría a los grupos interesados se puede realizar de manera presencial, con reuniones periódicas en las cuales se discuten los avances en el protocolo y se da apoyo en lo necesario, o en forma virtual, revisando el protocolo y enviando al grupo los comentarios y sugerencias pertinentes.
Una vez que el Protocolo de RFI ha sido finalizado, éste es revisado por un tercero, miembro de la Dirección Académica de CLC, quien debe asegurar que el RFI cuenta con todos los elementos metodológicos necesarios para su implementación. Se entrega una carta de revisión metodológica.
Posteriormente, el responsable del RFI debe presentar toda la documentación (protocolo, formularios de consentimientos informados, currículum vitae, cartas de compromiso de confidencialidad de información y carta de aprobación metodológica del RFI) al Comité de Ética de Investigación local para su aprobación9.
Finalmente, el Director Médico de CLC debe dar su aprobación, para comenzar a utilizar el RFI9.
Formulario en ficha clínica electrónica para la implementación del RFIA través de la ficha clínica electrónica, la información puede ser recolectada durante la práctica clínica habitual y utilizada para el cuidado del paciente para mejorar la calidad de la atención y desarrollar investigación clínica18. En nuestro centro, cada investigador responsable de un RFI aprobado, diseña en conjunto con el Departamento de Tecnologías de la Información, un formulario electrónico específico que contiene todas las variables incluidas en el protocolo.
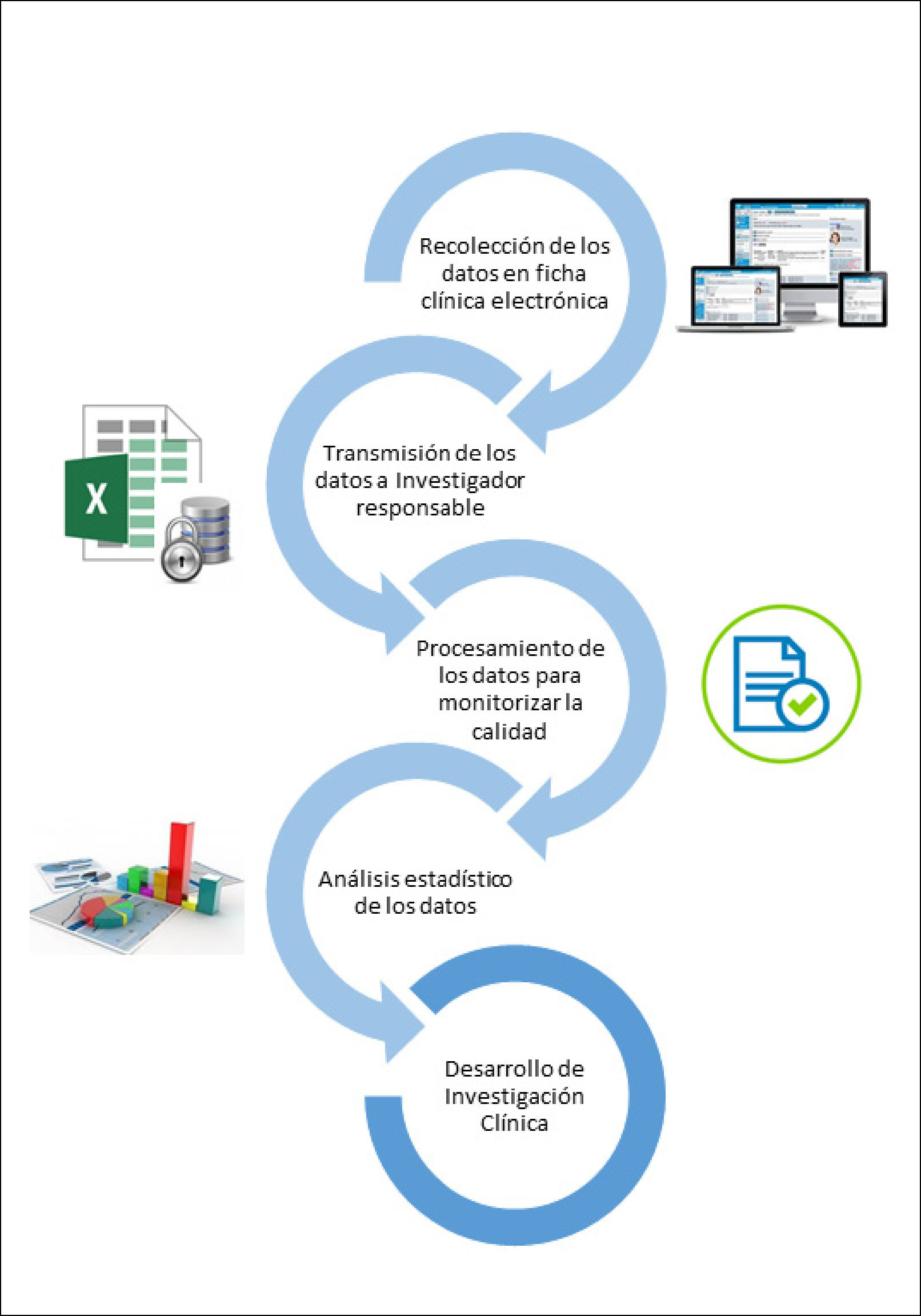
A continuación, se detallan las áreas en las que se debe centrar la implementación del registro cuando se utiliza una ficha clínica electrónica para su desarrollo19,20 (Figura 2):
a. Recolección de los datos: el requisito principal de recopilación de datos es proporcionar a los usuarios la capacidad de capturar información específica de la condición clínica o patología en particular, en la ficha clínica electrónica durante la consulta médica. La información se registra con fines clínicos, idealmente en un formulario específico, como parte de la atención de salud rutinaria, quedando almacenada en la ficha clínica electrónica, de manera de poder desarrollar investigación a partir de ésta. Es recomendable que el formulario de recolección de información se pueda modificar según los requerimientos clínicos y de investigación. Para disminuir la posibilidad de error, se sugiere utilizar avisos de comprobaciones de validación, por ejemplo, cuando un dato ingresado está fuera de los intervalos permitidos. Para evitar información incompleta, se puede programar el formulario, de tal manera de no poder cerrar el documento sin completar algunos campos obligatorios.
b. Transmisión de los datos: todos los datos del formulario electrónico se envían al responsable del registro periódicamente, quien construye el RFI y lo almacena, cautelando la seguridad y confidencialidad de la información contenida en él. La transmisión de datos de manera electrónica automatizada evita el doble registro de información, entre la ficha del paciente y el RFI, previniendo errores de transcripción15.
c. Procesamiento de los datos: el responsable que recibe los datos debe tener la capacidad para administrarlos, realizar el control de calidad de la información (campos sin completar, mal ingresados, etc.), hacer análisis estadístico básico y revisar medidas de calidad, para hacer recomendaciones al equipo de salud responsables de los registros. La administración de datos es crucial para monitorear la calidad de los datos clínicos.
d. Análisis: los datos contenidos en el RFI podrían permitir responder preguntas de investigación a través de análisis estadísticos adecuados, basados en la práctica clínica real de esa condición o patología específica.
Seguimiento y desarrollo de investigación en base a un RFILa Subdirección de Investigación realiza en forma anual un seguimiento vía correo electrónico a los RFI aprobados en la institución, lo que permite velar por el buen funcionamiento y procurar la mantención de la confidencialidad de la información y un uso correcto de los datos sensibles. Además, permite la identificación y resolución de posibles problemas que impidan la continuidad de éste, conocer el desarrollo de investigación y ofrecer asesoría en nuevos proyectos a partir de él.
En relación a la difusión y publicación de los resultados en base a RFI, es recomendable utilizar las Guías RECORD (Reporting of studies Conducted using Observational Routinely-collected health Data)21. Estas guías fueron creadas para orientar la publicación generada a partir de datos de salud recolectados rutinariamente. Consisten en un listado de revisión de 13 ítems relativos al título, resumen, introducción, métodos, resultados y discusión de artículos, entre otros, que buscan mejorar la calidad de las publicaciones generadas a partir de RFI.
CONCLUSIÓNSin duda, la ficha clínica como fuente de investigación observacional prospectiva, es un excelente recurso que se debe considerar al momento de desarrollar investigación en los centros de salud, la que se facilita enormemente cuando hay acceso a ficha clínica electrónica. El RFI fomenta la participación de todo el equipo de salud involucrado, homogeniza las variables, reduce los errores de transcripción, los datos perdidos y el tiempo invertido en la recolección de información para investigación. Finalmente, permite realizar investigación a partir de la práctica clínica habitual, de manera que, en un futuro, todo dato clínico pueda ser usado con fines de investigación.
El protocolo para el desarrollo de un RFI compartido en este artículo, podría ser de utilidad para que otros centros interesados, que cuenten con las herramientas necesarias, puedan implementarlo, previa autorización de la Dirección y Comité de Ética local respectivo.
Declaración Conflicto de InterésLas autoras declaran no tener conflicto de intereses.