La enfermedad inflamatoria intestinal (EII), cuyos fenotipos más frecuentes son la enfermedad de Crohn (EC) y la colitis ulcerosa (CU), tiene una etiología multifactorial, que resulta de la interacción de factores genéticos, ambientales y del microbioma. Su incidencia ha aumentado en las últimas décadas, así como también lo ha hecho la occidentalización de la dieta: alta en grasas, carbohidratos refinados, azúcar, carnes rojas y alimentos procesados. Una dieta occidental es considerada como factor de riesgo para el desarrollo de EII, ya que está asociada a disbiosis, alteración de la barrera intestinal y de la inmunidad del huésped. Existen diversas dietas de eliminación que podrían ejercer un rol en la inducción/mantención de la remisión. Sin embargo, la mayoría requiere estudios de mejor calidad científica para poder recomendarlas. A su vez, existen suplementos nutricionales que estarían asociados a la incidencia y curso de la enfermedad. El objetivo de esta revisión es mostrar el posible rol de la dieta en la incidencia de la EII, y las estrategias dieto-terapéuticas, incluyendo suplementos específicos y nutrición enteral, considerando periodos de crisis y remisión.
Inflammatory bowel diseases (IBD), most frequent phenotypes Crohn's disease and Ulcerative colitis, have a multifactorial etiology, resulting from genetics, environmental triggers and microbiome alterations. Its incidence has been increasing as well as the western diet, high in fat, refined carbohydrates, sugar, red meat and processed foods. A western diet is considered a risk factor for the development of IBD, since it is associated with dysbiosis, alteration of the intestinal barrier and host immunity. There are several elimination diets that could play a role in induction/maintenance of remission. However, most of them require better quality scientific studies. Also, there are nutritional supplements associated with the incidence and evolution of the disease. The aim of this review is to show the possible role of the diet in the incidence, and diet-therapeutic strategies, including specific supplements and enteral nutrition, considering periods of active disease and remission.
La enfermedad inflamatoria intestinal (EII), cuyos fenotipos más frecuentes son la enfermedad de Crohn (EC) y la colitis ulcerosa (CU), es un desorden inmunológico complejo caracterizado por una condición inflamatoria crónica con periodos de remisión y actividad1,2. Su etiología es multifactorial, resultante de la interacción genética, elementos ambientales (tabaquismo, antiinflamatorios no esteroidales, anticonceptivos, clase social, locación geográfica y dieta) y alteraciones en el microbioma intestinal, generando una respuesta inmune aberrante reflejada en una inflamación crónica intestinal3.
Durante el siglo XX, la EII predominó en países occidentalizados de Norteamérica, Europa y Oceanía. Sin embargo, durante las siguientes décadas su incidencia ha aumentado en países industrializados de Asia, Sudamérica y África4, contribuyendo a la hipótesis de que la occidentalización del estilo de vida está relacionada con el aumento en la incidencia de la EII5. En Norteamérica, la incidencia y prevalencia reportada para EC es de 23,8 por 100.000 personas-año y 318,5 por 100.000 personas, respectivamente. Para la CU, es de 23,14 por 100.000 personas-año y de 286,3 por 100.000 personas, respectivamente4. En Latinoamérica, la incidencia la EII ha aumentado durante las últimas décadas, presentando Brasil la mayor tasa de incidencia para CU (8,0 por 100.000 personas-año) y EC (5,8 por 100.000 personas-año)6.
La EC es una enfermedad inflamatoria transmural que puede afectar cualquier área del tracto digestivo, siendo más frecuente íleon y colon. La CU, contrariamente, afecta solo la mucosa del colon y recto7. Se habla de EII no clasificada, en pacientes que tienen actividad inflamatoria solo a nivel del colon sin tener elementos endoscópicos, histológicos o imagenológicos que permitan determinar si se trata de uno de sus fenotipos más frecuentes8. Sin embargo, la EII debería ser considerada una enfermedad sistémica y no limitarla solo al tracto digestivo, pues muchos pacientes desarrollarán síntomas extraintestinales (6-47%), pudiendo involucrar cualquier órgano, afectando negativamente su funcionalidad y calidad de vida7.
El objetivo de esta revisión es mostrar el posible rol de la dieta en la incidencia de la EII, y las estrategias dieto-terapéuticas, incluyendo suplementos específicos y nutrición enteral, para el manejo de esta enfermedad, considerando periodos de crisis y remisión.
I. Componentes de la dieta en la incidencia de EIINumerosos estudios han identificado patrones de alimentación que aumentarían el riesgo de desarrollar EII. Las personas de mayor riesgo serían aquellas que consumen grandes cantidades de carnes rojas (144,4g/día versus 31,8g/día)9 y grasas, particularmente ácidos grasos (AG) poliinsaturados omega-6 (mayor a 10% calorías totales)10; y las de menor riesgo, aquellas que ingieren dietas altas en fibra, frutas (para EC >4 porciones/día versus <1 porción/día OR 0,58; IC 95% 0,37–0,91)11 y vegetales (para EC 1 porción/día versus consumo ocasional, OR 0,41; IC 95% 0,24-0,71; para CU consumo diario o >1 vez a la semana versus ≤1 porción/semana OR 0,3; IC 95% 0,1-0,8)12. La dieta cumple un rol clave en el microambiente intestinal normal, afectando la composición y función de la microbiota, la barrera intestinal y la inmunidad del huésped13. (Tabla 1).
Resumen del posible rol de distintos componentes dietarios, en la incidencia de EII
| Componente dietario | Posible efecto en la incidencia de enfermedad inflamatoria Intestinal |
|---|---|
| Ácidos grasos saturados | Inducción inflamación colónica, aumentando la expresión de citoquinas proinflamatorias y la permeabilidad intestinal. |
| Ácidos grasos poliinsaturados:Omega-6Omega-3 | Proinflamatorio: aumento en la producción de citoquinas proinflamatorias.Antiinflamatorio: disminución producción citoquinas inflamatorias. |
| Azúcar | Inducción de disbiosis y promoción expansión de patobiontes, aumento de la permeabilidad e inflamación intestinal |
| Fibra | Promoción de síntesis de ácidos grasos de cadena corta, homeostasis intestinal, tolerancia inmunológica. Ejerce control epigenético en la respuesta inflamatoria |
| Proteína | Aumento en la producción de metabolitos bacterianos. Alteración membrana celular colonocito y pérdida de la función de barrera |
La dieta occidental, caracterizada por una elevada ingesta calórica, especialmente proveniente de azúcar, carbohidratos refinados, proteína de origen animal y alimentos ultraprocesados13, se ha asociado a una marcada reducción de la diversidad del microbioma14. No se ha logrado definir por qué la disbiosis contribuye con el desarrollo de EII, pero el aumento de especies de bacterias invasivas15 (proteobacteria: principalmente Escherichia coli adherente invasiva, bacterias mucolíticas: Ruminococcus gnavas y Ruminococcus torques, bacteria sulfato reductora: Desulfovibrio)16 junto con una disminución de bacterias protectoras15 (Clostridium cluster IV, XIVa, XVII, Faecalibacterium prausnitzii)16 desencadenaría una respuesta inmunológica celular inapropiada, con la posterior disrupción de las respuestas inmunes Th1 y Th17, aumentando la permeabilidad de la mucosa y pérdida de la tolerancia inmunológica15.
Azúcar y carbohidratosRussel y cols. estudiaron los factores de riesgo nutricionales asociados al desarrollo de CU y EC, describiendo una asociación positiva entre el consumo de bebidas carbonatadas y chocolates17. Estas observaciones fueron confirmadas posteriormente por Sakamoto y cols., quienes evaluaron la dieta en 128 pacientes con EC y 111 pacientes con CU, y encontraron una asociación positiva entre el consumo de dulces y el riesgo de desarrollar CU y EC, respectivamente (OR 2,86; IC 95%, 1,24-6,57 y OR 2,83; IC 95%, 1,38-5,83)18. Por el contrario, Chan y cols. no observaron relación en el análisis de la subcohorte de “El estudio prospectivo Europeo sobre dieta, cáncer y salud” (EPIC)19. Evaluaron, los casos incidentes de EII en 401.326 mujeres y hombres sanos, entre 20 y 80 años de edad, y su relación con la dieta, mediante cuestionarios validados de frecuencia de consumo de alimentos. Diagnosticándose 110 casos de EC y 244 de CU, concluyendo que no existía relación entre la ingesta total de carbohidratos, azúcar y almidones con la incidencia de EII. Sin embargo, esto podría explicarse por el sesgo inherente del método de evaluación de ingesta nutricional empleado.
Estudios en modelos murinos de EII, reportan que una dieta de tipo occidental (alta en azúcar y grasas), puede favorecer la disbiosis intestinal, facilitando la colonización del intestino por Escherichia coli adherente invasiva, con liberación posterior del factor de necrosis tumoral alfa, promoviendo un aumento en la permeabilidad e inflamación intestinal20.
El mayor riesgo de desarrollar EII asociado a un alto consumo de azúcar, es concomitante a una disminución en la ingesta de fibra, sugiriendo un rol protector de este tipo de carbohidrato en las EII3.
FibraLa fibra dietaria corresponde a un tipo de carbohidrato no digerible3. Desde un punto de vista práctico, ésta puede clasificarse como soluble e insoluble, siendo la primera altamente fermentable por bacterias colónicas21 (Faecalibacterium, Phascolarctobacterium, Roseburia, Leuconostocaceae)22, promoviendo la diversidad bacteriana, mantención de la barrera mucosa y favoreciendo la producción de AG de cadena corta (AGCC), como el acetato, butirato y propionato. Estos AG benefician la mantención de la homeostasis intestinal3 y la promoción de la tolerancia inmunológica, aumentando la producción de linfocitos T reguladores5. Además, cumplirían un rol crítico en el control epigenético de la respuesta inflamatoria14. El butirato juega un papel importante en el intestino, suprimiendo la inflamación, al inhibir la transcripción de citoquinas (IL-1, IL-6, TNF-α)23 y aumentando la diferenciación y población de linfocitos T reguladores de la lámina propia. Además, en modelos animales se ha demostrado que mejora la inmunidad innata al regular las defensinas y catelicidinas24.
Un bajo consumo de fibra dietética provocaría el catabolismo de la capa mucosa, aumentando la permeabilidad, permitiendo un aumento del contacto entre bacterias luminales y el epitelio intestinal24.
En un estudio que incluyó participantes de ambas cohortes del Estudio de la Salud de las Enfermeras I y II (NHS), se evaluó el riesgo de desarrollar CU y EC según el consumo de distintas fuentes de fibra. Se documentaron 260 casos de EC (incidencia de 8 por 100.000 personas-año) y 338 casos de CU (incidencia de 10 por 100.000 personas-año). El grupo en el quintil más alto de ingesta acumulada de fibra, tuvo una reducción del riesgo de desarrollar EC de un 40%, no así de CU (HR para EC, 0,59; IC 95%, 0,39-0,90, HR para CU 0,82; IC 95%, 0,58-1,17). Este efecto protector sería mayor para la fibra proveniente de las frutas por ser más fermentable, siendo metabolizada por bacterias intestinales a AGCC, que inhiben al factor nuclear ¿ß (NF-¿ß) y la transcripción de mediadores proinflamatorios25. Así mismo, un estudio realizado en sujetos menores de 20 años de edad confirmó el rol protector del consumo de fibra en la prevención de EC (OR 0,12, IC 95%, 0,04–0,37, p<0,001)26.
La razón del potencial efecto divergente de la fibra en la CU en comparación con la EC requiere una mayor exploración. Una hipótesis podría ser la diferencia en la patogenia de estas dos entidades25.
ProteínasDietas ricas en grasas y proteínas, algo común entre países occidentales y otros con similares estilos de vida, han sido identificadas como factores de riesgo para el desarrollo de EII27. La ingesta de una dieta rica en proteínas y/o carnes rojas, podría aumentar la producción de metabolitos bacterianos, como amonio, indoles, fenoles y sulfuros, potencialmente dañinos para el intestino28. Se ha sugerido que el sulfuro en presencia de óxido nítrico (producido por bacterias anaerobias), alteraría la membrana celular del colonocito, provocando la pérdida de la función de barrera29.
En un estudio prospectivo francés, (n=67.581 hombres y mujeres, de mediana edad, seguidos por 10,4 años), una ingesta total elevada de proteína (promedio 207g/kg de peso), específicamente de origen animal-carne (roja y blanca) y pescado- se asoció con mayor riesgo de EII (HR del tercer versus primer tercil de 1,87, IC 95%: 1,00-3,49, p=0,02). Esta asociación no se encontró para el consumo de huevos o lácteos29.
GrasasLos AG saturados, se encuentran en productos que contienen grasa animal, como la carne, mantequilla, leche entera y otros productos lácteos. Si bien, en estudios de casos y controles, se ha identificado una pequeña relación entre el consumo de AG saturados y el riesgo de desarrollar EII, estudios de cohortes prospectivas no han confirmado esta asociación, lo que sugiere que la relación entre ambos es más compleja. En estudios animales una dieta rica en AG saturados induce la inflamación colónica, aumentando la expresión de citoquinas proinflamatorias y la permeabilidad intestinal28.
La dieta occidental, alta en aporte de AG poliinsaturados omega-6 y baja en aporte de AG poliinsaturados omega 3, favorecería el desarrollo de EII28. Se ha demostrado un efecto negativo del consumo de ácido linoleico, un AG poliinsaturado omega-6, en el riesgo de desarrollar CU. Éste es un precursor del ácido araquidónico (AA), cuyos metabolitos exhiben propiedades proinflamatorias. El consumo de AA también aumentaría el riesgo de desarrollar CU, mientras que un aumento en el consumo de ácido oleico, un AG monoinsaturado, sería un factor protector30. En el estudio EPIC (que incluyó más de 200.000 individuos) se diagnosticaron 126 casos de CU. Al analizar el nivel de consumo de ácido linoleico, aquellos sujetos que se encontraban en el cuartil de ingesta más alto tuvieron mayor riesgo de desarrollar CU (OR=2,49, IC 95% 1,23 a 5,07, p=0,01). Por otro lado, aquellos con mayor consumo de omega-3, tuvieron un menor riesgo de desarrollar esta enfermedad. La explicación radica en que los AG poliinsaturados omega-6 están presentes en las membranas de los colonocitos, pudiendo liberarse y ser metabolizados a prostaglandinas, leucotrienos y tromboxanos con efectos inmunoestimuladores, pudiendo predisponer al desarrollo de CU31.
John y cols. demostraron en su cohorte de más de 25.600 personas mayores de 45 años, un efecto protector del consumo de AG omega-3, específicamente para el ácido docosahexaenoico, en la incidencia de CU (OR=0,43, IC 95%=0,22-0,86, p=0,02)32. Este AG es metabolizado a prostaglandinas y tromboxanos de la serie 3 y leucotrienos de la serie 5, que provocan un menor grado de inflamación y ejercen efectos antiinflamatorios33.
II. Rol de la dieta en períodos de crisisNo existe una dieta específica que pueda recomendarse para promover la remisión en pacientes con EII activa. Aún faltan estudios aleatorizados y controlados respecto a los efectos de estas dietas en la inflamación intestinal o en la inducción de la remisión34.
La intervención nutricional más ampliamente estudiada en EII es la nutrición enteral exclusiva (NEE). Ésta fue la primera intervención nutricional clínicamente validada para tratar esta enfermedad, especialmente la EC35.
Las tasas de efectividad reportadas para el uso de NEE en el tratamiento de la EC en adultos varían considerablemente. Por el contrario, estudios en población pediátrica son más consistentes, reportándose una tasa de efectividad de hasta un 90%36. Un reciente meta-análisis propone que este efecto sería independiente del tipo de fórmula empleada (elemental versus polimérica)37. La Sociedad Europea de Nutrición Clínica y Metabolismo (ESPEN), recomienda el uso de NEE como primera línea para la inducción de la remisión en pacientes pediátricos con EC activa34. En adultos, si bien la mayoría de los centros utiliza corticoides o terapia biológica como primera línea de tratamiento en la EC moderada a severa, la ESPEN refiere que las características del paciente y de la enfermedad, contribuyen en las decisiones terapéuticas, pudiendo ser la NEE una opción en algunos pacientes38.
Los mecanismos beneficiosos propuestos de la NEE son su efecto antiinflamatorio, restauración de la barrera epitelial y cambios favorables en la microbiota intestinal. Recientemente, el efecto de la NEE se ha atribuido a la exclusión específica de algunos componentes de la dieta30. Levine y cols. apoyan esta hipótesis en su estudio, donde 74 niños con EC leve a moderada fueron aleatorizados a una de las siguientes intervenciones realizadas en 2 etapas; grupo 1: dieta de exclusión – se excluye el consumo de lácteos, toda proteína de origen animal que no sea pechuga de pollo o pescado fresco magro, grasa de origen animal, trigo, aditivos, emulsionantes, alimentos enlatados, congelados o precocidos, suplementos de hierro, soya, productos sin gluten, diversos aderezos ultraprocesados, frituras, bebidas alcohólicas y jugos- junto a nutrición enteral parcial (NEP) (50% de las calorías totales por las primeras seis semanas, luego DEEC+NEP en forma de 25% calorías hasta la semana 12 de intervención) o grupo 2: NEE (primeras 6 semanas, seguido de dieta sin restricción+25% calorías en forma de NEP). Ambos grupos lograron la remisión a las 6 semanas, sin diferencias entre ellos (p=0,38). Sin embargo, a la semana 12 un 75% de los niños del grupo 1 mantuvo la remisión versus un 45,1% de los niños del grupo 2 (p=0,01; OR 3,77; IC 1,34–10,59)39.
La NE sería preferible al uso de nutrición parenteral, indicándose esta última solo cuando la alimentación oral o por sonda no sea posible (tracto gastrointestinal disfuncional, pacientes con EC con intestino corto) o en presencia de una obstrucción intestinal en la que no es posible colocar una sonda de alimentación distal a ésta, fugas anastomóticas y fístula intestinal de alto flujo34.
A diferencia de la EC, la NE no se ha estudiado adecuadamente en pacientes con CU activa. Se requieren estudios adicionales que incluyan cohortes más grandes de pacientes40.
III. Dietas TipoLas dietas tipo son regímenes prescritos en base a una teoría subyacente de interacción entre alimentos y el organismo41. El objetivo es evitar alimentos únicos o grupos de alimentos y aditivos que puedan, a través de sus efectos antigénicos, proinflamatorios u osmóticos, provocar alteraciones en la integridad de la barrera epitelial, disbiosis, inflamación intestinal y/o intolerancias alimentarias42. Existen diversas dietas de eliminación, ya sea para inducción/mantención de la remisión clínica o para la mejoría de los síntomas funcionales28. La mayoría de éstas carecen de una evaluación científica rigurosa43, siendo necesarios estudios de mejor calidad.
Dieta específica de carbohidratos (DEC)Fue descrita inicialmente como una dieta para tratar la enfermedad celíaca por Sidney Haas en 192444 y luego popularizada por Elaine Gottschall en su libro Breaking the Vicious Cycle para tratar la EII luego de que su hija, siguiendo esta dieta, se curó de CU45. La DEC es una dieta rígida que permite el consumo de carnes no procesadas, huevos, pescados, frutas, vegetales, grasas y aceites, yogurt casero fermentado y miel como endulzante46. Sus propulsores postulan que los carbohidratos di y polisacáridos son mínimamente absorbidos en el tracto intestinal, produciendo sobrecrecimiento bacteriano y sobreproducción de mucus41, recomendando así la exclusión de carbohidratos complejos en favor de monosacáridos46.
Dieta AntiinflamatoriaDeriva de la anterior y comparte su hipótesis sobre ciertos carbohidratos, que al consumirlos producen disbiosis y aumento de la permeabilidad intestinal. Se basa en: 1) restricción de carbohidratos (refinados o procesados, lactosa), 2) uso de prebióticos y probióticos, 3) reducción del consumo AG saturados, aceites hidrogenados y aumento del consumo de AG omega-3 y 4) reducción de texturizantes de alimentos46.
Actualmente, falta evidencia para recomendar la DEC y/o la dieta antiinflamatoria en pacientes con EII41,46.
Dieta Paleolítica (DP)Su fundamento apunta a que el tracto digestivo está pobremente capacitado para procesar la dieta moderna, postulando que la exposición a comidas que eran inexistentes en la era de evolución del hombre, provocarían enfermedades modernas41. La DP evita el consumo de alimentos procesados, azúcares refinados, legumbres, lácteos, granos y cereales, y promueve el consumo de proteína de animales que fueron alimentados con pastos (no domesticados), pescados salvajes, frutas, vegetales, frutos secos y grasas saturadas “sanas”47. Además, promueve una ingesta elevada de fibra vegetal (45-100g/día)41.
A pesar de los intuitivos efectos beneficiosos de una dieta que evite el consumo de alimentos procesados y de alta densidad calórica, no existen estudios clínicos que evalúen su eficacia para el tratamiento de la EII2. Al igual que la DEC, esta dieta podría conducir a un déficit de vitamina D41.
Dieta de exclusión de la enfermedad de Crohn (DECC)Se basa en la exclusión de componentes que, en modelos murinos, han demostrado afectar la inmunidad innata, aumentar la permeabilidad intestinal, provocar disbiosis o permitir una translocación bacteriana a través del epitelio intestinal28. Excluye el consumo de gluten, lácteos, soya, grasas animales, carnes procesadas, emulsificantes, alimentos envasados, productos enlatados, café, chocolate, alcohol42. Esta dieta es rica en fibra y en fuentes naturales de almidón resistente28.
Sigall y cols. exponen en su estudio realizado en pacientes adultos y pediátricos con EC (n=21), con falta de respuesta a tratamiento biológico (a pesar de optimización de dosis o de terapia combinada), que al ser tratados con NE parcial mediante una fórmula polimérica y DECC, 13 de 21 pacientes (61,9%) lograron la remisión clínica luego de 6 semanas de tratamiento. La limitación de este estudio es su naturaleza retrospectiva y que no contó con grupo control48.
Dieta semi-vegetariana (DSV)Un estudio prospectivo realizado en Japón en 22 pacientes con EC, examinó el efecto de una DSV versus dieta omnívora en la mantención de la remisión. La DSV permite el consumo de huevos, lácteos, carne cada dos semanas y pescado una vez por semana. La remisión clínica lograda con DSV fue de un 100% a 1 año y de 92% a los 2 años, comparada con un 67% y 25%, respectivamente en el grupo control, y también fue superior en cuanto a la prevención de recaídas (p=0,0003)49. Los autores postulan que la EII está relacionada con la dieta occidental, razón por la que fomentan el consumo de granos, vegetales y frutas. Y recomiendan limitar el consumo de alimentos de origen animal, que tienden a disminuir las bacterias intestinales protectoras y que serían un factor de riesgo para el desarrollo de EII49.
En base a estas observaciones, una DSV puede ser altamente efectiva en la mantención de la remisión en EC, aunque se requieren más estudios para validar su eficacia2.
Dieta baja en residuos (DBR)Recomendada en pacientes con exacerbación de la EII, especialmente aquellos con estenosis intestinal. El objetivo es reducir la frecuencia y el volumen de las deposiciones y reducir el riesgo de obstrucción intestinal. La DBR excluye el consumo de cereales integrales, legumbres, frutas y vegetales (excepto plátano y papas sin cáscara), lácteos y carnes fibrosas2.
Hasta ahora, no se ha propuesto una definición clara para una dieta baja en residuos, ya que existen discrepancias entre las recomendaciones dietéticas de una dieta baja en residuos y/o fibra. En la práctica, la información relacionada con la cantidad de residuo de una dieta, hace usualmente referencia a la cantidad de fibra de ésta50.
No existe evidencia que respalde este tipo de dieta. Además, una dieta baja en fibra podría promover la disbiosis, por lo que se sugiere evitar la eliminación de ésta por períodos largos2.
Dieta baja en FODMAPFODMAP es un acrónimo de Oligo-Di y Monosacáridos Fermentables y Polioles. Estas moléculas son pobremente absorbidas en el intestino delgado y altamente fermentables y osmóticas, favoreciendo la producción de gas, meteorismo y diarrea51. Pueden generar síntomas digestivos en pacientes con Síndrome de Intestino Irritable (SII) al aumentar el contenido de agua en el intestino delgado, producir gas en el colon y AGCC (que pueden actuar sobre la motilidad intestinal y absorción de sodio y agua). Por lo tanto, una reducción en el contenido de FODMAP de la dieta, puede ser una opción terapeútica para el SII52. Sin embargo, estas moléculas tienen además efectos beneficiosos, por ejemplo: la inducción selectiva del crecimiento de microorganismos como Bifidobacterias, además ejercen un efecto prebiótico y podrían proteger contra el cáncer de colon51.
Los pacientes con EII a menudo reportan síntomas relacionados con el tracto gastrointestinal, sin evidencia objetiva de actividad inflamatoria, estimándose una prevalencia de síntomas sugerentes de SII cercana a 40%53. Gearry y cols. evaluaron la relación de una dieta baja en FODMAPs en 52 pacientes con EC y 20 pacientes con CU, con síntomas digestivos; dolor y distensión abdominal, flatulencias y diarrea. Aproximadamente un 56% de los pacientes notaron una disminución de estos síntomas tras seguir esta dieta54. (Tabla 2).
Resumen de distintas intervenciones nutricionales en la inducción y mantención de la remisión
| Intervenciones nutricionales | Posible efecto en la inducción/mantención de la remisión |
|---|---|
| Nutrición enteral exclusiva (NEE) | Efecto antiinflamatorio, restauración de la barrera epitelial, cambios en la microbiota intestinal, exclusión específica de algunos componentes dietarios. |
| Dieta específica de carbohidratos (DEC) | Exclusión de carbohidratos complejos, ya que estos serían mínimamente absorbidos en el tracto intestinal. Permite consumo de monosacáridos. |
| Dieta Antiinflamatoria | Ciertos carbohidratos (carbohidratos refinados y lactosa) producirían disbiosis y aumento de la permeabilidad intestinal. |
| Dieta Paleolítica (DP) | Tracto digestivo estaría pobremente capacitado para procesar la dieta moderna. Evita alimentos procesados, azúcares refinados, legumbres, lácteos, granos y cereales. |
| Dieta de exclusión de la enfermedad de Crohn (DECC) | Excluye gluten, lácteos, soya, grasas animales, carnes procesadas, emulsificantes, envasados y enlatados, café, chocolate, alcohol, ya que en modelos murinos afectan inmunidad innata y generan aumento permeabilidad intestinal y disbiosis. |
| Dieta semi-vegetariana (DSV) | Fomenta el consumo de granos, vegetales y frutas. Mientras que limita el consumo de alimentos de origen animal y otros alimentos reportados como factor de riesgo para desarrollar EII. |
| Dieta baja en residuos (DBR) | Manejo en exacerbación, especialmente en estenosis intestinal. Excluye el consumo de cereales integrales, legumbres, frutas y vegetales (excepto plátano y papas sin cáscara), lácteos y carnes fibrosas. |
| Dieta baja en FODMAP | Reduce el consumo de oligo-di y monosacáridos fermentables y polioles, los que son pobremente absorbidos en el intestino delgado y altamente fermentables y osmóticos, favoreciendo sintomatología digestiva. |
FODMAP: Fermentable Oligosaccharides, Disaccharides, Monosaccharides And Polyols.
Es una vitamina liposoluble que posee propiedades inmunomoduladoras importantes para regular la inflamación y mantener la barrera epitelial intestinal. Por lo tanto, se ha planteado la hipótesis de que podría ayudar a disminuir la inflamación. En humanos, proviene principalmente de la síntesis en la piel mediada por radiación ultravioleta solar (RS)46,55.
Niveles bajos de VD se han estudiado como factor de riesgo para EII, correlacionándose positivamente la distancia del Ecuador con su incidencia. Mientras que, niveles elevados han sido asociados inversamente33. Chile exhibe una gran variación de RS de norte a sur. Así, en un estudio en pacientes pediátricos y adultos (n=12.869), se evidenció que, en términos de latitud, las mayores tasas de hospitalización para pacientes pediátricos con EC y CU y para adultos con CU, fueron observadas en las regiones más australes donde la RS anual es más baja55.
Un estudio de prevalencia, realizado en 91 pacientes adultos con EII, mostró que un 76% de ellos tenía bajos niveles de VD; 50,5% tenía niveles bajo 20 ng/ml y 25,3% entre 20-30 ng/ml. Aquellos que fueron sometidos a intervenciones quirúrgicas relacionadas a su enfermedad, tenían niveles de VD significativamente menores (19,1±12,3 versus 24,1±11,1 ng/ml, p<0,02). Estos niveles también fueron significativamente menores en pacientes con enfermedad moderada-severa en comparación con pacientes en remisión o con actividad inflamatoria leve56.
CurcuminaLa curcumina es el constituyente activo principal de la cúrcuma. Estudios en animales han reportado que inhibe la inflamación colónica y previene el desarrollo de cáncer colorrectal, al inhibir el NF-¿ß. Además, podría inhibir la expresión de genes asociados a EII46.
Lang y cols. evaluaron su efecto en 50 pacientes con CU activa, leve-moderada. Los pacientes fueron aleatorizados a curcumina (n=26) 3g/día vía oral+mesalamina (4g/día) versus placebo (n=24)+mesalamina (4g/día). Al mes de seguimiento, 14 (53,8%) de los pacientes en el grupo de la curcumina lograron la remisión clínica versus ninguno en el grupo placebo (p=0,01; OR 42; IC 95%, 2,3–760)57.
Por otra parte, Hanai y cols. realizaron un estudio aleatorizado, doble ciego, controlado con placebo, en 89 pacientes con CU en remisión. De éstos, 45 recibieron 1g de curcumina después del desayuno y la cena junto con sulfasalazina (SZ) 1,0-3,0g/día (media 2,0g/día) y 44 recibieron placebo más mesalamina 1,5-3,0g/día (media 2,25g/día). El grupo tratado con curcumina tuvo menor tasa de recaída a los 6 meses de iniciada la intervención versus el grupo placebo (4,65% vs 20,51%, p=0,04)58.
Ácidos grasos omega 3Diversos estudios han demostrado que su suplementación disminuye la producción de citoquinas proinflamatorias59,60. Diversa evidencia ha demostrado efectos positivos de los AG omega-3 como tratamiento complementario o en la prevención de CU o EC61–63.
Scaioli y cols. realizaron un estudio aleatorizado, doble ciego, controlado con placebo en 60 pacientes con CU. Se aleatorizaron a los pacientes a recibir suplementación con EPA (en forma de ácido graso libre) 500mg, 2 cápsulas x 2 veces al día o placebo. Al cabo de 6 meses de seguimiento, un 76,7% mantuvo la remisión clínica en el grupo suplementado versus 50% en el grupo control (OR 3,29; IC 95% 1,08-9,95; p=0,035)61.
Sin embargo, una revisión sistemática que analizó la tasa de remisión en 6 estudios en pacientes con EC (n=1039) suplementados con AG omega-3 (EPA+DHA en dosis variables; EPA de 1,2g/día a 3,3g/día, DHA de 0,6g/día a 1,8g/día), reportó que si bien en éstos hubo una menor tasa de recaída versus grupo control (39% y 47%, respectivamente; RR 0,77; IC 95% 0,61-0,98), al analizar los 2 estudios más grandes (n=738), el beneficio perdió significancia estadística (RR 0,88; IC 95% 0,74–1,05). Los resultados son difíciles de interpretar, pero posiblemente se deban a diferencias en los métodos de cada estudio, forma química de la suplementación (ácido graso libre, ester o triglicérido), dosis utilizada, entre otros64.
GlutaminaEs considerada un aminoácido condicionalmente esencial debido a que su consumo aumenta durante condiciones de estrés catabólico. Es la principal fuente de energía para los enterocitos65. Además, es sustrato para la síntesis de glutatión, un eficaz antioxidante. En pacientes con NP, su suplementación mejora la permeabilidad intestinal y previene la atrofia intestinal. Sin embargo, se ha descrito que el exceso de ésta en el colon aumenta el estrés oxidativo y posiblemente empeora la actividad inflamatoria a nivel intestinal. En consecuencia, su uso actualmente no está recomendado y se mantiene como un tema controversial46.
Aditivos polisacáridosUn aspecto de la dieta occidental que está en observación es el efecto de los aditivos polisacáridos de los alimentos en el desarrollo y evolución de la EII3.
Dentro de estos se encuentra la maltodextrina, utilizada comúnmente como espesante66. Aunque es considerada segura, estudios han demostrado un rol perjudicial en el ambiente intestinal, sugiriendo participación en el rápido aumento en la incidencia de enfermedades inflamatorias crónicas, como la EII67. Modelos murinos de colitis han evidenciado que su consumo exacerba la inflamación intestinal en una forma dosis-dependiente, a través de la activación del retículo endoplásmico y la subsiguiente alteración de la capa mucosa protectora67.
La carragenina y carboximetilcelulosa son agregados en las comidas procesadas como estabilizadores, espesantes, texturizantes, emulsificadores y endulzantes. Paralelamente al aumento del consumo de alimentos procesados durante el siglo XX, hubo un alza en la incidencia de EII3. Se propone que la carragenina y la carboximetilcelulosa, provocan la erosión de la capa mucosa protectora y la expresión anormal de proteínas de uniones estrechas. Así, las partículas de alimentos no digeridas, junto a toxinas y microorganismos son capaces de pasar a través del epitelio intestinal, provocando la translocación de gérmenes y la colonización excesiva por patobiontes, que pueden alterar la composición del microbioma, gatillando la activación del sistema inmune y el desarrollo de la inflamación68.
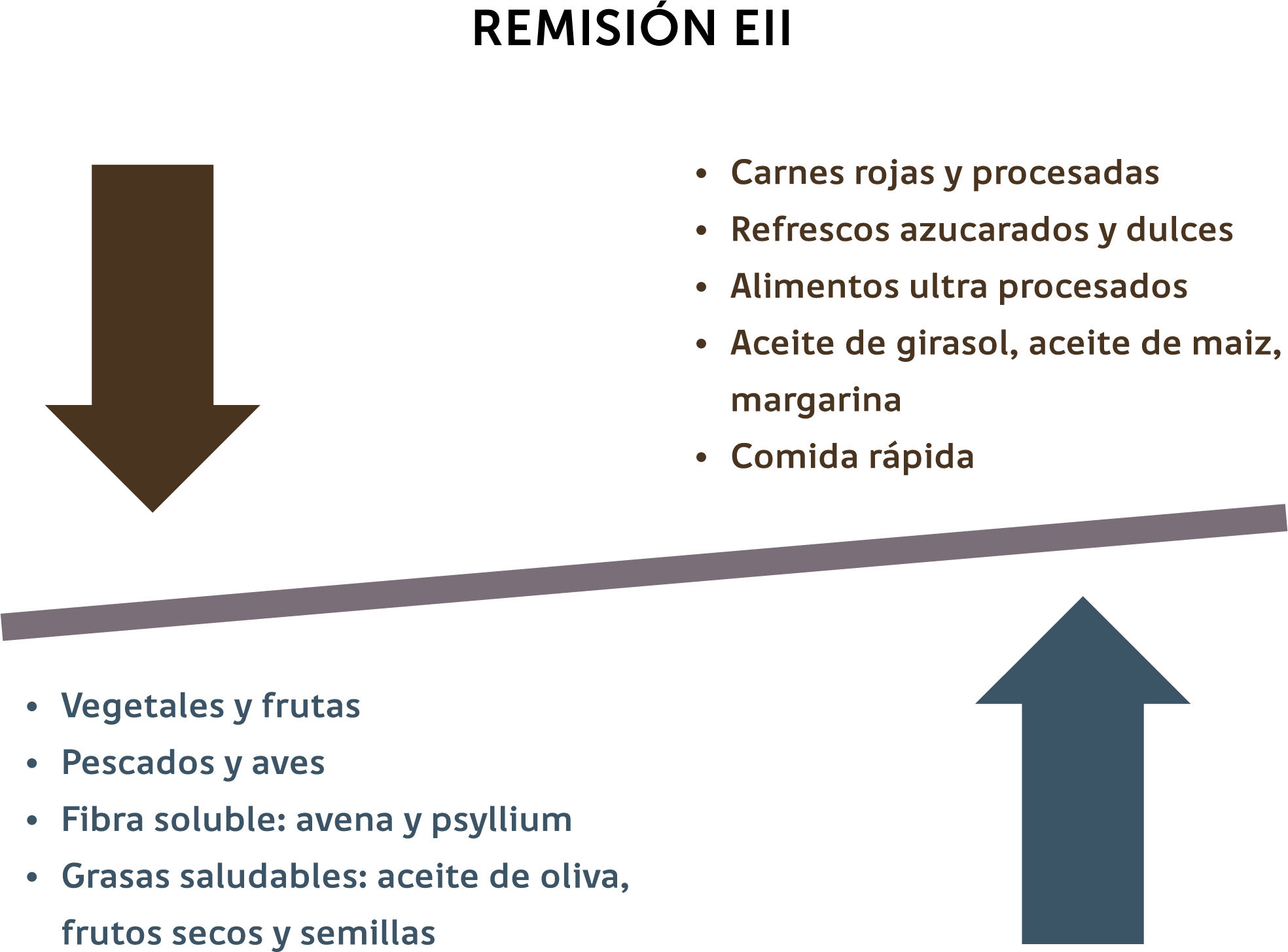
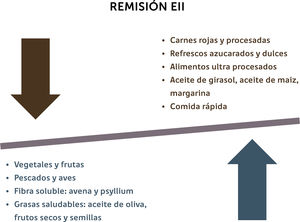
V. Rol de la dieta en períodos de remisiónLa mantención de un buen estado nutricional y el reemplazo de las pérdidas nutricionales representan los principales objetivos de un tratamiento eficaz40. Por ende, se debe alentar a los pacientes a consumir una dieta con un elevado contenido de fibra, especialmente aquella proveniente de frutas y verduras y evitar el consumo de AG omega-6, AG trans, carbohidratos refinados, en especial bebidas azucaradas y carnes rojas y procesadas (Figura 1)2.
Recomendaciones nutricionales para la mantención de la remisión en pacientes con EII
(Adaptada de Haskey N y cols)2.
El estilo de vida occidental se ha asociado con un aumento progresivo de diversas enfermedades metabólicas, autoinmunes y enfermedades inflamatorias crónicas, incluyendo la EII14. Los patrones de alimentación pueden contribuir a un mayor riesgo de incidencia de EII. Así, estudios señalan que aquellas personas que llevan un patrón de dieta occidental (gran consumo de carnes rojas y grasas) presentan un mayor riesgo de desarrollar EII. Y que aquellas que consumen una dieta rica en fibra, frutas y verduras, tendrían un menor riesgo de presentarla11,69.
La dieta juega un rol importante en la composición del microbioma intestinal y la modulación de la inflamación intestinal.
Aunque ésta no es el único factor ambiental que impacta a la susceptibilidad o la progresión de la EII, es uno de los factores que podría controlarse. Considerando que aún es escasa la evidencia que apoya el uso de algunas dietas en la inducción o mantención de la remisión en la EII, son necesarios estudios con una mayor calidad metodológica para poder hacer recomendaciones a este grupo de pacientes.
Declaración de conflicto de interésLos autores declaramos que no tenemos conflictos de interés.