La insuficiencia cardíaca constituye una prioridad esencial en el ámbito de la salud, tanto en Norteamérica como en Sud-américa, donde incluso se llega a las hospitalizaciones cuando el diagnóstico principal presenta condiciones graves. Hay una relación directamente proporcional entre prevalencia de insuficiencia cardíaca y edad. Sin embargo, la mortalidad por insuficiencia cardíaca está en declinación debido a los avances médicos, administración de medicamentos, e intervenciones no farmacológicas. Una de estas intervenciones es, el entrenamiento físico o el ejercicio, los cuales están siendo ampliamente aceptados por la comunidad médica como una opción viable en el manejo médico de pacientes con insuficiencia cardíaca permanente. Tanto los ejercicios aeróbicos como de fuerza han demostrado ser eficaces en este tipo de pacientes. Actualmente la evidencia no sólo respalda el ejercicio para mejorar o mantener la función física en pacientes con insuficiencia cardíaca, sino también la calidad de vida en general. Muchos estudios han demostrado que el ejercicio en la población mejora el carácter de las personas y el bienestar general reconocido por ellas mismas. Aunque los beneficios al miocardio producidos por el ejercicio pueden ser mínimos en pacientes con insuficiencia cardíaca, los beneficios periféricos que dan como resultado una mejor capacidad física y la conservación de la independencia son muy significativos. Basados en la evidencia científica existente en el ámbito del ejercicio y la insuficiencia cardíaca, los médicos que trabajan con esta población tienen la información necesaria para recomendar prescripciones de ejercicios. Actualmente, diversas declaraciones de puntos de vista médicos confirman el ejercicio como una modalidad segura y efectiva para pacientes con insuficiencia cardíaca.
La insuficiencia cardíaca (IC) se ha transformado en una preocupación creciente del cuidado de la salud y en una carga económica tanto en Norteamérica como en Sudamérica. El costo de tratamiento de la IC es cada vez más alto debido al mayor número de personas que vive con este problema. Se pronostica que los costos relacionados con IC llegarán a los US$ 44,6mil millones en los EE.UU. en 2015 (1). La IC se define como una presentación de síntomas clínicos multifacéticos que se deben a desorden funcional o estructural cardíaco que deteriora la capacidad del corazón para impulsar sangre o hacer que ésta llegue a todas partes. Los síntomas subjetivos de la IC son la disnea y la fatiga, que a su vez, atenúan la tolerancia al ejercicio y pueden causar retención de líquido. Finalmente esto conduce a un edema pulmonar o periférico (2). Las causas de la IC pueden deberse a deterioro de la función ventricular izquierda por anomalía en la arterias coronarias, miocardio-patía dilatada, hipertensión, cardiopatía congénita estructural, miocarditis, cardiopatía valvular, enfermedad reumática del corazón, infarto al miocardio, mal de Chagas, arritmias, o miocardiopatía idiopática.
Estos números están aumentados debido a una población que envejece y a una mayor sobrevida que sigue luego de que ocurren eventos cardíacos graves. Debido a la sobrevida que sigue a eventos cardíacos precoces, la incidencia de IC está aumentando, pero la mortalidad relacionada a IC está disminuyendo lentamente debido a mejores estrategias de intervención. Además de los avances de la tecnología médica y de la administración de medicamentos, el ejercicio se está transformando en una forma importante de manejar pacientes con IC con función ventricular izquierda no marcadamente deprimida.
Muchos estudios sobre ejercicios físicos han demostrado mejoría en la capacidad funcional (aeróbica) en pacientes con IC en forma similar a la observada en poblaciones sanas. Estudios sobre entrenamiento físico en pacientes con IC han demostrado mejorías de un 18% a 25% en consumo máximo de oxígeno, y 18% a 34% en la tolerancia al ejercicio, en donde las mediciones de clase funcional y calidad de vida también están mejorando (3). Estos datos y otros fueron proporcionados por el American College of Cardiology and the American Heart Association con el fin de reconocer el acondicionamiento físico en pacientes con IC como una intervención beneficiosa (4). Se han utilizado los ejercicios para tratar pacientes con IC porque se ha demostrado que otorgan tanto beneficios fisiológicos como psicológicos (5-7).
Incidencia y prevalenciaMuchos países revelan números cada vez mayores de personas con enfermedades al corazón e insuficiencia cardíaca. En los Estados Unidos se estima que se diagnostican más de 550.000 nuevos casos al año de IC, y más de cinco millones de personas viven actualmente con IC (8). En este mismo país, entre 1990 y 1999, las hospitalizaciones por IC como diagnóstico principal aumentaron de 810.000 a más de 1.000.000. Más aún, estos números llegaron a 3.600.000 cuando la insuficiencia cardíaca constituía un diagnóstico principal o secundario (9). La IC afecta al 2,4% de la población adulta y la incidencia va a aumentar con la edad a más del 7% en la población mayor de 75 años. El riesgo de por vida de desarrollar IC a la edad de 40 es 20% en las mujeres y 21 % en los hombres. La mortalidad por IC está disminuyendo mientras está aumentando la prevalencia de este mal. El aumento por ajuste por edad en IC que se observó en un estudio hecho en una comunidad (1996-2000) reveló una prevalencia de 29 por 10.000 mujeres y 38 por 10.000 hombres (8). La mortalidad por insuficiencia cardíaca ha disminuido de 57% entre 1979 y 1984 a 48% entre 1996 y 2000 (10). El factor que más influye en la prevalencia e influencia de IC, es el aumento de la población de edad avanzada. Se pronostica que el número de personas con diagnóstico de IC se duplicará entre el 2000 y el 2030 (9).
La tendencia en países sudamericanos revela que el número de personas con IC está alcanzando la cifra de Norteamérica y del Mundo Occidental. La coronariopatía en presencia de hipertensión y diabetes mellitus es la causa más común de IC en Sudamérica (11). En 2002, 1.524 admisiones de hospital en Brasil eran por IC, que representa aproximadamente 3% de todas las admisiones (12). En 2002, 6,9% del total de mortalidad en hospitales se debió a IC. Más aún, se estima que la prevalencia de IC en Sudamérica es aproximadamente 4% en la población mayor de 65 años. En 2003, la World Heart Failure Society, informó que aproximadamente 30.000 muertes se debían a IC dentro de las cuales la mayoría se producía en los mayores de 75 (13).
La IC lidera la causa de hospitalización en Sudamérica debido a coronariopatía, cardiopatía valvular, miocardiopatía dilatada idiopática, y cardiopatía chagásica. A la insuficiencia cardíaca se debe el 6,3% de todas las muertes en Sudamérica. La cardiopatía producida por el Mal de Chagas es una causa de insuficiencia cardíaca en muchos países latinoamericanos y se ha convertido en una crisis de salud y económica seria, y la mortalidad proveniente del Mal de Chagas relacionada con IC es alta. El Mal de Chagas generalmente se adquiere durante la infancia cuando el huésped es infectado con Trypanosoma cruzi. Esta enfermedad parasitaria se transmite a los humanos a través de heces de insectos infectados encontrados en áreas endémicas como zonas de vivienda rural (14). El énfasis en la prevención y tratamiento temprano del Mal de Chagas seguramente reducirá la incidencia de IC en los países sudamericanos (15).
Entrenamiento de ejercicio aeróbico en la insuficiencia cardíacaAdemás de un tratamiento médico tradicional y avanzado, la actividad física y el ejercicio son terapias bien organizadas para la IC y se ha demostrado que mejoran la función cardíaca, la calidad de vida y reducen los síntomas relacionados con IC. En personas con función cardíaca normal, la práctica del ejercicio aeróbico da como resultado una mejor función cardiovascular y mejor consumo de oxígeno así como una menor frecuencia cardíaca en reposo y un mayor doble producto. El mejoramiento en el consumo de oxígeno es el resultado de un aumento del desempeño cardíaco y una mayor extracción de oxígeno en los músculos que están trabajando. El mejor desempeño cardíaco resulta de un aumento en el llenado ventricular y el volumen latido. Hay un aumento en el tamaño del lecho vascular coronario y una mayor capacidad de las arterias coronarias para dilatarse. El volumen sanguíneo aumenta y la sangre es menos viscosa lo que disminuye la resistencia al flujo y aumenta la entrega de oxígeno.
El entrenamiento de ejercicio aeróbico para pacientes con IC generalmente se prescribe a un 70% u 80% de la frecuencia cardíaca lograda en el test de ejercicios. Esto se considera dentro de un rango de alta a moderada intensidad por lo que algunos pacientes no pueden ejercitar a este nivel y se beneficiarán con una intensidad más baja (16,17). Al igual que las personas con función ventricular izquierda normal, a los pacientes con IC se les recomienda ejercitar 30minutos o más por 5 días o más a la semana. Esto puede ser continuo o dividido en intervalos más cortos. Un estudio comparó el efecto del entrenamiento aeróbico con intervalos (AIT, por su sigla en inglés) con ejercicio continuo moderado con un máximo de frecuencia cardíaca de 60% a 70% en pacientes con IC (18). El grupo AIT desempeñó intervalos de tres a cuatro minutos de ejercicios de alta intensidad con un máximo de frecuencia cardíaca de 90% a 95%. El grupo AIT mostró un mayor consumo de oxígeno, mayor remodelamiento ventricular izquierdo inverso o un aumento en la fracción de eyección y una disminución del volumen del ventrículo izquierdo. Las funciones endotelial y mitocondrial también fueron impactadas en forma favorable con AIT. Estos cambios son importantes debido a que tanto la función endotelial como mitocondrial disminuyen con la edad.
La atrofia muscular ocurre tanto en el envejecimiento normal como en pacientes con insuficiencia cardíaca (IC). Esto contribuye a aumentar la intolerancia al esfuerzo, la morbilidad y la mortalidad. Un estudio reciente demostró que el ejercicio termina con la atrofia muscular y fomenta el desarrollo muscular en grupos de pacientes con IC menores de 55 años y mayores de 65. Antes y después de la intervención del ejercicio se obtuvieron biopsias del músculo vastus lateralis. Específicamente, el programa de ejercicios de cuatro semanas al 70% del consumo máximo de oxígeno redujo los niveles de MuRF-1 en 32,8% en pacientes menores de 55 (P=0,02) y en 37% (P<0,05) en aquéllos mayores de 65. Los autores concluyen que MuRF-1, un componente del sistema ubicuitina-proteasoma involucrado en la proteólisis del músculo, está aumentado en el músculo esquelético de los pacientes con IC. El entrenamiento físico da como resultado niveles reducidos de MuRF-1 sugiriendo así que bloquea la activación del sistema ubicuitina-proteasoma tanto en pacientes con IC jóvenes como mayores. También hubo una notable mejoría en el consumo de oxígeno luego del entrenamiento en ambos grupos (19).
Un estudio reciente llamado HF-ACTION incluyó a 2331 pacientes en 82 sitios de estudio en EE.UU., Canadá, y Francia. Este fue un estudio multicéntrico controlado aleatoriamente y diseñado para medir los efectos del ejercicio en los resultados clínicos de pacientes estables y con tratamiento médico óptimo con IC sistólica (fracción de eyección ventricular izquierda menor a 35%). Los pacientes recibieron ya sea el cuidado habitual o éste más un programa de entrenamiento físico. Este entrenamiento fue inicialmente supervisado y luego traspasado a un programa de ejercicios realizados en casa. La fracción de eyección ventricular izquierda (FEVI) promedio fue 25%, la edad promedio de los pacientes era 59 años, y un tercio correspondía a mujeres. El programa de ejercicios progresaba gradualmente, con un objetivo de 3 sesiones de 30minutos de ejercicios 3 veces por semana. El grupo de pacientes trabajaba a una intensidad moderada que correspondía al 60% o 70% de su frecuencia cardíaca. Al cabo de 18 sesiones, el grupo fue traspasado al programa de ejercicios en casa, con un objetivo de 40 minutos 4 veces por semana en bicicleta estática o trotadora. A los pacientes se les hizo seguimiento por un promedio de 2 años y medio. Los investigadores descubrieron que gracias al ejercicio el riesgo de hospitalización o mortalidad se redujo en un 11 % (p=0.03). Al examinar una variable de valoración secundaria de este estudio, el grupo de ejercicio demostró tener un 15% menos de riesgo de mortalidad por enfermedades cardiovasculares y hospitalización debido a complicaciones por IC (p=0.03).
La pérdida de capacidad física en la insuficiencia cardíaca está bien documentada y está relacionada con dificultades en el desempeño de actividades tanto en momentos de ocio como en la vida diaria. En parte debido a una disminución de la tolerancia al ejercicio físico (21). Los pacientes con IC tienen dificultades para desempeñar actividades de la vida diaria en donde generalmente se emplean más las extremidades superiores que las inferiores. La dificultad para desarrollar actividades de la vida diaria es un factor importante porque disminuye la calidad de vida de aquéllos con IC. En individuos con insuficiencia cardíaca, el entrenamiento físico puede aumentar la resistencia física (22) y se ha demostrado no en todos pero sí en algunos estudios que mejora la calidad de vida relacionada con la salud (17, 23-27). Las razones de incongruencia entre estudios puede estar relacionada a cómo los sujetos entrenan (protocolos de extremidades superiores vs. extremidades inferiores) e intensidades de los programas de ejercicios.
Entrenamiento físico de las extremidades superioresLos estudios científicos han demostrado que el entrenamiento físico en sujetos con disfunción ventricular izquierda es seguro y eficaz. Los beneficios funcionales se relacionan con mejorías en el músculo esquelético así como con cambios en la dinámica cardíaca (5, 6). Sin embargo, gran parte de los estudios de investigación previos utilizaron programas de ejercicios de corta duración (3 a 12 semanas) e incluyeron, en su mayoría, entrenamiento físico de las extremidades inferiores. Hay menos estudios que respaldan una mejoría de la función ventricular izquierda cuando el programa de entrenamiento físico es de mayor duración o más intenso. Además, en muchos estudios se han recomendado más los ejercicios de extremidades inferiores que los de extremidades superiores.
Basado en la evidencia previa, se realizó un estudio que utilizaba un ergómetro de brazo en pacientes con IC (28). Los investigadores llegaron a la hipótesis de que el entrenamiento ergométrico del brazo sería beneficioso en reducir la intolerancia a los ejercicios durante actividades que requirieran un trabajo sostenido del brazo. Debido a que la mayoría de las actividades de la vida diaria involucran las extremidades superiores, el entrenamiento ergométrico del brazo sería beneficioso para este grupo. Los sujetos tenían 3 meses de sobrevivencia a un infarto al miocardio, estaban estables y sometidos a farmacoterapia. Se reclutaron diez sujetos con FEVI promedio de 30+6 Clase ll-lll de NYHA (Tabla 1) (29).
Clasificación funcional de insuficiencia cardíaca según la nyha
| CLASIFICACIÓN SEGÚN NYHA | SÍNTOMAS DEL PACIENTE |
|---|---|
| I | Enfermedad cardiovascular reconocida sin limitaciones de actividad física. La actividad física regular no da como resultado fatiga excesiva, disnea, palpitaciones o angina. |
| II | Enfermedad cardiovascular reconocida con leves limitaciones de la actividad física. Los pacientes se sienten cómodos en reposo pero pueden experimentar algún tipo de fatiga, disnea, palpitaciones, o angina durante actividad física moderada. |
| III | Enfermedad cardiovascular reconocida con notorias limitaciones de la actividad física. Los pacientes se sienten cómodos en reposo pero experimentan fatiga, disnea, palpitaciones, o angina durante actividad física leve. |
| IV | Enfermedad cardiovascular reconocida con síntomas de insuficiencia cardíaca en reposo. Cualquier actividad física resulta altamente inconfortable. |
A los sujetos se les entregó el Cuestionario de Minnesota “Cómo Vivir con Insuficiencia Cardíaca”, Minnesota Living with Heart Failure Questionnaire y Medical Outcomes Study Short Form-36, y pruebas cardio-pulmonares con ergómetro del brazo y sintomatología limitada con ecocardiografia. Luego del test ergométrico del brazo, los sujetos fueron reclutados para rehabilitación cardíaca durante 12 a 15 semanas. El entrenamiento de los brazos se realizó durante 40 minutos 3 veces por semana utilizando un ergómetro de brazo NuStep® y una bicicleta estática Airdyne®. La frecuencia cardíaca ideal fue 75%-85% del ritmo cardíaco máximo en las pruebas de ejercicios de base. Seis hombres y una mujer de edad promedio 68+4 años completaron el estudio. Tres sujetos se salieron debido a problemas de salud no relacionados con el protocolo de entrenamiento físico o por empeoramiento de insuficiencia cardíaca. El entrenamiento con ergómetro de brazos aumentó la duración del test del ejercicio de brazos en aproximadamente un 22% (p=.008), (Cohen d=1.5). La FEVI ecocardiográfica en reposo no se modificó. La FEVI en ejercicio máximo no mostraron diferencias significativas (p=. 16) pero el d=0.53 de Cohen mostró una mejoría moderada.
El puntaje total promedio del Cuestionario de Minnesota “Cómo Vivir con Insuficiencia Cardíaca” mejoró después de la intervención (p=.02, d=1.1 de Cohen), y seis de siete participantes mostraron una diferencia clínicamente significativa de más de cinco puntos. El puntaje total del Formulario 36 del Estudio Corto de Resultados Médicos mantenerlo en inglés), mostraron que 5 sujetos tuvieron un cambio en puntajes que iban de los 3 a 13 puntos en la escala de 100 puntos (p=.05, d=.5 de Cohen). Se observaron mejorías significativas en la limitación inicial de jugar roles debido a la mejoría de la capacidad física. (p=.04, d=1.0 de Cohen). Las mejoras en la calidad de vida total y en la duración del ejercicio sin un cambio nocivo en la FEVI son alentadoras para el uso de entrenamiento físico de brazos en pacientes con IC. Para definir el modo y la duración específica del entrenamiento en pacientes con IC justifica mayor investigación.
Ejercicios de fuerzaLos síntomas distintivos de insuficiencia cardíaca son disnea, fatiga, e intolerancia al ejercicio. Cada vez hay más evidencia que respalda la disfunción del músculo esquelético (reducciones de la masa del músculo esquelético, de la fuerza, y de la resistencia) como contribuyente de la intolerancia al ejercicio y a la fatiga de los pacientes con IC. Además, el grado de disfunción del músculo esquelético en los pacientes con IC, impacta negativamente la movilidad funcional, que a su vez disminuye la capacidad de desempeñar actividades de la vida diaria, disminuye la calidad de vida, y el pronóstico de enfermedades.
La masa y fuerza del músculo esquelético están correlacionadas significativamente con la capacidad de ejercicio en pacientes con IC y pueden predecir en forma independiente la sobrevida en pacientes con IC severa (30-34). Harrington y colaboradores (32) clasificaron 100 pacientes con IC de acuerdo a cuán limitados estaban para hacer ejercicios, según el VO2 máximo enml/kg/min; leve 24,7ml/kg/min, moderada 17,4ml/kg/min, y severa 12,2ml/kg/min. La fuerza muscular, el área de la sección transversal del cuádríceps, y el área de la sección transversal total del muslo estaban disminuidas proporcionalmente a la intolerancia al ejercicio. Izawa y colaboradores (33) descubrieron disminuciones significativas en el VO2 máx. en pacientes con IC a medida de que la clase funcional de la NYHA progresó de la clase I a la clase III (23.4, 19.6 y 14.7ml/kg/min respectivamente) (Tabla 1). Cabe hacer notar que se observó que tanto la fuerza muscular de las extremidades superiores como inferiores predecían el VO2 máx. en estos pacientes. Hulsmann y colaboradores (31) informaron que la fuerza de los músculos flexores de la rodilla era superior al VO2 máx. y a la carga de trabajo como predictor de mortalidad en pacientes con IC grave (FEVI 21%) destacando la importancia de las actividades de fuerza muscular.
Las mediciones de la calidad de vida en pacientes con IC disminuyen significativamente a través de la clasificación funcional de NYHA y ésta a su vez se reduce significativamente cuando se la compara con un grupo de referencia sano (35). Los cambios en la calidad de vida de pacientes con IC pueden explicarse mejor por capacidad de ejercicio (test de marcha de seis minutos y VO2 máx.) que por FEVI (35). Además, las actividades de la vida diaria y la calidad de vida pueden predecir en forma independiente la mortalidad y hospitalizaciones relacionadas con IC (36). Como se mencionó anteriormente, realizar actividades de fuerza muscular cumple una función importantísima en la optimización de la capacidad del ejercicio en pacientes con IC y por lo tanto debiera impactar positivamente las actividades de la vida diaria, la calidad de vida, la mortalidad y hospitalizaciones relacionadas con insuficiencia cardíaca.
El entrenamiento de la fuerza ha sido tradicionalmente la modalidad de ejercicio elegida para disminuir la pérdida tanto de masa como de fuerza del músculo esquelético y facilitar la hipertrofia muscular y la aptitud anaeróbica tanto en poblaciones sanas como con insuficiencia cardíaca. Por lo tanto, el entrenamiento de fuerza está ganando aceptación como terapia adjunta al ejercicio aeróbico en pacientes con IC estable a los cuales se les haya indicado terapia de ejercicios. Lamentablemente, algunos informes preliminares que daban cuenta de una considerable carga de presión aplicada sobre el corazón de jóvenes sanos que realizaban un ejercicio de fuerza o estático máximo hizo que muchos médicos no consideraran esta intervención en los programas de rehabilitación de pacientes con IC (37). Las preocupaciones iniciales eran que el entrenamiento de fuerza podría deteriorar más la estructura y función ventricular izquierda. Se han identificado diversos factores en la prescripción del entrenamiento de la fuerza que influyen en la magnitud de la carga de presión (38).
- 1)
La magnitud de la carga en relación a una repetición máxima (1-RM). La carga de presión aumenta a medida de que la carga aumenta hacia el peso máximo que un individuo puede levantar en una sola repetición. Ejemplo: Si la 1-RM de un paciente es 100 libras, la carga de presión será mayor cuando levante 100 libras una sola vez que cuando levante un peso sub-máximo (60 libras) una sola vez.
- 2)
El número de repeticiones relativo a un máximo de repetición múltiple. La carga de presión aumenta a medida de que el levantador de peso se acerca a la fatiga de voluntad con repeticiones múltiples. Ejemplo: Si un paciente puede levantar 60 libras 20 veces seguidas antes de la fatiga, la carga de presión será mayor durante la vigésima repetición que durante la décimo quinta.
- 3)
El volumen de masa muscular que se contrae. Los ejercicios de entrenamiento de la fuerza de ambas extremidades crean una mayor carga de presión que los ejercicios unilaterales. Dos músculos que se contraen al mismo tiempo crean una mayor carga de presión que un músculo que se contrae a la misma intensidad relativa.
- 4)
Duración de la contracción muscular relativa al resto entre repeticiones y períodos de ejercicio. Cuando el descanso entre sets es corto, los sets subsiguientes de la misma carga de trabajo relativa aumentará la carga de presión. Por lo tanto, se recomienda que el descanso entre sets sea de 1:2 respecto al ejercicio. Ejemplo: Si un set de 10 repeticiones toma un minuto completarlo, el período de descanso antes del ejercicio subsiguiente deberá ser al menos de 2 minutos.
Recientemente, se han desarrollado protocolos de ejercicios de fuerza leve a moderada que minimizan la carga de presión y que han sido bien tolerados por pacientes diagnosticados con IC (38-40). Claramente la implementación de programas de ejercicio en el tratamiento y rehabilitación de pacientes con IC es una práctica en desarrollo. De hecho, en los últimos 10 años orientaciones profesionales recomendadas por el American College of Sports Medicine (41), la Asociación Estadunidense del Corazón (42), la Asociación de Insuficiencia Cardíaca y la Sociedad Europea de Cardiología (43), y la Ciencia de los Deportes y Ejercicios de Australia (44) han apoyado la implementación de ejercicios de entrenamiento de la fuerza en el tratamiento y rehabilitación de pacientes con IC. Se han publicado declaraciones de posturas específicas que detallan prescripciones de ejercicios de entrenamiento de fuerza para pacientes con IC (43-44).
Intervenciones en el entrenamiento de la fuerza en pacientes con ICLos hallazgos de investigaciones recientes son que los programas de entrenamiento de la fuerza diseñados adecuadamente en pacientes con IC no tienen un impacto negativo en la función o estructura ventricular izquierda. Más aún, el entrenamiento de la fuerza es bien tolerado por pacientes con IC (43-45). Se observó que -luego de un protocolo estructurado de entrenamiento de la fuerza que duró 8 semanas y que involucró a 10 pacientes hombres de las clase II o III de NYHA que realizaron 2 series de 12 repeticiones al 60% de 1-RM tres veces por semana- hubo mejoría significativa en FEVI (pre 32% vs. post 37%) y volumen expulsivo (pre 46ml/latido vs. post 53ml/latido) (45). En una revisión realizada por Smart y Marwick (45) de 81 estudios de ejercicios en pacientes con IC reportaron que no había muertes relacionadas con el ejercicio en más de 60.000 horas-paciente de ejercicios (30% de estos estudios incluyeron entrenamiento de la fuerza ya sea separadamente o en combinación con ejercicio aeróbico).
Se han encontrado mejorías en la fuerza muscular y resistencia aeróbica, que a menudo exceden el 20% y 30%, en intervenciones con entrenamiento de la fuerza en pacientes con insuficiencia cardíaca (5, 6). El entrenamiento de la fuerza ha atenuado en forma consistente la pérdida de masa muscular con la edad o enfermedades relacionadas en pacientes con IC, y la evidencia demuestra que hay aumento en la masa corporal magra. Feiereisen y colaboradores (47) designaron aleatoriamente 45 hombres y mujeres con IC clase II y III del NYHA (Tabla 1), con FEVI <35% ya sea en un grupo con entrenamiento de fuerza que realizaban 4 series de 10 repeticiones al 60 o 70% de 1-RM, en un grupo de entrenamiento aeróbico que realizaba ejercicios de bicicleta o trotadora al 60% o 75% VO2 máx., o una combinación de entrenamiento de fuerza y entrenamiento aeróbico. Todos los sujetos desempeñaron 40 sesiones de ejercicios que duraban 40 minutos cada uno. Quince pacientes con IC que no pudieron asistir a las sesiones de ejercicios debido a razones geográficas fueron usados como controles. Se registraron ganancias significativas en fuerza sólo en los grupos que incluían entrenamiento de la fuerza sólo o combinado. Se observó mejoría significativa en la masa del músculo cuádríceps, el VO2 máximo, la FEVI, el volumen sistólico final ventricular izquierdo, el volumen diastólico final ventricular izquierdo y la calidad de vida en los tres grupos de entrenamiento. No se observaron cambios en estos parámetros en los controles.
Las intervenciones en el entrenamiento de la fuerza en pacientes con insuficiencia cardíaca han tenido como resultado mejoras significativas en la calidad de vida de los pacientes. Edelmann y colaboradores (48) estudiaron a 64 sujetos entre hombres y mujeres, pacientes de la clase funcional II y III de NYHA (Tabla 1) cuya edad promedio era de 65 años. Se eligieron al azar 44 pacientes que fueron asignados a: un grupo de entrenamiento de ejercicios de 32 sesiones que incluía tanto entrenamiento de fuerza (una serie de 15 repeticiones al 60%-65% de 1-RM de 6 ejercicios diferentes para brazos y piernas dos veces por semana) como entrenamiento aeróbico (bicicleta dos o tres días a la semana del 50% al 70% del VO2 máx.) o el grupo de control de cuidados habituales.
Tanto el Formulario Corto (36) del Estudio de Resultados Médicos como el Cuestionario de Minnesota “Cómo Vivir con Insuficiencia Cardíaca” mostraron mejorías significativas. No se encontraron progresos en la calidad de vida del grupo de control.
En IC el rol primario es del ejercicio aeróbico y éste no debe ser descontinuado; la inclusión del ejercicio de la fuerza dinámico como modalidad de ejercicio secundario y complementario es en la actualidad ampliamente reconocida en las indicaciones de tratamiento para pacientes con insuficiencia cardíaca.
En todo caso, es necesario tomar ciertas precauciones al adoptar ejercicios de entrenamiento de la fuerza en pacientes con insuficiencia cardíaca:
- 1)
Los pacientes deben ser clínicamente estables y haber demostrado tolerancia al ejercicio aeróbico antes de comenzar con el entrenamiento de fuerza.
- 2)
La intensidad del entrenamiento de la fuerza debe ser individualizada.
- 3)
Se debe comenzar lentamente y el progreso debe ser gradual.
- 4)
Controlar ECG, presión arterial, empleo de fuerza percibida, y el peso corporal.
- 5)
Estar informado de posibles indicaciones de que la gravedad de la insuficiencia cardíaca pueda haber cambiado.
- 6)
El entrenamiento de la fuerza generalmente es contraindicado para pacientes con insuficiencia cardíaca Clase IV de NYHA (Tabla 1).
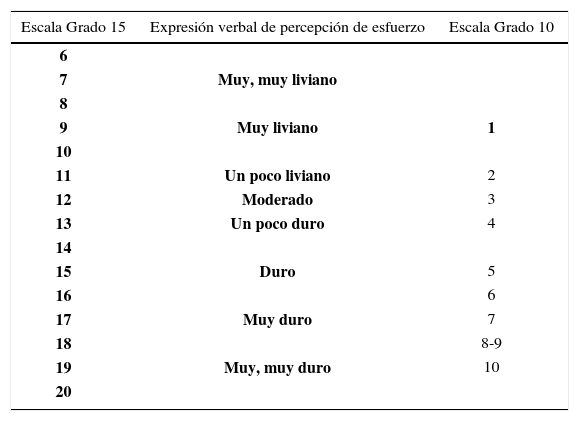
Generalmente, las cargas iniciales de entrenamiento de la fuerza deben ser livianas, en donde los pacientes completen 6 a 15 repeticiones, sin cansarse (10 a 13 en los 6 a 20 de la escala de Borg de percepción de ejercicio), de ejercicios dirigidos a los músculos superiores e inferiores del cuerpo uno o dos días por semana. El ritmo del ejercicio debe ser lento, dejando al menos el doble de tiempo para descanso/recuperación en comparación con las fases de trabajo/contracción. Comenzar con ejercicios unilaterales puede aumentar la tolerancia al entrenamiento de fuerza. Carga y frecuencia pueden aumentar progresivamente con el tiempo hasta lograr un nivel de empleo de la fuerza de 11 a 15 (6 a 20 en la escala de Borg) y dos a tres días por semana. Para mayor detalle de prescripción de ejercicios, ver la publicación de Braith y colaboradores (38). Un ejemplo que integra el grado 15 y 10 de los índices de Borg puede encontrarse en la Tabla 2 (49).
Grado 15 y grado 10 del índice de percepción de esfuerzo (RPE) de la escala de borg
| Escala Grado 15 | Expresión verbal de percepción de esfuerzo | Escala Grado 10 |
|---|---|---|
| 6 | ||
| 7 | Muy, muy liviano | |
| 8 | ||
| 9 | Muy liviano | 1 |
| 10 | ||
| 11 | Un poco liviano | 2 |
| 12 | Moderado | 3 |
| 13 | Un poco duro | 4 |
| 14 | ||
| 15 | Duro | 5 |
| 16 | 6 | |
| 17 | Muy duro | 7 |
| 18 | 8-9 | |
| 19 | Muy, muy duro | 10 |
| 20 |
Finalmente, los médicos también necesitan considerar el doble producto (frecuencia cardíaca χ presión arterial sistólica), que es un indicador de la demanda de oxígeno miocárdica. Debe evitarse cualquier combinación de presión arterial sistólica y frecuencia cardíaca que resulte en un doble producto elevado y que produzca síntomas al paciente. Por ejemplo, nuestro paciente en estudio mostró síntomas de angina a un doble producto de 24.000 (160mmHg χ 150 Ipm). Este mismo paciente también sufrirá de angina cuando sus respuestas de presión arterial sistólica y frecuencia cardíaca sean de 136mmHg y 177 Ipm, respectivamente. Esto es importante porque diversas modalidades de ejercicios producen diferentes respuestas hemodinámicas. El doble producto también es un buen indicador de progreso del entrenamiento físico. Un doble producto más bajo en una carga de trabajo previa similar indica una mejoría en la capacidad funcional. Un doble producto más alto, en cambio, indica una menor capacidad funcional, o cuando se trata de una enfermedad cardíaca isquémica, avance de la enfermedad. El doble producto es una excelente herramienta clínica no invasiva.
Caso clínicoHombre de 59 años que solía trabajar como carnicero en una carnicería de barrio de Santiago de Chile. Tuvo un infarto al miocardio en mayo de 2012 que resultó en insuficiencia cardíaca con una fracción de eyección ventricular izquierda del 32% (Clase II de NYHA). En agosto de este año se encuentra estable con leve fatiga y disnea durante actividades de la vida diaria. Reporta tomar regularmente sus medicamentos cardiovasculares. Practica un poco de caminata en su barrio pero quiere aumentar su nivel de actividad física y retornar al trabajo. Su médico le indicó un test de esfuerzo para recetarle en forma más precisa los ejercicios que podría realizar. Se le aplicó una prueba de esfuerzo con protocolo de Bruce modificado con medición consumo de oxígeno y se obtuvieron los siguientes datos:
Tiempo de ejercicio: 11 minutos.
Frecuencia cardíaca en reposo: 68 latidos por minuto (Ipm).
Frecuencia cardíaca m áxima: 150 Ipm.
Respuesta de la presión arterial reposo/ejercicio: 130/80 a 160/90mmHg.
í ndice de Esfuerzo Percibido (Borg): 16
VO2máximo: 18ml/kg/min.
METs: 5.1 (3.5ml/kg/min =1 MET)
Doble Producto: 24.000 (en el ejercicio máximo).
La prueba de esfuerzo se detuvo por disnea, sin angina. El ECG fue no diagnóstico, mostró una depresión del segmento ST leve y no significativa.
Basándose en estos resultados, el médico de este paciente y su equipo le prescribieron el siguiente programa de ejercicios aeróbicos. Los ejercicios debían realizarse durante rehabilitación cardíaca tres días a la semana además de caminata a la casa dos o tres días semanalmente.
Programa de ejercicios de rehabilitación cardíacaEjercicios aeróbicosLa intensidad del ejercicio debe ser prescrita basada en la frecuencia cardíaca (fc) [entre 55% a 80% de la Reserva de Frecuencia Cardíaca (Rfc), el índice de Esfuerzo Percibido (Borg), y Consumo de oxígeno (VO2)[40% a 75% del V02max] o nivel de unidad metabólica (MET).
- •
Cálculo de Rfc=fc máxima0020-fc en Reposo = 150 –68 = 82Ipm.
- •
Determinación de la intensidad del ejercicio basada en la reserva de fc (Rfc × intensidad de entrenamiento + fc reposo).
- •
Cálculo del “nivel bajo” de la intensidad del ejercicio usando Rfc: (82×55%+68) =113 Ipm.
- •
Cálculo del “nivel alto” de la intensidad del ejercicio usando Rfc: (82×80%+68)=134 Ipm.
- •
Intensidad del ejercicio prescrita basada en Rfc = obtener y mantener frecuencia cardíaca del ejercicio entre 113 y 134 Ipm.
- •
Alternativamente, la escala de Borg o MET pueden usarse para prescribir intensidad de ejercicios en pacientes con Rfc inapropiada o inadecuada (ejemplo, beta bloqueadores o con fibrilación auricular).
- •
Borg de 11 a 14 (bastante leve a algo pesado).
- •
Cálculo de la intensidad del ejercicio basado en VO2 máx. o nivel MET: 40 a 75% de VO2 máx. = 7 a 13 ml/kg/min o aproximadamente 2 a 4 METs.
- •
Intensidad del ejercicio aeróbico recetada: 113 a 134 Ipm, Borg de 11 a 14, o 2 a 4 METs. Las cargas de trabajo se ajustarán periódicamente para mantener la intensidad prescrita (a medida de que el paciente se acondicione físicamente, las cargas de trabajo previas resultarán en una menor frecuencia cardíaca de entrenamiento y un nivel de esfuerzo percibido más bajo).
Duración del ejercicio — Inicialmente 10 a 20 minutos aumentando gradualmente hasta 40 a 60 minutos si el paciente demuestra tolerancia. Modo - Caminata sobre trotadora, bicicleta estática, elíptica, ergómetro de brazo, remoergómetro, etc. El paciente es instado a dividir sus ejercicios aeróbicos entre múltiples modalidades. También se le aconseja que use modalidades que incorporen el ejercicio de brazos que lo prepararán para el retorno al trabajo.
Enfriamiento - Cinco minutos de caminata lentaEl ejercicio aeróbico puede realizarse en forma continua o con pequeños descansos dependiendo de los síntomas y preocupándose que permanezca dentro de los rangos objetivos de intensidad.
Programa de Caminata a Casa1ay 2a semana -Caminar 800 metros en 10 minutos 2 veces al día*.
3a y 4a semana - Caminar 1600 metros en 20 minutos 2 veces al día*.
5a y 6a semana - Caminar 2400 metros en 30 minutos 2 veces al día*.
7a y 8a semana - Caminar 3200 metros en 40 minutos*.
9a semana en adelante - Continuar con la caminata durante 30 - 60 minutos 2 o 3 días a la semana a una velocidad de 15 minutos por kilometro o más rápido si puede (puede realizar intervalos o tandas continuas de caminata)*.
*Si presenta mareos, disnea, angina o palpitaciones cardíacas irregulares, detenga el ejercicio e informe estos síntomas a su equipo médico. La caminata deberá hacerse sin pendiente.
Ejercicios de fuerzaUna vez demostrada la tolerancia al ejercicio aeróbico, se puede comenzar con el ejercicio de fuerza en tres pasos progresivos. Este ejercicio de fuerza deberá sumarse al ejercicio aeróbico.
- 1)
Período de instrucción (una a dos semanas): Al paciente se le muestran dos o tres ejercicios dinámicos de entrenamiento de la fuerza segmentados para grupos de músculos del cuerpo superior e inferior (cuatro a seis ejercicios en total) y se le da instrucciones de completar 5 a 10 repeticiones. La intensidad de los ejercicios debe ser liviana con un Borg de grado 10 en la escala de 1 5 grados (<30% 1 RM) (Tabla 2). Estos ejercicios deben hacerse dos o tres días por semana. El foco deberá estar en aumentar la coordinación del movimiento y chequear si hay limitaciones ortopédicas a través de todo el rango de movimiento del ejercicio.
- 2)
Período de entrenamiento de la fuerza y resistencia aer ó-bica (dos a cuatro semanas): La carga es aumentada gradualmente desde liviana (Borg de 10) a moderada (Borg de 12) y luego a un poco más pesada (Borg de 13) según se tolere (Tabla 2). Las repeticiones pueden ser de 8 a 15 por ejercicio. Éstas deben realizarse de una forma controlada (1 a 3 segundos en la fase concéntrica, 1 a 3 segundos en la fase excéntrica). Debe existir una relación ejercicio descanso de al menos 1:2 (si el paciente completa 10 repeticiones de entrenamiento dinámico de la resistencia en 1 minuto, permitir al menos dos minutos de recuperación antes de comenzar el próximo ejercicio). Estos ejercicios deben realizarse 2 o 3 días por semana. En ningún momento el paciente debe hacer un esfuerzo desmedido por completar una repetición con esta carga de trabajo.
- 3)
Período de entrenamiento espec ífico de la fuerza: La carga es aumentada gradualmente de algo pesado (Borg de 13) a pesado (Borg de 15) según lo tolere el paciente (Tabla 2). Las repeticiones pueden ser de 8 a 15 por ejercicio. Éstas deben realizarse de manera controlada (1 a 3 segundos la fase concéntrica, 1 a 3 segundos la fase excéntrica). Debe existir una relación ejercicio descanso de al menos 1:2. Se puede añadir un ejercicio o serie de ejercicios para los grupos de músculos corporales superiores o inferiores según lo tolere el paciente (seis a ocho ejercicios en total). Estos ejercicios deben realizarse 2 o 3 días por semana. En ningún momento el paciente debe hacer un esfuerzo desmedido por completar una repetición con esta carga de trabajo. Ini-cialmente, el médico deberá chequear la respuesta de la presión arterial al entrenamiento de la fuerza para asegurar estabilidad hemodinámica para este tipo de ejercicio. La presión arterial deberá hacerse chequearse periódicamente.
Los ejercicios de elongación para los grandes grupos de musculares deberán realizarse 2 o 3 días por semana durante 5 a 10 minutos por sesión según lo tolere el paciente.
Luego de 4 meses de adherencia al programa, el paciente fue referido para un test de esfuerzo con protocolo de Bruce modificado para evaluar sus progresos. Se obtuvieron los siguientes datos:
Tiempo de ejercicio: 14 minutos.
Frecuencia Cardíaca reposo a ejercicio m áximo: 64 a 145 latidos por minuto.
Respuesta de la presión arterial al ejercicio: 124/80 a 160/90 mmHg.
Borg: 17
VO2máx: 21ml/kg/min.
METs: 6 (3.5ml/kg/min = 1 MET).
Doble Producto: 23200
La prueba se detuvo por disnea, no hubo angina; los cambios en los segmentos de depresión ST fueron similares al test de ejercicios inicial. El médico estaba muy contento con los progresos del paciente y le recomendó continuar con su programa de ejercicios y que retornara al trabajo en un horario limitado de 4 horas diarias por 3 a 4 días a la semana.
Los autores queremos agradecer a Michael Ryan Richardson por su asistencia en el formateo de todas las citas y bibliografía de este manuscrito.
Los autores declaran no tener conflictos de interés, con relación a este artículo.