La vasectomía es un método anticonceptivo seguro con un porcentaje de fracasos de la técnica inferior al 1%. Pese a ello, el seminograma posvasectomía continúa siendo fundamental para asegurar el éxito de la técnica.
Tratamos de establecer el momento idóneo para hacer el primer seminograma y determinar la actitud ante aquellos pacientes con espermatozoides residuales inmóviles.
Material y métodosSe analizaron un total de 2.168 vasectomías realizadas entre el año 2010 y 2017. El primer seminograma se hizo a los 3 meses. Aquellos pacientes con azoospermia no siguieron más controles. Los pacientes con espermatozoides inmóviles (<100.000/ml o>100.000/ml) fueron considerados potencialmente fértiles y fueron seguidos con seminogramas mensuales hasta obtener la azoospermia.
ResultadosFinalmente, 1.807 pacientes fueron incluidos. De ellos, 1.297 presentaron azoospermia en el primer control a los 3 meses y 501 pacientes presentaron espermatozoides residuales inmóviles. De estos últimos, solo 24 pacientes presentaron concentraciones superiores a 100.000 espermatozoides/ml. En 9 pacientes se hallaron espermatozoides móviles.
Al final, el 100% de los pacientes con espermatozoides residuales inmóviles consiguió la azoospermia en un tiempo medio de 4,5 meses, con un rango de 4-10 meses, independientemente del número de espermatozoides inicial. El número medio de seminogramas realizados a cada paciente fue de 2,5 pruebas.
Los pacientes con espermatozoides móviles fueron reintervenidos.
ConclusiónTodos los pacientes con espermatozoides inmóviles en el primer seminograma, independientemente del número inicial, alcanzarán la azoospermia. Por lo tanto, los controles seriados hasta obtener un seminograma negativo son innecesarios.
Vasectomy is a safe and effective technique to achieve azoospermia, although the failure rate of the technique is less than 1%. Sterility is not immediate so the post-vasectomy seminogram continues o be essential to ensure the success of the technique. The aim of this trial is to establish the attitude when dealing with immobile residual sperm patients.
Material and methodsCross-sectional analysis of 2,168 vasectomies performed between January 2010 and March 2017. The first post-vasectomy seminogram was performed at 3 months. Those patients with azoospermia did not undergo further controls. Patients with immobile sperm (<100,000/ml o>100,000/ml) were considered potentially fertile and were followed with monthly seminograms until azoospermia was obtained.
ResultsOf a total of 1,807 patients were included; 1,297 of these had azoospermia at 3 months seminogram and 501 patients had immobile residual sperm. Only 24 patients of this last group showed more than 100.000 sperm/ml; 9 cases showed mobile sperm. All patients who presented immobile residual sperm underwent serial seminograms. Azoospermia was achieved in an average time of 4,5 months in a rage of 4-10 months, regardless of the initial sperm count. An average of 2,5 tests were performed on each patient. All of the patients with mobile sperm required a reintervention.
ConclusionAll patients with immobile sperm on the first post-vasectomy seminogram will achieve azoospermia regardless of the initial count. Therefore, serial controls until a negative seminogram is obtained are unnecessary.
La vasectomía constituye un método anticonceptivo seguro y eficaz en el varón, aunque la esterilidad no puede asegurarse inmediatamente tras el procedimiento quirúrgico. Por ello, el papel del seminograma posvasectomía es fundamental para confirmar el éxito de la técnica.
Pese a tratarse de un procedimiento sencillo, existe un riesgo de fracaso vinculado a la presencia de espermatozoides móviles que se estima inferior al 1%1. Algunos estudios mencionan la reaparición temporal de espermatozoides inmóviles hasta un año después de un seminograma posvasectomía negativo2. Por tanto, la adecuada información al paciente resulta fundamental desde el punto de vista médico-legal.
En la actualidad, el éxito de la vasectomía se describe como la presencia de azoospermia en el primer seminograma posvasectomía o un recuento de <100.000 espermatozoides inmóviles por eyaculado, tras uno o 2seminogramas consecutivos3,4.
La presencia de espermatozoides inmóviles en los seminogramas posvasectomía no es algo infrecuente: se ha descrito su persistencia en un 33% y un 10% a los 3 y a los 6 meses, respectivamente, según diferentes estudios5.
El objetivo de nuestro estudio es el de establecer el tiempo óptimo para la realización del primer seminograma posvasectomía y determinar la actitud ante aquellos pacientes con espermatozoides residuales móviles e inmóviles.
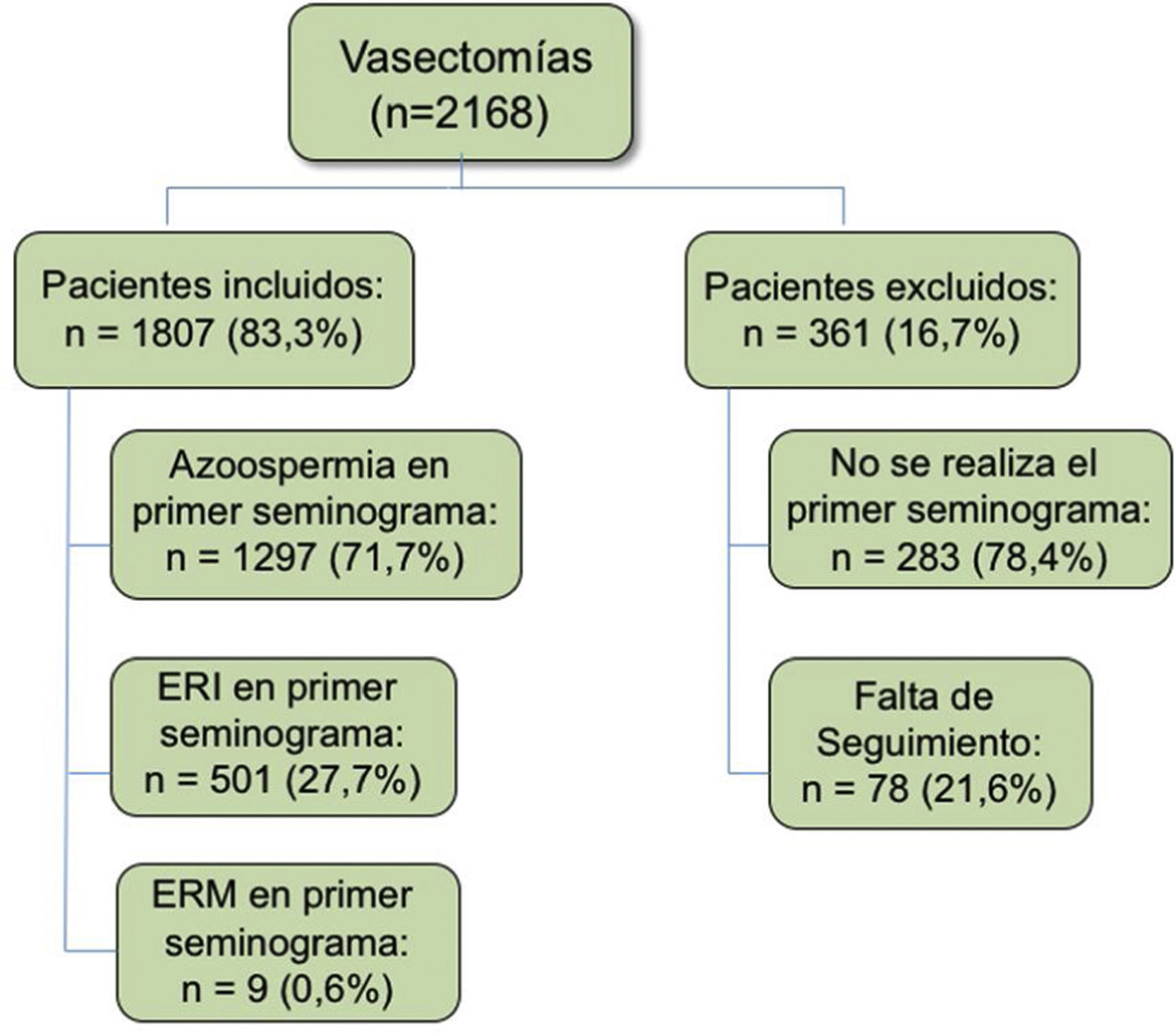
Material y métodosEfectuamos un análisis observacional, retrospectivo, de corte transversal de una serie de 2.168 vasectomías realizadas en nuestro centro entre enero de 2010 y diciembre de 2017 (fig. 1). La edad media de los pacientes fue de 39 años. Las vasectomías fueron efectuadas por diversos urólogos y residentes de nuestro servicio, aunque con uniformidad en la técnica. Bajo anestesia local se practica una incisión bilateral para exponer y seccionar los conductos deferentes. Se emplea una triple técnica de seguridad consistente en cauterización de conductos deferentes tras el corte, ligadura de conducto deferente e interposición fascial.
Todos los pacientes firmaron un consentimiento informado antes de la cirugía y recibieron instrucciones escritas sobre cuándo y cómo hacerse el primer seminograma de control. Las recomendaciones incluyen haber tenido al menos 25 eyaculaciones y un periodo de abstinencia mínimo de 48 h previo a la recogida de la muestra. La muestra debe ser completa y entregada en un tiempo inferior a una hora.
Para su análisis se obtienen 2alícuotas de semen diluidas 1:1 para obtener 2muestras de 10 μL. Si el recuento de espermatozoides en cada una de ellas coincide, se calcula la concentración. En caso contrario, se trabajará con otras 2muestras. No se centrifuga la muestra. El recuento se hace en una cámara de Neubauer Improve con amplificación óptica de 200 a 400 aumentos. Se hace un recuento de al menos 200 espermatozoides, para obtener un error en la muestra <7,1%. Si el recuento por cámara es menor de 25 espermatozoides, se informa como «muy pocos espermatozoides para una determinación adecuada de la concentración (menor de 56.000/ml)», según las recomendaciones de la Organización Mundial de la Salud6.
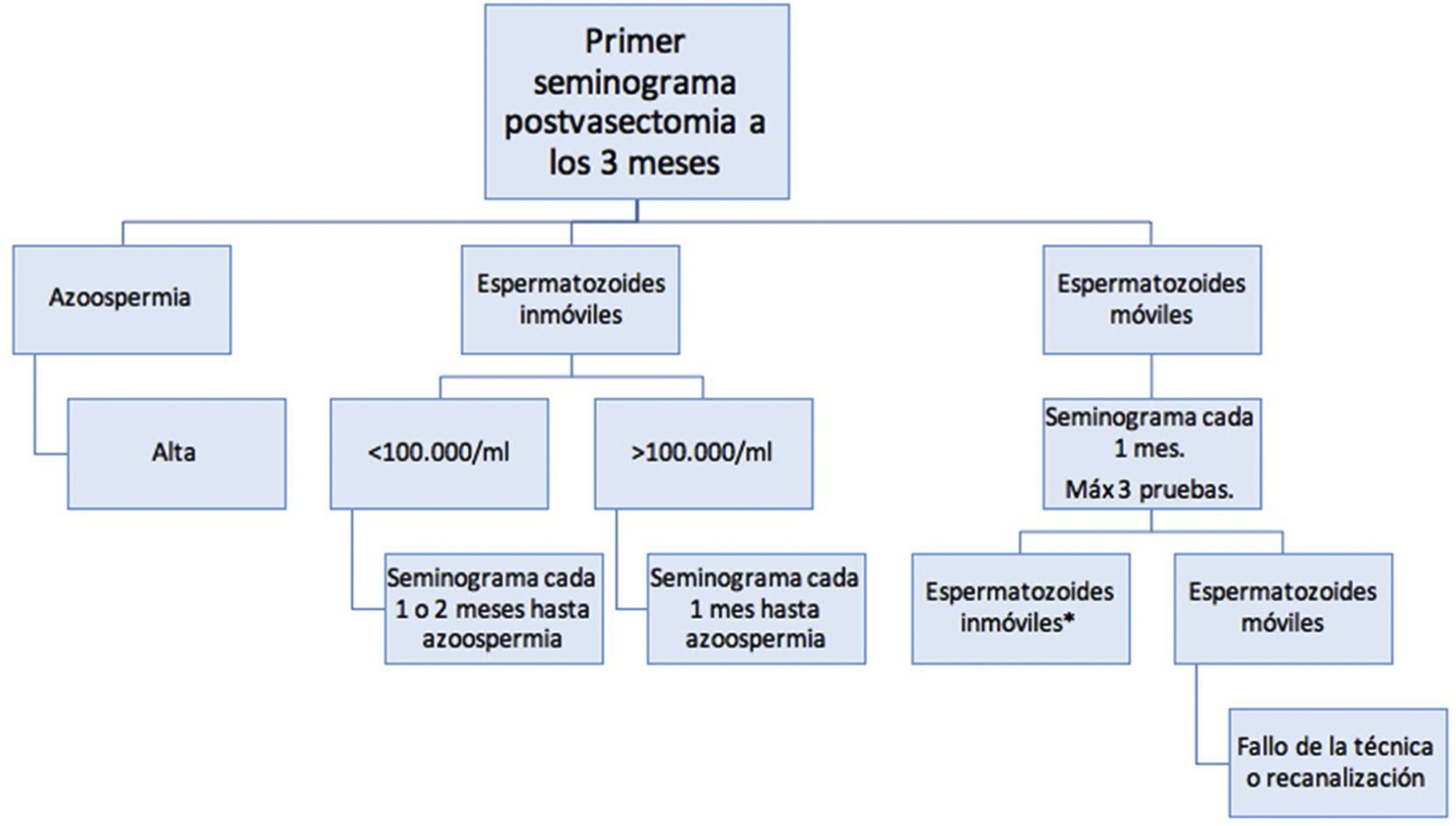
Definimos el éxito de la técnica como la presencia de azoospermia en la primera muestra de líquido seminal. Nuestro protocolo de seguimiento contemplaba un primer seminograma a los 3 meses de la vasectomía. Aquellos pacientes con espermatozoides residuales en el primer seminograma se clasificaron en función de si se trataba de espermatozoides móviles o inmóviles. Todos ellos fueron considerados como potencialmente fértiles, con independencia del número de espermatozoides inmóviles/ml (>100.000/ml o <100.000/ml).
En los pacientes con espermatozoides residuales inmóviles en el primer seminograma de control, se hicieron controles cada uno o 2meses hasta conseguir la azoospermia (fig. 2). En los pacientes con espermatozoides residuales móviles en el primer seminograma se hizo un control cercano consistente en seminogramas mensuales hasta un máximo de 3 pruebas, momento en el que se asumía el fracaso de la técnica.
ResultadosDe los 2.168 varones intervenidos durante el periodo del estudio, 361 pacientes (16,7%) fueron excluidos por no haber hecho un seguimiento completo en nuestro centro: 283 no se realizaron el primer seminograma y 78 perdieron el seguimiento en algún momento del estudio sin haber registrado la azoospermia. Esta pérdida se justifica por la movilidad de los pacientes entre áreas sanitarias.
Al final, 1.807 pacientes (83,3%) fueron incluidos en el análisis y se hicieron controles posvasectomía, cumpliendo un seguimiento posterior íntegro ajustado a nuestro protocolo.
De ellos, 1.297 (71,7%) pacientes presentaron azoospermia en el primer control, lo que confirmó el éxito de la técnica sin precisar posteriores controles. De aquellos pacientes con espermatozoides residuales, 501 (27,7%) presentaron espermatozoides inmóviles y tan solo 9 (0,6%) presentaron espermatozoides móviles (fig. 1). Por lo tanto, un 28,3% de las muestras se consideraron como potencialmente fértiles.
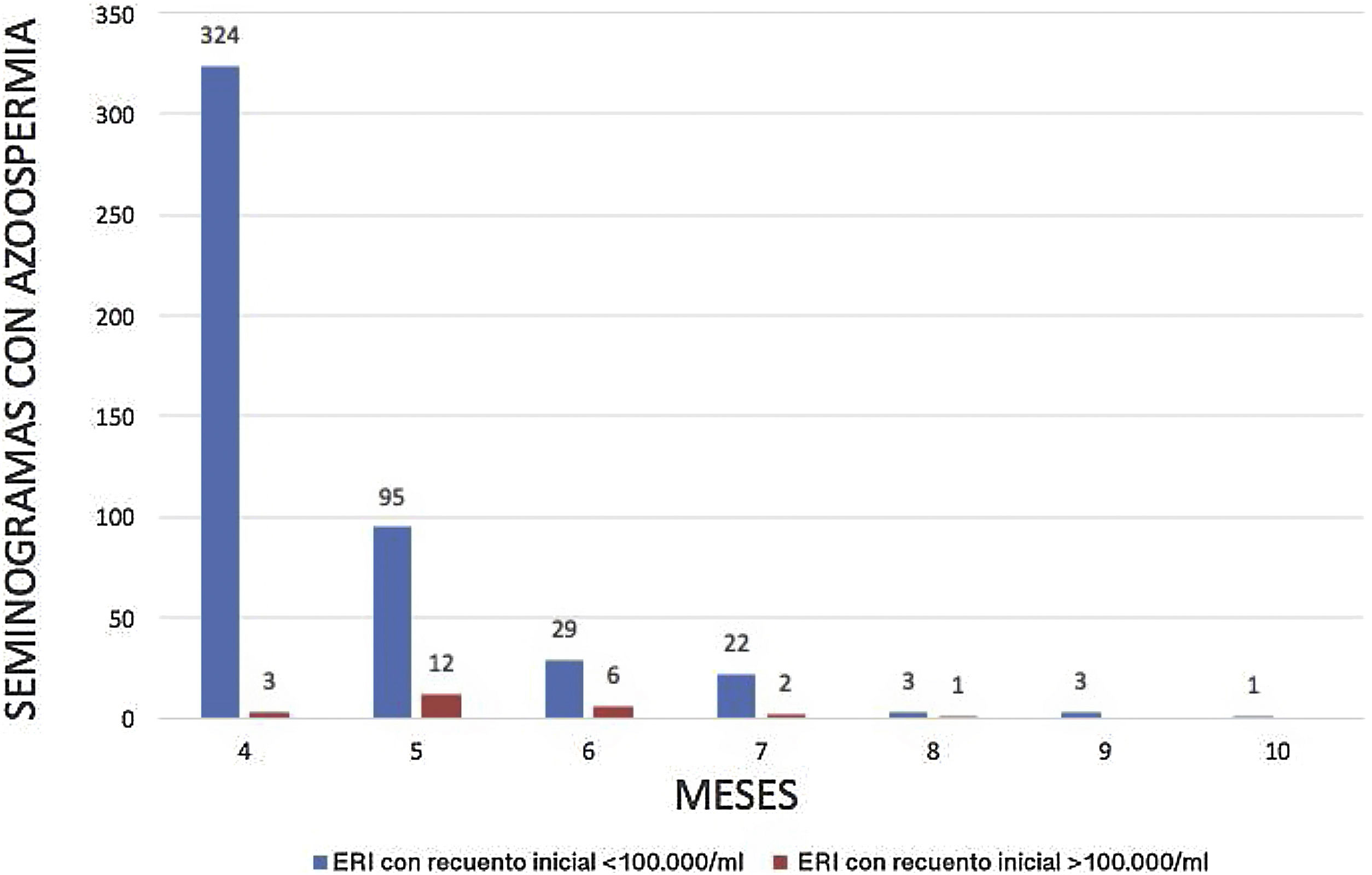
Los pacientes con espermatozoides residuales inmóviles se clasificaron en función del recuento de espermatozoides/ml: 477 pacientes presentaron un recuento <100.000 espermatozoides/ml y 24 (1,8%) pacientes>100.000/ml en el primer seminograma de control. Al final, el 100% de los pacientes consiguió la azoospermia en un tiempo medio de 4,5 meses, con un rango de 4-10 meses. El número medio de seminogramas realizados a cada paciente fue de 2,5 pruebas. El subgrupo de 24 pacientes con espermatozoides residuales inmóviles y un recuento> 100.000/ml registró un tiempo medio de 5,4 meses, con un rango de 3-8 meses y 3,4 pruebas hasta alcanzar la azoospermia. La figura 3 muestra el histograma con el número de seminogramas de los pacientes hasta lograr la azoospermia en cada uno de los 2subgrupos de pacientes con espermatozoides residuales inmóviles. En ningún caso se registró una cifra ascendente en el número de espermatozoides inmóviles de un seminograma previo a otro posterior.
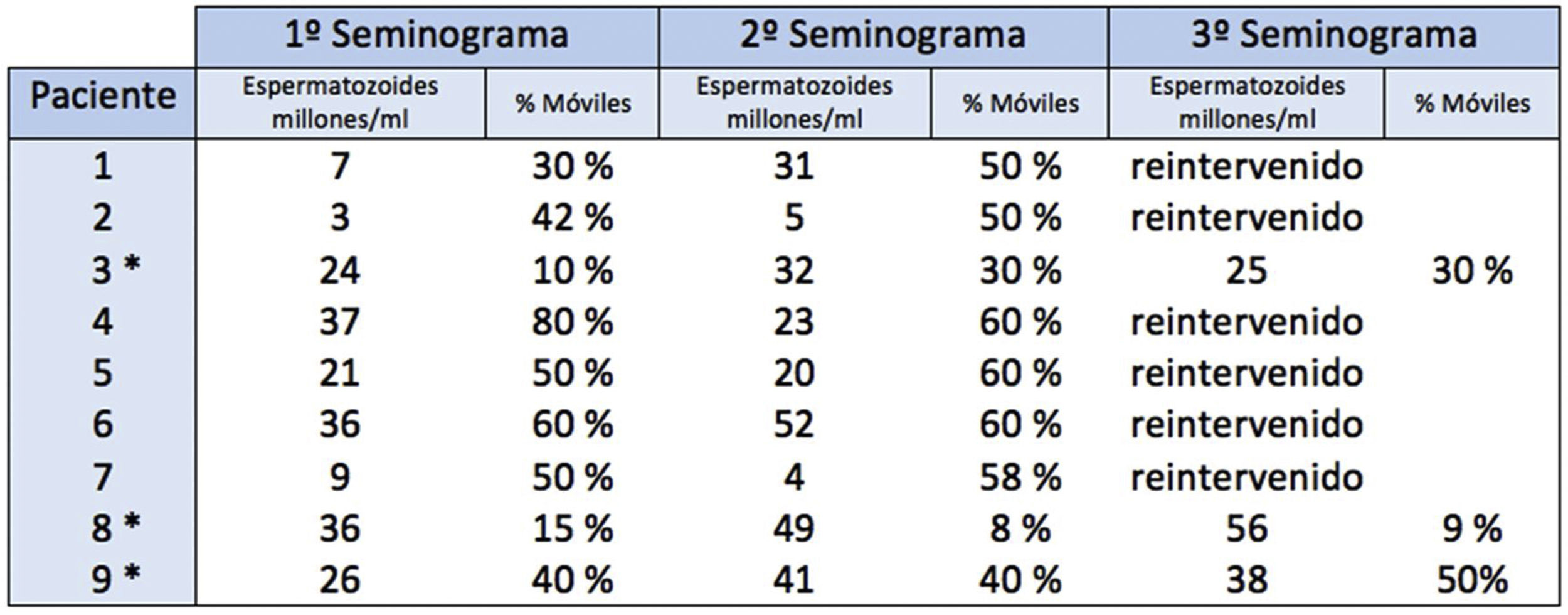
De los 9 pacientes con espermatozoides residuales móviles en el primer seminograma, ninguno registró azoospermia en controles sucesivos. La mayoría de ellos solo hicieron un segundo seminograma para confirmar los hallazgos del primero. En todos ellos persistió un alto porcentaje de espermatozoides móviles (fig. 4). Se interpretó como recanalización precoz o fracaso de la técnica quirúrgica. Todos ellos precisaron una segunda vasectomía bilateral para conseguir la azoospermia. El tiempo medio hasta la reintervención fue de 7 meses, dentro de un rango de 5-10 meses.
El hallazgo de células polimorfonucleares en el líquido seminal se obtuvo en 54 pacientes, lo que corresponde a un 3% de la muestra. Este hallazgo se vinculó en su mayoría a seminogramas con registros de azoospermia y, en menor medida, con espermatozoides inmóviles. No se asoció a procesos infecciosos sintomáticos, aunque su escasa representación en nuestra muestra impide extraer conclusiones significativas7.
DiscusiónLa vasectomía es un procedimiento relativamente sencillo y con una baja tasa de complicaciones posquirúrgicas, que van desde infecciones locales y de la piel hasta dolor epididimario crónico8. Sin embargo, aparte de los efectos adversos quirúrgicos, el paciente debe conocer otras peculiaridades de la técnica antes de decidirse.
El riesgo de mantener la fertilidad tras la vasectomía se justifica por errores en la ejecución del procedimiento o por recanalización del conducto deferente. Un relevante estudio de Reino Unido cifró el riesgo de fallo en la técnica en un 0,36%, asociado a la presencia de espermatozoides móviles en el primer control9. La recanalización del conducto deferente puede ser precoz y tardía. Aunque infrecuente, esta recanalización se ha reportado en un 0,04-0,08% de los casos y suele diagnosticarse tras un embarazo inesperado3.
Otro de los inconvenientes de la vasectomía es la presencia de espermatozoides inmóviles en un notable número de pacientes. Estos espermatozoides proceden en su mayoría de la ampolla de los conductos deferentes y pueden mantenerse hasta varios meses después de la cirugía3. Algunos estudios describen hasta un 33% de muestras con espermatozoides residuales a los 3 meses y hasta un 10% a los 6 meses9. El miedo a posibles demandas médico-legales justificaba protocolos muy conservadores, con largos seguimientos y series de seminogramas hasta registrar la azoospermia. Clásicamente, el seguimiento de los pacientes posvasectomizados ha consistido en un seminograma a los 3meses de la intervención y un segundo seminograma que confirmara la azoospermia4. Con posterioridad, un buen número de publicaciones consideraron que una única muestra era suficiente1,3,10.
En aquellos pacientes con espermatozoides residuales inmóviles, el protocolo conlleva algo más de controversia. Distintos estudios muestran que el riesgo de fecundación por un paciente con espermatozoides residuales inmóviles es equivalente al riesgo de fecundación tras haber presentado 2muestras consecutivas de azoospermia2. Es decir, un riesgo similar al de una recanalización tardía, que se estima en 0,05% según algunas series10,11.
En la actualidad, algunas guías de práctica clínica, como las de la American Urological Association o de la Faculty of Sexual and Reproductive Healthcare (FSRH) de Reino Unido, establecen un límite de <100.000/ml espermatozoides para finalizar el seguimiento1. Se trata de una concentración de espermatozoides segura y que permite un recuento preciso con los métodos actuales3,4,12. En estos casos puede otorgarse un «permiso especial» para finalizar el uso de otras medidas anticonceptivas tras una correcta explicación y aceptando el bajo riesgo de embarazo1,2. Por su parte, las guías de la European Associacion of Urology siguen recogiendo esa afirmación con escepticismo. De esta forma, son muchos los trabajos que reconocen innecesario hacer seminogramas sucesivos un vez que obtenemos un recuento de espermatozoides residuales inmóviles <100.000/ml. Como ocurre con la presencia de espermatozoides residuales móviles, la detección de un número de espermatozoides inmóviles>100.000/ml se ha asociado un alto riesgo de fertilidad y, en muchos casos, el urólogo optará por repetir la cirugía cuanto antes5. Al tratarse de un punto de corte orientativo, existe incertidumbre acerca de la evolución de aquellos pacientes con espermatozoides residuales inmóviles>100.000/ml y de si finalmente alcanzan la azoospermia.
El momento del primer seminograma siempre ha sido motivo de discusión, pero una realización precoz conllevaría un alto porcentaje de falsos positivos, una mayor presencia de células inflamatorias y, por tanto, un mayor gasto sanitario3,8. En nuestra serie obtuvimos un porcentaje de azoospermia en el primer control a los 3 meses del 71,4%, muy similar a lo registrado en otras series de la literatura12,13. Este alto porcentaje de muestras libres de espermatozoides habla a favor del momento de realización de la prueba. Sin embargo, si hubiésemos practicado el primer seminograma a los 4 meses, el porcentaje de azoospermias habría sido del 89,7%. Por nuestra parte, no se realizó un segundo seminograma de confirmación en ninguno de estos pacientes9. En cuanto a los pacientes con espermatozoides residuales inmóviles con recuentos <100.000/ml en el primer seminograma, el 68% alcanzaron la azoospermia al 4.° mes, y el 100% a los 10 meses. En el grupo de pacientes con recuentos de espermatozoides>100.000/ml siguieron controles mensuales para una monitorización cercana. Las escasas referencias en la literatura hacia este subgrupo nos condujeron a un manejo cauteloso y con una adecuada asistencia al paciente. La media de tiempo hasta obtener la azoospermia fue mayor que en los pacientes con <100.000 espermatozoides/ml; el 63% registró la azoospermia a los 5 meses durante el 3.er seminograma de control y el 100% de los pacientes lograron la azoospermia antes de los 8 meses. Por tanto, en nuestra serie todos los pacientes con espermatozoides residuales inmóviles negativizaron el seminograma en un periodo inferior a 10 meses, independientemente de la concentración inicial. Nuestros resultados corroboran lo descrito en las series más actuales y defienden el alta precoz de aquellos pacientes con espermatozoides residuales inmóviles, ya que todos ellos acabaron negativizando tras un mayor o menor periodo de tiempo. Hacer seminogramas seriados hasta obtener la azoospermia conlleva un gasto sanitario innecesario y genera incertidumbre en el paciente. Si asumimos que la presencia de espermatozoides residuales inmóviles <100.000/ml en el primer seminograma es equivalente a la azoospermia, el 99,1% de nuestros pacientes serían susceptibles de abandonar el uso de otras medidas anticonceptivas tras el seminograma de los 3 meses. A pesar del tamaño de la muestra y del tiempo trascurrido desde alguna de las vasectomías hasta la actualidad, no se han registrado recanalizaciones tardías en nuestra serie. Aunque nuestro seguimiento no va más allá de la obtención de la azoospermia y, por tanto, no describe gestaciones secundarias a recanalizaciones tardías, ningún paciente ha reclamado valoración por este motivo.
ConclusiónBasándonos en nuestra experiencia, todos los pacientes con espermatozoides inmóviles en el primer seminograma, independientemente del número inicial, alcanzarán la azoospermia. Por lo tanto, los controles seriados hasta obtener un seminograma negativo son innecesarios.
En caso de registrarse la azoospermia en el primer seminograma no se precisan más muestras para confirmarla.
No se debería ofrecer una segunda vasectomía a aquellos pacientes correctamente informados con recuentos de espermatozoides residuales inmóviles> 100.000/ml; sin embargo, dada la escasa representación en nuestra muestra de este subgrupo, los resultados deben interpretarse con cautela.
Nuestra serie consolida el intervalo de 3 a 4 meses tras la vasectomía como el óptimo para realizar el primer seminograma, al registrar altos porcentajes de azoospermia.
Responsabilidades éticasProtección de personas y animales
Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos
Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado
Los autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNo hemos recibido ningún tipo de financiación en nuestro estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.