La tiña de cabeza (tinea capitis) es una dermatofitosis causada por hongos pertenecientes a los géneros Microsporum y Trichophyton, y constituye un importante problema sanitario en Argentina. El objetivo fue conocer la incidencia y la respuesta terapéutica en los pacientes que asistieron a la consulta en un hospital pediátrico de alta complejidad durante un período de 2 años de estudio. Se diagnosticaron 98 casos de tinea capitis y 13 de querion de Celso. Microsporum canis se aisló en el 61,28% de los casos.
El rango de los valores de concentración mínima inhibitoria para fluconazol, itraconazol, voriconazol, terbinafina, ketoconazol y griseofulvina fueron, respectivamente, > 32: 0,06–4; < 0,015–2; < 0,015–0,25; 0,13–8, y de 0,06–128μg/ml.
Tinea capitis is an infection caused by dermatophytes of the genera Microsporum and Trichophyton, and constitutes a major health problem in Argentina. The aim of the present study was to find out the incidence of those etiological agents and the therapeutic response in patients attending a High-Complexity Paediatric Hospital within a two-year period. A total of 98 tinea capitis were diagnosed, 13 of which were Celsus kerion. Microsporum canis was isolated in 61.28%. The range of values for minimum inhibitory concentrations were >32, 0,06–4; <0,015–2; <0,015–0.25; 0.13–8; 0.06–128μg/mL for fluconazole itraconazole, voriconazole, terbinafine, ketoconazole and griseofulvin, respectively.
Las dermatoficias son micosis superficiales de distribución universal causadas por especies de los géneros Microsporum, Trichophyton y Epidermophyton. Los agentes etiológicos son ubicuos y su distribución geográfica es variada23. Los niños adquieren la enfermedad por contacto directo con animales, personas, tierra o a través de las escamas vehiculizadas por la ropa u otros objetos25. La tiña de la cabeza (tinea capitis) es una enfermedad muy frecuente, que presenta dificultades en el diagnóstico y en el tratamiento. La griseofulvina es el fármaco de elección para el tratamiento, aunque existen riesgos de efectos adversos y en ocasiones fallos terapéuticos, por lo que es necesario conocer la actividad in vitro de otros antifúngicos potencialmente más eficaces8,22.
Recientemente, el Clinical and Laboratory Standard Institute (CLSI) ha publicado los documentos de referencia M38-A2 y M51-P para la determinación de la concentración mínima inhibitoria (CMI) y la difusión en agar para dermatofitos20,21.
El objetivo del presente trabajo fue conocer la incidencia, la sensibilidad in vitro y la respuesta terapéutica en los pacientes, durante un período de 2 años, en un hospital pediátrico de alta complejidad de Buenos Aires, Argentina.
Materiales y métodosSe realizó un estudio prospectivo, descriptivo y observacional durante el período septiembre de 2004 a septiembre de 2006. Se incluyó en el estudio a los niños con clínica compatible de tinea capitis o querion de Celso. Se realizó la observación microscópica directa y el cultivo a todas las muestras obtenidas por escarificación de escamas de cuero cabelludo en los casos de sospecha de tinea capitis. En los pacientes con sospecha clínica de querion de Celso, la extracción del material fue por raspado, punción-aspiración o drenaje espontáneo a partir de la lesión.
Las muestras se procesaron con KOH al 20% y calor (ebullición) para favorecer la observación de elementos fúngicos. Para el aislamiento primario se utilizó el medio agar dextrosa Sabouraud al 20%+cloranfenicol+cicloheximida. La identificación de las especies se realizó según el estudio de las características macromorfológicas y micromorfológicas18.
La determinación de la CMI se realizó según el método de referencia M38-A2 del CLSI21. Se utilizó, además, la técnica de difusión en agar con tabletas cargadas con antifúngicos (Neo-Sensitabs®, Rosco, Dinamarca). La prueba se llevó a cabo según las instrucciones del fabricante, así como la interpretación de los resultados16,20. Se evaluó la actividad in vitro de la terbinafina (Novartis, Argentina), el fluconazol y el voriconazol (Pfizer, S.A., Argentina) el itraconazol (Janssen, Argentina), el ketoconazol (Ladilan Trading S. A., Argentina) y la griseofulvina (Sigma, Chemical Co., St. Luis, EE. UU.). Se utilizaron tabletas Neo-Sensitabs® cargadas con fluconazol, itraconazol, ketoconazol y terbinafina. Se estudiaron las siguientes especies: Microsporum canis (n=33), Trichophyton mentagrophytes (n=16) y Trichophyton tonsurans (n=2). El inóculo se realizó a partir de un cultivo de 7 – 10 días en agar patata (Oxoid, Argentina) a 28°C. Se hizo una suspensión en solución 0,15M de NaCl estéril (solución salina al 0,85%) hasta alcanzar una turbidez equivalente al grado 2 de la escala de McFarland. El recuento de colonias se hizo en cámara de Neubauer y el inóculo final se ajustó hasta alcanzar la concentración final de 1–5×103UFC/ml. Las microplacas se sembraron según las directrices del documento M38-A2 del CLSI19. Las microplacas y las placas para difusión se incubaron a 28°C durante 120h. Las lecturas se realizaron de forma visual para ambos métodos. Al término de ese período, se determinaron las CMI de todos los antifúngicos, definidas como la menor concentración que produjo el 80% o más de inhibición del crecimiento fúngico para los azoles y del 100% para el resto de los antifúngicos. Para la prueba de difusión en agar se realizó la medición del diámetro del halo de inhibición con regla. Al no existir puntos de corte para la interpretación en hongos miceliales, se consideraron los propuestos por el fabricante16.
Resultados y discusiónSe estudió a 178 pacientes que asistieron a la consulta en el Hospital de Pediatría Dr. J. P. Garrahan. La edad promedio de los pacientes fue de 5 años, 92 varones y 86 mujeres. En el 62,3% (111/178) de los pacientes se obtuvieron resultados positivos. Prevaleció la forma clínica de tinea capitis (98/111 [88,29%]) sobre el querion de Celso (13/111 [11,71%]). M. canis fue la especie aislada con mayor frecuencia (68/111 [61,28%]), seguida por T. mentagrophytes (29/111 [26,13%]) y T. tonsurans (14/111 [12,61%]).
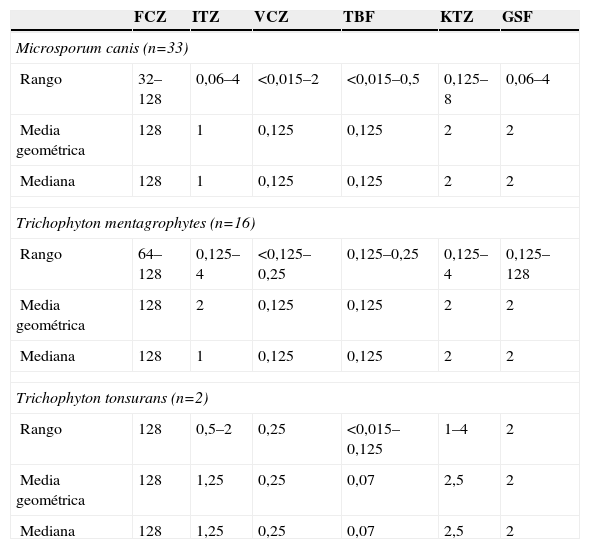
Se determinó la CMI y se valoró la actividad in vitro por difusión a 51 cepas de dermatofitos (tabla 1). Se observó reducida actividad antifúngica in vitro de fluconazol e itraconazol, mientras que voriconazol y terbinafina fueron más eficaces (tabla 1).
Concentración mínima inhibitoria de 51 hongos dermatofitos frente a 6 antifúngicos (μg/ml)
| FCZ | ITZ | VCZ | TBF | KTZ | GSF | |
| Microsporum canis (n=33) | ||||||
| Rango | 32–128 | 0,06–4 | <0,015–2 | <0,015–0,5 | 0,125–8 | 0,06–4 |
| Media geométrica | 128 | 1 | 0,125 | 0,125 | 2 | 2 |
| Mediana | 128 | 1 | 0,125 | 0,125 | 2 | 2 |
| Trichophyton mentagrophytes (n=16) | ||||||
| Rango | 64–128 | 0,125–4 | <0,125–0,25 | 0,125–0,25 | 0,125–4 | 0,125–128 |
| Media geométrica | 128 | 2 | 0,125 | 0,125 | 2 | 2 |
| Mediana | 128 | 1 | 0,125 | 0,125 | 2 | 2 |
| Trichophyton tonsurans (n=2) | ||||||
| Rango | 128 | 0,5–2 | 0,25 | <0,015–0,125 | 1–4 | 2 |
| Media geométrica | 128 | 1,25 | 0,25 | 0,07 | 2,5 | 2 |
| Mediana | 128 | 1,25 | 0,25 | 0,07 | 2,5 | 2 |
FCZ: fluconazol; GSF: griseofulvina; ITZ: itraconazol; KTZ: ketoconazol; TBF: terbinafina; VCZ: voriconazol.
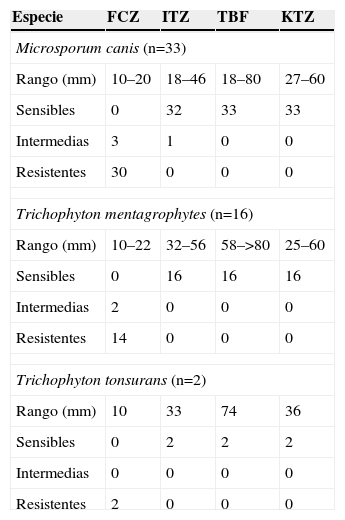
Para las 51 cepas estudiadas, ketoconazol y terbinafina fueron los antifúngicos más activos in vitro cuando se valoró la sensibilidad por difusión en agar (tabla 2). El método de difusión en agar no permitió detectar cepas resistentes a itraconazol y se obtuvieron 7 errores muy importantes (very major) (13,7%): M. canis (n=2) y T. mentagrophytes n=5). Del mismo modo, para ketoconazol se obtuvo un total de 3 errores muy importantes (5,88%): M. canis (n=1) y T. mentagrophytes (n=2), que mostraron valores de halo de 27 y 25mm, respectivamente, y cuya CMI fue de 4 y 2μg/ml.
Difusión en agar. Valor del diámetro del halo de inhibición (mm) e interpretación de los resultados (n.o de aislamientos)
| Especie | FCZ | ITZ | TBF | KTZ |
| Microsporum canis (n=33) | ||||
| Rango (mm) | 10–20 | 18–46 | 18–80 | 27–60 |
| Sensibles | 0 | 32 | 33 | 33 |
| Intermedias | 3 | 1 | 0 | 0 |
| Resistentes | 30 | 0 | 0 | 0 |
| Trichophyton mentagrophytes (n=16) | ||||
| Rango (mm) | 10–22 | 32–56 | 58–>80 | 25–60 |
| Sensibles | 0 | 16 | 16 | 16 |
| Intermedias | 2 | 0 | 0 | 0 |
| Resistentes | 14 | 0 | 0 | 0 |
| Trichophyton tonsurans (n=2) | ||||
| Rango (mm) | 10 | 33 | 74 | 36 |
| Sensibles | 0 | 2 | 2 | 2 |
| Intermedias | 0 | 0 | 0 | 0 |
| Resistentes | 2 | 0 | 0 | 0 |
FCZ: fluconazol; ITZ: itraconazol; KTZ: ketoconazol; TBF: terbinafina.
Tinea capitis es una de las micosis superficiales más frecuentes en la infancia y constituye un problema sanitario importante, cuya incidencia y agentes causales varían según la ubicación geográfica, el clima y las características socioeconómicas5–7, 23. En nuestro estudio, M. canis fue el agente causal aislado con mayor frecuencia (61,28%), en coincidencia con Mangiaterra et al7,19. Es importante destacar el aislamiento de T. mentagrophytes como segundo agente etiológico en tinea capitis y querion de Celso (26,13%). La intensa reacción inflamatoria de las lesiones, que muchas veces dificulta el diagnóstico diferencial, y el rol del conejo como potencial agente transmisor de este hongo, que se ha incorporado a los hogares como mascota, con pleno desconocimiento del cuidado, el hábitat y el control sanitario que requiere esta especie, contribuyeron al aumento de prevalencia de esta zoonosis.
El tratamiento antifúngico de los pacientes fue griseofulvina 20mg/kg/día por vía oral durante un período de 45 días y ketoconazol tópico17,24. Se obtuvo buena respuesta clínica, salvo en 2 casos, en los que se registraron efectos adversos que obligaron a cambiar el tratamiento. Con respecto a la sensibilidad in vitro, nuestros datos no concuerdan con los de otros autores2–4,9–14. Observamos discordancias entre los resultados obtenidos por el método de microdilución y la difusión en agar, que se deberían al efecto de las variables inherentes a las técnicas, como el prolongado período de incubación para dermatofitos, que incrementa la difusión15. Debido a las dificultades en el diagnóstico y el tratamiento, la tiña de la cabeza es aún una enfermedad emergente que requiere de un estudio consensuado por parte del equipo de salud para lograr su correcto tratamiento y prevención1.
Conflicto de interesesLa Fundación Alberto J. Roemmers subsidió este trabajo a través de un proyecto de investigación epidemiológica otorgado en el período 2004–2006.