En la medicina tradicional de Colombia, las plantas de la familia Asteraceae se han utilizado con fines medicinales.
ObjetivoEvaluar la actividad antimicótica y el efecto citotóxico de 15 aceites esenciales de plantas de la familia Asteraceae.
MétodosLa actividad antimicótica se evaluó con las cepas Candida parapsilosis ATCC 22019, Candida krusei ATCC 6258, Aspergillus flavus ATCC 204304 y Aspergillus fumigatus ATCC 204305 de acuerdo con las técnicas EUCAST y CLSI M38-A para levaduras y hongos filamentosos, respectivamente. La actividad citotóxica se evaluó mediante la técnica del MTT en la línea celular Vero.
ResultadosLos aceites de las plantas Achyrocline alata y Baccharis latifolia fueron los únicos activos contra A. fumigatus (media geométrica de la concentración mínima inhibitoria=78,7 y 157,4μg/ml, respectivamente). En contraste, no se evidenció actividad de los aceites contra especies de Candida. Además, estos aceites no fueron citotóxicos en las células Vero.
ConclusionesLos aceites de A. alata y B. latifolia podrían ser candidatos para la desinfección de ambientes hospitalarios y para la inhibición de formación de biopelículas por A. fumigatus.
The plants of the Asteraceae family have been used for medicinal purposes,in traditional Colombian medicine.
AimTo evaluate the antifungal activity and the cytotoxic effects of 15 essential oils from plants of the Asteraceae family.
MethodsAntifungal activity was evaluated against Candida parapsilosis ATCC 22019, Candida krusei ATCC 6258, Aspergillus flavus ATCC 204304 and Aspergillus fumigatus ATCC 204305 following EUCAST and CLSI M38-A standard methods, for yeast and filamentous fungi, respectively. Cytotoxic effect was evaluated on Vero cell line by MTT assay.
ResultsThe oils from the plants Achyrocline alata and Baccharislatifolia were the only ones active against A. fumigatus (GM-MIC=78.7 and 157.4μg/ml, respectively). In contrast, there was no evidence of oils active against Candida species. In addition, these oils were not cytotoxic on Vero cells. The oils of A. alata and Baccharis latifolia could be candidates for disinfecting hospital environments and for inhibiting biofilm formation by A. fumigatus
ConclusionsThe oils of A. alata and B. latifolia could be candidates for disinfecting hospital environments and for inhibiting biofilm formation by A. fumigatus
La incidencia de las infecciones micóticas ha aumentado en los últimos 20 años principalmente en la población de individuos inmunodeficientes13. Teniendo en cuenta la resistencia de algunas especies de Aspergillus y Candida a antimicóticos, como la anfotericina B, el fluconazol, el itraconazol y el voriconazol4, en las últimas décadas se vienen explorando nuevas fuentes de agentes antimicóticos de origen natural, entre ellos los aceites esenciales derivados de plantas1. En el presente estudio se evaluó la actividad antimicótica y citotóxica de 15 aceites esenciales obtenidos de plantas de la familia Asteraceae recolectadas en Colombia.
Los aceites esenciales se extrajeron a partir de 300g de hojas secas y tallos de las plantas, y se utilizó la técnica de hidrodestilación asistida por radiación con microondas por medio de un equipo de destilación tipo Clevenger y un horno microondas12. La caracterización de los aceites esenciales que mostraron actividad se llevó a cabo por cromatografía de gases acoplada a espectrometría de masas12.
La actividad antimicótica se evaluó con las cepas Candida parapsilosis ATCC 22019, Candida krusei ATCC 6258, Aspergillus flavus ATCC 204304 y Aspergillus fumigatus ATCC 204305 mediante las técnicas de microdilución estándar EUCAST3 y M38-A CLSI9 para levaduras y hongos filamentosos, respectivamente.
Los aceites esenciales se evaluaron en un rango entre 31,25 y 500μg/ml. Los fármacos itraconazol y anfotericina B (Sigma-Aldrich) se emplearon como controles a concentraciones en un rango de 0,031–16μg/ml. Además, en cada ensayo se incluyó un control de crecimiento que correspondió al inoculo de cada hongo sin tratamiento. Los ensayos se realizaron por duplicado en 3 momentos diferentes. Se expresaron como las medias geométricas (MG) de las concentraciones mínimas inhibitorias (CMI).
La citotoxicidad de los aceites se evaluó a concentraciones entre 25–200μg/ml en las células de riñón de mono verde africano (Vero ATCC CCL-81) mediante la técnica del MTT 3-(4,5-dimetiltiazol-2-yl)-2,5-difeniltetrazolio bromuro2. Los ensayos se realizaron por duplicado. Las concentraciones inhibitorias del 50% del crecimiento se obtuvieron mediante análisis de regresión lineal simple con el paquete estadístico R (Viena, Austria, 2008), en el que se correlacionó la media del porcentaje de inhibición (100−[densidad óptica del tratamiento/densidad óptica del control]*100) y la concentración. La citotoxicidad se definió de acuerdo con el criterio del Instituto Nacional de Cáncer de Estados Unidos7.
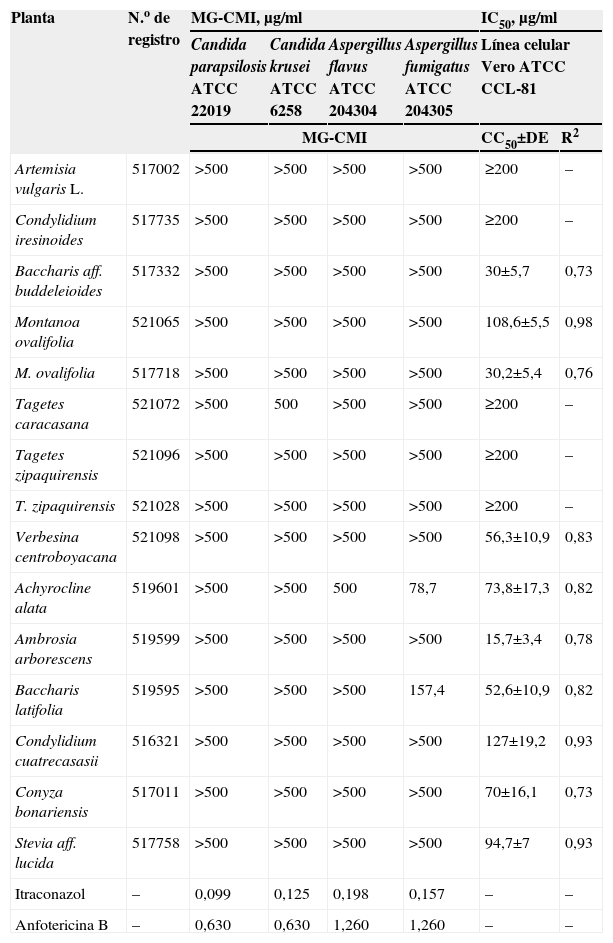
Actualmente no se tienen criterios estándares para definir la actividad antimicótica de productos naturales. Holetz et al (2002) indican clasificar la actividad antimicótica de productos naturales con base en el valor de la CMI de la siguiente manera: CMI inferior o igual a 100μg/ml: buena, CMI entre 100 y 500μg/ml: moderada, y CMI entre 500 y 1.000μg/ml: débil8. En base a lo anterior, sólo los aceites de las plantas Achyrocline alata (MG-CMI=78,7μg/ml) y Baccharis latifolia (MG-CMI=157,4μg/ml) mostraron actividad moderada frente a A. fumigatus (tabla 1). Con las cepas de Candida, no se encontró actividad (CMI >500μg/ml). Las MG-CMI de los fármacos itraconazol y anfotericina B se encontraron dentro de los valores establecidos por las técnicas de referencia.
Nombre de las plantas, y sus números de registro, medias geométricas de las concentraciones mínimas inhibitorias (μg/ml) y concentración inhibitoria 50 (μg/ml) de los aceites evaluados
| Planta | N.o de registro | MG-CMI, μg/ml | IC50, μg/ml | ||||
| Candida parapsilosis ATCC 22019 | Candida krusei ATCC 6258 | Aspergillus flavus ATCC 204304 | Aspergillus fumigatus ATCC 204305 | Línea celular Vero ATCC CCL-81 | |||
| MG-CMI | CC50±DE | R2 | |||||
| Artemisia vulgaris L. | 517002 | >500 | >500 | >500 | >500 | ≥200 | – |
| Condylidium iresinoides | 517735 | >500 | >500 | >500 | >500 | ≥200 | – |
| Baccharis aff. buddeleioides | 517332 | >500 | >500 | >500 | >500 | 30±5,7 | 0,73 |
| Montanoa ovalifolia | 521065 | >500 | >500 | >500 | >500 | 108,6±5,5 | 0,98 |
| M. ovalifolia | 517718 | >500 | >500 | >500 | >500 | 30,2±5,4 | 0,76 |
| Tagetes caracasana | 521072 | >500 | 500 | >500 | >500 | ≥200 | – |
| Tagetes zipaquirensis | 521096 | >500 | >500 | >500 | >500 | ≥200 | – |
| T. zipaquirensis | 521028 | >500 | >500 | >500 | >500 | ≥200 | – |
| Verbesina centroboyacana | 521098 | >500 | >500 | >500 | >500 | 56,3±10,9 | 0,83 |
| Achyrocline alata | 519601 | >500 | >500 | 500 | 78,7 | 73,8±17,3 | 0,82 |
| Ambrosia arborescens | 519599 | >500 | >500 | >500 | >500 | 15,7±3,4 | 0,78 |
| Baccharis latifolia | 519595 | >500 | >500 | >500 | 157,4 | 52,6±10,9 | 0,82 |
| Condylidium cuatrecasasii | 516321 | >500 | >500 | >500 | >500 | 127±19,2 | 0,93 |
| Conyza bonariensis | 517011 | >500 | >500 | >500 | >500 | 70±16,1 | 0,73 |
| Stevia aff. lucida | 517758 | >500 | >500 | >500 | >500 | 94,7±7 | 0,93 |
| Itraconazol | – | 0,099 | 0,125 | 0,198 | 0,157 | – | – |
| Anfotericina B | – | 0,630 | 0,630 | 1,260 | 1,260 | – | – |
DE: desviación estándar; IC50: concentración inhibitoria 50; MG-CMI: media geométrica de la concentración mínima inhibitoria; R2: coeficiente de correlación múltiple al cuadrado.
Hasta el momento, no se había evaluado la actividad antimicótica de B. latifolia. Albuquerque et al1 encontraron actividad contra Candida albicans (CMI=2,8μg/ml) en el aceite de otra especie de esta familia (Baccharis trinervis) con una técnica de difusión en agar.
La divergencia de los valores de las CMI de aceites esenciales entre los diferentes estudios puede explicarse por la diversidad de las técnicas utilizadas en los estudios, la variación en la composición de los aceites esenciales de acuerdo con los géneros y las especies de las plantas o por la procedencia geográfica. Las diferencias estructurales que existen entre los géneros o las especies de los hongos evaluados también pueden ser un factor de variabilidad en los resultados de la actividad antimicótica de productos naturales.
El componente mayoritario del aceite de B. latifolia fue limoneno (9,4%) y el de A. alata fue timol (24,04%). En estudios previos se ha demostrado la actividad del limoneno y el timol contra Fusarium oxysporum y C. albicans, respectivamente; por tanto, posiblemente estos terpenos son los causantes de la actividad de los aceites mencionados11,5.
Los aceites no mostraron citotoxicidad sobre las células Vero, excepto el aceite de Ambrosia arborescens (concentraciones inhibitorias 50=15,7±3,4) (tabla 1).
En este estudio se demostró la actividad de los aceites esenciales de las plantas B. latifolia y A. alata contra A. fumigatus, así como la ausencia de citotoxicidad en las células Vero. Estos hallazgos son importantes si se considera que este hongo se encuentra en el ambiente y que representa un riesgo en hospitales6. Además, tiene la capacidad de formar biopelículas en catéteres10, por tanto, una posible aplicación de estos aceites podría estar a este nivel.
FinanciaciónLos resultados de este artículo se derivan del proyecto RC 432-2004, financiado por el Instituto Colombiano para el Desarrollo de la Ciencia y la Tecnología (COLCIENCIAS), Bogotá, Colombia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.