Se presenta el caso de una paciente de 26 años de edad, sexo femenino, empleada de comercio que vivía en el conurbano sur de la provincia de Buenos Aires, Argentina. No refirió haber realizado viajes al exterior y sólo mencionó un viaje a la provincia de Misiones, cinco años antes de la enfermedad actual. Vivía en casa de material con sanitarios completos.
La paciente comenzó con dolor en el hipocondrio derecho asociado con coluria e ictericia de piel y mucosas dos meses antes de su ingreso en nuestro hospital. Según informó se encontraba afebril pero con marcada astenia y adinamia. Debido a estas manifestaciones se le realizó una ecografía hepatobiliar y pancreática, que puso en evidencia una litiasis biliar múltiple. Por esta razón se le efectuó una colecistectomía con colocación de un tubo de Kehr. Durante el posoperatorio persistió con ictericia, y por esta razón la paciente decidió abandonar el hospital zonal donde estaba internada, sin el alta médica. Días más tarde consultó en la guardia del Hospital F. J. Muñiz y se determinó su ingreso para diagnóstico y tratamiento.
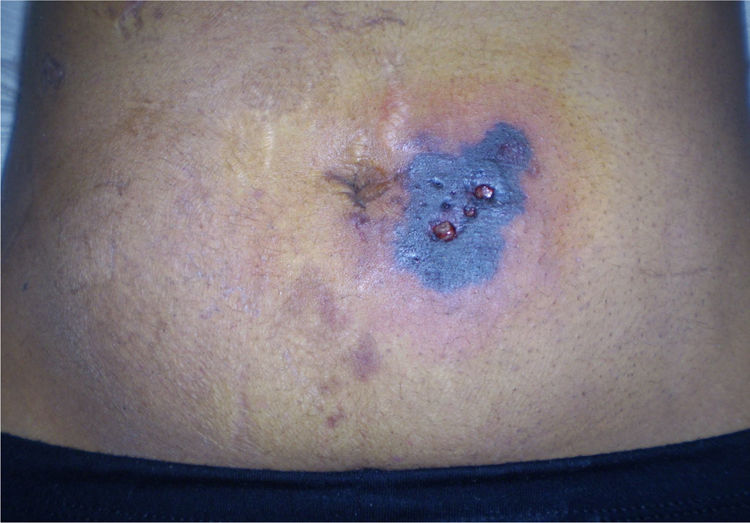
Examen físico. La paciente ingresó en regular estado general. Estaba adelgazada, asténica, lúcida, reactiva, sin déficits motores ni síntomas meníngeos, Glasgow 15/15, con ictericia de piel y mucosas. La temperatura axilar era de 36°C, la frecuencia cardíaca de 95 pulsaciones/min, la frecuencia respiratoria de 17 inspiraciones/min, y la tensión arterial 100/70 mmHg. Tenía una buena mecánica ventilatoria, con buena entrada de aire bilateral, sin ruidos agregados. El abdomen se presentaba globoso con marcada ascitis, hepatomegalia leve, sin circulación colateral evidente, sin esplenomegalia y con ruidos hidroaéreos conservados. No presentaba eritema de palmas ni «flapping». En la zona periumbilical, por debajo de la cinta adhesiva que sostenía el tubo de drenaje colocado en la cirugía previa, se observaba una lesión costrosa con fondo necrótico y la piel vecina presentaba un color azul violáceo debido a la aplicación tópica de violeta de genciana durante su internación en el hospital zonal (fig. 1). Se realizó colangiografía trans-Kehr, que mostró un buen paso del contraste por la vía biliar.
Exámenes de laboratorio. Eritrosedimentación de 70 mm en la primera hora, hematocrito 40,5%, hemoglobina 10,3 g/dL, plaquetas 106.000/μl, leucocitos 4.800/μl (neutrófilos 72%, linfocitos 16%, monocitos 8%, eosinófilos 3% y basófilos 1%), transaminasa glutámico-oxalacética 217 U/I, transaminasa glutámico-pirúvica 152 U/l, fosfatasa alcalina 244 U/l, tiempo de Quick 60%, KPTT 36,3 segundos, glucemia 78 mg/dL, uremia 50 mg/dL, creatininemia 0,6 mg/dL, bilirrubina total de predominio directo 21 mg/dL. Las pruebas serológicas HIV1/2, HCV, HAV y HB core fueron no reactivas; FAN (factor antinuclear): negativo, anticuerpos antimitocondriales: positivos 1/80, anticuerpos anti-LKM y anti-músculo liso: negativos.
Se consideró que la paciente padecía una hepatitis autoinmune, por lo que se le prescribieron corticosteroides, inicialmente 20 mg de meprednisona por vía oral, dosis que se redujo a la mitad tras 72 h. Se estudió la causa de la úlcera periumbilical y fue tratada oportunamente. Debido al empeoramiento de su hepatitis, que evolucionó hacia una insuficiencia hepática grave, fue trasladada al Hospital Argerich para realizarle un trasplante hepático pero falleció sin haber encontrado un donante adecuado.
Preguntas- 1.
¿Cuáles pueden ser las causas de la lesión úlcero-necrótica?
- 2.
¿Qué estudios se deben realizar para llegar al diagnóstico de una úlcera como la que presentaba esta paciente?
- 3.
¿Cómo deben procesarse las muestras clínicas obtenidas? Especificar también la forma de envío de estas muestras a los laboratorios, qué estudios microscópicos deben hacerse y en qué forma deben sembrarse estos materiales para obtener los cultivos del agente causal.
- 4.
Teniendo en cuenta las figuras 2 y 3, ¿cuál es el diagnóstico?
- 5.
¿Cuál es la probable vía de infección y cuál el tratamiento de elección?
Las hialohifomicosis, en especial las producidas por el género Fusarium, pueden causar, en pacientes que reciben corticosteroides en altas dosis y por tiempo prolongado, enfermos neutropénicos y/o receptores de trasplantes de órganos, una infección sistémica con lesiones en la piel. Comienzan como pápulas o máculas eritematosas que rápidamente evolucionan hacia la ulceración y la formación de costras necróticas. Con menor frecuencia el género Aspergillus puede producir lesiones similares. En ocasiones estas infecciones diseminadas tienen como punto de partida una onicomicosis del pie.
En las mucormicosis se presentan también lesiones ulceradas en la piel que, con frecuencia, se cubren con costras negruzcas de aspecto necrótico. Estas pueden afectar tanto a enfermos inmunodeficientes, especialmente diabéticos descompensados, como a inmunocompetentes, que hayan sufrido traumatismos graves o intervenciones quirúrgicas1.
El carbunco o ántrax cutáneo cursa inicialmente con una lesión eritematosa que pasa a ser una pápula que rápidamente evoluciona a una vesícula de contenido seroso o serohemático y posteriormente a una escara (lesión carbonosa). Es una enfermedad bacteriana, zoonótica, causada por Bacillus anthracis. Esta paciente no refería contacto reciente con animales que suelen transmitir el microorganismo. Los bacilos pueden observarse en el examen microscópico directo con la tinción de Gram y se desarrollan en medios de cultivo comunes como el agar sangre al 5% con o sin atmósfera de CO2.
El ectima es una infección dermohipodérmica causada por Streptococcus pyogenes o por Staphylococcus aureus. Se caracteriza por pústulas que más tarde producen úlceras tórpidas cubiertas por costras hemorrágico-necróticas; frecuentemente comprometen las extremidades inferiores en enfermos diabéticos.
El ectima gangrenoso produce placas eritemato-violáceas con centro cubierto por una costra de aspecto necrótico y con lesiones satélites en forma de pápulas eritematosas. Se observa en enfermos con déficit inmunitario grave y es causado por bacterias como Pseudomonas aeruginosa u hongos de los géneros Candida, Aspergillus y Fusarium.
Debe realizarse una escarificación de la lesión necrótica levantando la costra y tomando la muestra en el fondo de la úlcera. La muestra se extiende sobre un portaobjetos y se lleva a cabo el examen directo en fresco con solución fisiológica. También se hacen extendidos que se tiñen con las técnicas de Giemsa y Gram. A su vez debe realizarse una toma de biopsia profunda para enviar parte de la muestra en formol al 10% para examen histopatológico, y otra parte con solución fisiológica estéril para hacer el examen microbiológico (directo y cultivo). En los pacientes que presentan un cuadro clínico compatible con una infección diseminada aguda deben efectuarse hemocultivos. Estos últimos, dentro de las micosis que hemos considerado, suelen ser positivos en la fusariosis. Los preparados para el estudio histopatológico deben ser teñidos con hematoxilina eosina, PAS y metenamina-plata de Grocott3,6.
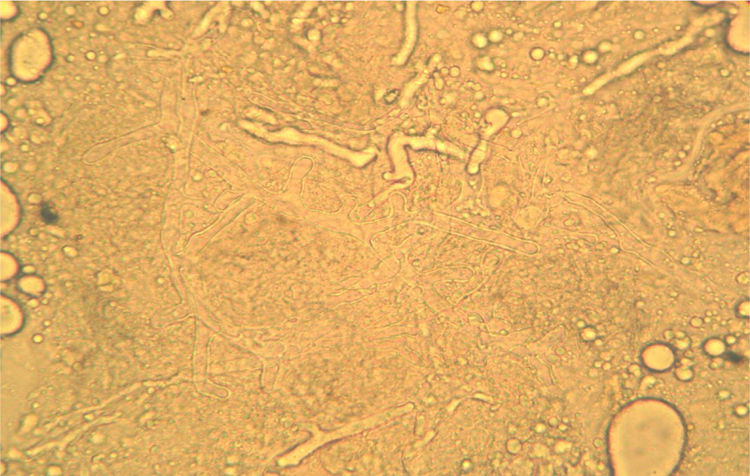
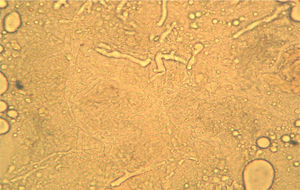
La biopsia remitida para el estudio microbiológico en solución salina estéril debe llegar al laboratorio en menos de cuatro horas o mantenerse a 4°C hasta un máximo de 24 h. El examen microscópico directo del material obtenido de las lesiones por escarificación de la úlcera o biopsia cutánea se hace al estado fresco, sin fijar y sin emplear colorantes, entre portaobjetos y cubreobjetos con una gota de solución salina isotónica o hidróxido de potasio al 10% para mejorar la definición. Esta última preparación permite una mejor observación de las hifas en el caso de las micosis debidas a hongos miceliares. Estos preparados se miran con microscopio óptico a 200 X o 400 X (fig. 2). Puede montarse también en solución de blanco de calcoflúor y emplear microscopio de fluorescencia, con lo que se obtiene una mejor definición de las hifas. Para la observación de los agentes bacterianos que producen las otras patologías como el carbunco y el ectima deben hacerse extendidos sobre portaobjetos que se tiñen por la técnica de Gram. La porción de la biopsia destinada a los cultivos debe ser fragmentada en pequeños trozos con pinza y bisturí estériles, que son luego sembrados sobre los medios de cultivo. Esta preparación de la muestra es preferible a la habitual trituración en mortero con arena, dado que esta última reduce la viabilidad de las hifas de los mucorales, que tienen hifas con escasos tabiques y cuando se rompen se libera una gran cantidad de contenido citoplasmático, con lo que el hongo muere. La siembra de la muestra se realiza en agar glucosado de Sabouraud y lactrimel de Borelli sin cicloheximida. La incubación se hace a 28°C y 37°C durante cuatro semanas. Para las infecciones bacterianas se utiliza la siembra en placas de Petri con agar sangre y/o medios selectivos, así como en medio líquido enriquecido, y la incubación se hace a 37°C durante tres a cuatro días2,3,6 con y sin atmósfera de CO2.
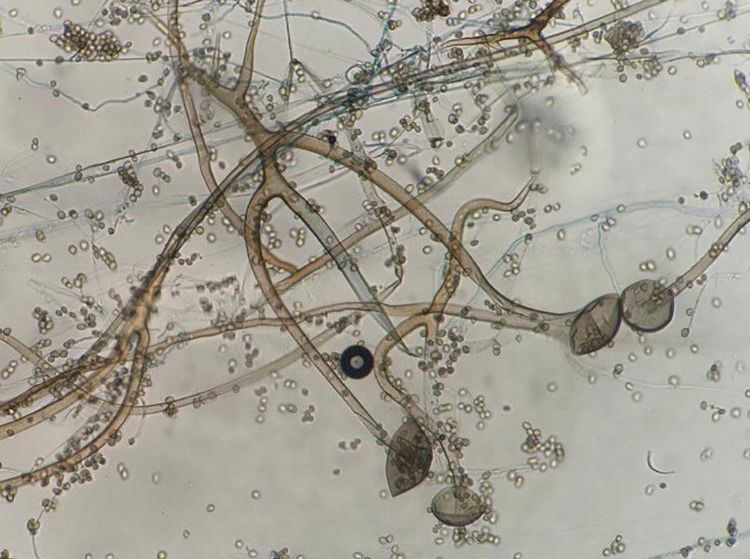
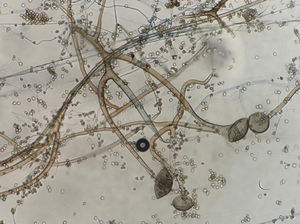
La figura 2 es una microfotografía del examen microscópico directo al estado fresco de la muestra obtenida de la lesión cutánea: se observan hifas hialinas, con escasos tabiques, anchas de 8 a 10μm de diámetro y con ramificaciones que salen en ángulo recto del eje principal de la hifa. Estas características corresponden a un hongo del orden Mucorales. En los cultivos se desarrollaron colonias con abundante micelio aéreo, de color gris claro en la base y más oscuro en los extremos de las hifas, de crecimiento rápido y extenso que abarcaba todo el tubo. El examen microscópico de los microcultivos de este microorganismo (fig. 3) permitió observar la presencia de un micelio vegetativo caracterizado por la presencia de hifas hialinas anchas y con pocos tabiques, con rizoides y estolones. De los rizoides salían tres esporangióforos largos que terminaban en esporangios grandes, globulosos, con columela, apófisis y numerosas esporangiosporas ovaladas, ligeramente amarillentos, de 4 x 7 μm de diámetro. Estas características permitieron identificarlo dentro del género Rhizopus, probablemente Rhizopus arrhizus. Este género es el agente más frecuente en las mucormicosis. Por lo tanto, esta paciente padecía una mucormicosis cutánea.
Los mucorales son hongos que viven en la naturaleza, especialmente en la tierra, sobre desechos orgánicos, sus esporas pasan al aire y pueden penetrar en el organismo humano a través de la piel, por inhalación llegan a los senos paranasales o a los pulmones y por ingestión invaden el tubo digestivo. En el caso clínico presentado lo más probable es la penetración cutánea, posiblemente a través de la herida quirúrgica, y la fuente de infección puede haber sido el esparadrapo (tela adhesiva). Esta pudo estar guardada en un sitio húmedo, donde puede haber hongos en las paredes; en ese caso, las esporas se pegan a la tela adhesiva y se genera así una posible fuente de infección intrahospitalaria. Esto ha sido motivo de brotes en diversos centros asistenciales y la mayoría han sido publicados en revistas de interés médico. La capacidad invasora de este hongo se vio facilitada por la insuficiencia hepática, el tratamiento con corticosteroides y el mal estado general de la paciente5. Probablemente la cirugía realizada en una enferma cirrótica con un brote ictérico de causa no obstructiva desencadenó su descompensación.
El tratamiento de elección de la mucormicosis es la anfotericina B intravenosa. Debido a que las mucormicosis suelen tener un curso agudo y grave se prefiere el uso de las fórmulas de este fármaco asociadas a lípidos, anfotericina B liposomal o anfotericina B en complejos lipídicos. Estas formulaciones asociadas a lípidos permiten la administración de dosis diarias de 3 a 5 mg/kg. Como su coste es mucho más elevado que el de la anfotericina B desoxicolato no siempre está disponible en los lugares de escasos recursos. Dos triazoles han demostrado su eficacia en el tratamiento de las mucormicosis: el posaconazol por vía oral, en dosis de 300 mg cada 12 h, administrado en comprimidos, y el isavuconazol, que puede ser suministrado por vía oral o intravenosa, con una dosis de carga de 200 mg cada 8 h los primeros dos días y posteriormente 200 mg por día. Dado que la biodisponibilidad de este fármaco administrado por vía oral es superior al 98%, las dosis orales e intravenosas son intercambiables. Estos compuestos triazólicos suelen emplearse como tratamiento de sostén después de la administración de la anfotericina B2,4.
Además del tratamiento antifúngico debe hacerse la remoción amplia de todos los tejidos necrosados y la compensación, hasta donde sea posible, de todas las causas de depresión de la inmunidad. Se han utilizado también, como coadyuvante de estos tratamientos, las cámaras hiperbáricas, que no están disponibles en todos los centros asistenciales2-4.
En esta paciente se indicó anfotericina B complejo lipídico a razón de 5 mg/kg/día y se efectuó un amplio desbridamiento de todos los tejidos necrosados. Debido a su grave insuficiencia hepática no se pudieron prescribir triazoles para el tratamiento de sostén, ni suprimir el tratamiento con corticosteroides. Por estas razones sólo se observó una mejoría clínica de la lesión cutánea, pero la paciente falleció debido a la insuficiencia hepática.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.