A 43 year-old diabetic woman, who suffered chronic cough and brown expectoration, is presented in this clinical problem. X-ray exam and CT thorax scan showed a cavitary lung lesion, located at the upper field of the left lung. This lesion had 5 cm in diameter, with a thick wall and a spherical shadow inside. The diagnosis of chronic cavitary pulmonary coccidioidomycosis was based on the isolation of Coccidioides sp. from cultures of expectoration and bronchoalveolar lavage, and the detection of specific antibodies in immunodiffusion test and counterimmunoelectrophoresis with coccidiodin. Her diabetes was not well controlled. She was treated with intravenous amphotericin B and oral itraconazole, with good clinical response; after four months of treatment the patient abandoned clinical controls.
We suppose that the patient presented a coccidioidal fungus ball, inside a chronic cavitary lesion due to pulmonary coccidiodomycosis. She came from an endemic zone of coccidioidomycosis in the Northwest of the Argentine Republic (Catamarca Province).
Paciente E.G., de 43 años de edad, sexo femenino, procedente de Santiago del Estero, ciudad capital de la provincia del mismo nombre (norte-centro de la República Argentina). La paciente, insulinodependiente, sufría desde hacía 10 años una diabetes de tipo ii, tratada de manera discontinua y sin control de la dieta. Cinco años antes comenzó la afección por la cual consultó, con tos, a veces escasa expectoración y disnea leve de esfuerzo. Realizó múltiples consultas en su ciudad, donde le efectuaron estudios por imágenes (radiografías y tomografías computarizadas), que llevaron al diagnóstico presuntivo de tuberculosis, por una cavidad pulmonar en el vértice del pulmón izquierdo. Este diagnóstico no fue confirmado microbiológicamente, pero la paciente recibió tratamiento antituberculoso con 4 fármacos (isoniazida, pirazinamida, rifampicina y etambutol) durante 6 meses, sin experimentar mejoría clínica. Posteriormente le diagnosticaron un quiste hidatídico, fue tratada quirúrgicamente en abril de 2010 y después de la operación recibió 6 meses de albendazol. Debido a que continuó con tos y se le sumó expectoración de color marrón, fue derivada al Hospital Austral (provincia de Buenos Aires, partido de Pilar) en noviembre de 2011. En este centro se decidió su traslado al Hospital de Infecciosas Francisco Javier Muñiz para su mejor estudio.
El examen físico a su ingreso mostró una enferma adelgazada, de 1,52m de altura, 43kg de peso, decúbito activo indiferente, afebril, eupneica, 16 respiraciones por minuto, frecuencia cardíaca de 84 pulsaciones por minuto, presión arterial de 110-65mmHg. En la auscultación pulmonar se comprobaron roncus bilaterales y un soplo tubario en el ápice del pulmón izquierdo. El resto del examen físico no mostró otras alteraciones.
Los estudios de laboratorio presentaron los siguientes datos: eritrosedimentación 74mm en la primera hora, hematíes 4×106/μl, hemoglobina 11,6g/dl, hematocrito 34,6%, leucocitos 6,100/μl, neutrófilos 55,8%, linfocitos 32,7%, monocitos 9,7%, eosinófilos 1,3%, basófilos 0,5%, plaquetas 290.000/μl, uremia 26mg/dl, glucemia 343mg/dl, creatininemia 0,60mg/dl, sodio 142meq/l, potasio 4,8meq/l, cloruros 102meq/l, bilirrubina total 0,8mg/dl, bilirrubina directa 0,4mg/dl, transaminasa glutámico-oxalacética 34U/l, transaminasa glutámico pirúvica 17U/l, fosfatasa alcalina 124U/l, tiempo de protrombina 120%, KPTT 25,6seg, VDRL no reactiva. En el análisis de orina la densidad hallada fue de 1,020, con presencia de proteínas, glucosa y cuerpos cetónicos. La serología (ELISA) para VIH-1 y VIH-2 fue negativa.
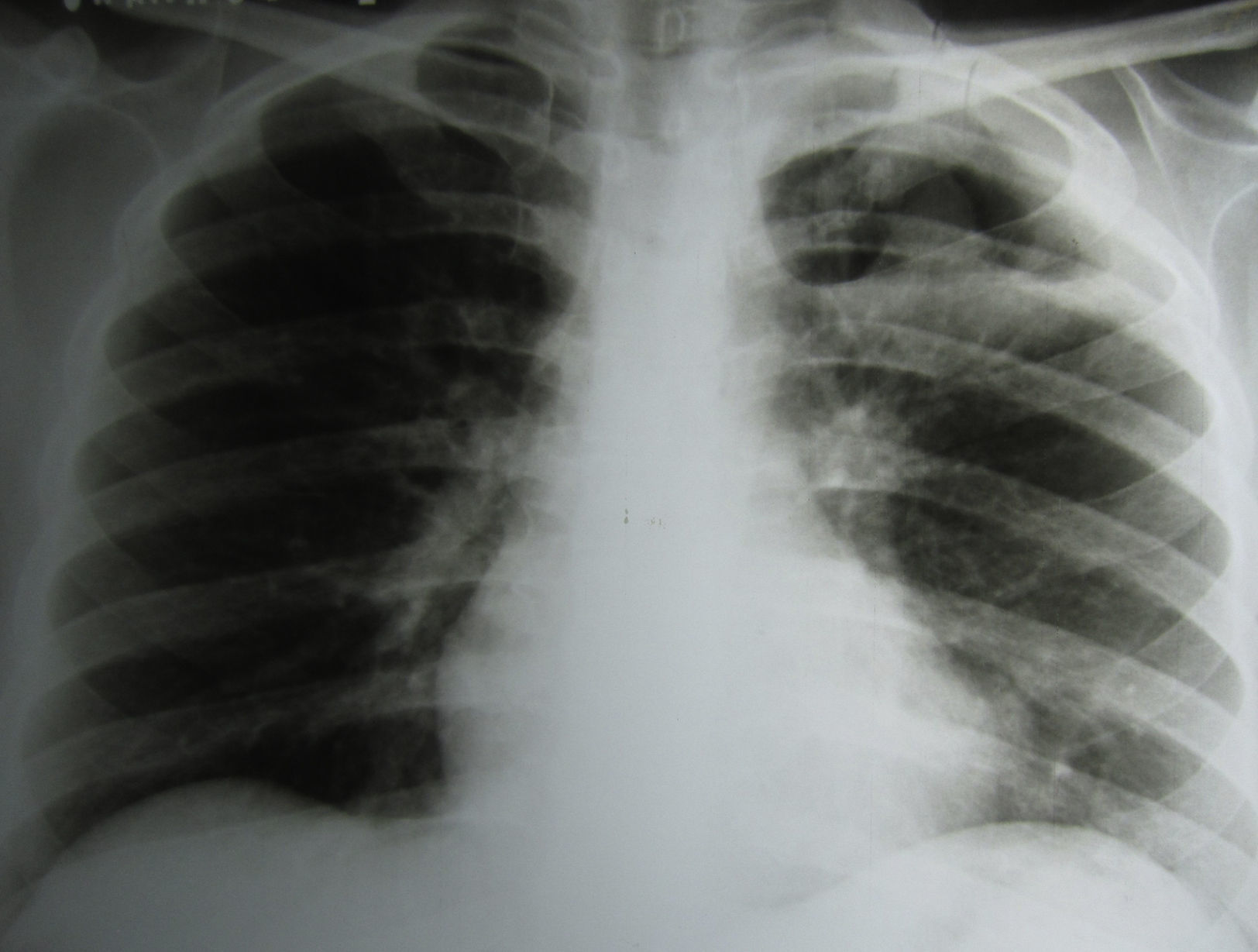
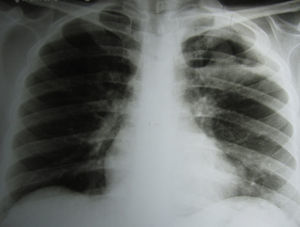
En la radiografía de tórax se observó una cavidad en el campo superior izquierdo de más de 4cm de diámetro, con paredes gruesas y una sombra esférica de 2cm de diámetro, con la misma densidad que las paredes de la cavidad, situada en su parte inferior. La porción apical de la pleura estaba engrosada (fig. 1).
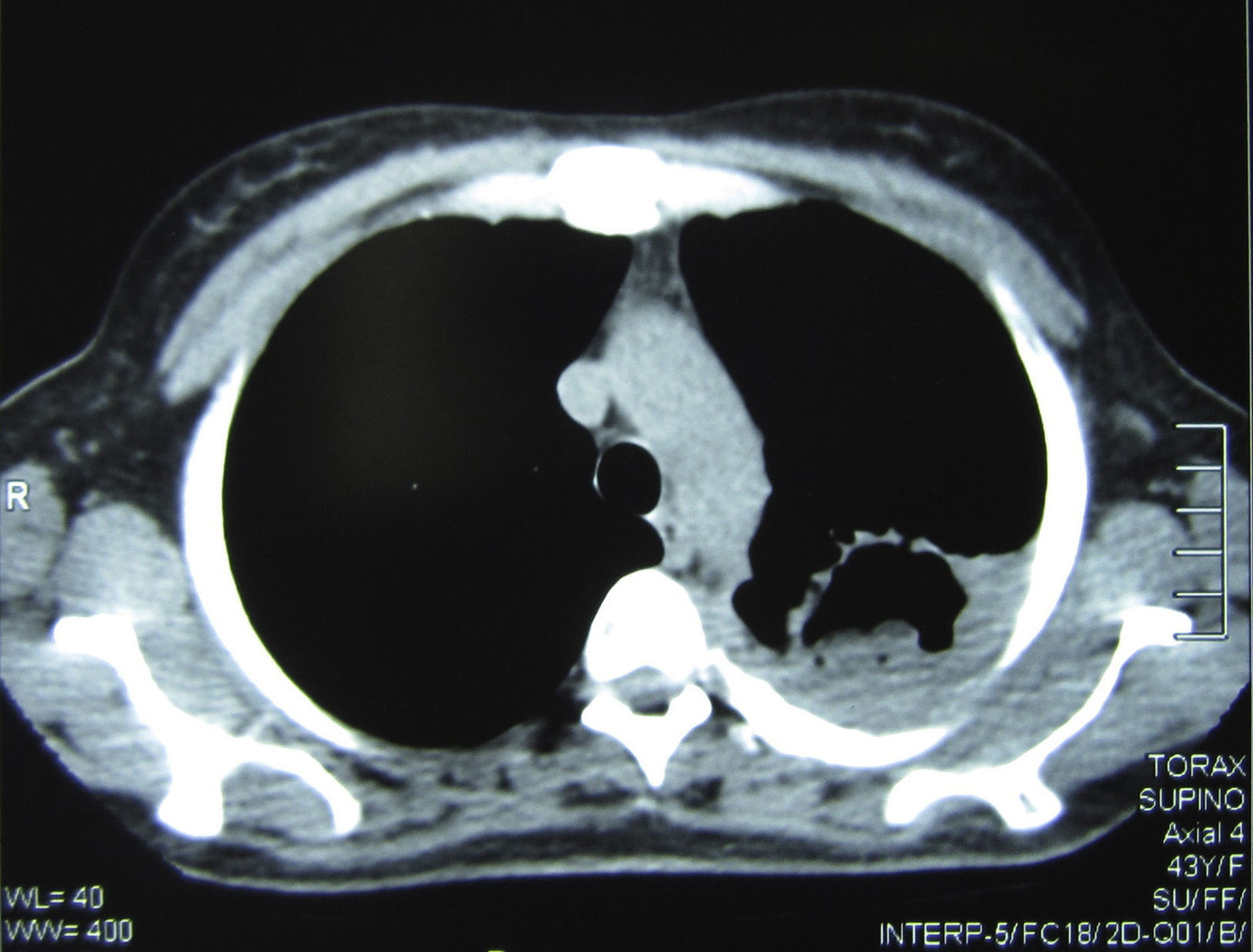
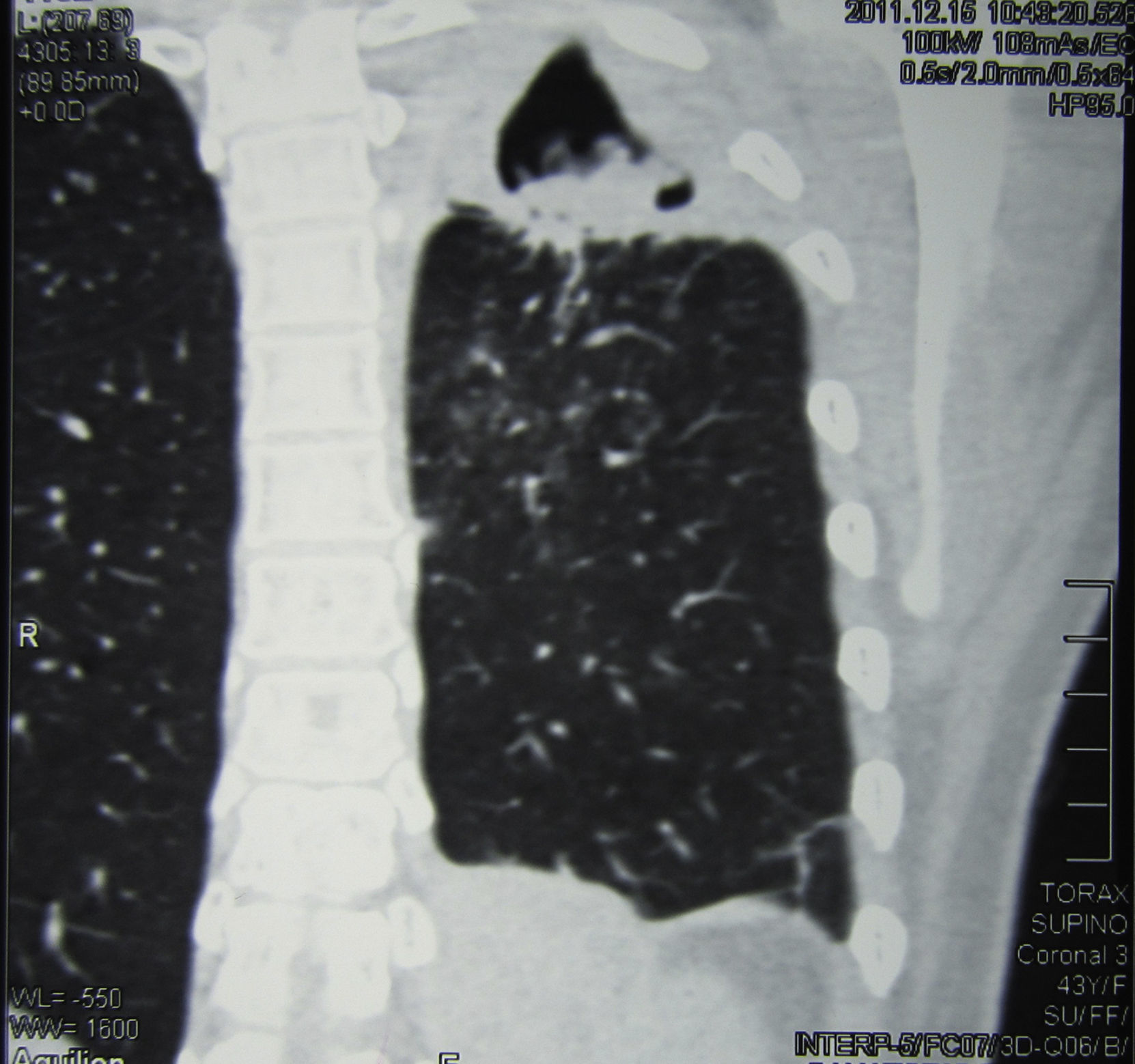
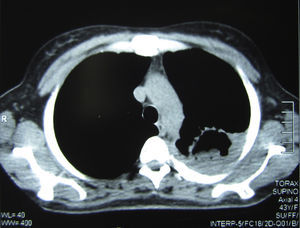
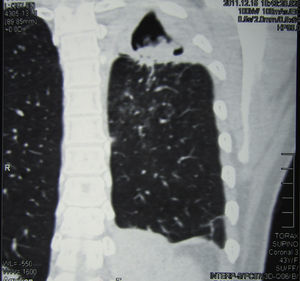
Se realizó una tomografía axial computarizada de tórax, donde pudo verse una imagen cavitaria de 5cm de diámetro, de paredes de 2mm de espesor, con contenido sólido en su interior, situada en la parte posterior del lóbulo superior izquierdo. En su porción posterior la cavidad exhibía paredes más gruesas y estaba adherida a la pleura, que se encontraba muy engrosada; el engrosamiento pleural se extendía a toda la cara externa de la cavidad. En su cara interna esta excavación estaba pegada al mediastino, que presentaba varios ganglios aumentados de tamaño con rango de adenomegalias (figs. 2 y 3).
La espirometría mostró una leve insuficiencia respiratoria restrictiva.
En la biopsia de pleura parietal se encontraron granulomas epitelioides con células gigantes, acompañados de un intenso infiltrado de células linfocitarias (diagnóstico de pleuritis crónica granulomatosa, sin hallazgo del agente causal).
Por fibrobroncoscopia se hallaron secreciones mucosas en el bronquio de drenaje del lóbulo superior izquierdo; la mucosa era normal y no había obstrucción bronquial. Se recogieron secreciones para su estudio posterior.
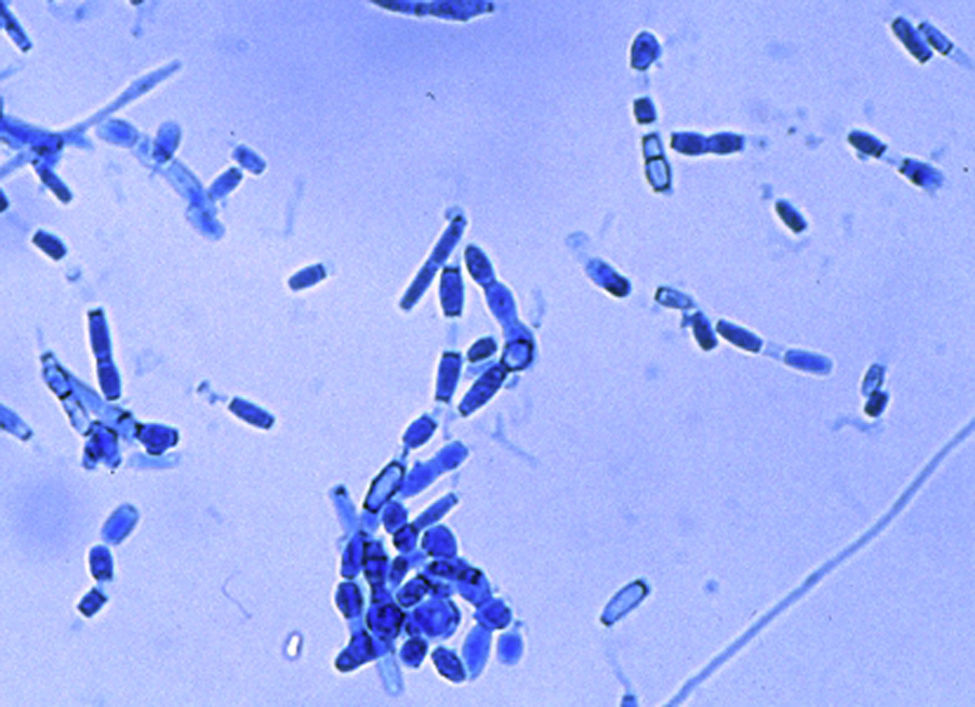
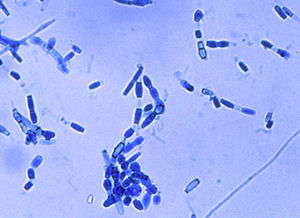
En los exámenes microscópicos de una muestra de esputo y del lavado broncoalveolar no se encontraron hongos ni bacilos ácido-alcohol resistentes. Los cultivos de ambas muestras en medios de agar-glucosado de Sabouraud y agar infusión de cerebro y corazón con antibióticos, incubados a 28 y 37°C, mostraron en cambio el desarrollo de un hongo micelial, con micelio algodonoso blanco-grisáceo, cuyo examen microscópico presentó el aspecto que se muestra en la figura 4. Debido a este hallazgo se completó el estudio de la paciente con pruebas cutáneas y serológicas y se inició un tratamiento por vía intravenosa.
Durante su internación la enferma presentó cefalea, crisis de excitación y una cierta incoherencia en el lenguaje. Por esta razón, y pese a la ausencia de signos meníngeos, se solicitó una tomografía computarizada de encéfalo que no acusó la presencia de hallazgos patológicos, y se efectuó una punción lumbar para estudiar el líquido cefalorraquídeo, cuyo examen físico, químico y citológico presentó resultados dentro de los límites normales. Los cultivos microbiológicos no permitieron el aislamiento de bacterias ni de hongos.
Preguntas- 1.
De acuerdo con las características clínicas y radiológicas de la afección que presentó esta paciente, así como con el aspecto micromorfológico de los cultivos, ¿cuál es la enfermedad que padecía esta enferma?
- 2.
¿A qué forma clínica de esta enfermedad corresponde?
- 3.
¿Considera que el aspecto micromorfológico de los cultivos es suficiente para identificar el agente causal? Si no lo fuera, ¿qué procedimientos deberían hacerse para confirmarlo?
- 4.
¿Cuáles son las pruebas serológicas que se realizan en casos como el presentado aquí? ¿Qué resultados piensa que dieron en este caso?
- 5.
¿Cómo interpreta la masa sólida intracavitaria?
- 6.
¿Cuál supone Ud. que fue el tratamiento intravenoso instaurado?
- 7.
¿Qué evolución suelen tener estos pacientes?
- 1.
Si se descarta la tuberculosis por las baciloscopias, los cultivos negativos y la falta de respuesta clínica al tratamiento antituberculoso con 4 fármacos durante 6 meses, y el quiste hidatídico por no haber mejorado con el albendazol y el tratamiento quirúrgico, quedan como posibilidades principales la histoplasmosis pulmonar crónica y la coccidioidomicosis. Los cultivos miceliales y la presencia de clamidoartroconidios en 2 muestras de secreciones respiratorias (esputo y lavado broncoalveolar) son una fuerte presunción a favor de esta última micosis. La coccidioidomicosis es endémica en la provincia de Santiago del Estero, en la que residía esta paciente6.
En ninguna de estas 2 muestras clínicas del aparato respiratorio se observaron esferas de Coccidioides spp. en el examen microscópico directo. Esto se debe a que esta forma clínica, de lenta evolución, tiene una carga fúngica baja.
- 2.
Las cavidades pulmonares en la coccidioidomicosis pueden corresponder a secuelas de la infección primaria o a una forma pulmonar progresiva o neumopatía persistente de evolución crónica. La primera tiene cavidades de aspecto quístico, con paredes finas, y suele ser asintomática, solo cuando se complica con infecciones bacterianas secundarias, hemoptisis o apertura a la pleura con neumotórax, presenta manifestaciones clínicas. La forma pulmonar crónica es habitualmente sintomática y las paredes de la cavidad son más gruesas y van acompañadas de paquipleuritis. Si bien ambas formas clínicas son más comunes en los pacientes diabéticos, las alteraciones clínicas y radiológicas de esta enferma corresponden a una coccidioidomicosis pulmonar crónica progresiva, también llamada neumopatía persistente1,3,6.
- 3.
El aspecto micromorfológico de la fase micelial de Coccidioides spp. no es suficiente para la identificación del género, ya que es compartido por un género no patógeno llamado Malbranchea. Para determinar la existencia de la forma parasitaria de esferas puede inocularse el cultivo en animales de laboratorio, o hacer un cultivo en agitación rico en proteínas empleando el método de Converse, con incubación a 40°C. También puede identificarse el género por medio de la extracción de exoantígenos, seguida de la realización de pruebas de inmunodifusión en gel de agar, o bien por identificación del ADN utilizando un equipo comercial de hibridación (no disponible en la Argentina). En nuestro caso inoculamos 0,05ml de una suspensión de clamidoartroconidios en la almohadilla plantar de 2 ratones Balb/C. A las 2 semanas presentaban tumefacción de las patas y a las 3 semanas se fistulizaron y dieron salida a una secreción purulenta, cuyo examen microscópico al estado fresco mostró esferas con endosporas típicas del género Coccidioides. No se llevó a cabo la identificación de la especie, pero en la República Argentina todas las cepas estudiadas corresponden a C. posadasii2,4,6.
- 4.
En la coccidioidomicosis se utilizan varias técnicas serológicas: inmunodifusión en gel de agar, contrainmunoelectroforesis con inmunodifusión secundaria en agarosa, fijación del complemento y ELISA para IgM e IgG. Las 2 primeras son las más específicas, y se emplean con mayor frecuencia para el diagnóstico y para seguir la evolución de los pacientes. Los títulos de anticuerpos son proporcionales a la gravedad de la enfermedad y descienden después de la mejoría clínica y la disminución de la carga fúngica4,6.
En la paciente que presentamos la inmunodifusión con coccidioidina fue positiva con suero puro y la contrainmunoelectroforesis con inmunodifusión secundaria presentó una banda de precipitación anódica. Este bajo nivel de anticuerpos específicos se relaciona con una baja carga fúngica.
- 5.
Las imágenes sólidas intracavitarias pueden corresponder a coágulos sanguíneos, focos de caseosis o bolas fúngicas (conglomerados de micelios). En las cavidades que se producen como consecuencia de la ruptura de un quiste hidatídico, los restos de la pared del quiste suelen producir esta imagen («signo del camalote»). En la coccidioidomicosis pulmonar excavada se han documentado bolas fúngicas debidas a la forma micelial de Coccidioides spp3.
- 6.
La anfotericina B desoxicolato es la medicación intravenosa más frecuentemente empleada en la coccidioidomicosis. También están indicadas las formulaciones lipídicas de este antifúngico y, excepcionalmente, el voriconazol intravenoso. Como es bien conocido, la anfotericina B desoxicolato presenta la limitación de su elevada frecuencia de efectos colaterales, en particular la nefrotoxicidad. Las formulaciones lipídicas de la anfotericina B (anfotericina B liposomal, en dispersión coloidal y en complejos lipídicos) presentan una alta eficacia y mejor tolerancia, las dosis diarias varían entre 3 y 5mg/kg de peso y su coste es mucho más elevado. Existe escasa experiencia clínica con el voriconazol en esta micosis, y en la mayoría de los casos tratados con este azol la vía de administración ha sido la oral, con dosis de 400mg/día1,2,6.
- 7.
La coccidioidomicosis es la micosis sistémica endémica que peor responde a los tratamientos antifúngicos. Además, los pacientes diabéticos mal compensados suelen tener complicaciones graves como diseminación multiorgánica y compromiso del sistema nervioso central5. Sin embargo, las cavidades pulmonares solitarias presentan una evolución crónica y con escaso compromiso del estado general. Las complicaciones son hemoptisis importantes, infecciones bacterianas secundarias o apertura en la pleura con producción de pioneumotórax. Es frecuente, debido a la imposibilidad del cierre de estas cavidades, tener que recurrir a la extirpación del lóbulo pulmonar afectado, a fin de evitar las complicaciones antes mencionadas1,3,5,6.
La paciente que presentamos toleró mal la anfotericina B desoxicolato y este tratamiento debió interrumpirse una vez recibida una dosis total de 600mg debido al incremento de la uremia y la creatininemia. Se instauró itraconazol por vía oral como nuevo tratamiento, en dosis de 400mg/día. Cuando había completado 2 meses de tratamiento, la paciente dejó de acudir a los controles médicos.