Los hongos dermatofitos se agrupan en geofílicos (suelo), zoofílicos (animales) y antropofílicos (humanos), dependiendo de la fuente de queratina que pueden utilizar como sustrato nutritivo energético.
ObjetivosSe ha estudiado la sensibilidad in vitro de aislamientos clínicos de hongos dermatofitos pertenecientes a los 3 grupos ecológicos frente a antifúngicos utilizados para el tratamiento tópico de las dermatofitosis, con el fin de conocer la influencia del grupo en esta actividad.
MétodosMediante un micrométodo de dilución en medio líquido se determinó la actividad antifúngica in vitro de 9 antifúngicos de uso tópico: amorolfina (AMR), bifonazol (BFZ), clotrimazol, econazol, ketoconazol, miconazol, oxiconazol, terbinafina (TRB) y tioconazol frente a 124 aislamientos clínicos de hongos dermatofitos pertenecientes a los 3 grupos ecológicos (antropofílicos, zoofílicos y geofílicos).
ResultadosLa actividad antifúngica in vitro mostró diferencias según el grupo ecológico en el que se dividen los hongos dermatofitos, observándose también un patrón especie dependiente.
ConclusionesLos derivados azólicos mostraron un patrón de actividad similar entre ellos, con mayor actividad frente a los antropofílicos > zoofílicos > geofílicos. La actividad de TRB y AMR, por el contrario, fue: zoofílicos > antropofílicos > geofílicos. TRB y AMR fueron las más activas frente a los 3 grupos y BFZ la menos activa.
Dermatophytes can be divided into geophilic (soil), zoophilic (animals) and anthropophilic (humans) strains, depending on the source of the keratin that they use for nutritional purposes.
AimsThe in vitro susceptibility of clinical isolates of dermatophyte fungi has been studied in the 3 ecological groups with several antifungal agents for the topical management of dermatophytoses in order to determine their relationship with the ecological group.
MethodsA standardised dilution micromethod in a liquid medium was used for the determination of the in vitro antifungal activity of 9 topical antifungal drugs: amorolfine (AMR), bifonazole (BFZ), clotrimazole, econazole, ketoconazole, miconazole, oxiconazole, terbinafine (TRB) and tioconazole. The in vitro activity was obtained against 124 clinical isolates of dermatophyte moulds from the anthropophilic, zoophilic and geophilic ecological groups.
ResultsThe in vitro antifungal activity was different depending on the ecological group, although a species-dependent profile was also observed.
ConclusionsAzole derivatives showed a similar antifungal profile, being more active against anthropophilic dermatophytes > zoophilic > geophilic. Activity of TRB and AMR was different from that of azole derivatives (zoophilic > anthropophilic > geophilic). A higher in vitro antifungal activity against the 3 ecological groups was observed with TRB and AMR, whilst BFZ was the less active drug.
Bajo la denominación de dermatofitos se incluye un grupo de hongos capaces de utilizar la queratina como sustrato nutritivo-energético gracias a la presencia de enzimas queratinolíticas5,6,15. Por esta razón, afectan a los tejidos queratinizados incluyendo la piel, los pelos y las uñas del ser humano y otros grupos de animales vertebrados, produciendo diversos tipos de infecciones superficiales denominadas dermatofitosis12–16. Este grupo de hongos comprende los géneros Epidermophyton, Microsporum y Trichophyton, y sus especies han sido agrupadas en 3 categorías, según su hábitat natural o nicho ecológico, de modo que los del grupo antropofílico utilizan específicamente tejidos queratinizados del hombre y raramente los de otros animales, los zoofílicos tienen su nicho ecológico en los animales, pero ocasionalmente infectan al hombre, y, por último, los geofílicos, que utilizan los restos de queratina del hombre y de otros animales que están presentes en el suelo, participando en el proceso de descomposición de esta proteína4,5,12,15.
Las dermatofitosis responden bien en general a la terapia antifúngica por vía tópica, excepto determinadas formas de onicomicosis e infecciones con manifestaciones atípicas, a veces severas y extendidas, que requieren la utilización de tratamientos sistémicos específicos8,14,16.
La selección de un antifúngico debe hacerse siguiendo varios criterios, entre los que debe atenderse al mecanismo de acción desarrollado frente al agente etiológico, ya que no todos son igualmente activos frente a los hongos.
El propósito de este trabajo ha sido evaluar la sensibilidad in vitro de los 3 grupos ecológicos en los que se agrupan este tipo de hongos frente a 9 fármacos antifúngicos utilizados para el tratamiento tópico de las dermatofitosis, con el fin de conocer la posible existencia de una influencia del grupo ecológico de los dermatofitos en la actividad antifúngica in vitro.
Materiales y métodosSe estudiaron 124 aislamientos clínicos de hongos dermatofitos pertenecientes a géneros de los 3 grupos ecológicos, incluyendo Epidermophyton floccosum (n=10), Microsporum audouinii (n=2), Microsporum canis (n=26), Microsporum gypseum (n=6), Microsporum racemosum (n=1), Trichophyton equinum (n=1), Trichophyton interdigitale (n=19), Trichophyton mentagrophytes (n=26), Trichophyton rubrum (n=25), Trichophyton terrestre (n=1), Trichophyton tonsurans (n=2) y Trichophyton violaceum (n=5). Todos los aislamientos fueron identificados por medio de estudios morfológicos basados en características macroscópicas y microscópicas, bioquímicas y fisiológicas, incluyendo la produccion de pigmentos en agar patata glucosa, actividad ureásica, crecimiento en distintos medios suplementados con vitaminas y aminoácidos y test de perforación in vitro del cabello15,16.
Se determinó la actividad antifúngica in vitro de amorolfina (AMR), bifonazol (BFZ), clotrimazol (CLZ), econazol, ketoconazol, miconazol (MNZ), oxiconazol (OXZ), terbinafina (TRB) y tioconazol. Se utilizó el método de microdilución en medio líquido estandarizado por el Clinical and Laboratory Standard Institute (CLSI), M38-A27. Se utilizaron sustancias puras (Sigma-Aldrich). La adaptación y estandarización de estos métodos a los requerimientos de los hongos dermatofitos fue estudiada por diversos autores y permite valorar la actividad antifúngica in vitro basada en la determinación de las concentraciones mínimas inhibitorias (CMI)1–4,6,7,9–12. Las modificaciones de las técnicas mencionadas incluyen la temperatura de incubación (28°C) y la lectura a los 5 días o alternativamente hasta que fuese detectado algún tipo de desarrollo fúngico en los pocillos control de crecimiento. Por otro lado, también se adaptó la densidad del inóculo a fin de lograr un rango de concentración final entre 4,7×103 y 1,5×104UFC/ml9, que no influye de forma significativa en los resultados obtenidos11. Los rangos de concentraciones de los antifúngicos ensayados fueron de 0,015μg/ml a 16μg/ml11.
Se incluyeron las cepas control de calidad Candida krusei ATCC 6258 y Candida parapsilosis ATCC 22019, así como las de referencia Aspergillus fumigatus NCPF 7100 y A. fumigatus NCPF 7099. La CMI se definió como la concentración más baja capaz de inhibir el 80% del desarrollo de los inóculos respecto de los controles de crecimiento en el caso de los azoles y el 100% para los antifúngicos no azólicos, y la CMI90 como la concentración mínima inhibitoria capaz de inhibir el 90% de los aislamientos7.
La actividad antifúngica in vitro de las 9 sustancias frente a los aislamientos de hongos dermatofitos fue analizada comparando las medias geométricas de las CMI y utilizando la ANOVA de una vía y el test de Levene (p<0,05), como método estadístico para ver la influencia del grupo ecológico en la actividad in vitro de los antifúngicos y la aparición de subgrupos homogéneos de sensibilidad, respectivamente.
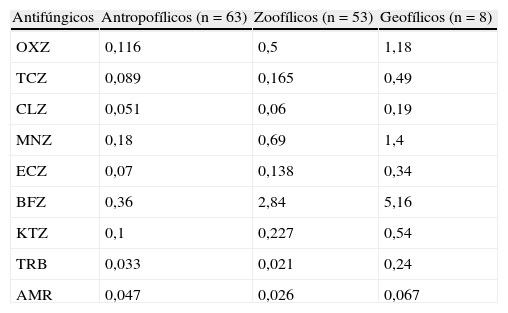
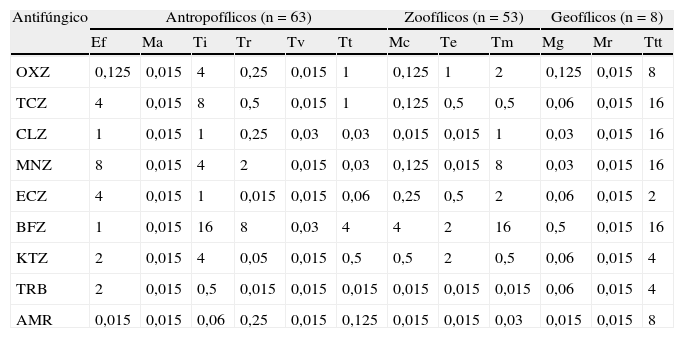
Resultados y discusiónEn la tabla 1 se presentan los valores de las medias geométricas de las CMI obtenidas para los 9 antifúngicos ensayados frente a los 3 grupos ecológicos de hongos dermatofitos a los 5 días de incubación. La tabla 2 muestra las CMI90 obtenidas con los 9 antifúngicos frente a las especies ensayadas de los 3 grupos ecológicos de hongos dermatofitos.
Medias geométricas de las concentraciones mínimas inhibitorias (μg/ml) obtenidas con los 9 antifúngicos frente a los grupos ecológicos de hongos dermatofitos
| Antifúngicos | Antropofílicos (n=63) | Zoofílicos (n=53) | Geofílicos (n=8) |
| OXZ | 0,116 | 0,5 | 1,18 |
| TCZ | 0,089 | 0,165 | 0,49 |
| CLZ | 0,051 | 0,06 | 0,19 |
| MNZ | 0,18 | 0,69 | 1,4 |
| ECZ | 0,07 | 0,138 | 0,34 |
| BFZ | 0,36 | 2,84 | 5,16 |
| KTZ | 0,1 | 0,227 | 0,54 |
| TRB | 0,033 | 0,021 | 0,24 |
| AMR | 0,047 | 0,026 | 0,067 |
AMR: amorolfina; BFZ: bifonazol; CLZ: clotrimazol; ECZ: econazol; KTZ: ketoconazol; MNZ: miconazol; OXZ: oxiconazol; TCZ: tioconazol; TRB: terbinafina.
Concentraciones mínimas inhibitorias 90 (μg/ml) obtenidas con los 9 antifúngicos frente a las especies testeadas de los grupos ecológicos de hongos dermatofitos
| Antifúngico | Antropofílicos (n=63) | Zoofílicos (n=53) | Geofílicos (n=8) | |||||||||
| Ef | Ma | Ti | Tr | Tv | Tt | Mc | Te | Tm | Mg | Mr | Ttt | |
| OXZ | 0,125 | 0,015 | 4 | 0,25 | 0,015 | 1 | 0,125 | 1 | 2 | 0,125 | 0,015 | 8 |
| TCZ | 4 | 0,015 | 8 | 0,5 | 0,015 | 1 | 0,125 | 0,5 | 0,5 | 0,06 | 0,015 | 16 |
| CLZ | 1 | 0,015 | 1 | 0,25 | 0,03 | 0,03 | 0,015 | 0,015 | 1 | 0,03 | 0,015 | 16 |
| MNZ | 8 | 0,015 | 4 | 2 | 0,015 | 0,03 | 0,125 | 0,015 | 8 | 0,03 | 0,015 | 16 |
| ECZ | 4 | 0,015 | 1 | 0,015 | 0,015 | 0,06 | 0,25 | 0,5 | 2 | 0,06 | 0,015 | 2 |
| BFZ | 1 | 0,015 | 16 | 8 | 0,03 | 4 | 4 | 2 | 16 | 0,5 | 0,015 | 16 |
| KTZ | 2 | 0,015 | 4 | 0,05 | 0,015 | 0,5 | 0,5 | 2 | 0,5 | 0,06 | 0,015 | 4 |
| TRB | 2 | 0,015 | 0,5 | 0,015 | 0,015 | 0,015 | 0,015 | 0,015 | 0,015 | 0,06 | 0,015 | 4 |
| AMR | 0,015 | 0,015 | 0,06 | 0,25 | 0,015 | 0,125 | 0,015 | 0,015 | 0,03 | 0,015 | 0,015 | 8 |
AMR: amorolfina; BFZ: bifonazol; CLZ: clotrimazol; ECZ: econazol; Ef: Epidermophyton floccosum; KTZ: ketoconazol; Ma: Microsporum audouinii; Mc: Microsporum canis; Mg: Microsporum gypseum; MNZ: miconazol; Mr: Microsporum racemosum; OXZ: oxiconazol; TCZ: tioconazol; Te: Trichophyton equinum; Ti: Trichophyton interdigitale; Tm: Trichophyton mentagrophytes; Tr: Trichophyton rubrum; TRB: terbinafina; Tt: Trichophyton tonsurans; Ttt: Trichophyton terrestre; Tv: Trichophyton violaceum.
Diversos estudios han facilitado la estandarización de las condiciones experimentales para el estudio de la sensibilidad in vitro de los dermatofitos a los antifúngicos7,9,10. El M38-A2 establece que la lectura de las CMI para los dermatofitos se debe realizar a partir del cuarto día de incubación. En este estudio se valoraron las CMI a los 5 días de incubación para conocer la variación de las mismas en los 3 grupos ecológicos. Las lecturas realizadas en períodos anteriores no mostraron un crecimiento óptimo que permitiera definir un punto de corte, el cual sí se observó a los 5 días. Esto se correlaciona con el tiempo de desarrollo de estos hongos y con lo que sugiere el CLSI en su protocolo, que indica la lectura después de los 4 días de incubación7.
La actividad antifúngica in vitro muestra diferencias según el grupo ecológico al cual pertenecen los hongos dermatofitos, pero también se observó un patrón dependiente de la especie. El patrón de actividad se presentó con mayores medias geométricas de las CMI para los dermatofitos geofílicos con respecto a los otros 2 grupos. Las medias geométricas de las CMI de los zoofílicos fueron en general mayores que las de los antropofílicos, excepto para TRB y AMR (tabla 1). Estos fármacos fueron los más activos frente a los 3 grupos.
Los derivados azólicos mostraron un patrón de actividad similar entre ellos, con mayor actividad frente a los dermatofitos antropofílicos > zoofílicos > geofílicos. La actividad de TRB y AMR, por el contrario, fue zoofílicos > antropofílicos > geofílicos (tabla 1).
Dentro de los antifúngicos azólicos ensayados, CLZ fue la sustancia que presentó mayor actividad frente a los 3 grupos ecológicos (tablas 1 y 2). Esta es una consideración importante, ya que TRB y CLZ son ampliamente utilizados para el tratamiento tópico de las dermatofitosis; además, la formulación sistémica de TRB permite su aplicación en formas clínicas severas y en onicomicosis6.
BFZ fue la sustancia menos activa para los 3 grupos ecológicos (tabla 2) y mostró diferencia estadísticamente significativa entre las medias geométricas de las CMI para los geofílicos > antropofílicos > zoofílicos (tabla 1). Esto es importante considerarlo ya que es uno de los fármacos de aplicación tópica con amplio uso.
Dentro de los hongos dermatofitos antropofílicos se observó una marcada variación en la sensibilidad de las especies. E. floccosum y T. interdigitale fueron los menos sensibles. E. floccosum presentó CMI90 altas para la mayoría de las sustancias, excepto para OXZ y AMR. T. interdigitale también mostró CMI90 elevadas, pero TRB resultó más activa frente a esta especie (tabla 2). Esto es importante por ser uno de los fármacos de elección en el tratamiento con estos agentes. T. rubrum fue sensible a la mayoría de las sustancias excepto para MNZ y BFZ. Estos fármacos fueron los menos activos frente al grupo de los antropofílicos (tabla 2). M. audouinii y T. violaceum resultaron marcadamente sensibles; por otro lado, T. tonsurans mostró CMI90 variables, pero el número de aislamientos ensayados de estas especies fue bajo, por lo que sería interesante evaluar un número mayor de cepas para obtener conclusiones más comparables.
Entre los dermatofitos zoofílicos, M. canis y T. equinum mostraron CMI bajas; en cambio, T. mentagrophytes presentó mayor variabilidad. Los antifúngicos azólicos fueron menos activos frente a esta última especie, y TRB, la más activa (tabla 2).
Dentro del grupo de los geofílicos, M. gypseum y M. racemosum fueron marcadamente sensibles. T. terrestre fue la especie que presentó CMI90 más altas. Considerando que se ensayó un solo aislamiento de esta última especie, no se puede sacar una conclusión de valor sobre su sensibilidad.
No se encontraron estudios previos que relacionaran la sensibilidad in vitro a los antifúngicos con la pertenencia a un determinado grupo ecológico de los hongos dermatofitos. En este trabajo, si bien se observaron diferencias en la actividad de los fármacos testados entre los 3 grupos, también se puso de manifiesto la gran variabilidad especie dependiente, lo que hace difícil concluir sobre una sensibilidad general a nivel de grupo ecológico. Esto resalta la importancia de la individualidad de cada especie dentro de un mismo grupo y de estudiar al hongo como género y especie, ya que según estos resultados, la pertenencia a un nicho ecológico no estaría relacionada con la sensibilidad de los mismos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.